离子反应及其条件
图片预览


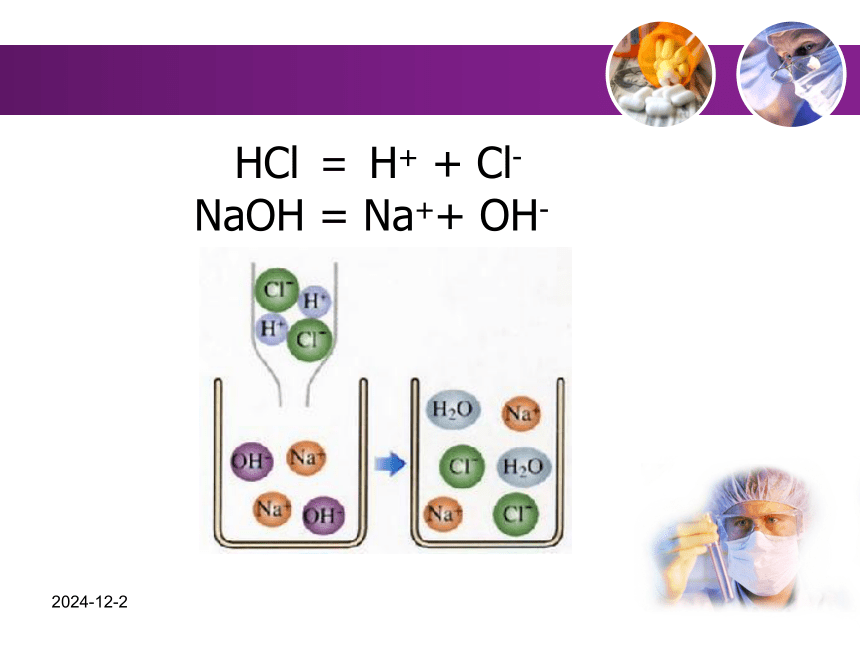


文档简介
课件17张PPT。离子反应复习回顾在下列物质中,
1.盐酸 2. KNO3固体 3. KOH溶液 4. CO2
5. 金刚石 6. NH3 7. CaCO3 固体 8.空气
9.蔗糖 10.酒精 11.铝
属于电解质的是:
属于非电解质的是:
2 4 7 4 6 9 10 2019-1-10 HCl = H+ + Cl-
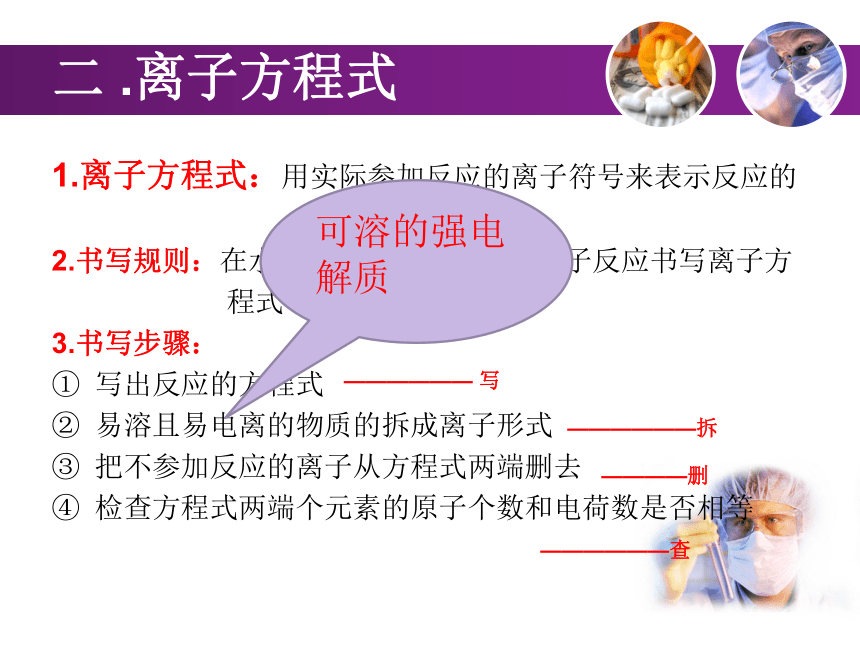
NaOH = Na++ OH-一. 离子反应离子反应:有离子参加或生成的反应。无明显现象有白色沉淀二 .离子方程式1.离子方程式:用实际参加反应的离子符号来表示反应的
式子。
2.书写规则:在水溶液或熔融状态下的离子反应书写离子方
程式
3.书写步骤:
写出反应的方程式
易溶且易电离的物质的拆成离子形式
把不参加反应的离子从方程式两端删去
检查方程式两端个元素的原子个数和电荷数是否相等
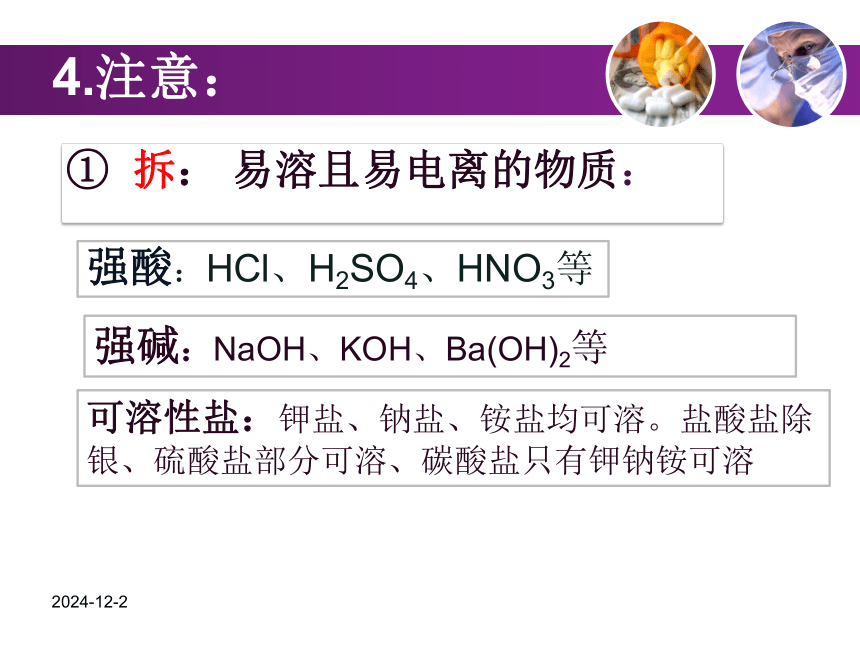
—————— 写——————拆————删——————查可溶的强电解质2019-1-10① 拆: 易溶且易电离的物质:4.注意:强酸:HCl、H2SO4、HNO3等强碱:NaOH、KOH、Ba(OH)2等可溶性盐:钾盐、钠盐、铵盐均可溶。盐酸盐除银、硫酸盐部分可溶、碳酸盐只有钾钠铵可溶
留:气体、沉淀、水、弱电解质、非电解
质、氧化物
4.注意:② 微溶物作为反应物,如果是澄清液,则写成离子符号;若是悬浊液,则写成化学式。
微溶物作为生成物,写成化学式,并写“↓”符号。③ 固体和固体反应、浓硫酸与固体反应,不能写成离子方程式2019-1-10 H2SO4 + 2KOH = K2SO4 +2H2O H2SO4 + Ba(OH)2 = BaSO4↓ + 2H2O Fe + H2SO4 = FeSO4 + H2↑H++OH- = H2O2H++ SO42-+2OH- + Ba2+ = BaSO4↓ + 2H2O Fe + 2H+ = H2↑ + Fe2+练习:将下列化学方程式改写成离子方程式练习: 氢气在加热的条件下还原氧化铜
碳酸钙与稀盐酸反应
判断下列反应能否写离子方程式,能的写出离子方程式 酸碱中和反应的实质是由酸电离出的H+ 与由碱电离出的OH- 结合生成H2O。
5.意义离子方程式与一般的化学方程式不同,它不仅能表示一个具体的化学反应,还能表示同一类型的离子反应。表示的是一个反应的实质1下列离子方程式能表示哪些物质之间的反应?写出化学方程式
Ba2+ +SO42- = BaSO4↓
BaCl2 +CuSO4 = BaSO4↓ + CuCl2
练习:……判断:2019-1-10H++OH- = H2O表示酸与碱的中和反应
表示强酸与强碱的中和反应
表示强酸与强碱生成可溶性盐的中和反应
只表示强酸与强碱生成可溶性盐的中和反应√ ╳╳╳三. 离子反应发生的条件现象:生成白色沉淀,离子方程式: 离子反应发生的条件:
生成沉淀Ba2++SO42- = BaSO4↓三.离子反应发生的条件现象:溶液的红色消失 离子方程式: 离子反应发生的条件:
水H++OH- = H2O三.离子反应发生的条件现象:有气泡冒出。 离子方程式: 离子反应发生的条件:生成气体离子反应发生的条件:
生成沉淀、气体或水离子反应发生的特点就是使反应物的离子浓度减少CO32- + 2H+ = CO2 +H2O四 .离子反应的应用离子共存问题:
下列各组中的离子,能在溶液中大量共存的是(??)
A .K+、?H+、?C1-?、?OH-????
B.Na+、Ba2+、CO32-?、NO3-
C.Na+、H+、?Cl-、?CO32-??
D.K+、Cu2+、?NO3-?、SO42-?
离子不能共存—发生复分解反应
在混合物的分离、物质的提纯、化合物组分的分析和鉴定、消除水污染等方面都有重要的应用。同学们课下自己搜集资料,与同学交流四 .离子反应的应用
1.盐酸 2. KNO3固体 3. KOH溶液 4. CO2
5. 金刚石 6. NH3 7. CaCO3 固体 8.空气
9.蔗糖 10.酒精 11.铝
属于电解质的是:
属于非电解质的是:
2 4 7 4 6 9 10 2019-1-10 HCl = H+ + Cl-
NaOH = Na++ OH-一. 离子反应离子反应:有离子参加或生成的反应。无明显现象有白色沉淀二 .离子方程式1.离子方程式:用实际参加反应的离子符号来表示反应的
式子。
2.书写规则:在水溶液或熔融状态下的离子反应书写离子方
程式
3.书写步骤:
写出反应的方程式
易溶且易电离的物质的拆成离子形式
把不参加反应的离子从方程式两端删去
检查方程式两端个元素的原子个数和电荷数是否相等
—————— 写——————拆————删——————查可溶的强电解质2019-1-10① 拆: 易溶且易电离的物质:4.注意:强酸:HCl、H2SO4、HNO3等强碱:NaOH、KOH、Ba(OH)2等可溶性盐:钾盐、钠盐、铵盐均可溶。盐酸盐除银、硫酸盐部分可溶、碳酸盐只有钾钠铵可溶
留:气体、沉淀、水、弱电解质、非电解
质、氧化物
4.注意:② 微溶物作为反应物,如果是澄清液,则写成离子符号;若是悬浊液,则写成化学式。
微溶物作为生成物,写成化学式,并写“↓”符号。③ 固体和固体反应、浓硫酸与固体反应,不能写成离子方程式2019-1-10 H2SO4 + 2KOH = K2SO4 +2H2O H2SO4 + Ba(OH)2 = BaSO4↓ + 2H2O Fe + H2SO4 = FeSO4 + H2↑H++OH- = H2O2H++ SO42-+2OH- + Ba2+ = BaSO4↓ + 2H2O Fe + 2H+ = H2↑ + Fe2+练习:将下列化学方程式改写成离子方程式练习: 氢气在加热的条件下还原氧化铜
碳酸钙与稀盐酸反应
判断下列反应能否写离子方程式,能的写出离子方程式 酸碱中和反应的实质是由酸电离出的H+ 与由碱电离出的OH- 结合生成H2O。
5.意义离子方程式与一般的化学方程式不同,它不仅能表示一个具体的化学反应,还能表示同一类型的离子反应。表示的是一个反应的实质1下列离子方程式能表示哪些物质之间的反应?写出化学方程式
Ba2+ +SO42- = BaSO4↓
BaCl2 +CuSO4 = BaSO4↓ + CuCl2
练习:……判断:2019-1-10H++OH- = H2O表示酸与碱的中和反应
表示强酸与强碱的中和反应
表示强酸与强碱生成可溶性盐的中和反应
只表示强酸与强碱生成可溶性盐的中和反应√ ╳╳╳三. 离子反应发生的条件现象:生成白色沉淀,离子方程式: 离子反应发生的条件:
生成沉淀Ba2++SO42- = BaSO4↓三.离子反应发生的条件现象:溶液的红色消失 离子方程式: 离子反应发生的条件:
水H++OH- = H2O三.离子反应发生的条件现象:有气泡冒出。 离子方程式: 离子反应发生的条件:生成气体离子反应发生的条件:
生成沉淀、气体或水离子反应发生的特点就是使反应物的离子浓度减少CO32- + 2H+ = CO2 +H2O四 .离子反应的应用离子共存问题:
下列各组中的离子,能在溶液中大量共存的是(??)
A .K+、?H+、?C1-?、?OH-????
B.Na+、Ba2+、CO32-?、NO3-
C.Na+、H+、?Cl-、?CO32-??
D.K+、Cu2+、?NO3-?、SO42-?
离子不能共存—发生复分解反应
在混合物的分离、物质的提纯、化合物组分的分析和鉴定、消除水污染等方面都有重要的应用。同学们课下自己搜集资料,与同学交流四 .离子反应的应用
