第一章 原子结构与性质 体系构建 体验高考(共21张ppt)
文档属性
| 名称 | 第一章 原子结构与性质 体系构建 体验高考(共21张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 819.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-18 20:54:22 | ||
图片预览








文档简介
(共21张PPT)
体系构建 理清脉络 / 体验高考 素养提升
体系构建 体验高考
第一章
内容索引
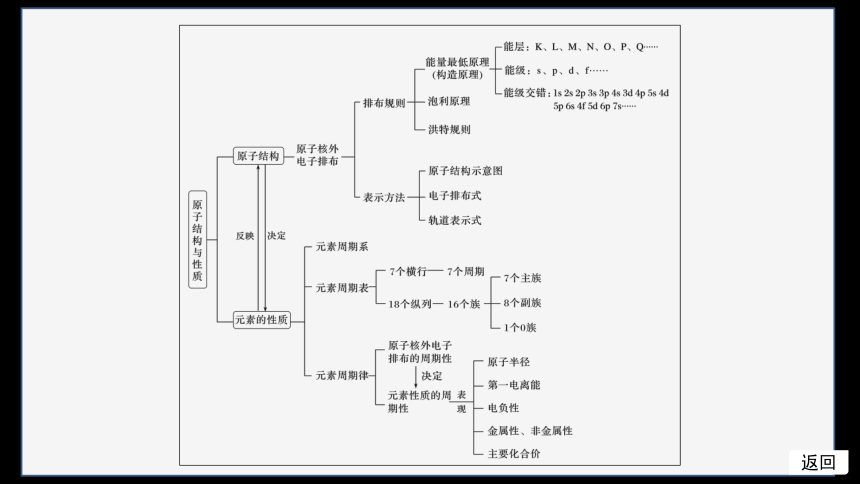
体系构建 理清脉络
体验高考 素养提升
体系构建 理清脉络
返回
体验高考 素养提升
考向一 原子的核外电子排布
3s23p2
例1
(1)[2021·全国甲卷,35(1)节选]太阳能电池板主要材料为单晶硅或多晶硅。Si的价电子层的电子排布式为________。
基态Si原子的核外电子排布式为1s22s22p63s23p2,因此Si的价电子层的电子排布式为3s23p2。
(2)[2021·广东,20(1)]基态硫原子价层电子排布式为_______。
3s23p4
基态硫原子核外电子排布式为1s22s22p63s23p4,因此基态硫原子价层电子排布式为3s23p4。
(3)[2021·海南,19(1)]基态锰原子的价层电子排布式为________。
3d54s2
Mn元素是第25号元素,其电子排布式为1s22s22p63s23p63d54s2,价层电子排布式为3d54s2。
(4)[2021·湖南,18(1)节选]基态硅原子最外层的轨道表示式为
__________________。
硅元素的原子序数为14,价层电子排布式为3s23p2,则价层电子的轨道
表示式为 。
(5)[2021·山东,16(1)]基态F原子核外电子的运动状态有____种。
9
基态F原子共有9个核外电子,则每个电子都有对应的轨道和自旋状态,所以核外电子的运动状态有9种。
[2021·全国乙卷,35(1)]过渡金属元素铬(Cr)是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。
对于基态Cr原子,下列叙述正确的是______ (填字母)。
A.轨道处于半充满时体系总能量低,核外电子排布应为[Ar]3d54s1
B.4s电子能量较高,总是在比3s电子离核更远的地方运动
C.电负性比钾高,原子对键合电子的吸引力比钾大
例2
AC
基态原子满足能量最低原理,Cr有24个核外电子,轨道处于半充满时体系总能量低,核外电子排布应为[Ar]3d54s1,A正确;
电负性为原子对键合电子的吸引力,同周期(除0族)元素原子序数越大电负性越大,钾与铬位于同周期,铬的原子序数大于钾,故铬的电负性比钾大,原子对键合电子的吸引力比钾大,C正确。
[2021·河北,17(1)(2)]KH2PO4晶体具有优异的非线性光学性能。我国科学工作者制备的超大KH2PO4晶体已应用于大功率固体激光器,填补了国家战略空白。回答下列问题:
(1)在KH2PO4的四种组成元素各自所能形成的简单离子中,核外电子排布相同的是__________(填离子符号)。
例3
K+和P3-
在KH2PO4的四种组成元素各自所能形成的简单离子分别为H+(或H-)、O2-、K+和P3-,其中核外电子排布相同的是K+和P3-。
(2)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+ 表示,与之相反的用- 表示,称为电子的自旋磁量子数。对于基态的磷
原子,其价层电子自旋磁量子数的代数和为___________。
对于基态的磷原子,其价层电子排布式为3s23p3,其中3s轨道的2个电子自旋状态相反,自旋磁量子数的代数和为0;根据洪特规则可知,其3p轨道的3个电子的自旋状态相同,因此,基态磷原子的价电子的自旋磁量子数的代数和为 。
考向二 元素的电离能和电负性
A.氢化物沸点:X>Y
B.原子半径:MC.第一电离能:WD.电负性:W例4
(2021·辽宁,14改编)某多孔储氢材料前驱体结构如图,M、W、X、Y、Z五种元素原子序数依次增大,基态Z原子的电子填充了3个能级,其中有2个未成对电子。下列说法正确的是
√
由题干信息可知,基态Z原子的电子填充了3个能级,其中有2个未成对电子,故Z为C或者O,根据多孔储氢材料前驱体结构图可知Y周围形成了4个单键,再结合信息M、W、X、Y、Z五种元素原子序数依次增大,故Y为N,Z为O,M只形成一个单键,M为H,X为C,则W为B,据此分析解题。
(1)[2021·海南,19(3)]第一电离能的大小:C________O(填“大于”或“小于”)。
(2)[2021·湖南,18(2)②节选]H、C、N的电负性由大到小的顺序为_________。
例5
小于
N>C>H
元素的非金属性越强,其电负性越大,元素的非金属性强弱顺序为N>C>H,则元素电负性的大小顺序为N>C>H。
(3)[2021·山东,16(2)节选]O、F、Cl电负性由大到小的顺序为________。
F>O>Cl
电负性一定程度上相当于得电子能力,半径越小,得电子能力越强,电负性越大,半径由小到大的顺序为FO>Cl。
[2020·全国卷Ⅰ,35(2)]Li及其周期表中相邻元素的第一电离能(I1)如表所示。I1(Li)> I1(Na),原因是________________________________
_____________________________。I1(Be)> I1(B)> I1(Li),原因是_____
____________________________________
_____________________________________
_____________________________________
____________________________________。
例6
Na与Li同主族,Na的电子层数多,
Li、
I1/(kJ·mol-1) Li 520 Be 900 B
801
Na 496 Mg 738 Al
578
原子半径大,故第一电离能更小
Be和B为同周期元素,同周期元素从左至
右,第一电离能呈现增大的趋势,但由于
基态Be原子的s能级处于全充满状态,能
量更低更稳定,故其第一电离能大于B的
Li和Na在同一主族,价层电子数相同,Li在Na的上一周期,原子半径:
LiI1/(kJ·mol-1) Li 520 Be 900 B
801
Na 496 Mg 738 Al
578
Be的电子排布式为1s22s2,是全充满稳定结构,故第一电离能大于B、Li;Li、B在同一周期,元素原子核外电子层数相同,但随核电荷数增大,原子半径减小,原子核对核外电子的有效吸引作用依次增强,故第一电离能:I1(B)>I1(Li)。
返回
本课结束
第一章
体系构建 理清脉络 / 体验高考 素养提升
体系构建 体验高考
第一章
内容索引
体系构建 理清脉络
体验高考 素养提升
体系构建 理清脉络
返回
体验高考 素养提升
考向一 原子的核外电子排布
3s23p2
例1
(1)[2021·全国甲卷,35(1)节选]太阳能电池板主要材料为单晶硅或多晶硅。Si的价电子层的电子排布式为________。
基态Si原子的核外电子排布式为1s22s22p63s23p2,因此Si的价电子层的电子排布式为3s23p2。
(2)[2021·广东,20(1)]基态硫原子价层电子排布式为_______。
3s23p4
基态硫原子核外电子排布式为1s22s22p63s23p4,因此基态硫原子价层电子排布式为3s23p4。
(3)[2021·海南,19(1)]基态锰原子的价层电子排布式为________。
3d54s2
Mn元素是第25号元素,其电子排布式为1s22s22p63s23p63d54s2,价层电子排布式为3d54s2。
(4)[2021·湖南,18(1)节选]基态硅原子最外层的轨道表示式为
__________________。
硅元素的原子序数为14,价层电子排布式为3s23p2,则价层电子的轨道
表示式为 。
(5)[2021·山东,16(1)]基态F原子核外电子的运动状态有____种。
9
基态F原子共有9个核外电子,则每个电子都有对应的轨道和自旋状态,所以核外电子的运动状态有9种。
[2021·全国乙卷,35(1)]过渡金属元素铬(Cr)是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。
对于基态Cr原子,下列叙述正确的是______ (填字母)。
A.轨道处于半充满时体系总能量低,核外电子排布应为[Ar]3d54s1
B.4s电子能量较高,总是在比3s电子离核更远的地方运动
C.电负性比钾高,原子对键合电子的吸引力比钾大
例2
AC
基态原子满足能量最低原理,Cr有24个核外电子,轨道处于半充满时体系总能量低,核外电子排布应为[Ar]3d54s1,A正确;
电负性为原子对键合电子的吸引力,同周期(除0族)元素原子序数越大电负性越大,钾与铬位于同周期,铬的原子序数大于钾,故铬的电负性比钾大,原子对键合电子的吸引力比钾大,C正确。
[2021·河北,17(1)(2)]KH2PO4晶体具有优异的非线性光学性能。我国科学工作者制备的超大KH2PO4晶体已应用于大功率固体激光器,填补了国家战略空白。回答下列问题:
(1)在KH2PO4的四种组成元素各自所能形成的简单离子中,核外电子排布相同的是__________(填离子符号)。
例3
K+和P3-
在KH2PO4的四种组成元素各自所能形成的简单离子分别为H+(或H-)、O2-、K+和P3-,其中核外电子排布相同的是K+和P3-。
(2)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+ 表示,与之相反的用- 表示,称为电子的自旋磁量子数。对于基态的磷
原子,其价层电子自旋磁量子数的代数和为___________。
对于基态的磷原子,其价层电子排布式为3s23p3,其中3s轨道的2个电子自旋状态相反,自旋磁量子数的代数和为0;根据洪特规则可知,其3p轨道的3个电子的自旋状态相同,因此,基态磷原子的价电子的自旋磁量子数的代数和为 。
考向二 元素的电离能和电负性
A.氢化物沸点:X>Y
B.原子半径:M
(2021·辽宁,14改编)某多孔储氢材料前驱体结构如图,M、W、X、Y、Z五种元素原子序数依次增大,基态Z原子的电子填充了3个能级,其中有2个未成对电子。下列说法正确的是
√
由题干信息可知,基态Z原子的电子填充了3个能级,其中有2个未成对电子,故Z为C或者O,根据多孔储氢材料前驱体结构图可知Y周围形成了4个单键,再结合信息M、W、X、Y、Z五种元素原子序数依次增大,故Y为N,Z为O,M只形成一个单键,M为H,X为C,则W为B,据此分析解题。
(1)[2021·海南,19(3)]第一电离能的大小:C________O(填“大于”或“小于”)。
(2)[2021·湖南,18(2)②节选]H、C、N的电负性由大到小的顺序为_________。
例5
小于
N>C>H
元素的非金属性越强,其电负性越大,元素的非金属性强弱顺序为N>C>H,则元素电负性的大小顺序为N>C>H。
(3)[2021·山东,16(2)节选]O、F、Cl电负性由大到小的顺序为________。
F>O>Cl
电负性一定程度上相当于得电子能力,半径越小,得电子能力越强,电负性越大,半径由小到大的顺序为F
[2020·全国卷Ⅰ,35(2)]Li及其周期表中相邻元素的第一电离能(I1)如表所示。I1(Li)> I1(Na),原因是________________________________
_____________________________。I1(Be)> I1(B)> I1(Li),原因是_____
____________________________________
_____________________________________
_____________________________________
____________________________________。
例6
Na与Li同主族,Na的电子层数多,
Li、
I1/(kJ·mol-1) Li 520 Be 900 B
801
Na 496 Mg 738 Al
578
原子半径大,故第一电离能更小
Be和B为同周期元素,同周期元素从左至
右,第一电离能呈现增大的趋势,但由于
基态Be原子的s能级处于全充满状态,能
量更低更稳定,故其第一电离能大于B的
Li和Na在同一主族,价层电子数相同,Li在Na的上一周期,原子半径:
Li
801
Na 496 Mg 738 Al
578
Be的电子排布式为1s22s2,是全充满稳定结构,故第一电离能大于B、Li;Li、B在同一周期,元素原子核外电子层数相同,但随核电荷数增大,原子半径减小,原子核对核外电子的有效吸引作用依次增强,故第一电离能:I1(B)>I1(Li)。
返回
本课结束
第一章
