第一章第一节 原子结构 第1课时 能层与能级 基态与激发态(共71张ppt)
文档属性
| 名称 | 第一章第一节 原子结构 第1课时 能层与能级 基态与激发态(共71张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-18 20:55:45 | ||
图片预览









文档简介
(共71张PPT)
能层与能级 / 基态与激发态 原子光谱 / 随堂演练 知识落实 / 课时对点练
能层与能级 基态与激发态
第一章
第1课时
核心素养
发展目标
1.通过认识原子结构与核外电子排布理解能层与能级的关系。
2.通过核外电子能量不同分析、理解基态与激发态的含义与关系。
3.能辨识光谱与电子跃迁之间的关系。
内容索引
一、能层与能级
二、基态与激发态 原子光谱
随堂演练 知识落实
课时对点练
能层与能级
一
1920年,丹麦科学家玻尔在氢原子模型基础上,提出 ,开启了用原子结构解释 的篇章。1925年以后,玻尔的“壳层”落实为“能层”与“能级”,厘清了核外电子的可能状态,复杂的原子光谱得以诠释。1936年,德国科学家马德隆发表了以 事实为依据的完整的 。
构造原理
元素周期律
原子光谱
构造原理
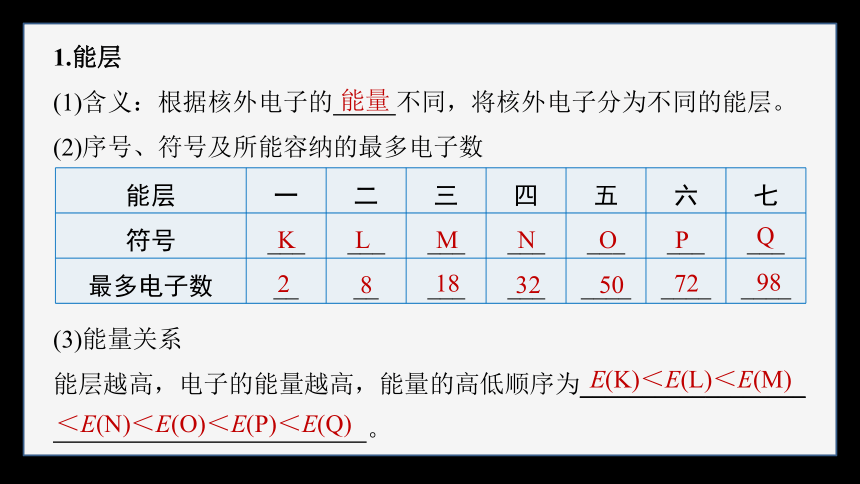
1.能层
(1)含义:根据核外电子的 不同,将核外电子分为不同的能层。
(2)序号、符号及所能容纳的最多电子数
(3)能量关系
能层越高,电子的能量越高,能量的高低顺序为__________________
。
能量
能层 一 二 三 四 五 六 七
符号 ___ ___ ___ ___ ___ ___ ___
最多电子数 __ __ ___ ___ ____ ____ ____
K
L
M
N
O
P
Q
2
8
18
32
50
72
98
E(K)<E(L)<E(M)
<E(N)<E(O)<E(P)<E(Q)
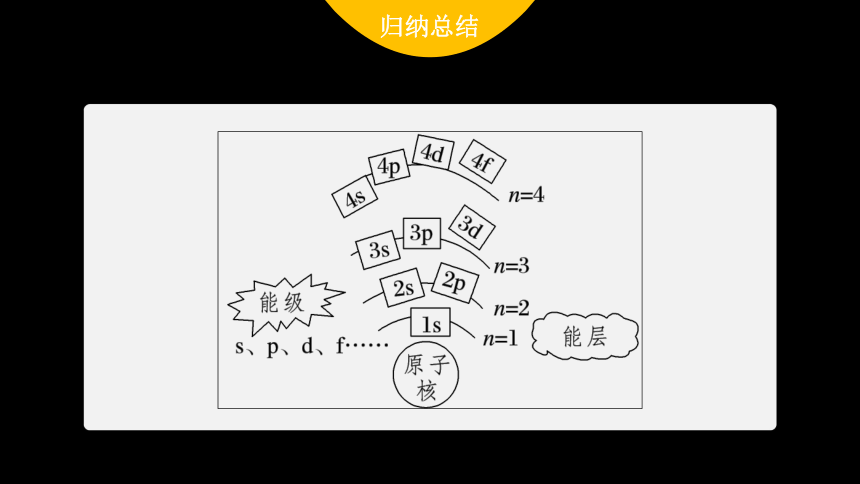
2.能级
(1)含义:根据多电子原子的同一能层电子的 不同,将它们分为不同能级。
(2)表示方法:分别用相应能层的序数和字母 等表示,如第n能层的能级按能量由低到高的排列顺序为ns、 、 、nf等。
能量
s、p、d、f
np
nd
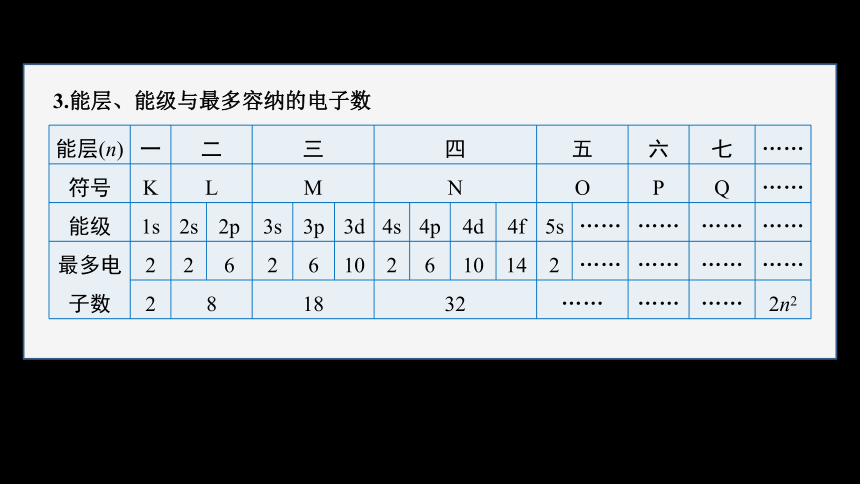
3.能层、能级与最多容纳的电子数
能层(n) 一 二 三 四 五 六 七 ……
符号 K L M N O P Q ……
能级 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s …… …… …… ……
最多电 子数 2 2 6 2 6 10 2 6 10 14 2 …… …… …… ……
2 8 18 32 …… …… …… 2n2
归纳总结
正误判断
(1)2d表示L层上的d能级( )
(2)同一原子中,1s、2s、3s电子的能量逐渐减小( )
(3)s能级的能量一定比p能级的能量低( )
(4)各能级最多可容纳的电子数按s、p、d、f……的顺序依次为自然数中的奇数序列1、3、5、7……的2倍( )
(5)4s、4p、4d、4f能级的能量的高低顺序为E(4s)<E(4p)<E(4d)<E(4f)( )
×
√
×
×
√
1.以s能级为例,不同能层的s能级之间的能量有何关系?同一能层不同能级间能量有何关系?
提示 不同能层:E(1s)<E(2s)<E(3s)<E(4s)……;同一能层:E(ns)<E(np)<E(nd)<E(nf)……。
深度思考
2.以s、p、d、f为符号的能级分别最多可容纳多少个电子?3d、4d、5d能级所容纳的最多电子数是否相同?
提示 最多容纳的电子数为s能级:2,p能级:6,d能级:10,f能级:14;3d、4d、5d能级所容纳的最多电子数相同。
深度思考
3.第五能层最多可容纳多少个电子?它们分别容纳在几个能级中?
提示 第五能层最多容纳50个电子;它们分别容纳在5个能级中。
深度思考
应用体验
1.N层所含的能级数为
A.2 B.3 C.4 D.5
√
N层为第四能层,有4个能级。
2.(2022·成都高二期中)原子核外的某一能层最多能容纳的电子数目为18,则该能层是
A.K能层 B.L能层
C.O能层 D.M能层
每一能层最多能容纳的电子数目为2n2,所以最多能容纳的电子数目为18的能层是第三能层即M能层。
√
3.下列说法正确的是
A.在同一能层不同能级上的电子,其能量肯定不同
B.各能层的能级都是从s能级开始至f能级结束
C.各能层含有的能级数为n-1
D.各能层含有的电子数为2n2
√
在多电子原子中,同一能层不同能级上的电子具有的能量不同,A项正确;
各能层的能级都是从s能级开始,但不都是至f能级结束,如L能层只有2s、2p两个能级,M能层只有3s、3p、3d三个能级,B项错误;
各能层含有的能级数与能层序数相同,C项错误;
各能层最多容纳的电子数为2n2,D项错误。
返回
基态与激发态 原子光谱
二
1.基态原子与激发态原子
(1)基态原子:处于 状态的原子。
(2)激发态原子:基态原子 能量,它的电子会跃迁到 能级,变为激发态原子。
(3)基态、激发态原子相互间转化的能量变化
吸收
释放
光
最低能量
吸收
较高
2.光谱
(1)光谱的成因及分类
吸收光谱
发射光谱
(2)拓展应用
①霓虹灯发光原理:充有氖气的霓虹灯能发出红光,产生这一现象的原因是通电后在电场作用下,放电管里氖原子中的电子吸收能量后跃迁到能量较高的能级,且处在能量较高的能级上的电子会很快地以光的形式释放能量而跃迁到能量较低的能级上,该光的波长恰好处于可见光区域中的红色波段。
②焰色试验中产生的焰色是电子跃迁的结果,焰色的产生与消失是物理变化,该过程中可能伴随化学变化。焰色发生的过程:基态原子
激发态原子 能量较低的激发态或基态原子。
③光谱分析法鉴定元素的原因
一种元素有一种原子光谱,一种原子光谱对应着一种元素,可以用光谱仪摄取各种元素原子的吸收光谱或发射光谱(总称原子光谱),所以,可以用光谱分析法鉴定元素。
正误判断
(1)光(辐射)是电子跃迁释放能量的重要形式之一( )
(2)霓虹灯光、激光、荧光都与原子核外电子跃迁吸收能量有关( )
(3)产生激光的前提是原子要处于激发态( )
(4)电子跃迁时只吸收能量( )
(5)同一原子处于激发态时的能量一定高于基态时的能量( )
(6)激发态原子的能量较高,极易失去电子,表现出较强的还原性( )
√
√
×
×
√
×
1.许多金属元素都可以发生焰色试验,请用原子结构的知识解释其原因。
提示 基态原子吸收能量,电子从基态跃迁到激发态后,电子从较高能量的激发态跃迁到较低能量的激发态乃至基态时,将能量以光的形式释放出来。
深度思考
2.金属元素的焰色试验属于吸收光谱还是发射光谱?
提示 光(辐射)是电子跃迁释放能量的重要形式之一,焰色试验属于发射光谱。
深度思考
方法规律
电子跃迁的形式
(1)电子吸收能量→从低能级跃迁至较高能级→吸收光谱。
(2)电子从高能级跃迁到低能级→释放能量→发射光谱。
应用体验
1.图中所发生的现象与电子的跃迁无关的是
燃放焰火、霓虹灯、燃烧蜡烛等发出的光都是电子跃迁时能量以光的形式释放出来导致的,而平面镜成像则是光线反射的结果。
√
2.电子由3d能级跃迁至4p能级时,可通过光谱仪直接摄取
A.电子的运动轨迹图像
B.原子的吸收光谱
C.电子体积大小的图像
D.原子的发射光谱
E(3d)√
返回
随堂演练 知识落实
1.下列叙述正确的是
A.能级就是电子层
B.每个能层最多可容纳的电子数是2n2
C.同一能层中的不同能级的能量高低相同
D.不同能层中的s能级的能量高低相同
1
2
3
√
4
5
1
2
3
能层是电子层,对于同一能层里能量不同的电子,又将其分为不同的能级,故A错误;
每个能层最多可容纳的电子数是2n2,故B正确;
同一能层里的不同能级,能量按照s、p、d、f……的顺序升高,故C错误;
不同能层中的s能级的能量不同,能层越大,s能级的能量越高,如E(1s)4
5
2.以下能级符号正确的是
A.3f B.2d
C.4s D.2f
1
2
3
√
4
5
第三能层有3个能级(3s、3p、3d),没有3f能级,故A错误;
第二能层有2个能级(2s和2p),没有2d、2f能级,故B、D错误;
第四能层有4个能级(4s、4p、4d、4f),故C正确。
1
2
3
4
5
3.N层所含能级数、最多容纳电子数分别为
A.3、18 B.4、24
C.5、32 D.4、32
1
2
3
√
N层含有的能级分别为s、p、d、f,最多可以容纳32个电子,D正确。
4
5
4.(2022·洛阳高二期中)下列现象与原子核外电子的跃迁无关的是
A.激光笔产生红色光线
B.金属钠在空气中燃烧时的火焰呈黄色
C.用光束照射胶体时产生光亮的通路
D.焰火在夜空中呈现五彩缤纷的图案
1
2
3
√
4
5
当基态原子的电子吸收能量后,电子会跃迁到较高能级,变成激发态原子;相反,电子从较高能量的激发态跃迁到较低能量的激发态乃至基态时,将释放能量。光是电子跃迁释放能量的重要形式之一。我们看到的许多可见光,如灯光、霓虹灯光、激光、焰火等都与原子核外电子发生跃迁释放能量有关。激光笔产生的红色光线是可见光,与原子核外电子的跃迁有关,故A正确;
金属元素的焰色试验,与原子核外电子的跃迁有关,故B正确;
1
2
3
4
5
用光束照射胶体时产生光亮的通路是胶体的性质,是丁达尔效应,与原子核外电子的跃迁无关,故C错误;
燃放的焰火在夜空中呈现五彩缤纷的图案为金属元素的焰色试验,与原子核外电子的跃迁有关,故D正确。
1
2
3
4
5
5.(1)已知短周期元素A、B,A元素原子的最外层电子数为m,次外层电子数为n;B元素原子的M层(有电子)电子数为m-n-1,L层电子数为m+n+2,则A为___(填元素符号,下同),B为____。
C
Na
1
2
3
4
5
短周期元素的原子最多有三个能层(K、L、M),则A元素原子的次外层只可能为K层或L层,n只可能是2或8,又因为B元素原子的L层电子数为m+n+2,而L层最多容纳8个电子,所以n只能是2。由m+n+2=8,得m=4。故A元素原子的核外电子排布情况为K层2个电子,L层4个电子,则A为C;B元素原子的核外电子排布情况为K层2个电子,L层8个电子,M层1个电子,则B为Na。
1
2
3
4
5
(2)已知X元素原子的L层比Y元素原子的L层少3个电子,Y元素原子的核外电子总数比X元素原子的多5,则X、Y分别为___、____。
N
Mg
由题意知,Y元素原子的最外层是M层,根据核外电子排布规律可知,其L层为次外层时只能排8个电子,则X元素原子的L层有5个电子,其原子核外电子数为2+5=7,故X为N;Y元素原子核外电子数为7+5=12,故Y为Mg。
返回
1
2
3
4
5
课时对点练
题组一 能层的理解与应用
1.在基态多电子原子中,关于核外电子能量的叙述错误的是
A.最易失去的电子能量最高
B.离核最远的电子能量最高
C.p能级电子的能量一定高于s能级电子的能量
D.在离核最近的区域内运动的电子能量最低
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
最易失去的电子,性质活泼,所以能量最高,A正确;
离核最近的区域内运动的电子能量最低,离核最远的区域内运动的电子能量最高,B、D正确;
处于同一能层时,p能级电子的能量一定高于s能级电子的能量,C错误。
2.在同一个原子中,M能层上的电子与Q能层上的电子的能量
A.前者大于后者 B.后者大于前者
C.前者等于后者 D.无法确定
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
3.下列说法中错误的是
A.某原子K层上只有一个电子
B.某离子M层和L层上的电子数均为K层的4倍
C.某原子M层上的电子数为L层电子数的4倍
D.存在核电荷数与最外层电子数相等的离子
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
氢原子K层上只有一个电子,A正确;
Cl-、K+等离子M层和L层上的电子数均为K层的4倍,B正确;
原子核外已有M层,则L层电子全排满,即8个电子,这样M层就有32个电子,而M层为第三层,最多容纳的电子数为18个,C错误;
O2-的核电荷数为8,核外最外层电子数也为8,D正确。
题组二 能层和能级
4.下列有关能层和能级的叙述正确的是
A.M能层有s、p共2个能级,最多能容纳8个电子
B.3d能级最多容纳5个电子,3f能级最多容纳7个电子
C.无论哪一能层的s能级最多容纳的电子数均为2
D.任一能层都有s、p能级,但不一定有d能级
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
A项,M能层有s、p、d共3个能级,最多能容纳 18个电子;
B项,3d能级最多容纳10个电子,从N能层开始有f能级,最多容纳14个电子,不存在3f能级;
C项,每个能层都从s能级开始,且s能级最多容纳2个电子;
D项,K能层只有s能级,没有p能级。
5.某一能层上nd能级最多所能容纳的电子数为
A.6 B.10 C.14 D.15
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
6.总共含有6个能级的能层符号为
A.M B.N C.P D.Q
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
每一能层所含的能级数目=能层序数,所以总共含有6个能级的能层是第六能层,第六能层符号为P。
7.下列能级符号表示正确且最多容纳的电子数按照从少到多的顺序排列的是
A.1s、2p、3d B.1s、2s、3s
C.2s、2p、2d D.3p、3d、3f
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
题组三 原子的基态、激发态与原子光谱
8.下列关于同一种原子的基态和激发态的说法正确的是
A.基态时的能量比激发态时高
B.激发态时比较稳定
C.由基态转化为激发态的过程中吸收能量
D.电子仅在激发态跃迁到基态时才会产生原子光谱
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
同一原子处于激发态时能量较高,较不稳定,A、B不正确;
电子从能量较低的基态跃迁到能量较高的激发态时,也会产生原子光谱,D不正确。
9.(2022·成都高二期中)吸收光谱和发射光谱统称为原子光谱。下列说法错误的是
A.同一种元素原子的吸收光谱和发射光谱的特征谱线相同
B.霓虹灯光与原子核外电子发生跃迁释放能量有关
C.光谱仪可以摄取元素的吸收光谱和发射光谱
D.目前发现的元素都是通过原子光谱发现的
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
同一种元素原子的吸收光谱和发射光谱的特征谱线相同,故A正确;
电子跃迁本质上是组成物质的粒子中电子的一种能量变化,霓虹灯光与原子核外电子发生跃迁释放能量有关,故B正确;
吸收光谱和发射光谱都是线谱,区别在于前者显示黑色线条,而发射光谱显示彩色线条,可以用光谱仪摄取各种元素原子的吸收光谱或发射光谱,故C正确;
每种元素都有特征谱线,在历史上,许多元素是通过原子光谱发现的,如铯和铷,但目前发现的元素并非都是通过原子光谱发现的,故D错误。
10.元素Na的焰色试验呈黄色,从能量变化的角度其光谱类型属于
A.发射光谱 B.吸收光谱
C.连续光谱 D.线状光谱
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
焰色试验是待测物的金属元素吸收能量后,原子中的电子发生跃迁变为激发态,而激发态不稳定,释放能量变为较低能量的激发态或基态,产生发射光谱。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
11.对充有氖气的霓虹灯管通电,灯管发出红色光。产生这一现象的主要原因是
A.电子由较高能量的激发态向较低能量的激发态或基态跃迁时以光的
形式释放能量
B.电子由基态向激发态跃迁时吸收除红光以外的光线
C.氖原子获得电子后转变成发出红光的物质
D.在电流的作用下,氖原子与构成灯管的物质发生反应
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
霓虹灯之所以能发光,是因为电子吸收能量后跃迁到能量较高的能级,能量较高能级上的电子会很快以光的形式释放能量而跃迁回能量较低的能级。
12.下列关于能层和能级的说法正确的是
A.原子核外每一能层最多可容纳的电子数为n2
B.能层序数较大的能级,能量不一定较高
C.同一原子中,1s、2s、3s电子的能量逐渐减小
D.同一原子中,2p、3p、4p能容纳的电子数逐渐增多
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
原子核外每一个能层最多可容纳的电子数为2n2,故A错误;
能层序数较大的能级,能量不一定较高,如4s的能量低于3d,故B正确;
不同能层的s能级,能层序数越大,其能量越高,即能量:1s<2s<3s,故C错误;
同一原子中,2p、3p、4p能容纳的电子数一样多,都为6个,故D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
13.对焰色试验的描述正确的是
A.焰色试验只是金属单质特有的性质
B.焰色试验是化学变化
C.焰色试验是金属原子从基态跃迁到激发态时,将能量以光的形式表
现出来
D.焰色试验是金属原子或离子从较高能量的激发态跃迁到较低能量的
激发态或基态时,将能量以光的形式表现出来的现象
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
焰色试验是大多数金属元素的性质,是物理变化,从基态→激发态要吸收能量,从激发态→基态会释放能量。
14.填空。
(1)用符号填写能层所含能级种类:
K层:____;L层:________;
M层:___________;N层:_______________。
(2)用数字填写能级所能容纳的最多电子数目:
s:____;p:____;d:____;f:___。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
1s
2s、2p
3s、3p、3d
4s、4p、4d、4f
2
6
10
14
(3)比较下列能级的能量高低(填“<”“=”或“>”)。
①4s____3s____2s____1s;
②4f____4d____4p____4s;
③1s____2p____3d____4f。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
>
>
>
>
>
>
<
<
<
15.(1)1861年德国人基尔霍夫(G.R.Kirchhoff)和本生(R.W.Bunsen)研究锂云母的某谱时,发现在深红区有一新线,从而发现了铷元素,他们研究的是__________。
(2)含有钾元素的盐的焰色试验为____色。许多金属盐都可以发生焰色试验,其原因是_______________________________________________
_________________________________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
紫
原子光谱
电子从能量较高的激发态跃迁到能量较低的激发态乃至基态时,以一定波长(可见光区域)光的形式释放能量
16.下表给出了五种元素的相关信息,其中A、B、C、D为短周期元素。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
元素 相关信息
A 在常温、常压下,其单质是气体,随着人类对环境的认识和要求的提高,它将成为备受青睐的清洁燃料
B 工业上通过分离液态空气获得其单质,其某种同素异形体是保护地球地表环境的重要屏障
C 植物生长三要素之一,它能形成多种氧化物,其中一种是早期医疗中使用的麻醉剂
D 室温下其单质是呈黄色的粉末状固体,加热易熔化。该单质在氧气中燃烧,发出明亮的蓝紫色火焰
E 它是人体不可缺少的微量元素,其单质也是日常生产和生活中不可缺少的金属原材料,常用于制造桥梁、楼房等
根据上述信息填空:
(1)B元素的基态原子含有___个能层,其中第二能层中含有的能级:
________;画出D的原子结构示意图:______。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
2
2s、2p
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
氢气是一种清洁燃料,所以A为氢元素;臭氧对紫外线有吸收作用,是保护地球地表环境的重要屏障,所以B为氧元素,其基态原子含有K层与L层2个能层,L层为第二能层,有s、p两个能级(即2s和2p);氮、磷、钾是植物生长三要素,N2O俗名“笑气”,是早期医疗中使用的麻醉剂,所以C为氮元素;单质硫在氧气中燃烧,发出明亮的蓝紫色火焰,所以D为硫元素;日常生产和生活中最常用的金属是铁、铜和铝,其中只有铁是人体不可缺少的微量元素,所以E为铁元素。
(2)C与A形成的某一化合物能和C与B形成的另一无色化合物(这两种化合物分子中的原子个数比皆为1∶2)一起用作火箭助推剂,写出两者发生反应生成无毒物质的化学方程式:____________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
2N2H4+N2O4 3N2+4H2O
氮和氢形成的原子个数比为1∶2的化合物为N2H4,氮和氧形成的原子个数比为1∶2的化合物有NO2和N2O4,其中N2O4是无色气体,NO2是红棕色气体,N2H4和N2O4反应生成无毒的N2和H2O。
(3)某矿藏主要含D、E两种元素组成的化合物,它在空气中高温条件下生成一种有刺激性气味的气体和一种红色氧化物。试写出该反应的化学方程式:______________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
返回
本课结束
第一章
能层与能级 / 基态与激发态 原子光谱 / 随堂演练 知识落实 / 课时对点练
能层与能级 基态与激发态
第一章
第1课时
核心素养
发展目标
1.通过认识原子结构与核外电子排布理解能层与能级的关系。
2.通过核外电子能量不同分析、理解基态与激发态的含义与关系。
3.能辨识光谱与电子跃迁之间的关系。
内容索引
一、能层与能级
二、基态与激发态 原子光谱
随堂演练 知识落实
课时对点练
能层与能级
一
1920年,丹麦科学家玻尔在氢原子模型基础上,提出 ,开启了用原子结构解释 的篇章。1925年以后,玻尔的“壳层”落实为“能层”与“能级”,厘清了核外电子的可能状态,复杂的原子光谱得以诠释。1936年,德国科学家马德隆发表了以 事实为依据的完整的 。
构造原理
元素周期律
原子光谱
构造原理
1.能层
(1)含义:根据核外电子的 不同,将核外电子分为不同的能层。
(2)序号、符号及所能容纳的最多电子数
(3)能量关系
能层越高,电子的能量越高,能量的高低顺序为__________________
。
能量
能层 一 二 三 四 五 六 七
符号 ___ ___ ___ ___ ___ ___ ___
最多电子数 __ __ ___ ___ ____ ____ ____
K
L
M
N
O
P
Q
2
8
18
32
50
72
98
E(K)<E(L)<E(M)
<E(N)<E(O)<E(P)<E(Q)
2.能级
(1)含义:根据多电子原子的同一能层电子的 不同,将它们分为不同能级。
(2)表示方法:分别用相应能层的序数和字母 等表示,如第n能层的能级按能量由低到高的排列顺序为ns、 、 、nf等。
能量
s、p、d、f
np
nd
3.能层、能级与最多容纳的电子数
能层(n) 一 二 三 四 五 六 七 ……
符号 K L M N O P Q ……
能级 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s …… …… …… ……
最多电 子数 2 2 6 2 6 10 2 6 10 14 2 …… …… …… ……
2 8 18 32 …… …… …… 2n2
归纳总结
正误判断
(1)2d表示L层上的d能级( )
(2)同一原子中,1s、2s、3s电子的能量逐渐减小( )
(3)s能级的能量一定比p能级的能量低( )
(4)各能级最多可容纳的电子数按s、p、d、f……的顺序依次为自然数中的奇数序列1、3、5、7……的2倍( )
(5)4s、4p、4d、4f能级的能量的高低顺序为E(4s)<E(4p)<E(4d)<E(4f)( )
×
√
×
×
√
1.以s能级为例,不同能层的s能级之间的能量有何关系?同一能层不同能级间能量有何关系?
提示 不同能层:E(1s)<E(2s)<E(3s)<E(4s)……;同一能层:E(ns)<E(np)<E(nd)<E(nf)……。
深度思考
2.以s、p、d、f为符号的能级分别最多可容纳多少个电子?3d、4d、5d能级所容纳的最多电子数是否相同?
提示 最多容纳的电子数为s能级:2,p能级:6,d能级:10,f能级:14;3d、4d、5d能级所容纳的最多电子数相同。
深度思考
3.第五能层最多可容纳多少个电子?它们分别容纳在几个能级中?
提示 第五能层最多容纳50个电子;它们分别容纳在5个能级中。
深度思考
应用体验
1.N层所含的能级数为
A.2 B.3 C.4 D.5
√
N层为第四能层,有4个能级。
2.(2022·成都高二期中)原子核外的某一能层最多能容纳的电子数目为18,则该能层是
A.K能层 B.L能层
C.O能层 D.M能层
每一能层最多能容纳的电子数目为2n2,所以最多能容纳的电子数目为18的能层是第三能层即M能层。
√
3.下列说法正确的是
A.在同一能层不同能级上的电子,其能量肯定不同
B.各能层的能级都是从s能级开始至f能级结束
C.各能层含有的能级数为n-1
D.各能层含有的电子数为2n2
√
在多电子原子中,同一能层不同能级上的电子具有的能量不同,A项正确;
各能层的能级都是从s能级开始,但不都是至f能级结束,如L能层只有2s、2p两个能级,M能层只有3s、3p、3d三个能级,B项错误;
各能层含有的能级数与能层序数相同,C项错误;
各能层最多容纳的电子数为2n2,D项错误。
返回
基态与激发态 原子光谱
二
1.基态原子与激发态原子
(1)基态原子:处于 状态的原子。
(2)激发态原子:基态原子 能量,它的电子会跃迁到 能级,变为激发态原子。
(3)基态、激发态原子相互间转化的能量变化
吸收
释放
光
最低能量
吸收
较高
2.光谱
(1)光谱的成因及分类
吸收光谱
发射光谱
(2)拓展应用
①霓虹灯发光原理:充有氖气的霓虹灯能发出红光,产生这一现象的原因是通电后在电场作用下,放电管里氖原子中的电子吸收能量后跃迁到能量较高的能级,且处在能量较高的能级上的电子会很快地以光的形式释放能量而跃迁到能量较低的能级上,该光的波长恰好处于可见光区域中的红色波段。
②焰色试验中产生的焰色是电子跃迁的结果,焰色的产生与消失是物理变化,该过程中可能伴随化学变化。焰色发生的过程:基态原子
激发态原子 能量较低的激发态或基态原子。
③光谱分析法鉴定元素的原因
一种元素有一种原子光谱,一种原子光谱对应着一种元素,可以用光谱仪摄取各种元素原子的吸收光谱或发射光谱(总称原子光谱),所以,可以用光谱分析法鉴定元素。
正误判断
(1)光(辐射)是电子跃迁释放能量的重要形式之一( )
(2)霓虹灯光、激光、荧光都与原子核外电子跃迁吸收能量有关( )
(3)产生激光的前提是原子要处于激发态( )
(4)电子跃迁时只吸收能量( )
(5)同一原子处于激发态时的能量一定高于基态时的能量( )
(6)激发态原子的能量较高,极易失去电子,表现出较强的还原性( )
√
√
×
×
√
×
1.许多金属元素都可以发生焰色试验,请用原子结构的知识解释其原因。
提示 基态原子吸收能量,电子从基态跃迁到激发态后,电子从较高能量的激发态跃迁到较低能量的激发态乃至基态时,将能量以光的形式释放出来。
深度思考
2.金属元素的焰色试验属于吸收光谱还是发射光谱?
提示 光(辐射)是电子跃迁释放能量的重要形式之一,焰色试验属于发射光谱。
深度思考
方法规律
电子跃迁的形式
(1)电子吸收能量→从低能级跃迁至较高能级→吸收光谱。
(2)电子从高能级跃迁到低能级→释放能量→发射光谱。
应用体验
1.图中所发生的现象与电子的跃迁无关的是
燃放焰火、霓虹灯、燃烧蜡烛等发出的光都是电子跃迁时能量以光的形式释放出来导致的,而平面镜成像则是光线反射的结果。
√
2.电子由3d能级跃迁至4p能级时,可通过光谱仪直接摄取
A.电子的运动轨迹图像
B.原子的吸收光谱
C.电子体积大小的图像
D.原子的发射光谱
E(3d)
返回
随堂演练 知识落实
1.下列叙述正确的是
A.能级就是电子层
B.每个能层最多可容纳的电子数是2n2
C.同一能层中的不同能级的能量高低相同
D.不同能层中的s能级的能量高低相同
1
2
3
√
4
5
1
2
3
能层是电子层,对于同一能层里能量不同的电子,又将其分为不同的能级,故A错误;
每个能层最多可容纳的电子数是2n2,故B正确;
同一能层里的不同能级,能量按照s、p、d、f……的顺序升高,故C错误;
不同能层中的s能级的能量不同,能层越大,s能级的能量越高,如E(1s)
5
2.以下能级符号正确的是
A.3f B.2d
C.4s D.2f
1
2
3
√
4
5
第三能层有3个能级(3s、3p、3d),没有3f能级,故A错误;
第二能层有2个能级(2s和2p),没有2d、2f能级,故B、D错误;
第四能层有4个能级(4s、4p、4d、4f),故C正确。
1
2
3
4
5
3.N层所含能级数、最多容纳电子数分别为
A.3、18 B.4、24
C.5、32 D.4、32
1
2
3
√
N层含有的能级分别为s、p、d、f,最多可以容纳32个电子,D正确。
4
5
4.(2022·洛阳高二期中)下列现象与原子核外电子的跃迁无关的是
A.激光笔产生红色光线
B.金属钠在空气中燃烧时的火焰呈黄色
C.用光束照射胶体时产生光亮的通路
D.焰火在夜空中呈现五彩缤纷的图案
1
2
3
√
4
5
当基态原子的电子吸收能量后,电子会跃迁到较高能级,变成激发态原子;相反,电子从较高能量的激发态跃迁到较低能量的激发态乃至基态时,将释放能量。光是电子跃迁释放能量的重要形式之一。我们看到的许多可见光,如灯光、霓虹灯光、激光、焰火等都与原子核外电子发生跃迁释放能量有关。激光笔产生的红色光线是可见光,与原子核外电子的跃迁有关,故A正确;
金属元素的焰色试验,与原子核外电子的跃迁有关,故B正确;
1
2
3
4
5
用光束照射胶体时产生光亮的通路是胶体的性质,是丁达尔效应,与原子核外电子的跃迁无关,故C错误;
燃放的焰火在夜空中呈现五彩缤纷的图案为金属元素的焰色试验,与原子核外电子的跃迁有关,故D正确。
1
2
3
4
5
5.(1)已知短周期元素A、B,A元素原子的最外层电子数为m,次外层电子数为n;B元素原子的M层(有电子)电子数为m-n-1,L层电子数为m+n+2,则A为___(填元素符号,下同),B为____。
C
Na
1
2
3
4
5
短周期元素的原子最多有三个能层(K、L、M),则A元素原子的次外层只可能为K层或L层,n只可能是2或8,又因为B元素原子的L层电子数为m+n+2,而L层最多容纳8个电子,所以n只能是2。由m+n+2=8,得m=4。故A元素原子的核外电子排布情况为K层2个电子,L层4个电子,则A为C;B元素原子的核外电子排布情况为K层2个电子,L层8个电子,M层1个电子,则B为Na。
1
2
3
4
5
(2)已知X元素原子的L层比Y元素原子的L层少3个电子,Y元素原子的核外电子总数比X元素原子的多5,则X、Y分别为___、____。
N
Mg
由题意知,Y元素原子的最外层是M层,根据核外电子排布规律可知,其L层为次外层时只能排8个电子,则X元素原子的L层有5个电子,其原子核外电子数为2+5=7,故X为N;Y元素原子核外电子数为7+5=12,故Y为Mg。
返回
1
2
3
4
5
课时对点练
题组一 能层的理解与应用
1.在基态多电子原子中,关于核外电子能量的叙述错误的是
A.最易失去的电子能量最高
B.离核最远的电子能量最高
C.p能级电子的能量一定高于s能级电子的能量
D.在离核最近的区域内运动的电子能量最低
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
最易失去的电子,性质活泼,所以能量最高,A正确;
离核最近的区域内运动的电子能量最低,离核最远的区域内运动的电子能量最高,B、D正确;
处于同一能层时,p能级电子的能量一定高于s能级电子的能量,C错误。
2.在同一个原子中,M能层上的电子与Q能层上的电子的能量
A.前者大于后者 B.后者大于前者
C.前者等于后者 D.无法确定
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
3.下列说法中错误的是
A.某原子K层上只有一个电子
B.某离子M层和L层上的电子数均为K层的4倍
C.某原子M层上的电子数为L层电子数的4倍
D.存在核电荷数与最外层电子数相等的离子
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
氢原子K层上只有一个电子,A正确;
Cl-、K+等离子M层和L层上的电子数均为K层的4倍,B正确;
原子核外已有M层,则L层电子全排满,即8个电子,这样M层就有32个电子,而M层为第三层,最多容纳的电子数为18个,C错误;
O2-的核电荷数为8,核外最外层电子数也为8,D正确。
题组二 能层和能级
4.下列有关能层和能级的叙述正确的是
A.M能层有s、p共2个能级,最多能容纳8个电子
B.3d能级最多容纳5个电子,3f能级最多容纳7个电子
C.无论哪一能层的s能级最多容纳的电子数均为2
D.任一能层都有s、p能级,但不一定有d能级
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
A项,M能层有s、p、d共3个能级,最多能容纳 18个电子;
B项,3d能级最多容纳10个电子,从N能层开始有f能级,最多容纳14个电子,不存在3f能级;
C项,每个能层都从s能级开始,且s能级最多容纳2个电子;
D项,K能层只有s能级,没有p能级。
5.某一能层上nd能级最多所能容纳的电子数为
A.6 B.10 C.14 D.15
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
6.总共含有6个能级的能层符号为
A.M B.N C.P D.Q
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
每一能层所含的能级数目=能层序数,所以总共含有6个能级的能层是第六能层,第六能层符号为P。
7.下列能级符号表示正确且最多容纳的电子数按照从少到多的顺序排列的是
A.1s、2p、3d B.1s、2s、3s
C.2s、2p、2d D.3p、3d、3f
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
题组三 原子的基态、激发态与原子光谱
8.下列关于同一种原子的基态和激发态的说法正确的是
A.基态时的能量比激发态时高
B.激发态时比较稳定
C.由基态转化为激发态的过程中吸收能量
D.电子仅在激发态跃迁到基态时才会产生原子光谱
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
同一原子处于激发态时能量较高,较不稳定,A、B不正确;
电子从能量较低的基态跃迁到能量较高的激发态时,也会产生原子光谱,D不正确。
9.(2022·成都高二期中)吸收光谱和发射光谱统称为原子光谱。下列说法错误的是
A.同一种元素原子的吸收光谱和发射光谱的特征谱线相同
B.霓虹灯光与原子核外电子发生跃迁释放能量有关
C.光谱仪可以摄取元素的吸收光谱和发射光谱
D.目前发现的元素都是通过原子光谱发现的
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
同一种元素原子的吸收光谱和发射光谱的特征谱线相同,故A正确;
电子跃迁本质上是组成物质的粒子中电子的一种能量变化,霓虹灯光与原子核外电子发生跃迁释放能量有关,故B正确;
吸收光谱和发射光谱都是线谱,区别在于前者显示黑色线条,而发射光谱显示彩色线条,可以用光谱仪摄取各种元素原子的吸收光谱或发射光谱,故C正确;
每种元素都有特征谱线,在历史上,许多元素是通过原子光谱发现的,如铯和铷,但目前发现的元素并非都是通过原子光谱发现的,故D错误。
10.元素Na的焰色试验呈黄色,从能量变化的角度其光谱类型属于
A.发射光谱 B.吸收光谱
C.连续光谱 D.线状光谱
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
焰色试验是待测物的金属元素吸收能量后,原子中的电子发生跃迁变为激发态,而激发态不稳定,释放能量变为较低能量的激发态或基态,产生发射光谱。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
11.对充有氖气的霓虹灯管通电,灯管发出红色光。产生这一现象的主要原因是
A.电子由较高能量的激发态向较低能量的激发态或基态跃迁时以光的
形式释放能量
B.电子由基态向激发态跃迁时吸收除红光以外的光线
C.氖原子获得电子后转变成发出红光的物质
D.在电流的作用下,氖原子与构成灯管的物质发生反应
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
霓虹灯之所以能发光,是因为电子吸收能量后跃迁到能量较高的能级,能量较高能级上的电子会很快以光的形式释放能量而跃迁回能量较低的能级。
12.下列关于能层和能级的说法正确的是
A.原子核外每一能层最多可容纳的电子数为n2
B.能层序数较大的能级,能量不一定较高
C.同一原子中,1s、2s、3s电子的能量逐渐减小
D.同一原子中,2p、3p、4p能容纳的电子数逐渐增多
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
原子核外每一个能层最多可容纳的电子数为2n2,故A错误;
能层序数较大的能级,能量不一定较高,如4s的能量低于3d,故B正确;
不同能层的s能级,能层序数越大,其能量越高,即能量:1s<2s<3s,故C错误;
同一原子中,2p、3p、4p能容纳的电子数一样多,都为6个,故D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
13.对焰色试验的描述正确的是
A.焰色试验只是金属单质特有的性质
B.焰色试验是化学变化
C.焰色试验是金属原子从基态跃迁到激发态时,将能量以光的形式表
现出来
D.焰色试验是金属原子或离子从较高能量的激发态跃迁到较低能量的
激发态或基态时,将能量以光的形式表现出来的现象
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
焰色试验是大多数金属元素的性质,是物理变化,从基态→激发态要吸收能量,从激发态→基态会释放能量。
14.填空。
(1)用符号填写能层所含能级种类:
K层:____;L层:________;
M层:___________;N层:_______________。
(2)用数字填写能级所能容纳的最多电子数目:
s:____;p:____;d:____;f:___。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
1s
2s、2p
3s、3p、3d
4s、4p、4d、4f
2
6
10
14
(3)比较下列能级的能量高低(填“<”“=”或“>”)。
①4s____3s____2s____1s;
②4f____4d____4p____4s;
③1s____2p____3d____4f。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
>
>
>
>
>
>
<
<
<
15.(1)1861年德国人基尔霍夫(G.R.Kirchhoff)和本生(R.W.Bunsen)研究锂云母的某谱时,发现在深红区有一新线,从而发现了铷元素,他们研究的是__________。
(2)含有钾元素的盐的焰色试验为____色。许多金属盐都可以发生焰色试验,其原因是_______________________________________________
_________________________________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
紫
原子光谱
电子从能量较高的激发态跃迁到能量较低的激发态乃至基态时,以一定波长(可见光区域)光的形式释放能量
16.下表给出了五种元素的相关信息,其中A、B、C、D为短周期元素。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
元素 相关信息
A 在常温、常压下,其单质是气体,随着人类对环境的认识和要求的提高,它将成为备受青睐的清洁燃料
B 工业上通过分离液态空气获得其单质,其某种同素异形体是保护地球地表环境的重要屏障
C 植物生长三要素之一,它能形成多种氧化物,其中一种是早期医疗中使用的麻醉剂
D 室温下其单质是呈黄色的粉末状固体,加热易熔化。该单质在氧气中燃烧,发出明亮的蓝紫色火焰
E 它是人体不可缺少的微量元素,其单质也是日常生产和生活中不可缺少的金属原材料,常用于制造桥梁、楼房等
根据上述信息填空:
(1)B元素的基态原子含有___个能层,其中第二能层中含有的能级:
________;画出D的原子结构示意图:______。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
2
2s、2p
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
氢气是一种清洁燃料,所以A为氢元素;臭氧对紫外线有吸收作用,是保护地球地表环境的重要屏障,所以B为氧元素,其基态原子含有K层与L层2个能层,L层为第二能层,有s、p两个能级(即2s和2p);氮、磷、钾是植物生长三要素,N2O俗名“笑气”,是早期医疗中使用的麻醉剂,所以C为氮元素;单质硫在氧气中燃烧,发出明亮的蓝紫色火焰,所以D为硫元素;日常生产和生活中最常用的金属是铁、铜和铝,其中只有铁是人体不可缺少的微量元素,所以E为铁元素。
(2)C与A形成的某一化合物能和C与B形成的另一无色化合物(这两种化合物分子中的原子个数比皆为1∶2)一起用作火箭助推剂,写出两者发生反应生成无毒物质的化学方程式:____________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
2N2H4+N2O4 3N2+4H2O
氮和氢形成的原子个数比为1∶2的化合物为N2H4,氮和氧形成的原子个数比为1∶2的化合物有NO2和N2O4,其中N2O4是无色气体,NO2是红棕色气体,N2H4和N2O4反应生成无毒的N2和H2O。
(3)某矿藏主要含D、E两种元素组成的化合物,它在空气中高温条件下生成一种有刺激性气味的气体和一种红色氧化物。试写出该反应的化学方程式:______________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
返回
本课结束
第一章
