第一章第一节 原子结构 第2课时 构造原理与电子排布式 电子云与原子轨道(共84张ppt)
文档属性
| 名称 | 第一章第一节 原子结构 第2课时 构造原理与电子排布式 电子云与原子轨道(共84张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-18 20:56:01 | ||
图片预览










文档简介
(共84张PPT)
构造原理与电子排布式 / 电子云与原子轨道 / 随堂演练 知识落实 / 课时对点练
构造原理与电子排布式
电子云与原子轨道
第一章
第2课时
核心素养
发展目标
1.结合构造原理形成核外电子排布式书写的思维模型,并根据思维模型熟练书写1~36号元素的电子排布式。
2.通过对原子轨道和电子云模型的学习,全面了解核外电子运动状态的描述方法。
内容索引
一、构造原理与电子排布式
二、电子云与原子轨道
随堂演练 知识落实
课时对点练
构造原理与电子排布式
一
1.构造原理
(1)含义
以 事实为基础,从氢开始,随核电荷数递增,新增电子填入
的顺序称为构造原理。
光谱学
能级
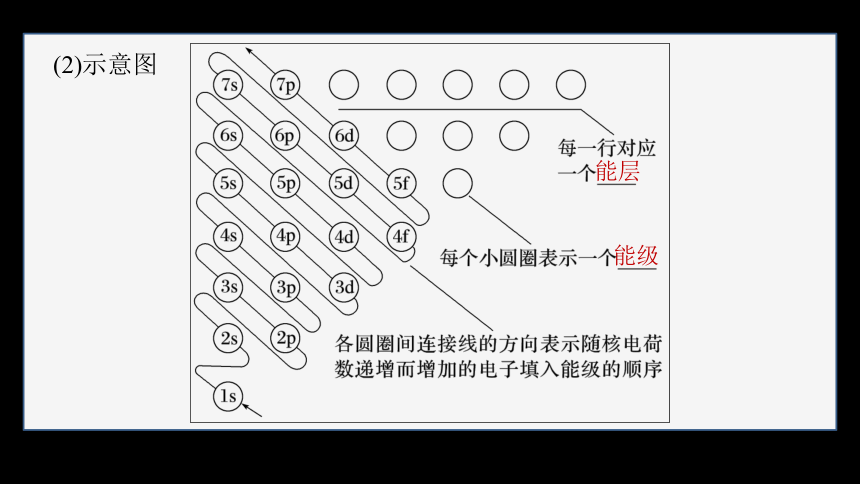
(2)示意图
能层
能级
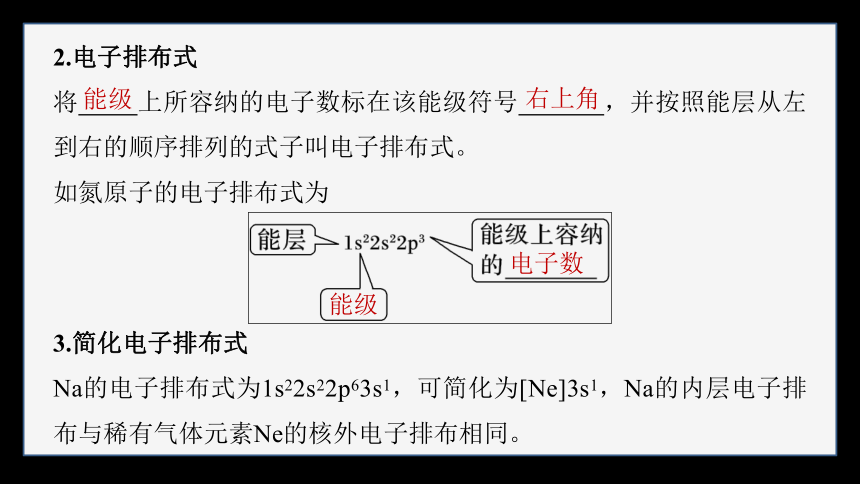
2.电子排布式
将 上所容纳的电子数标在该能级符号 ,并按照能层从左到右的顺序排列的式子叫电子排布式。
如氮原子的电子排布式为
能级
3.简化电子排布式
Na的电子排布式为1s22s22p63s1,可简化为[Ne]3s1,Na的内层电子排布与稀有气体元素Ne的核外电子排布相同。
右上角
电子数
能级
1.根据构造原理,试比较下列能级的能量高低(填“>”或“<”)。
①2p___3p___4p
②4s___4p___4d___4f
③4s___3d
④6s___4f___5d
深度思考
<
<
<
<
<
<
<
<
特别提醒
从构造原理示意图可以看出,从第三能层开始,不同能层的能级出现“能级交错”现象:随核电荷数的递增,电子并不总是填满一个能层后再开始填入下一个能层的。电子是按3p→4s→3d的顺序而不是按3p→3d→4s的顺序填充的。一般规律为ns<(n-2)f<(n-1)d<np,在书写基态原子的电子排布式时,仍按能层顺序书写。
2.根据构造原理,写出下列基态原子的核外电子排布式和简化电子排布式。
(1)8O:____________________;
(2)14Si:________________________;
(3)18Ar:_________________________;
(4)19K:________________________;
(5)21Sc:_____________________________;
(6)26Fe:_____________________________。
深度思考
1s22s22p4、[He]2s22p4
1s22s22p63s23p2、[Ne]3s23p2
1s22s22p63s23p6、[Ne]3s23p6
1s22s22p63s23p64s1、[Ar]4s1
1s22s22p63s23p63d14s2、[Ar]3d14s2
1s22s22p63s23p63d64s2、[Ar]3d64s2
特别提醒
对于较复杂原子的电子排布式,应先按构造原理从低到高排列,然后将同能层的能级移到一起。
3.价层电子排布式
为突出化合价与电子排布的关系,将在化学反应中可能发生电子变动的能级称为价电子层(简称价层)。如:Ni的简化电子排布式为___________,价层电子排布为______,试写出下列原子的价层电子排布:①13Al:________;②32Ge:________;③34Se:________。
深度思考
[Ar]3d84s2
3d84s2
3s23p1
4s24p2
4s24p4
4.写出24Cr、29Cu基态原子的核外电子排布式。它们的电子排布符合构造原理吗?
提示 24Cr:1s22s22p63s23p63d54s1或[Ar]3d54s1,29Cu:1s22s22p63s23p63d104s1或[Ar]3d104s1;均不符合构造原理。
深度思考
思维聚焦
当p、d、f能级处于全空、全充满或半充满状态时,能量相对较低,原子结构较稳定。如24Cr:
应用体验
1.下列各基态原子或离子的电子排布式错误的是
A.Mg2+ 1s22s22p6
B.Br 1s22s22p63s23p63d104s24p5
C.O2- 1s22s22p6
D.Cu 1s22s22p63s23p63d94s2
√
Mg的原子序数为12,基态Mg2+的核外电子排布式为1s22s22p6,故A正确;
35号基态Br原子的电子排布式为1s22s22p63s23p63d104s24p5,故B正确;
O原子核外有8个电子,基态O2-的核外电子排布式为1s22s22p6,最外层达到8电子稳定结构,故C正确;
Cu的3d能级处于全充满状态时较稳定,因此核外电子排布式为1s22s22p63s23p63d104s1,故D错误。
2.某基态原子的电子排布式为1s22s22p63s23p63d54s2,下列说法不正确的是
A.该元素原子中共有25个电子
B.该元素原子核外有4个能层
C.该元素原子最外层共有2个电子
D.该元素原子M能层共有8个电子
√
从电子排布式看,该原子最高能级为4s能级,故有4个能层,最外层有2个电子,B、C正确;
各能级的电子数之和为25,A正确;
M能层电子排布为3s23p63d5,故该能层电子数为13,D错误。
3.(1)基态B原子的电子排布式为______________________。
1s22s22p1(或[He]2s22p1)
B原子的核外有5个电子,电子排布式为1s22s22p1或[He]2s22p1。
(2)基态N原子的价层电子排布式为________。
2s22p3
基态N原子的价层电子排布式为2s22p3。
(3)Se原子的原子序数为____,其M层的电子排布式为__________。
34
3s23p63d10
Se与O同主族,原子序数为34,N层有6个电子,故其M层排满电子,M层的电子排布式为3s23p63d10。
(4)Li3N晶体中氮以N3-形式存在,基态N3-的电子排布式为________。
1s22s22p6
基态N原子的电子排布式为1s22s22p3,则基态N3-的电子排布式为1s22s22p6。
(5)写出基态镓(Ga)原子的电子排布式:________________________
________________。
1s22s22p63s23p63d104s24p1
(或[Ar]3d104s24p1)
Ga为第四周期第ⅢA族元素,故其基态原子最外层电子排布式为4s24p1,基态Ga原子的电子排布式为[Ar]3d104s24p1或1s22s22p63s23p63d104s24p1。
归纳总结
离子的电子排布式
(1)判断该原子变成离子时得到或失去的电子数。
(2)原子失去电子时,总是从能量高的能级失去电子,即失去电子的顺序是由外向里。一般来说,主族元素只失去它们的最外层电子,而副族元素可能还会进一步向里失去内层电子。
(3)原子得到电子形成阴离子,则得到的电子填充在最外层的某一个能级上。如Cl-的电子排布式为1s22s22p63s23p6(得到的电子填充在最外面的3p能级上)。
返回
电子云与原子轨道
二
1.概率密度
1913年,玻尔提出氢原子模型,电子在 上绕核运行。
量子力学指出,一定空间运动状态的电子在核外空间各处都可能出现,但出现的 不同,可用概率密度(ρ)表示,即ρ= (P表示电子在某处出现的概率,V表示该处的体积)。
线性轨道
概率
2.电子云
(1)定义:处于一定 的电子在原子核外空间的概率密度分布的形象化描述。
(2)含义:用单位体积内小点的疏密程度表示电子在原子核外出现的概率大小,小点越密,表示概率密度越大。
空间运动状态
(3)形状
一
球形
哑铃形
3.原子轨道
(1)概念:量子力学把电子在原子核外的一个 称为一个原子轨道。
(2)形状
①s电子的原子轨道呈 形,能层序数越大,原子轨道的半径越 。
空间运动状态
球
大
②p电子的原子轨道呈 形,能层序数越大,原子轨道的半径越大。
(3)各能级所含有的原子轨道数目
能级符号 ns np nd nf
轨道数目 ___ __ __ ___
哑铃
1
3
5
7
正误判断
(1)电子的运动与行星相似,围绕原子核在固定轨道上高速旋转( )
(2)1s的电子云图中一个小点表示一个自由运动的电子( )
(3)2p、3p、4p能级的轨道数依次增多( )
(4)2px、2py、2pz轨道相互垂直,但能量相等( )
×
×
√
×
1.s能级和p能级的原子轨道存在哪些方面的差异?
提示 轨道形状、数目、最多容纳电子数等不同。
深度思考
2.不同能层中的s轨道和p轨道电子云轮廓分别相同吗?能量分别相同吗?
提示 电子云轮廓相同(s轨道均为球形,p轨道均为哑铃形);能量不同(能层序数越大,能量越高)。
深度思考
3.基态原子的核外电子填充在6个轨道的元素有几种?填充在7个轨道中的元素有几种?
提示 s、p能级分别有1、3个原子轨道,按照构造原理,核外电子填充在6个轨道的元素为1s22s22p63s1(Na)和1s22s22p63s2(Mg),共2种;填充在7个轨道中的元素只有1s22s22p63s23p1(Al)一种元素。
深度思考
归纳总结
原子轨道与能层序数的关系
(1)不同能层的相同能级的原子轨道形状相同,只是半径不同。能层序数n越大,原子轨道的半径越大。如:
(2)s能级只有1个原子轨道。p能级有3个原子轨道,它们互相垂直,分别以px、py、pz表示。在同一能层中px、py、pz的能量相同。
(3)在同一能层,原子轨道数与能层序数(n)的关系:原子轨道数目=n2。
应用体验
1.图1和图2分别是1s电子的概率密度分布图和原子轨道图。下列有关说法正确的是
A.图1中的每个小点表示1个电子
B.图2表示1s电子只能在球体内出现
C.图2表明1s轨道呈球形,有无数条对称轴
D.图1中的小点表示电子在核外所处的位置
√
小点表示原子核外空间各电子出现的概率,故A、D错误;
在球体内出现该电子的概率约为90%,球体外出现该电子的概率约为10%,故B错误;
1s轨道呈球形,球形有无数条对称轴,故C正确。
2.下列有关电子云和原子轨道的说法正确的是
A.原子核外的电子像云雾一样笼罩在原子核周围,故称电子云
B.s能级的原子轨道呈球形,处在该轨道上的电子只能在球壳内运动
C.与s电子原子轨道相同,p电子原子轨道的平均半径也随能层的增大而
增大
D.基态原子电子能量的高低顺序为E(1s)<E(2s)<E(2px)<E(2py)<E(2pz)
√
电子云是处于一定空间运动状态的电子在原子核外空间的概率密度分布的形象化描述,故A错误;
s能级的原子轨道呈球形,处在该轨道上的电子不只在球壳内运动,还在球壳外运动,只是在球壳外运动的概率较小,故B错误;
离原子核越远的电子,其能量越大,所以p原子轨道电子的平均半径随能层的增大而增大,故C正确;
2px、2py、2pz轨道是3个不同的原子轨道,空间伸展方向不同,3个轨道上的电子的运动状态不同,但同一能级上的原子轨道具有相同的能量,所以基态原子电子能量:E(1s)<E(2s)<E(2px)=E(2py)=E(2pz),故D错误。
3.元素X的基态原子最外层电子排布式为nsnnpn+1。试回答下列各题:
(1)电子排布式中的n=___;原子中能量最高的是____电子,其电子云在空间有___________________方向,原子轨道呈_____形。
(2)元素X的名称是____。
元素X的基态原子最外层电子排布式为nsnnpn+1,根据核外电子排布规律可知n=2,则X是N。
返回
2
2p
三种互相垂直的伸展
哑铃
氮
随堂演练 知识落实
1.北京奥运会主体育场“鸟巢”使用了高强度、高性能的钒氮合金高新钢。钒原子的价层电子排布为
A.3s23p6 B.3d34s2
C.3d64s2 D.4s2
1
2
3
钒原子的电子排布式为1s22s22p63s23p63d34s2,其价层电子排布为3d34s2。
4
√
2.元素的原子失去最外层电子形成阳离子,元素的原子得到电子填充在最外层形成阴离子。下列各基态原子或离子的电子排布式错误的是
A.Ca2+:1s22s22p63s23p6
B.O2-:1s22s22p4
C.Cl-:[Ne]3s23p6
D.Ar:1s22s22p63s23p6
1
2
3
4
√
基态氧原子的电子排布式为1s22s22p4,故基态O2-的电子排布式应为1s22s22p6。
1
2
3
4
3.下列有关原子轨道和电子云的说法正确的是
A.s轨道呈球形,随能层序数的增加,s轨道数也增加
B.p轨道呈哑铃形,p轨道电子绕核做“∞”形运动
C.电子云是笼罩在原子核外的云雾
D.电子云轮廓图中小点的疏密程度表示电子在原子核外空间出现概率的
大小
1
2
3
4
√
1
2
3
4
任何能层的s能级都有1个原子轨道,与能层序数的大小无关,故A错误;
电子在p轨道上绕核高速运动,不是做“∞”形运动,故B错误;
电子云不是笼罩在原子核外的云雾,是表示电子出现的概率,小点的疏密表示电子在核外单位体积的空间出现的概率多少,故C错误;
电子云轮廓图中,小点的疏密不表示电子的多少,而是表示电子在原子核外空间出现概率的大小,疏的区域表示电子出现的概率小,密的区域表示电子出现的概率大,故D正确。
4.A、B、C、D是四种短周期元素。A、B、C同周期,C、D同主族,A
的原子结构示意图为 ,B是同周期除稀有气体外半径最大的元素,
C的最外层有五个电子。回答下列问题:
(1)A为____(写出元素符号,下同)。
(2)B为____,简化电子排布式是_______。
(3)C为___,核外电子排布式是__________________________。
(4)D为___,价层电子排布式是_______。
1
2
3
4
Si
Na
[Ne]3s1
P
1s22s22p63s23p3(或[Ne]3s23p3)
N
2s22p3
A、B、C、D是四种短周期元素,由A的原子结构示意图可知,x=2,A的原子序数为14,故A为Si元素;A、B、C同周期,B是同周期除稀有气体外半径最大的元素,故B为Na元素,C的最外层有五个电子,故C为P元素;C、D同主族,故D为N元素。
1
2
3
4
返回
课时对点练
题组一 构造原理的应用
1.构造原理揭示的电子排布能级顺序,实质是各能级能量高低。若以E表示某能级的能量,以下各式中正确的是
A.E(5s)>E(4f)>E(4s)>E(3d)
B.E(3d)>E(4s)>E(3p)>E(3s)
C.E(4s)D.E(5s)>E(4s)>E(4f)>E(3d)
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
17
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
根据构造原理,各能级能量由高到低的顺序为1s、2s、2p、3s、3p、4s、3d、4p、5s……,A项和D项正确顺序为E(4f)>E(5s)>E(3d)>E(4s);对于不同能层的相同能级,能层序数越大,能量越高,故C项错误。
17
2.以下电子排布式是基态原子的电子排布的是
①1s12s1 ②1s22s12p1 ③1s22s22p63s2 ④1s22s22p63s23p1
A.①② B.①③ C.②③ D.③④
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
①基态原子的电子排布式应为1s2,发生电子跃迁为1s12s1,错误;
②基态原子的电子排布式应为1s22s2,发生电子跃迁为1s22s12p1,错误;
③④符合基态原子电子排布规律,正确。
17
3.表示一个原子在M能层上有10个电子,可以写成
A.3p6 B.3d10
C.3s23p63d24s2 D.3s23p64s2
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
M能层为第三能层,每一能层中的电子按照能级从低到高的顺序进行排列。所以应该先排3s,然后3p,然后是4s,最后是3d,C项正确。
17
4.下列各项中,前面的能级先填入电子的为
①3d和4s ②4p和5s ③5s和4d ④5p和4d
A.①② B.②③ C.②④ D.③④
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
原子核外电子优先占有能量低的轨道,轨道能量的高低由能层和能级决定。能量:①中3d>4s,②中:4p<5s,③中:5s<4d,④中:5p>4d;故B正确。
17
5.某微粒的核外电子排布式为1s22s22p63s23p6,下列关于该微粒的说法正确的是
A.它的质子数一定是18
B.它的原子和37Cl可能互为同位素
C.它的单质一定是强还原剂
D.可以确定该微粒为Ar
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
此微粒核外共有18个电子,可能是原子也可能是离子,若为离子,可能为Ca2+、K+、S2-、Cl-、P3-等。
17
6.某元素的基态原子的M能层p能级上有4个电子,下列有关该原子的叙述错误的是
A.该原子的N能层不含电子
B.该原子容易得到2个电子
C.该原子的L能层一定有8个电子
D.该原子的最外层上有4个电子
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
17
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
根据构造原理可知,该原子的电子排布式为1s22s22p63s23p4,则该原子的L能层有8个电子,N能层不含电子,最外层上有6个电子,容易得到2个电子,故D项错误。
17
7.下列元素基态原子的简化电子排布式中,前者一定是金属元素,后者一定是非金属元素的是
A.[Ne]3s23p2 [Ne]3s2
B.[Ar]4s1 [Ne]3s23p4
C.[Ne]3s23p1 [Ar]4s2
D.[He]2s22p4 [Ne]3s23p5
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
17
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
A项,两种元素分别为Si、Mg,Si为非金属元素,Mg为金属元素;
B项,两种元素分别为K、S,符合题意;
C项,两种元素分别为Al、Ca,均为金属元素;
D项,两种元素分别为O、Cl,均为非金属元素。
17
题组二 电子云与原子轨道
8.符号3px所代表的含义是
A.px轨道上有3个电子
B.第三能层px轨道有3个伸展方向
C.px电子云有3个伸展方向
D.第三能层沿x轴方向伸展的p轨道
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
17
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
p能级有3个轨道,沿x、y、z轴三个不同的方向延伸,3px所代表的含义是第三能层沿x轴方向伸展的p轨道,最多只能容纳2个电子。
17
9.(2022·河南驻马店高二期中)下列说法正确的是
A.1s与2s轨道最多容纳的电子数不同
B.3p与2p的原子轨道都是哑铃形
C.p轨道电子能量一定比s轨道电子能量大
D.电子云表示的是电子在原子核外空间的运动轨道
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
17
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
每个能层最多容纳的电子数为2n2(n为能层序数),s能级最多容纳的电子数是2,则1s、2s轨道最多容纳的电子数都是2,故A错误;
不同能层的p轨道的形状和数目相同,则3p轨道和2p轨道都呈哑铃形,故B正确;
电子能量与能层和能级有关,电子离核越远能量越高,则p轨道电子的能量不一定高于s轨道电子的能量,如2p小于3s,故C错误;
电子云表示电子在核外单位体积的空间出现的概率大小,电子在原子核外的运动是无规则的,则电子云不能表示电子在原子核外空间的运动轨道,故D错误。
17
10.下列有关原子轨道的叙述正确的是
A.氢原子的2s轨道能量较3p轨道高
B.能层n=4的原子轨道最多可容纳16个电子
C.p能级的原子轨道呈哑铃形,随着能层序数的增加,p能级原子轨道
也在增多
D.锂原子的2s与5s轨道皆呈球形
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
17
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
氢原子2s轨道的能量低于3p轨道,故A错误;
每个能层最多能容纳2n2个电子,所以能层n=4的原子轨道最多可容纳32个电子,故B错误;
所有的p能级都含有3个轨道,所以随着能层序数的增加,p能级原子轨道数不变,故C错误;
所有的s轨道电子云轮廓图都是球形,所以锂原子的2s与5s轨道皆呈球形,故D正确。
17
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
11.下列说法正确的是
A.1s电子云呈球形,表示电子绕原子核做圆周运动
B.ns能级的原子轨道图可表示为
C.3d3表示3d能级有3个轨道
D.电子云图中的小点越密,说明该原子核外空间电子数目越多
√
17
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
电子云表示电子在核外空间某处出现的概率,不代表电子的运动轨迹,故A错误;
ns能级的电子云呈球形,所以可以用该图表示该能级的原子轨道,故B正确;
3d3表示3d能级有3个电子,故C错误;
电子云图中小点的疏密表示电子出现概率的大小,密则概率大,疏则概率小,故D错误。
17
12.硫离子核外具有多少种不同能量的电子
A.16种 B.18种 C.2种 D.5种
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
硫离子是由硫原子得到两个电子形成的,核内质子数是16,核外电子分三层排布,第一层2个,第二层8个,第三层8个,离子结构示意图为
,核外电子排布式为1s22s22p63s23p6,不同能级上的电子具有不同
的能量,所以核外有5种不同能量的电子。
17
13.X、Y两元素可形成X2Y3型化合物,则X、Y原子处于基态时的最外层电子排布式可能是
A.X:3s23p1 Y:3s23p5
B.X:2s22p3 Y:2s22p4
C.X:3s23p2 Y:3s23p4
D.X:3s2 Y:2s22p3
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
17
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
X为Al,Y为Cl,形成的化合物为AlCl3,A项不可能;
X为N,Y为O,可形成化合物N2O3,B项可能;
X为Si,Y为S,不能形成X2Y3型化合物,C项不可能;
X为Mg,Y为N,可形成化合物Mg3N2,不能形成X2Y3型化合物,D项不可能。
17
14.X、Y、Z三种短周期元素原子的最外层电子排布式分别为ns1、3s23p1和2s22p4,由这三种元素组成的化合物的化学式可能是
A.X2YZ3 B.X2YZ2
C.XYZ2 D.XYZ3
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
原子的最外层电子排布式为3s23p1和2s22p4的元素分别是Al和O,它们形成化合物时的常见化合价分别为+3、-2,最外层电子排布式为ns1的短周期元素形成化合物时的化合价为+1,根据化合物中元素化合价代数和为0的原则可知C项符合题意。
17
15.完成下列各题。
(1)基态Zn原子核外电子排布式为_______________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
Zn为30号元素,原子核外有30个电子,基态Zn原子的核外电子排布式为1s22s22p63s23p63d104s2或[Ar]3d104s2。
1s22s22p63s23p63d104s2(或[Ar]3d104s2)
17
(2)Fe成为阳离子时首先失去________轨道电子,Sm的价层电子排布式为4f66s2,Sm3+的价层电子排布式为______。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
Fe为26号元素,基态Fe原子的核外电子排布式为[Ar]3d64s2,成为阳离子时首先失去最外层电子,即4s轨道的电子;Sm的价层电子排布式为4f66s2,失去6s轨道上两个电子以及4f轨道上1个电子后形成Sm3+,所以Sm3+的价层电子排布式为4f5。
4s
4f5
17
(3)基态Fe2+核外电子排布式为___________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
由(2)可知,基态Fe2+的核外电子排布式为1s22s22p63s23p63d6或[Ar]3d6。
1s22s22p63s23p63d6(或[Ar]3d6)
17
(4)基态K原子中,核外电子占据的最高能层的符号是_____。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
K为19号元素,核外电子排布式为[Ar]4s1,核外电子占据的最高能层为第四能层,符号为N。
N
17
(5)基态Ge原子的核外电子排布式为[Ar]__________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
Ge为32号元素,核外有32个电子,基态Ge原子的电子排布式为[Ar]3d104s24p2。
3d104s24p2
17
(6)写出基态Se原子的核外电子排布式:_______________________
________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
Se为34号元素,核外有34个电子,基态Se原子的核外电子排布式为1s22s22p63s23p63d104s24p4或[Ar]3d104s24p4。
1s22s22p63s23p63d104s24p4
(或[Ar]3d104s24p4)
17
16.推导下列元素,回答有关问题:
(1)具有1个4p电子的元素为____(写元素名称,下同)。
(2)N层只有1个电子的主族元素是____,其氯化物的焰色试验呈____色。
(3)3d能级全充满,4s能级只有1个电子的元素为____,原子序数为___。
(4)原子序数小于36的元素X和Y,在周期表中既处于同一周期又位于同一族,且Y的原子序数比X大2,则Y的基态原子的价层电子排布式是_______,X在参与化学反应时,1个原子失去的电子数为________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
镓
钾
紫
铜
29
3d84s2
2个或3个
17
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
原子序数小于36的元素X和Y,在周期表中既处于同一周期又位于同一族,且Y的原子序数比X大2,则X为Fe、Y为Ni;Ni基态原子的电子排布式是1s22s22p63s23p63d84s2或[Ar]3d84s2,Ni基态原子的价层电子排布式是3d84s2;Fe基态原子的电子排布式是1s22s22p63s23p63d64s2,Fe基态原子的价层电子排布是3d64s2,参与化学反应时,失去2个或3个电子,表现为+2价或+3价。
17
17.有几种元素的基态粒子核外电子排布式为1s22s22p63s23p6,其中:
(1)某粒子一般不与其他元素的原子反应,这种粒子的符号是_____。
(2)某粒子的盐溶液能使溴水褪色,并出现浑浊,这种粒子的符号是____。
(3)某粒子还原性虽弱,但失去电子后氧化性很强,且这种元素的原子得到一个电子即达到稳定结构,这种粒子的符号是_____。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
Ar
S2-
Cl-
17
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
返回
符合题述核外电子排布式的粒子中,很难发生化学反应的应为稀有气体Ar;能使溴水褪色,应为还原性较强的S2-,发生反应:S2-+Br2===S↓+2Br-;原子得到一个电子即达到稳定结构,该粒子应为Cl-。
17
本课结束
第一章
构造原理与电子排布式 / 电子云与原子轨道 / 随堂演练 知识落实 / 课时对点练
构造原理与电子排布式
电子云与原子轨道
第一章
第2课时
核心素养
发展目标
1.结合构造原理形成核外电子排布式书写的思维模型,并根据思维模型熟练书写1~36号元素的电子排布式。
2.通过对原子轨道和电子云模型的学习,全面了解核外电子运动状态的描述方法。
内容索引
一、构造原理与电子排布式
二、电子云与原子轨道
随堂演练 知识落实
课时对点练
构造原理与电子排布式
一
1.构造原理
(1)含义
以 事实为基础,从氢开始,随核电荷数递增,新增电子填入
的顺序称为构造原理。
光谱学
能级
(2)示意图
能层
能级
2.电子排布式
将 上所容纳的电子数标在该能级符号 ,并按照能层从左到右的顺序排列的式子叫电子排布式。
如氮原子的电子排布式为
能级
3.简化电子排布式
Na的电子排布式为1s22s22p63s1,可简化为[Ne]3s1,Na的内层电子排布与稀有气体元素Ne的核外电子排布相同。
右上角
电子数
能级
1.根据构造原理,试比较下列能级的能量高低(填“>”或“<”)。
①2p___3p___4p
②4s___4p___4d___4f
③4s___3d
④6s___4f___5d
深度思考
<
<
<
<
<
<
<
<
特别提醒
从构造原理示意图可以看出,从第三能层开始,不同能层的能级出现“能级交错”现象:随核电荷数的递增,电子并不总是填满一个能层后再开始填入下一个能层的。电子是按3p→4s→3d的顺序而不是按3p→3d→4s的顺序填充的。一般规律为ns<(n-2)f<(n-1)d<np,在书写基态原子的电子排布式时,仍按能层顺序书写。
2.根据构造原理,写出下列基态原子的核外电子排布式和简化电子排布式。
(1)8O:____________________;
(2)14Si:________________________;
(3)18Ar:_________________________;
(4)19K:________________________;
(5)21Sc:_____________________________;
(6)26Fe:_____________________________。
深度思考
1s22s22p4、[He]2s22p4
1s22s22p63s23p2、[Ne]3s23p2
1s22s22p63s23p6、[Ne]3s23p6
1s22s22p63s23p64s1、[Ar]4s1
1s22s22p63s23p63d14s2、[Ar]3d14s2
1s22s22p63s23p63d64s2、[Ar]3d64s2
特别提醒
对于较复杂原子的电子排布式,应先按构造原理从低到高排列,然后将同能层的能级移到一起。
3.价层电子排布式
为突出化合价与电子排布的关系,将在化学反应中可能发生电子变动的能级称为价电子层(简称价层)。如:Ni的简化电子排布式为___________,价层电子排布为______,试写出下列原子的价层电子排布:①13Al:________;②32Ge:________;③34Se:________。
深度思考
[Ar]3d84s2
3d84s2
3s23p1
4s24p2
4s24p4
4.写出24Cr、29Cu基态原子的核外电子排布式。它们的电子排布符合构造原理吗?
提示 24Cr:1s22s22p63s23p63d54s1或[Ar]3d54s1,29Cu:1s22s22p63s23p63d104s1或[Ar]3d104s1;均不符合构造原理。
深度思考
思维聚焦
当p、d、f能级处于全空、全充满或半充满状态时,能量相对较低,原子结构较稳定。如24Cr:
应用体验
1.下列各基态原子或离子的电子排布式错误的是
A.Mg2+ 1s22s22p6
B.Br 1s22s22p63s23p63d104s24p5
C.O2- 1s22s22p6
D.Cu 1s22s22p63s23p63d94s2
√
Mg的原子序数为12,基态Mg2+的核外电子排布式为1s22s22p6,故A正确;
35号基态Br原子的电子排布式为1s22s22p63s23p63d104s24p5,故B正确;
O原子核外有8个电子,基态O2-的核外电子排布式为1s22s22p6,最外层达到8电子稳定结构,故C正确;
Cu的3d能级处于全充满状态时较稳定,因此核外电子排布式为1s22s22p63s23p63d104s1,故D错误。
2.某基态原子的电子排布式为1s22s22p63s23p63d54s2,下列说法不正确的是
A.该元素原子中共有25个电子
B.该元素原子核外有4个能层
C.该元素原子最外层共有2个电子
D.该元素原子M能层共有8个电子
√
从电子排布式看,该原子最高能级为4s能级,故有4个能层,最外层有2个电子,B、C正确;
各能级的电子数之和为25,A正确;
M能层电子排布为3s23p63d5,故该能层电子数为13,D错误。
3.(1)基态B原子的电子排布式为______________________。
1s22s22p1(或[He]2s22p1)
B原子的核外有5个电子,电子排布式为1s22s22p1或[He]2s22p1。
(2)基态N原子的价层电子排布式为________。
2s22p3
基态N原子的价层电子排布式为2s22p3。
(3)Se原子的原子序数为____,其M层的电子排布式为__________。
34
3s23p63d10
Se与O同主族,原子序数为34,N层有6个电子,故其M层排满电子,M层的电子排布式为3s23p63d10。
(4)Li3N晶体中氮以N3-形式存在,基态N3-的电子排布式为________。
1s22s22p6
基态N原子的电子排布式为1s22s22p3,则基态N3-的电子排布式为1s22s22p6。
(5)写出基态镓(Ga)原子的电子排布式:________________________
________________。
1s22s22p63s23p63d104s24p1
(或[Ar]3d104s24p1)
Ga为第四周期第ⅢA族元素,故其基态原子最外层电子排布式为4s24p1,基态Ga原子的电子排布式为[Ar]3d104s24p1或1s22s22p63s23p63d104s24p1。
归纳总结
离子的电子排布式
(1)判断该原子变成离子时得到或失去的电子数。
(2)原子失去电子时,总是从能量高的能级失去电子,即失去电子的顺序是由外向里。一般来说,主族元素只失去它们的最外层电子,而副族元素可能还会进一步向里失去内层电子。
(3)原子得到电子形成阴离子,则得到的电子填充在最外层的某一个能级上。如Cl-的电子排布式为1s22s22p63s23p6(得到的电子填充在最外面的3p能级上)。
返回
电子云与原子轨道
二
1.概率密度
1913年,玻尔提出氢原子模型,电子在 上绕核运行。
量子力学指出,一定空间运动状态的电子在核外空间各处都可能出现,但出现的 不同,可用概率密度(ρ)表示,即ρ= (P表示电子在某处出现的概率,V表示该处的体积)。
线性轨道
概率
2.电子云
(1)定义:处于一定 的电子在原子核外空间的概率密度分布的形象化描述。
(2)含义:用单位体积内小点的疏密程度表示电子在原子核外出现的概率大小,小点越密,表示概率密度越大。
空间运动状态
(3)形状
一
球形
哑铃形
3.原子轨道
(1)概念:量子力学把电子在原子核外的一个 称为一个原子轨道。
(2)形状
①s电子的原子轨道呈 形,能层序数越大,原子轨道的半径越 。
空间运动状态
球
大
②p电子的原子轨道呈 形,能层序数越大,原子轨道的半径越大。
(3)各能级所含有的原子轨道数目
能级符号 ns np nd nf
轨道数目 ___ __ __ ___
哑铃
1
3
5
7
正误判断
(1)电子的运动与行星相似,围绕原子核在固定轨道上高速旋转( )
(2)1s的电子云图中一个小点表示一个自由运动的电子( )
(3)2p、3p、4p能级的轨道数依次增多( )
(4)2px、2py、2pz轨道相互垂直,但能量相等( )
×
×
√
×
1.s能级和p能级的原子轨道存在哪些方面的差异?
提示 轨道形状、数目、最多容纳电子数等不同。
深度思考
2.不同能层中的s轨道和p轨道电子云轮廓分别相同吗?能量分别相同吗?
提示 电子云轮廓相同(s轨道均为球形,p轨道均为哑铃形);能量不同(能层序数越大,能量越高)。
深度思考
3.基态原子的核外电子填充在6个轨道的元素有几种?填充在7个轨道中的元素有几种?
提示 s、p能级分别有1、3个原子轨道,按照构造原理,核外电子填充在6个轨道的元素为1s22s22p63s1(Na)和1s22s22p63s2(Mg),共2种;填充在7个轨道中的元素只有1s22s22p63s23p1(Al)一种元素。
深度思考
归纳总结
原子轨道与能层序数的关系
(1)不同能层的相同能级的原子轨道形状相同,只是半径不同。能层序数n越大,原子轨道的半径越大。如:
(2)s能级只有1个原子轨道。p能级有3个原子轨道,它们互相垂直,分别以px、py、pz表示。在同一能层中px、py、pz的能量相同。
(3)在同一能层,原子轨道数与能层序数(n)的关系:原子轨道数目=n2。
应用体验
1.图1和图2分别是1s电子的概率密度分布图和原子轨道图。下列有关说法正确的是
A.图1中的每个小点表示1个电子
B.图2表示1s电子只能在球体内出现
C.图2表明1s轨道呈球形,有无数条对称轴
D.图1中的小点表示电子在核外所处的位置
√
小点表示原子核外空间各电子出现的概率,故A、D错误;
在球体内出现该电子的概率约为90%,球体外出现该电子的概率约为10%,故B错误;
1s轨道呈球形,球形有无数条对称轴,故C正确。
2.下列有关电子云和原子轨道的说法正确的是
A.原子核外的电子像云雾一样笼罩在原子核周围,故称电子云
B.s能级的原子轨道呈球形,处在该轨道上的电子只能在球壳内运动
C.与s电子原子轨道相同,p电子原子轨道的平均半径也随能层的增大而
增大
D.基态原子电子能量的高低顺序为E(1s)<E(2s)<E(2px)<E(2py)<E(2pz)
√
电子云是处于一定空间运动状态的电子在原子核外空间的概率密度分布的形象化描述,故A错误;
s能级的原子轨道呈球形,处在该轨道上的电子不只在球壳内运动,还在球壳外运动,只是在球壳外运动的概率较小,故B错误;
离原子核越远的电子,其能量越大,所以p原子轨道电子的平均半径随能层的增大而增大,故C正确;
2px、2py、2pz轨道是3个不同的原子轨道,空间伸展方向不同,3个轨道上的电子的运动状态不同,但同一能级上的原子轨道具有相同的能量,所以基态原子电子能量:E(1s)<E(2s)<E(2px)=E(2py)=E(2pz),故D错误。
3.元素X的基态原子最外层电子排布式为nsnnpn+1。试回答下列各题:
(1)电子排布式中的n=___;原子中能量最高的是____电子,其电子云在空间有___________________方向,原子轨道呈_____形。
(2)元素X的名称是____。
元素X的基态原子最外层电子排布式为nsnnpn+1,根据核外电子排布规律可知n=2,则X是N。
返回
2
2p
三种互相垂直的伸展
哑铃
氮
随堂演练 知识落实
1.北京奥运会主体育场“鸟巢”使用了高强度、高性能的钒氮合金高新钢。钒原子的价层电子排布为
A.3s23p6 B.3d34s2
C.3d64s2 D.4s2
1
2
3
钒原子的电子排布式为1s22s22p63s23p63d34s2,其价层电子排布为3d34s2。
4
√
2.元素的原子失去最外层电子形成阳离子,元素的原子得到电子填充在最外层形成阴离子。下列各基态原子或离子的电子排布式错误的是
A.Ca2+:1s22s22p63s23p6
B.O2-:1s22s22p4
C.Cl-:[Ne]3s23p6
D.Ar:1s22s22p63s23p6
1
2
3
4
√
基态氧原子的电子排布式为1s22s22p4,故基态O2-的电子排布式应为1s22s22p6。
1
2
3
4
3.下列有关原子轨道和电子云的说法正确的是
A.s轨道呈球形,随能层序数的增加,s轨道数也增加
B.p轨道呈哑铃形,p轨道电子绕核做“∞”形运动
C.电子云是笼罩在原子核外的云雾
D.电子云轮廓图中小点的疏密程度表示电子在原子核外空间出现概率的
大小
1
2
3
4
√
1
2
3
4
任何能层的s能级都有1个原子轨道,与能层序数的大小无关,故A错误;
电子在p轨道上绕核高速运动,不是做“∞”形运动,故B错误;
电子云不是笼罩在原子核外的云雾,是表示电子出现的概率,小点的疏密表示电子在核外单位体积的空间出现的概率多少,故C错误;
电子云轮廓图中,小点的疏密不表示电子的多少,而是表示电子在原子核外空间出现概率的大小,疏的区域表示电子出现的概率小,密的区域表示电子出现的概率大,故D正确。
4.A、B、C、D是四种短周期元素。A、B、C同周期,C、D同主族,A
的原子结构示意图为 ,B是同周期除稀有气体外半径最大的元素,
C的最外层有五个电子。回答下列问题:
(1)A为____(写出元素符号,下同)。
(2)B为____,简化电子排布式是_______。
(3)C为___,核外电子排布式是__________________________。
(4)D为___,价层电子排布式是_______。
1
2
3
4
Si
Na
[Ne]3s1
P
1s22s22p63s23p3(或[Ne]3s23p3)
N
2s22p3
A、B、C、D是四种短周期元素,由A的原子结构示意图可知,x=2,A的原子序数为14,故A为Si元素;A、B、C同周期,B是同周期除稀有气体外半径最大的元素,故B为Na元素,C的最外层有五个电子,故C为P元素;C、D同主族,故D为N元素。
1
2
3
4
返回
课时对点练
题组一 构造原理的应用
1.构造原理揭示的电子排布能级顺序,实质是各能级能量高低。若以E表示某能级的能量,以下各式中正确的是
A.E(5s)>E(4f)>E(4s)>E(3d)
B.E(3d)>E(4s)>E(3p)>E(3s)
C.E(4s)
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
17
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
根据构造原理,各能级能量由高到低的顺序为1s、2s、2p、3s、3p、4s、3d、4p、5s……,A项和D项正确顺序为E(4f)>E(5s)>E(3d)>E(4s);对于不同能层的相同能级,能层序数越大,能量越高,故C项错误。
17
2.以下电子排布式是基态原子的电子排布的是
①1s12s1 ②1s22s12p1 ③1s22s22p63s2 ④1s22s22p63s23p1
A.①② B.①③ C.②③ D.③④
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
①基态原子的电子排布式应为1s2,发生电子跃迁为1s12s1,错误;
②基态原子的电子排布式应为1s22s2,发生电子跃迁为1s22s12p1,错误;
③④符合基态原子电子排布规律,正确。
17
3.表示一个原子在M能层上有10个电子,可以写成
A.3p6 B.3d10
C.3s23p63d24s2 D.3s23p64s2
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
M能层为第三能层,每一能层中的电子按照能级从低到高的顺序进行排列。所以应该先排3s,然后3p,然后是4s,最后是3d,C项正确。
17
4.下列各项中,前面的能级先填入电子的为
①3d和4s ②4p和5s ③5s和4d ④5p和4d
A.①② B.②③ C.②④ D.③④
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
原子核外电子优先占有能量低的轨道,轨道能量的高低由能层和能级决定。能量:①中3d>4s,②中:4p<5s,③中:5s<4d,④中:5p>4d;故B正确。
17
5.某微粒的核外电子排布式为1s22s22p63s23p6,下列关于该微粒的说法正确的是
A.它的质子数一定是18
B.它的原子和37Cl可能互为同位素
C.它的单质一定是强还原剂
D.可以确定该微粒为Ar
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
此微粒核外共有18个电子,可能是原子也可能是离子,若为离子,可能为Ca2+、K+、S2-、Cl-、P3-等。
17
6.某元素的基态原子的M能层p能级上有4个电子,下列有关该原子的叙述错误的是
A.该原子的N能层不含电子
B.该原子容易得到2个电子
C.该原子的L能层一定有8个电子
D.该原子的最外层上有4个电子
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
17
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
根据构造原理可知,该原子的电子排布式为1s22s22p63s23p4,则该原子的L能层有8个电子,N能层不含电子,最外层上有6个电子,容易得到2个电子,故D项错误。
17
7.下列元素基态原子的简化电子排布式中,前者一定是金属元素,后者一定是非金属元素的是
A.[Ne]3s23p2 [Ne]3s2
B.[Ar]4s1 [Ne]3s23p4
C.[Ne]3s23p1 [Ar]4s2
D.[He]2s22p4 [Ne]3s23p5
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
17
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
A项,两种元素分别为Si、Mg,Si为非金属元素,Mg为金属元素;
B项,两种元素分别为K、S,符合题意;
C项,两种元素分别为Al、Ca,均为金属元素;
D项,两种元素分别为O、Cl,均为非金属元素。
17
题组二 电子云与原子轨道
8.符号3px所代表的含义是
A.px轨道上有3个电子
B.第三能层px轨道有3个伸展方向
C.px电子云有3个伸展方向
D.第三能层沿x轴方向伸展的p轨道
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
17
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
p能级有3个轨道,沿x、y、z轴三个不同的方向延伸,3px所代表的含义是第三能层沿x轴方向伸展的p轨道,最多只能容纳2个电子。
17
9.(2022·河南驻马店高二期中)下列说法正确的是
A.1s与2s轨道最多容纳的电子数不同
B.3p与2p的原子轨道都是哑铃形
C.p轨道电子能量一定比s轨道电子能量大
D.电子云表示的是电子在原子核外空间的运动轨道
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
17
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
每个能层最多容纳的电子数为2n2(n为能层序数),s能级最多容纳的电子数是2,则1s、2s轨道最多容纳的电子数都是2,故A错误;
不同能层的p轨道的形状和数目相同,则3p轨道和2p轨道都呈哑铃形,故B正确;
电子能量与能层和能级有关,电子离核越远能量越高,则p轨道电子的能量不一定高于s轨道电子的能量,如2p小于3s,故C错误;
电子云表示电子在核外单位体积的空间出现的概率大小,电子在原子核外的运动是无规则的,则电子云不能表示电子在原子核外空间的运动轨道,故D错误。
17
10.下列有关原子轨道的叙述正确的是
A.氢原子的2s轨道能量较3p轨道高
B.能层n=4的原子轨道最多可容纳16个电子
C.p能级的原子轨道呈哑铃形,随着能层序数的增加,p能级原子轨道
也在增多
D.锂原子的2s与5s轨道皆呈球形
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
17
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
氢原子2s轨道的能量低于3p轨道,故A错误;
每个能层最多能容纳2n2个电子,所以能层n=4的原子轨道最多可容纳32个电子,故B错误;
所有的p能级都含有3个轨道,所以随着能层序数的增加,p能级原子轨道数不变,故C错误;
所有的s轨道电子云轮廓图都是球形,所以锂原子的2s与5s轨道皆呈球形,故D正确。
17
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
11.下列说法正确的是
A.1s电子云呈球形,表示电子绕原子核做圆周运动
B.ns能级的原子轨道图可表示为
C.3d3表示3d能级有3个轨道
D.电子云图中的小点越密,说明该原子核外空间电子数目越多
√
17
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
电子云表示电子在核外空间某处出现的概率,不代表电子的运动轨迹,故A错误;
ns能级的电子云呈球形,所以可以用该图表示该能级的原子轨道,故B正确;
3d3表示3d能级有3个电子,故C错误;
电子云图中小点的疏密表示电子出现概率的大小,密则概率大,疏则概率小,故D错误。
17
12.硫离子核外具有多少种不同能量的电子
A.16种 B.18种 C.2种 D.5种
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
硫离子是由硫原子得到两个电子形成的,核内质子数是16,核外电子分三层排布,第一层2个,第二层8个,第三层8个,离子结构示意图为
,核外电子排布式为1s22s22p63s23p6,不同能级上的电子具有不同
的能量,所以核外有5种不同能量的电子。
17
13.X、Y两元素可形成X2Y3型化合物,则X、Y原子处于基态时的最外层电子排布式可能是
A.X:3s23p1 Y:3s23p5
B.X:2s22p3 Y:2s22p4
C.X:3s23p2 Y:3s23p4
D.X:3s2 Y:2s22p3
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
17
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
X为Al,Y为Cl,形成的化合物为AlCl3,A项不可能;
X为N,Y为O,可形成化合物N2O3,B项可能;
X为Si,Y为S,不能形成X2Y3型化合物,C项不可能;
X为Mg,Y为N,可形成化合物Mg3N2,不能形成X2Y3型化合物,D项不可能。
17
14.X、Y、Z三种短周期元素原子的最外层电子排布式分别为ns1、3s23p1和2s22p4,由这三种元素组成的化合物的化学式可能是
A.X2YZ3 B.X2YZ2
C.XYZ2 D.XYZ3
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
原子的最外层电子排布式为3s23p1和2s22p4的元素分别是Al和O,它们形成化合物时的常见化合价分别为+3、-2,最外层电子排布式为ns1的短周期元素形成化合物时的化合价为+1,根据化合物中元素化合价代数和为0的原则可知C项符合题意。
17
15.完成下列各题。
(1)基态Zn原子核外电子排布式为_______________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
Zn为30号元素,原子核外有30个电子,基态Zn原子的核外电子排布式为1s22s22p63s23p63d104s2或[Ar]3d104s2。
1s22s22p63s23p63d104s2(或[Ar]3d104s2)
17
(2)Fe成为阳离子时首先失去________轨道电子,Sm的价层电子排布式为4f66s2,Sm3+的价层电子排布式为______。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
Fe为26号元素,基态Fe原子的核外电子排布式为[Ar]3d64s2,成为阳离子时首先失去最外层电子,即4s轨道的电子;Sm的价层电子排布式为4f66s2,失去6s轨道上两个电子以及4f轨道上1个电子后形成Sm3+,所以Sm3+的价层电子排布式为4f5。
4s
4f5
17
(3)基态Fe2+核外电子排布式为___________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
由(2)可知,基态Fe2+的核外电子排布式为1s22s22p63s23p63d6或[Ar]3d6。
1s22s22p63s23p63d6(或[Ar]3d6)
17
(4)基态K原子中,核外电子占据的最高能层的符号是_____。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
K为19号元素,核外电子排布式为[Ar]4s1,核外电子占据的最高能层为第四能层,符号为N。
N
17
(5)基态Ge原子的核外电子排布式为[Ar]__________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
Ge为32号元素,核外有32个电子,基态Ge原子的电子排布式为[Ar]3d104s24p2。
3d104s24p2
17
(6)写出基态Se原子的核外电子排布式:_______________________
________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
Se为34号元素,核外有34个电子,基态Se原子的核外电子排布式为1s22s22p63s23p63d104s24p4或[Ar]3d104s24p4。
1s22s22p63s23p63d104s24p4
(或[Ar]3d104s24p4)
17
16.推导下列元素,回答有关问题:
(1)具有1个4p电子的元素为____(写元素名称,下同)。
(2)N层只有1个电子的主族元素是____,其氯化物的焰色试验呈____色。
(3)3d能级全充满,4s能级只有1个电子的元素为____,原子序数为___。
(4)原子序数小于36的元素X和Y,在周期表中既处于同一周期又位于同一族,且Y的原子序数比X大2,则Y的基态原子的价层电子排布式是_______,X在参与化学反应时,1个原子失去的电子数为________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
镓
钾
紫
铜
29
3d84s2
2个或3个
17
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
原子序数小于36的元素X和Y,在周期表中既处于同一周期又位于同一族,且Y的原子序数比X大2,则X为Fe、Y为Ni;Ni基态原子的电子排布式是1s22s22p63s23p63d84s2或[Ar]3d84s2,Ni基态原子的价层电子排布式是3d84s2;Fe基态原子的电子排布式是1s22s22p63s23p63d64s2,Fe基态原子的价层电子排布是3d64s2,参与化学反应时,失去2个或3个电子,表现为+2价或+3价。
17
17.有几种元素的基态粒子核外电子排布式为1s22s22p63s23p6,其中:
(1)某粒子一般不与其他元素的原子反应,这种粒子的符号是_____。
(2)某粒子的盐溶液能使溴水褪色,并出现浑浊,这种粒子的符号是____。
(3)某粒子还原性虽弱,但失去电子后氧化性很强,且这种元素的原子得到一个电子即达到稳定结构,这种粒子的符号是_____。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
Ar
S2-
Cl-
17
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
返回
符合题述核外电子排布式的粒子中,很难发生化学反应的应为稀有气体Ar;能使溴水褪色,应为还原性较强的S2-,发生反应:S2-+Br2===S↓+2Br-;原子得到一个电子即达到稳定结构,该粒子应为Cl-。
17
本课结束
第一章
