第二章第三节 分子结构与物质的性质 第1课时 共价键的极性(共76张ppt)
文档属性
| 名称 | 第二章第三节 分子结构与物质的性质 第1课时 共价键的极性(共76张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-18 21:28:13 | ||
图片预览











文档简介
(共76张PPT)
键的极性和分子的极性 / 键的极性对化学性质的影响 / 随堂演练 知识落实 / 课时对点练
共价键的极性
第二章
第1课时
核心素养
发展目标
1.能从微观角度理解共价键的极性和分子极性的关系。
2.通过键的极性对物质性质的影响的探析,形成“结构决定性质”的认知模型。
内容索引
一、键的极性和分子的极性
二、键的极性对化学性质的影响
随堂演练 知识落实
课时对点练
键的极性和分子的极性
一
1.共价键的极性
极性键 非极性键
定义 由 原子形成的共价键,电子对发生偏移 电子对不发生偏移的共价键
原子吸引电子能力 ______ ______
共用电子对 共用电子对偏向________ 的原子 共用电子对________
偏移
不同
不同
相同
吸引电子
能力强
不发生
成键原子电性 _________ _______
成键元素 一般是 非金属元素 非金属元素
举例 H—Cl、 Cl—Cl、H—H
显电性
电中性
不同种
同种
说明:(1)根据元素电负性的大小判断共价键中键合原子的电性。形成共价键的两个原子,电负性大的原子呈负电性(用δ-表示),电负性小的原子呈正电性(用δ+表示)。
(2)电负性差值越大的两原子形成的共价键的极性越强。
2.分子的极性
(1)极性分子与非极性分子
不重合
不为零
重合
为零
(2)含 键的双原子分子是极性分子,含 键的双原子分子是非极性分子。
极性
非极性
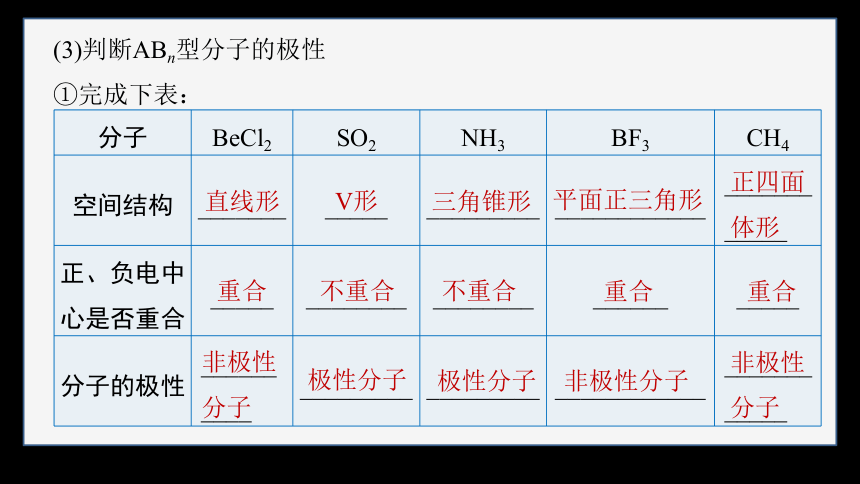
(3)判断ABn型分子的极性
①完成下表:
分子 BeCl2 SO2 NH3 BF3 CH4
空间结构 _______ _____ _________ ____________ ____________
正、负电中心是否重合 _____ ________ ________ ______ _____
分子的极性 __________ _________ _________ ____________ ____________
直线形
V形
三角锥形
平面正三角形
正四面体形
重合
不重合
不重合
重合
重合
非极性分子
极性分子
极性分子
非极性分子
非极性分子
②认真研究①中各分子中心原子的化合价,寻找中心原子的化合价与分子极性的关系。
提示 中心原子的化合价呈最高价的ABn型分子为非极性分子,否则为极性分子。
(4)探究判断下列分子是极性分子还是非极性分子。
①P4(白磷) ②CH2==CH2 ③CH≡CH
④C2H5OH ⑤
极性分子:_____(填序号,下同);
非极性分子:__________。
④
①②③⑤
正误判断
(1)以非极性键结合的双原子分子一定是非极性分子( )
(2)以极性键结合的分子一定是极性分子( )
(3)非极性分子只能是双原子单质分子( )
(4)非极性分子中,一定含有非极性共价键( )
(5)极性分子中不可能含有极性键( )
√
×
×
×
×
1.键的极性与分子极性有何关系?
提示 ①只含有非极性键的分子一定是非极性分子,如P4。
②含极性键的分子,如果分子结构是空间对称的,则为非极性分子,否则为极性分子。
③注意:含有非极性键的分子不一定是非极性分子(如H2O2);极性分子中不一定只含有极性键(如CH3CH2OH)。
深度思考
2.臭氧是极性分子还是非极性分子?从结构上如何理解?
提示 O3是极性分子;臭氧分子的空间结构与水分子的相似,由于中心氧原子有1个孤电子对,孤电子对对成键电子对排斥力大,故臭氧分子中的共价键是极性键,中心氧原子呈正电性,端位的两个氧原子呈负电性,故其分子具有微弱的极性。
深度思考
归纳总结
键的极性和分子极性的关系
应用体验
1.下列跟氢原子形成的极性键最强的原子是
A.F B.Cl C.Br D.P
成键的两原子的电负性差值越大,极性越强,F的电负性最大,则跟氢原子形成的极性键最强。
√
2.已知N、P均属于元素周期表的第ⅤA族元素。N在第二周期,P在第三周期。NH3分子呈三角锥形,N原子位于锥顶,3个H原子位于锥底,N—H间的夹角是107°。
(1)N4分子的空间结构为 ,它是一种______(填“极性”或“非极性”)分子。
非极性
N4分子是正四面体形结构,是一种非极性分子。
(2)PH3分子中P—H____(填“有”或“无”,下同)极性,PH3分子_____极性。
有
有
P—H为不同元素原子之间形成的共价键,为极性键,PH3分子的空间结构为三角锥形,正、负电中心不重合,PH3为极性分子。
(3)NCl3是一种淡黄色油状液体,下列对NCl3的有关描述不正确的是____(填字母)。
a.该分子呈平面三角形
b.该分子中的化学键为极性键
c.该分子为极性分子
d.因N—Cl的键能大,故NCl3稳定
a
NCl3中N原子的价层电子对数为3+ =4,孤电子对数为1,该分子为三角锥形,a错误;
N、Cl之间形成的键为极性键,b正确;
NCl3分子中正、负电中心不重合,故该分子为极性分子,c正确;
共价键的键能越大,含有该键的物质越稳定,d正确。
返回
键的极性对化学性质的影响
二
羧酸的酸性大小与其分子的组成和结构有关,羧酸的酸性可用pKa(pKa=
-lg Ka)的大小来衡量,pKa越小,酸性越强。
根据下表,回答有关问题:
羧酸 pKa
丙酸(C2H5COOH) 4.88
乙酸(CH3COOH) 4.76
甲酸(HCOOH) 3.75
氯乙酸(CH2ClCOOH) 2.86
二氯乙酸(CHCl2COOH) 1.29
三氯乙酸(CCl3COOH) 0.65
三氟乙酸(CF3COOH) 0.23
1.三氟乙酸和三氯乙酸哪个酸性强?原因是什么?
提示 酸性:三氟乙酸>三氯乙酸,原因是氟的电负性大于氯的电负性,F—C的极性大于Cl—C的极性,使F3C—的极性大于Cl3C—的极性,导致三氟乙酸的羧基中的羟基的极性更大,更易电离出氢离子。
2.甲酸和乙酸哪个酸性强?原因是什么?
提示 酸性:甲酸>乙酸,原因是烷基(R—)是推电子基团,烷基越长推电子效应越大,使羧基中的羟基的极性越小,羧酸的酸性越弱。
1.CH3CH2OH、H2O分别与钠反应,哪个反应更剧烈?解释原因。
提示 水与钠反应更剧烈,是由于C的电负性略大于H的电负性,烷基是推电子基团,使醇分子中的氢氧键的极性小于水分子中的氢氧键的极性。
深度思考
2.三氟乙酸(CF3COOH)的酸性远强于乙酸(CH3COOH)的原因是什么?
提示 由于F的电负性较大,—CF3是吸电子基团,使羧基中羟基的极性更大,更易电离出H+。
深度思考
应用体验
1.下列物质中,酸性最强的是
A.HCOOH B.HOCOOH
C.CH3COOH D.C6H13COOH
√
推电子效应:—C6H13>—CH3>—H,HOCOOH是碳酸,故酸性:HCOOH>CH3COOH>HOCOOH>C6H13COOH。
2.下列几种有机羧酸中,按酸性由强到弱的顺序排列正确的是
①乙酸(CH3COOH) ②氯乙酸(CH2ClCOOH) ③三氯乙酸(CCl3COOH) ④三氟乙酸(CF3COOH)
A.②①④③ B.①②③④
C.④③②① D.③②④①
√
由于电负性:F>Cl>H,则键的极性:C—F>C—Cl>C—H,故三氟乙酸中羧基中的羟基的极性最大,最易电离出氢离子,酸性最强;乙酸中羧基中的羟基的极性最小,酸性最弱。酸性强弱顺序:CF3COOH>CCl3COOH>CH2ClCOOH>CH3COOH,C正确。
归纳总结
1.键的极性对物质的化学性质有重要影响
由于不同的成键原子间电负性的差异,共用电子对会发生偏移,偏移的程度越大,即共价键的极性越强,在反应中越容易断裂。
2.羧基的酸性大小与分子组成和结构的关系
(1)含卤素原子的一元羧酸的酸性
①含相同个数的不同卤素原子的羧酸,卤素原子的电负性数值越大,羧酸的酸性越强。
归纳总结
返回
②含不同数目的同种卤素原子的羧酸,卤素原子的数目越多,羧酸的酸性越强。
(2)只含烷基的一元羧酸的酸性
随着烷基加长,酸性的差异越来越小。
(3)只含烷基的多元羧酸的酸性
烷基所含碳原子数越少,羧基个数越多,酸性越强。
随堂演练 知识落实
1.下列叙述正确的是
A.卤化氢分子中,卤素的非金属性越强,共价键的极性越强,热稳定
性也越强
B.只含非极性键的分子不一定是非极性分子
C.判断A2B或AB2型分子是否是极性分子的依据是看分子中是否含有极
性键
D.非极性分子中,各原子间都应以非极性键结合
1
2
3
4
5
√
1
2
3
卤素的非金属性越强,键的极性越强,A项正确;
如CO2、CS2为直线形,分子的空间结构对称,含有极性键,为非极性分子,C、D项错误。
4
5
2.用一带静电的玻璃棒分别靠近A、B两种纯液体流,现象如图所示,下列关于A、B两种液体分子的极性判断正确的是
A.A是极性分子,B是非极性分子
B.A是非极性分子,B是极性分子
C.A、B都是极性分子
D.A、B都是非极性分子
1
2
3
4
5
√
1
2
3
4
5
带静电的玻璃棒靠近纯液体流后,B液体流发生偏离,说明B液体的分子有极性,故A是非极性分子,B是极性分子。
3.下列叙述正确的是
A.NO、N2O、NO2、NH3都是非极性分子
B.CO2、SO3、BCl3都是非极性分子
C.H2O、NH3都是极性分子,分子中的O—H比N—H的极性弱
D.PCl5、NCl3、SO3、BF3、CCl4都是非极性分子
1
2
3
4
5
√
1
2
3
4
5
根据ABn型分子中,中心原子的化合价的绝对值等于该元素的价电子数时,该分子为非极性分子,若不相等则为极性分子。中心原子N原子价电子数为5,四种化合物中没有一种氮元素的化合价为+5,故A项错误;
中心原子C、S、B的化合价的绝对值等于其价电子数,CO2、SO3、BCl3均为非极性分子,故B项正确;
O的电负性比N的电负性强,对成键电子对的吸引力也强,分子中O—H比N—H的极性强,故C项错误;
NCl3分子中N原子化合价的绝对值与其价电子数不等,故D项错误。
4.(2022·山西柳林县鑫飞中学高二期中)下列模型分别表示C2H2、S8、SF6的结构,下列说法错误的是
1
2
3
4
5
A.SF6是由极性键构成的非极性分子
B.32 g S8分子中含有0.125 mol σ键
C.C2H2是既有极性键又有非极性键的非极性分子
D.S8中S原子的杂化方式为sp3杂化
√
SF6分子中含有硫氟极性键,分子的空间结构为对称的正八面体结构,属于非极性分子,故A正确;
1
2
3
4
5
C2H2分子中含有碳氢极性键和碳碳非极性键,分子的空间结构为对称的直线形,属于非极性分子,故C正确;
S8分子中硫原子的价层电子对数为4,杂化方式为sp3杂化,故D正确。
5.在HF、H2O、NH3、CS2、CH4、N2分子中:
(1)以非极性键相结合的非极性分子是_____。
(2)以极性键相结合,具有直线形结构的非极性分子是____。
(3)以极性键相结合,具有三角锥形结构的极性分子是_____。
(4)以极性键相结合,具有正四面体结构的非极性分子是____。
(5)以极性键相结合,具有V形结构的极性分子是_____。
(6)以极性键相结合,而且分子极性最大的是____。
N2
1
2
3
4
5
CS2
NH3
CH4
H2O
HF
不同元素间形成的共价键均为极性键,以极性键形成的分子,正、负电中心重合的为非极性分子,不重合的为极性分子。
返回
1
2
3
4
5
课时对点练
题组一 键的极性与分子的极性
1.下列各组分子中,按共价键极性由强到弱排序正确的是
A.HF H2O NH3 CH4
B.CH4 NH3 H2O HF
C.H2O HF CH4 NH3
D.HF H2O CH4 NH3
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
共价键极性的强弱取决于形成共价键的两原子的电负性,其电负性相差越大,形成的共价键极性越强。
2.X、Y为两种不同元素,由它们组成的下列物质的分子中,肯定有极性的是
A.XY4 B.XY3 C.XY2 D.XY
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
不同种元素对电子对的吸引能力不同,所形成的双原子分子必有极性。
3.下列各组物质中,都是由极性键构成的极性分子的一组是
A.CH4和Br2 B.NH3和H2O
C.H2S和CCl4 D.CO2和HCl
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
CH4、CCl4、CO2都是由极性键形成的非极性分子,NH3、H2O、H2S、HCl都是由极性键形成的极性分子。
√
4.下列物质:①MgCl2、②H2S、③白磷、④BF3、⑤NH3、⑥四氯化碳,其中含极性键的非极性分子是
A.①②③④⑥ B.①④⑤⑥
C.③④⑥ D.④⑥
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
①MgCl2只有离子键,不存在共价键,故错误;
②H2S中含有极性键,空间结构为V形,正负电中心不重合,为极性分子,故错误;
③白磷为单质,分子中只含有非极性键,属于非极性分子,故错误;
④BF3中含有极性键,为平面三角形分子,正负电中心重合,为非极性分子,故正确;
⑤NH3中含有极性键,空间结构为三角锥形,正负电的中心不重合,为极性分子,故错误;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
⑥四氯化碳中含有极性键,空间结构为正四面体形,正负电中心重合,为非极性分子,故正确。
题组二 极性分子、非极性分子的判断
5.使用微波炉加热,具有使物质受热均匀、表里一致、速度快、热效率高等优点。其工作原理是微波炉内的微波场以几亿的高频改变电场的方向,水分子因而能迅速摆动,产生热效应。这是因为
A.水分子具有极性共价键
B.水分子中有共用电子对
C.水由氢、氧两元素组成
D.水分子是极性分子
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
只有极性分子才能在电场中定向移动,非极性分子几乎不发生定向移动。水分子是由极性键构成的极性分子,故选D。
6.下列叙述正确的是
A.NH3是极性分子,分子中氮原子是在3个氢原子所组成的三角形的中心
B.CCl4是非极性分子,分子中碳原子处在4个氯原子所组成的正方形的
中心
C.H2O是极性分子,分子中氧原子不处在2个氢原子所连成的直线的中央
D.CO2是非极性分子,分子中碳原子不处在2个氧原子所连成的直线的
中央
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
7.膦(PH3)又称磷化氢,在常温下是一种无色有大蒜臭味的有毒气体,电石气的杂质中常含有磷化氢。它的分子空间结构是三角锥形。以下关于PH3的叙述正确的是
A.PH3分子中有未成键的孤电子对
B.PH3是非极性分子
C.PH3是一种强氧化剂
D.PH3分子的P—H是非极性键
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
A项正确,P原子最外层有5个电子,只有3个电子参与成键,另有2个电子形成一个孤电子对;
B项错误,与NH3类似,PH3是极性分子;
C项错误,PH3中P处于最低价态,+1价氢的氧化性极弱,不可能具有强氧化性;
D项错误,由于P和H的电负性明显不同,故P—H是极性键。
8.下列说法正确的是
A.含有非极性键的分子一定是非极性分子
B.非极性分子中一定含有非极性键
C.由极性键形成的双原子分子一定是极性分子
D.两个原子之间共用两个电子对,形成的化学键一定有极性
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
H2O2分子中含非极性键,但空间结构不对称,正负电中心不重合,是极性分子,故A错误;
CO2是非极性分子,但含有的是极性键,故B错误;
由极性键形成的双原子分子,分子中正负电中心不重合,所以是极性分子,故C正确;
两个原子之间共用两个电子对可能是相同原子形成,如C==C,为非极性键,也可能是不同原子形成,如C==O,为极性键,故D错误。
题组三 键的极性对化学性质的影响
9.下列物质中,酸性最强的是
A.CH2ClCOOH B.CH2FCOOH
C.CHF2COOH D.CHBr2COOH
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
电负性:F>Cl>Br,则酸性最强的是CHF2COOH。
10.从深海鱼油中提取的被称作“脑黄金”的DHA(C21H31COOH)就是一种不饱和度很高的脂肪酸。下列说法正确的是
CH3CH2CH==CHCH2CH==CHCH2CH==CHCH2CH==CHCH2CH==
CHCH2CH==CHCH2CH2COOH
DHA的结构简式
A.酸性:C21H31COOH<CH3COOH
B.DHA中含有的元素中电负性最大的是碳元素
C.DHA中碳原子存在三种杂化方式
D.DHA中所有原子共面
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
推电子效应:—C21H31>—CH3,故酸性:C21H31COOH<CH3COOH,A项正确;
C、H、O三种元素中,O元素的电负性最大,B项错误;
DHA中,碳原子存在sp2和sp3两种杂化方式,C项错误;
DHA中存在—CH3结构,故所有原子不可能共面,D项错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
11.有一种AB2C2型分子,在该分子中A为中心原子。下列关于该分子的空间结构和极性的说法正确的是
A.假设为平面四边形,则该分子一定为非极性分子
B.假设为四面体形,则该分子一定为非极性分子
C.假设为平面四边形,则该分子可能为非极性分子
D.假设为四面体形,则该分子可能为非极性分子
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
12.中国化学家研究出一种新型复合光催化剂(C3N4/CQDs),能利用太阳光高效分解水,原理如图所示。下列说法正确的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
A.H2O2中存在非极性共价键,
是非极性分子
B.反应Ⅰ中涉及极性键的断裂
和非极性键的形成
C.H2O分子的VSEPR模型为V形
D.H2O是非极性分子
√
H2O2是极性分子,A错误;
反应Ⅰ是H2O生成H2和H2O2,涉及极性键H—O的断裂和非极性键H—H、O—O的形成,B正确;
H2O是极性分子,故D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
13.近年来,利用电化学催化方法进行CO2转化的研究引起了世界范围内的高度关注。如图是以Cu作为催化剂时CO2转化为甲酸的反应过程,下列有关说法不正确的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
A.过程①说明在催化剂作用下,O—C—O之间形成了一种特殊的化学键
B.过程②和③吸收了能量并形成了O—H和C—H
C.CO2和HCOOH中均只含有极性共价键
D.1 mol CO2完全转化为甲酸需得到2 mol e-
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
过程①中碳氧双键断裂,O—C—O之间形成了一种特殊的化学键,故A正确;
化学键的形成要放出能量,故过程②和③放出了能量并形成了O—H和C—H,故B错误;
不同种原子之间形成的共价键为极性共价键,故CO2和HCOOH中均只含有极性共价键,故C正确;
二氧化碳转化为甲酸时,碳元素化合价由+4价变为+2价,故1 mol CO2完全转化为甲酸需得到2 mol e-,故D正确。
14.硫-氮化合物是现代无机化学研究的热点之一。如图是已经合成的某硫-氮化合物(S4N4)的分子结构。下列有关该物质的说法正确的是
A.其分子中各原子最外层都达到了8电子稳定结构
B.其分子中只含极性键
C.其分子是非极性分子
D.其与化合物S2N2互为同素异形体
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
硫原子最外层有6个电子,若形成两个共价单键,则达到8电子稳定结构,氮原子最外层有5个电子,若形成3个共价单键,则达到8电子稳定结构,据图可知,A项正确;
该物质的分子中既含S—N极性键,也含N—N非极性键,B项错误;
该分子正、负电中心不重合,属于极性分子,C项错误;
同素异形体描述的对象是单质,而不是化合物,D项错误。
15.已知,极性分子易溶于极性溶剂,非极性分子易溶于非极性溶剂。PtCl2(NH3)2可以形成两种固体,一种为淡黄色,在水中的溶解度较小,另一种为黄绿色,在水中的溶解度较大。请回答下列问题:
(1)PtCl2(NH3)2的结构是____________(填“平面四边形”或“四面体形”)。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
平面四边形
由于PtCl2(NH3)2存在两种同分异构体,所以是平面四边形结构。
(2)淡黄色固体物质由___________(填“极性分子”或“非极性分子”,下同)组成,黄绿色固体物质由_________组成。
(3)请在以下横线上画出这两种固体分子的空间结构图:淡黄色固体:
______________,黄绿色固体:____________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
非极性分子
极性分子
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
因为水是极性分子,所以淡黄色固体是非极性分子,黄绿色固体是极
性分子,因此空间结构图分别是 、 。
16.CH3COOH是一种弱酸,而氯乙酸(ClCH2COOH)的酸性强于CH3COOH,这是因为—Cl是一种强吸电子基团,能使—OH上的H原子具有更大的活泼性,有的基团属于推电子基团,能减弱—OH上H原子的活泼性;这些作用统称为“诱导效应”。试依据上述规律填空:
(1)HCOOH显酸性,而H2O显中性,这是由于HCOOH分子中存在_____(填“吸”或“推”)电子基团,这种基团是________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
吸
—CHO
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
HCOOH显酸性,H2O呈中性,说明HCOOH分子中存在强吸电子基团,能使—OH上的H原子活泼性增强而使该物质的酸性大于水,HCOOH中含有—CHO,属于强吸电子基团。
(2)CH3COOH的酸性弱于HCOOH,这是由于CH3COOH分子中存在______(填“吸”或“推”)电子基团,这种基团是________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
推
—CH3
CH3COOH的酸性弱于HCOOH,说明CH3COOH分子中存在推电子基团,能减弱—OH上H原子的活泼性而使该物质的酸性减弱,CH3COOH中含有—CH3,—CH3属于推电子基团。
(3)—C6H5也属于吸电子基团,故C6H5COOH的酸性比CH3COOH的酸性____(填“强”或“弱”)。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
强
—C6H5属于吸电子基团,—CH3属于推电子基团,故C6H5COOH的酸性比CH3COOH的酸性强。
(4)下列酸中:CF3COOH、CCl3COOH、CHCl2COOH、CH2ClCOOH,酸性最强的是___________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
CF3COOH
返回
本课结束
第二章
键的极性和分子的极性 / 键的极性对化学性质的影响 / 随堂演练 知识落实 / 课时对点练
共价键的极性
第二章
第1课时
核心素养
发展目标
1.能从微观角度理解共价键的极性和分子极性的关系。
2.通过键的极性对物质性质的影响的探析,形成“结构决定性质”的认知模型。
内容索引
一、键的极性和分子的极性
二、键的极性对化学性质的影响
随堂演练 知识落实
课时对点练
键的极性和分子的极性
一
1.共价键的极性
极性键 非极性键
定义 由 原子形成的共价键,电子对发生偏移 电子对不发生偏移的共价键
原子吸引电子能力 ______ ______
共用电子对 共用电子对偏向________ 的原子 共用电子对________
偏移
不同
不同
相同
吸引电子
能力强
不发生
成键原子电性 _________ _______
成键元素 一般是 非金属元素 非金属元素
举例 H—Cl、 Cl—Cl、H—H
显电性
电中性
不同种
同种
说明:(1)根据元素电负性的大小判断共价键中键合原子的电性。形成共价键的两个原子,电负性大的原子呈负电性(用δ-表示),电负性小的原子呈正电性(用δ+表示)。
(2)电负性差值越大的两原子形成的共价键的极性越强。
2.分子的极性
(1)极性分子与非极性分子
不重合
不为零
重合
为零
(2)含 键的双原子分子是极性分子,含 键的双原子分子是非极性分子。
极性
非极性
(3)判断ABn型分子的极性
①完成下表:
分子 BeCl2 SO2 NH3 BF3 CH4
空间结构 _______ _____ _________ ____________ ____________
正、负电中心是否重合 _____ ________ ________ ______ _____
分子的极性 __________ _________ _________ ____________ ____________
直线形
V形
三角锥形
平面正三角形
正四面体形
重合
不重合
不重合
重合
重合
非极性分子
极性分子
极性分子
非极性分子
非极性分子
②认真研究①中各分子中心原子的化合价,寻找中心原子的化合价与分子极性的关系。
提示 中心原子的化合价呈最高价的ABn型分子为非极性分子,否则为极性分子。
(4)探究判断下列分子是极性分子还是非极性分子。
①P4(白磷) ②CH2==CH2 ③CH≡CH
④C2H5OH ⑤
极性分子:_____(填序号,下同);
非极性分子:__________。
④
①②③⑤
正误判断
(1)以非极性键结合的双原子分子一定是非极性分子( )
(2)以极性键结合的分子一定是极性分子( )
(3)非极性分子只能是双原子单质分子( )
(4)非极性分子中,一定含有非极性共价键( )
(5)极性分子中不可能含有极性键( )
√
×
×
×
×
1.键的极性与分子极性有何关系?
提示 ①只含有非极性键的分子一定是非极性分子,如P4。
②含极性键的分子,如果分子结构是空间对称的,则为非极性分子,否则为极性分子。
③注意:含有非极性键的分子不一定是非极性分子(如H2O2);极性分子中不一定只含有极性键(如CH3CH2OH)。
深度思考
2.臭氧是极性分子还是非极性分子?从结构上如何理解?
提示 O3是极性分子;臭氧分子的空间结构与水分子的相似,由于中心氧原子有1个孤电子对,孤电子对对成键电子对排斥力大,故臭氧分子中的共价键是极性键,中心氧原子呈正电性,端位的两个氧原子呈负电性,故其分子具有微弱的极性。
深度思考
归纳总结
键的极性和分子极性的关系
应用体验
1.下列跟氢原子形成的极性键最强的原子是
A.F B.Cl C.Br D.P
成键的两原子的电负性差值越大,极性越强,F的电负性最大,则跟氢原子形成的极性键最强。
√
2.已知N、P均属于元素周期表的第ⅤA族元素。N在第二周期,P在第三周期。NH3分子呈三角锥形,N原子位于锥顶,3个H原子位于锥底,N—H间的夹角是107°。
(1)N4分子的空间结构为 ,它是一种______(填“极性”或“非极性”)分子。
非极性
N4分子是正四面体形结构,是一种非极性分子。
(2)PH3分子中P—H____(填“有”或“无”,下同)极性,PH3分子_____极性。
有
有
P—H为不同元素原子之间形成的共价键,为极性键,PH3分子的空间结构为三角锥形,正、负电中心不重合,PH3为极性分子。
(3)NCl3是一种淡黄色油状液体,下列对NCl3的有关描述不正确的是____(填字母)。
a.该分子呈平面三角形
b.该分子中的化学键为极性键
c.该分子为极性分子
d.因N—Cl的键能大,故NCl3稳定
a
NCl3中N原子的价层电子对数为3+ =4,孤电子对数为1,该分子为三角锥形,a错误;
N、Cl之间形成的键为极性键,b正确;
NCl3分子中正、负电中心不重合,故该分子为极性分子,c正确;
共价键的键能越大,含有该键的物质越稳定,d正确。
返回
键的极性对化学性质的影响
二
羧酸的酸性大小与其分子的组成和结构有关,羧酸的酸性可用pKa(pKa=
-lg Ka)的大小来衡量,pKa越小,酸性越强。
根据下表,回答有关问题:
羧酸 pKa
丙酸(C2H5COOH) 4.88
乙酸(CH3COOH) 4.76
甲酸(HCOOH) 3.75
氯乙酸(CH2ClCOOH) 2.86
二氯乙酸(CHCl2COOH) 1.29
三氯乙酸(CCl3COOH) 0.65
三氟乙酸(CF3COOH) 0.23
1.三氟乙酸和三氯乙酸哪个酸性强?原因是什么?
提示 酸性:三氟乙酸>三氯乙酸,原因是氟的电负性大于氯的电负性,F—C的极性大于Cl—C的极性,使F3C—的极性大于Cl3C—的极性,导致三氟乙酸的羧基中的羟基的极性更大,更易电离出氢离子。
2.甲酸和乙酸哪个酸性强?原因是什么?
提示 酸性:甲酸>乙酸,原因是烷基(R—)是推电子基团,烷基越长推电子效应越大,使羧基中的羟基的极性越小,羧酸的酸性越弱。
1.CH3CH2OH、H2O分别与钠反应,哪个反应更剧烈?解释原因。
提示 水与钠反应更剧烈,是由于C的电负性略大于H的电负性,烷基是推电子基团,使醇分子中的氢氧键的极性小于水分子中的氢氧键的极性。
深度思考
2.三氟乙酸(CF3COOH)的酸性远强于乙酸(CH3COOH)的原因是什么?
提示 由于F的电负性较大,—CF3是吸电子基团,使羧基中羟基的极性更大,更易电离出H+。
深度思考
应用体验
1.下列物质中,酸性最强的是
A.HCOOH B.HOCOOH
C.CH3COOH D.C6H13COOH
√
推电子效应:—C6H13>—CH3>—H,HOCOOH是碳酸,故酸性:HCOOH>CH3COOH>HOCOOH>C6H13COOH。
2.下列几种有机羧酸中,按酸性由强到弱的顺序排列正确的是
①乙酸(CH3COOH) ②氯乙酸(CH2ClCOOH) ③三氯乙酸(CCl3COOH) ④三氟乙酸(CF3COOH)
A.②①④③ B.①②③④
C.④③②① D.③②④①
√
由于电负性:F>Cl>H,则键的极性:C—F>C—Cl>C—H,故三氟乙酸中羧基中的羟基的极性最大,最易电离出氢离子,酸性最强;乙酸中羧基中的羟基的极性最小,酸性最弱。酸性强弱顺序:CF3COOH>CCl3COOH>CH2ClCOOH>CH3COOH,C正确。
归纳总结
1.键的极性对物质的化学性质有重要影响
由于不同的成键原子间电负性的差异,共用电子对会发生偏移,偏移的程度越大,即共价键的极性越强,在反应中越容易断裂。
2.羧基的酸性大小与分子组成和结构的关系
(1)含卤素原子的一元羧酸的酸性
①含相同个数的不同卤素原子的羧酸,卤素原子的电负性数值越大,羧酸的酸性越强。
归纳总结
返回
②含不同数目的同种卤素原子的羧酸,卤素原子的数目越多,羧酸的酸性越强。
(2)只含烷基的一元羧酸的酸性
随着烷基加长,酸性的差异越来越小。
(3)只含烷基的多元羧酸的酸性
烷基所含碳原子数越少,羧基个数越多,酸性越强。
随堂演练 知识落实
1.下列叙述正确的是
A.卤化氢分子中,卤素的非金属性越强,共价键的极性越强,热稳定
性也越强
B.只含非极性键的分子不一定是非极性分子
C.判断A2B或AB2型分子是否是极性分子的依据是看分子中是否含有极
性键
D.非极性分子中,各原子间都应以非极性键结合
1
2
3
4
5
√
1
2
3
卤素的非金属性越强,键的极性越强,A项正确;
如CO2、CS2为直线形,分子的空间结构对称,含有极性键,为非极性分子,C、D项错误。
4
5
2.用一带静电的玻璃棒分别靠近A、B两种纯液体流,现象如图所示,下列关于A、B两种液体分子的极性判断正确的是
A.A是极性分子,B是非极性分子
B.A是非极性分子,B是极性分子
C.A、B都是极性分子
D.A、B都是非极性分子
1
2
3
4
5
√
1
2
3
4
5
带静电的玻璃棒靠近纯液体流后,B液体流发生偏离,说明B液体的分子有极性,故A是非极性分子,B是极性分子。
3.下列叙述正确的是
A.NO、N2O、NO2、NH3都是非极性分子
B.CO2、SO3、BCl3都是非极性分子
C.H2O、NH3都是极性分子,分子中的O—H比N—H的极性弱
D.PCl5、NCl3、SO3、BF3、CCl4都是非极性分子
1
2
3
4
5
√
1
2
3
4
5
根据ABn型分子中,中心原子的化合价的绝对值等于该元素的价电子数时,该分子为非极性分子,若不相等则为极性分子。中心原子N原子价电子数为5,四种化合物中没有一种氮元素的化合价为+5,故A项错误;
中心原子C、S、B的化合价的绝对值等于其价电子数,CO2、SO3、BCl3均为非极性分子,故B项正确;
O的电负性比N的电负性强,对成键电子对的吸引力也强,分子中O—H比N—H的极性强,故C项错误;
NCl3分子中N原子化合价的绝对值与其价电子数不等,故D项错误。
4.(2022·山西柳林县鑫飞中学高二期中)下列模型分别表示C2H2、S8、SF6的结构,下列说法错误的是
1
2
3
4
5
A.SF6是由极性键构成的非极性分子
B.32 g S8分子中含有0.125 mol σ键
C.C2H2是既有极性键又有非极性键的非极性分子
D.S8中S原子的杂化方式为sp3杂化
√
SF6分子中含有硫氟极性键,分子的空间结构为对称的正八面体结构,属于非极性分子,故A正确;
1
2
3
4
5
C2H2分子中含有碳氢极性键和碳碳非极性键,分子的空间结构为对称的直线形,属于非极性分子,故C正确;
S8分子中硫原子的价层电子对数为4,杂化方式为sp3杂化,故D正确。
5.在HF、H2O、NH3、CS2、CH4、N2分子中:
(1)以非极性键相结合的非极性分子是_____。
(2)以极性键相结合,具有直线形结构的非极性分子是____。
(3)以极性键相结合,具有三角锥形结构的极性分子是_____。
(4)以极性键相结合,具有正四面体结构的非极性分子是____。
(5)以极性键相结合,具有V形结构的极性分子是_____。
(6)以极性键相结合,而且分子极性最大的是____。
N2
1
2
3
4
5
CS2
NH3
CH4
H2O
HF
不同元素间形成的共价键均为极性键,以极性键形成的分子,正、负电中心重合的为非极性分子,不重合的为极性分子。
返回
1
2
3
4
5
课时对点练
题组一 键的极性与分子的极性
1.下列各组分子中,按共价键极性由强到弱排序正确的是
A.HF H2O NH3 CH4
B.CH4 NH3 H2O HF
C.H2O HF CH4 NH3
D.HF H2O CH4 NH3
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
共价键极性的强弱取决于形成共价键的两原子的电负性,其电负性相差越大,形成的共价键极性越强。
2.X、Y为两种不同元素,由它们组成的下列物质的分子中,肯定有极性的是
A.XY4 B.XY3 C.XY2 D.XY
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
不同种元素对电子对的吸引能力不同,所形成的双原子分子必有极性。
3.下列各组物质中,都是由极性键构成的极性分子的一组是
A.CH4和Br2 B.NH3和H2O
C.H2S和CCl4 D.CO2和HCl
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
CH4、CCl4、CO2都是由极性键形成的非极性分子,NH3、H2O、H2S、HCl都是由极性键形成的极性分子。
√
4.下列物质:①MgCl2、②H2S、③白磷、④BF3、⑤NH3、⑥四氯化碳,其中含极性键的非极性分子是
A.①②③④⑥ B.①④⑤⑥
C.③④⑥ D.④⑥
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
①MgCl2只有离子键,不存在共价键,故错误;
②H2S中含有极性键,空间结构为V形,正负电中心不重合,为极性分子,故错误;
③白磷为单质,分子中只含有非极性键,属于非极性分子,故错误;
④BF3中含有极性键,为平面三角形分子,正负电中心重合,为非极性分子,故正确;
⑤NH3中含有极性键,空间结构为三角锥形,正负电的中心不重合,为极性分子,故错误;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
⑥四氯化碳中含有极性键,空间结构为正四面体形,正负电中心重合,为非极性分子,故正确。
题组二 极性分子、非极性分子的判断
5.使用微波炉加热,具有使物质受热均匀、表里一致、速度快、热效率高等优点。其工作原理是微波炉内的微波场以几亿的高频改变电场的方向,水分子因而能迅速摆动,产生热效应。这是因为
A.水分子具有极性共价键
B.水分子中有共用电子对
C.水由氢、氧两元素组成
D.水分子是极性分子
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
只有极性分子才能在电场中定向移动,非极性分子几乎不发生定向移动。水分子是由极性键构成的极性分子,故选D。
6.下列叙述正确的是
A.NH3是极性分子,分子中氮原子是在3个氢原子所组成的三角形的中心
B.CCl4是非极性分子,分子中碳原子处在4个氯原子所组成的正方形的
中心
C.H2O是极性分子,分子中氧原子不处在2个氢原子所连成的直线的中央
D.CO2是非极性分子,分子中碳原子不处在2个氧原子所连成的直线的
中央
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
7.膦(PH3)又称磷化氢,在常温下是一种无色有大蒜臭味的有毒气体,电石气的杂质中常含有磷化氢。它的分子空间结构是三角锥形。以下关于PH3的叙述正确的是
A.PH3分子中有未成键的孤电子对
B.PH3是非极性分子
C.PH3是一种强氧化剂
D.PH3分子的P—H是非极性键
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
A项正确,P原子最外层有5个电子,只有3个电子参与成键,另有2个电子形成一个孤电子对;
B项错误,与NH3类似,PH3是极性分子;
C项错误,PH3中P处于最低价态,+1价氢的氧化性极弱,不可能具有强氧化性;
D项错误,由于P和H的电负性明显不同,故P—H是极性键。
8.下列说法正确的是
A.含有非极性键的分子一定是非极性分子
B.非极性分子中一定含有非极性键
C.由极性键形成的双原子分子一定是极性分子
D.两个原子之间共用两个电子对,形成的化学键一定有极性
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
H2O2分子中含非极性键,但空间结构不对称,正负电中心不重合,是极性分子,故A错误;
CO2是非极性分子,但含有的是极性键,故B错误;
由极性键形成的双原子分子,分子中正负电中心不重合,所以是极性分子,故C正确;
两个原子之间共用两个电子对可能是相同原子形成,如C==C,为非极性键,也可能是不同原子形成,如C==O,为极性键,故D错误。
题组三 键的极性对化学性质的影响
9.下列物质中,酸性最强的是
A.CH2ClCOOH B.CH2FCOOH
C.CHF2COOH D.CHBr2COOH
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
电负性:F>Cl>Br,则酸性最强的是CHF2COOH。
10.从深海鱼油中提取的被称作“脑黄金”的DHA(C21H31COOH)就是一种不饱和度很高的脂肪酸。下列说法正确的是
CH3CH2CH==CHCH2CH==CHCH2CH==CHCH2CH==CHCH2CH==
CHCH2CH==CHCH2CH2COOH
DHA的结构简式
A.酸性:C21H31COOH<CH3COOH
B.DHA中含有的元素中电负性最大的是碳元素
C.DHA中碳原子存在三种杂化方式
D.DHA中所有原子共面
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
推电子效应:—C21H31>—CH3,故酸性:C21H31COOH<CH3COOH,A项正确;
C、H、O三种元素中,O元素的电负性最大,B项错误;
DHA中,碳原子存在sp2和sp3两种杂化方式,C项错误;
DHA中存在—CH3结构,故所有原子不可能共面,D项错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
11.有一种AB2C2型分子,在该分子中A为中心原子。下列关于该分子的空间结构和极性的说法正确的是
A.假设为平面四边形,则该分子一定为非极性分子
B.假设为四面体形,则该分子一定为非极性分子
C.假设为平面四边形,则该分子可能为非极性分子
D.假设为四面体形,则该分子可能为非极性分子
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
12.中国化学家研究出一种新型复合光催化剂(C3N4/CQDs),能利用太阳光高效分解水,原理如图所示。下列说法正确的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
A.H2O2中存在非极性共价键,
是非极性分子
B.反应Ⅰ中涉及极性键的断裂
和非极性键的形成
C.H2O分子的VSEPR模型为V形
D.H2O是非极性分子
√
H2O2是极性分子,A错误;
反应Ⅰ是H2O生成H2和H2O2,涉及极性键H—O的断裂和非极性键H—H、O—O的形成,B正确;
H2O是极性分子,故D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
13.近年来,利用电化学催化方法进行CO2转化的研究引起了世界范围内的高度关注。如图是以Cu作为催化剂时CO2转化为甲酸的反应过程,下列有关说法不正确的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
A.过程①说明在催化剂作用下,O—C—O之间形成了一种特殊的化学键
B.过程②和③吸收了能量并形成了O—H和C—H
C.CO2和HCOOH中均只含有极性共价键
D.1 mol CO2完全转化为甲酸需得到2 mol e-
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
过程①中碳氧双键断裂,O—C—O之间形成了一种特殊的化学键,故A正确;
化学键的形成要放出能量,故过程②和③放出了能量并形成了O—H和C—H,故B错误;
不同种原子之间形成的共价键为极性共价键,故CO2和HCOOH中均只含有极性共价键,故C正确;
二氧化碳转化为甲酸时,碳元素化合价由+4价变为+2价,故1 mol CO2完全转化为甲酸需得到2 mol e-,故D正确。
14.硫-氮化合物是现代无机化学研究的热点之一。如图是已经合成的某硫-氮化合物(S4N4)的分子结构。下列有关该物质的说法正确的是
A.其分子中各原子最外层都达到了8电子稳定结构
B.其分子中只含极性键
C.其分子是非极性分子
D.其与化合物S2N2互为同素异形体
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
硫原子最外层有6个电子,若形成两个共价单键,则达到8电子稳定结构,氮原子最外层有5个电子,若形成3个共价单键,则达到8电子稳定结构,据图可知,A项正确;
该物质的分子中既含S—N极性键,也含N—N非极性键,B项错误;
该分子正、负电中心不重合,属于极性分子,C项错误;
同素异形体描述的对象是单质,而不是化合物,D项错误。
15.已知,极性分子易溶于极性溶剂,非极性分子易溶于非极性溶剂。PtCl2(NH3)2可以形成两种固体,一种为淡黄色,在水中的溶解度较小,另一种为黄绿色,在水中的溶解度较大。请回答下列问题:
(1)PtCl2(NH3)2的结构是____________(填“平面四边形”或“四面体形”)。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
平面四边形
由于PtCl2(NH3)2存在两种同分异构体,所以是平面四边形结构。
(2)淡黄色固体物质由___________(填“极性分子”或“非极性分子”,下同)组成,黄绿色固体物质由_________组成。
(3)请在以下横线上画出这两种固体分子的空间结构图:淡黄色固体:
______________,黄绿色固体:____________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
非极性分子
极性分子
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
因为水是极性分子,所以淡黄色固体是非极性分子,黄绿色固体是极
性分子,因此空间结构图分别是 、 。
16.CH3COOH是一种弱酸,而氯乙酸(ClCH2COOH)的酸性强于CH3COOH,这是因为—Cl是一种强吸电子基团,能使—OH上的H原子具有更大的活泼性,有的基团属于推电子基团,能减弱—OH上H原子的活泼性;这些作用统称为“诱导效应”。试依据上述规律填空:
(1)HCOOH显酸性,而H2O显中性,这是由于HCOOH分子中存在_____(填“吸”或“推”)电子基团,这种基团是________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
吸
—CHO
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
HCOOH显酸性,H2O呈中性,说明HCOOH分子中存在强吸电子基团,能使—OH上的H原子活泼性增强而使该物质的酸性大于水,HCOOH中含有—CHO,属于强吸电子基团。
(2)CH3COOH的酸性弱于HCOOH,这是由于CH3COOH分子中存在______(填“吸”或“推”)电子基团,这种基团是________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
推
—CH3
CH3COOH的酸性弱于HCOOH,说明CH3COOH分子中存在推电子基团,能减弱—OH上H原子的活泼性而使该物质的酸性减弱,CH3COOH中含有—CH3,—CH3属于推电子基团。
(3)—C6H5也属于吸电子基团,故C6H5COOH的酸性比CH3COOH的酸性____(填“强”或“弱”)。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
强
—C6H5属于吸电子基团,—CH3属于推电子基团,故C6H5COOH的酸性比CH3COOH的酸性强。
(4)下列酸中:CF3COOH、CCl3COOH、CHCl2COOH、CH2ClCOOH,酸性最强的是___________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
CF3COOH
返回
本课结束
第二章
