第二章第三节 分子结构与物质的性质 第2课时 分子间的作用力 分子的手性(共87张ppt)
文档属性
| 名称 | 第二章第三节 分子结构与物质的性质 第2课时 分子间的作用力 分子的手性(共87张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-18 21:28:44 | ||
图片预览











文档简介
(共87张PPT)
分子间的作用力 / 分子的手性 / 随堂演练 知识落实 / 课时对点练
分子间的作用力 分子的手性
第二章
第2课时
核心素养
发展目标
1.掌握范德华力、氢键的概念。
2.通过范德华力、氢键对物质性质影响的探析,形成“结构决定性质”的认知模型。
3.能从微观角度理解分子的手性,形成判断手性分子的思维模型。
内容索引
一、分子间的作用力
二、分子的手性
随堂演练 知识落实
课时对点练
分子间的作用力
一
1.范德华力及其对物质性质的影响
(1)概念:是 间普遍存在的 ,它使得许多物质能以一定的凝聚态(固态和液态)存在。
(2)特征:很 ,比化学键的键能小1~2个数量级。
(3)影响因素:分子的极性越大,范德华力 ;组成和结构相似的物质,相对分子质量越大,范德华力 。
(4)对物质性质的影响:范德华力主要影响物质的 性质,如熔、沸点,组成和结构相似的物质,范德华力越大,物质熔、沸点 。
分子
相互作用力
弱
越大
越大
物理
越高
特别提醒
(1)范德华力的正确理解
范德华力很弱,比化学键的键能小1~2个数量级,范德华力的实质是电性作用,其主要特征有以下几个方面:
①广泛存在于分子之间;
②只有分子间充分接近时才有分子间的相互作用力(范德华力),如固体和液体物质中;
③范德华力无方向性和饱和性。只要分子周围空间允许,分子总是尽可能多地吸引其他分子。
(2)键能大小影响分子的热稳定性,范德华力的大小影响物质的熔、沸点。
(3)相对分子质量接近时,分子的极性越大,范德华力越大。
(4)相对分子质量、极性相似的分子,分子的对称性越强,范德华力越弱,如正丁烷>异丁烷,邻二甲苯>间二甲苯>对二甲苯。
2.氢键及其对物质性质的影响
(1)概念:由已经与 很大的原子形成共价键的 (如水分子中的氢)与另一个 很大的原子(如水分子中的氧)之间的作用力。
(2)表示方法:氢键通常用 表示,其中X、Y为 ,“—”表示 ,“…”表示形成的 。
电负性
氢原子
电负性
X—H…Y—
N、O、F
共价键
氢键
(3)氢键的本质和性质
氢键的本质是静电相互作用,它比化学键弱得多,通常把氢键看作是一种比较强的分子间作用力。
氢键具有方向性和饱和性,但本质上与共价键的方向性和饱和性不同。
①方向性:X—H…Y—三个原子一般在同一方向上。原因是在这样的方向上成键两原子电子云之间的排斥力最小,形成的氢键最强,体系最稳定。
②饱和性:每一个X—H只能与一个Y原子形成氢键,原因是H原子半径很小,再有一个原子接近时,会受到X、Y原子电子云的排斥。
(4)分类:氢键可分为 氢键和 氢键两类。
存在 氢键, 存在 氢键。前者的沸点 后者的沸点。
(5)氢键对物质性质的影响
①对物质熔、沸点的影响
a.某些氢化物分子间存在氢键,如H2O、NH3、HF等,使其熔、沸点高于同族元素氢化物。
分子间
分子内
分子内
分子间
低于
b.同分异构体中分子间形成氢键的物质比分子内形成氢键的物质熔、沸点高,如熔、沸点:邻羟基苯甲酸( )<对羟基苯甲酸( )。
②对物质溶解度的影响
溶剂和溶质之间形成氢键使溶质的溶解度增大,如氨、甲醇、甲醛、甲酸等易溶于水。
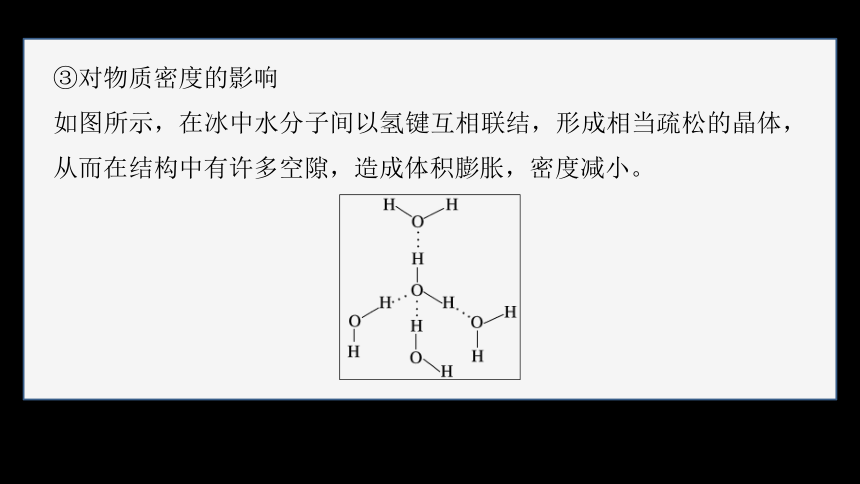
③对物质密度的影响
如图所示,在冰中水分子间以氢键互相联结,形成相当疏松的晶体,从而在结构中有许多空隙,造成体积膨胀,密度减小。
3.溶解性
(1)“相似相溶”规律
非极性溶质一般能溶于 溶剂,极性溶质一般能溶于 溶剂,如蔗糖和氨 溶于水, 溶于四氯化碳;萘和碘 溶于四氯化碳,
溶于水。
非极性
极性
易
难
易
难
(2)影响物质溶解性的因素
①外界因素:主要有 等。
②氢键:溶剂和溶质之间的氢键作用力越大,溶解性越 。
③分子结构的相似性:溶质和溶剂的分子结构相似程度越大,其溶解性越 ,如乙醇与水 ,而戊醇在水中的溶解度明显减小。
温度、压强
好
大
互溶
正误判断
(1)HI分子间的范德华力大于HCl分子间的范德华力,故HI的沸点比HCl的高( )
(2)CO的沸点大于N2( )
(3)氢键的键长是指“X—H…Y”中“H…Y”的长度( )
(4)H2O的热稳定性大于H2S,是因为H2O分子间存在氢键( )
(5)冰融化成水,仅仅破坏氢键( )
(6)氢键均能使物质的熔、沸点升高( )
(7)I2在酒精中易溶,故可用酒精萃取碘水中的碘( )
(8)配制碘水时,为了增大碘的溶解性,常加入KI溶液( )
√
√
×
×
×
×
×
√
1.根据下表,怎样解释卤素单质从F2~I2的熔点和沸点越来越高?
提示 卤素单质分子(都是非极性分子)的结构相似,F2~I2相对分子质量依次增大,范德华力依次增大,其熔、沸点依次升高。
深度思考
单质 熔点/℃ 沸点/℃
F2 -219.6 -188.1
Cl2 -101 -34.6
Br2 -7.2 58.78
I2 113.5 184.4
2.(1)试表示HF水溶液中的氢键。
提示 F—H…F、O—H…F、F—H…O、O—H…O。
深度思考
(2)甲酸可通过氢键形成二聚物,HNO3可形成分子内氢键。试在下图中画出氢键。
提示
深度思考
3.比较NH3和CH4在水中的溶解度。怎样用“相似相溶”规律理解它们的溶解度不同?
提示 NH3为极性分子,CH4为非极性分子,而水是极性分子,根据“相似相溶”规律,NH3易溶于水,而CH4不易溶于水,且NH3与水分子之间可形成氢键,使得氨更易溶于水。
深度思考
4.怎样理解低碳醇与水互溶,而高碳醇在水中的溶解度却很小?
提示 “相似相溶”也适用于分子结构的相似性。低碳醇中的烃基较小,分子中的—OH与水分子中的—OH相近,因而低碳醇能与水互溶;而高碳醇的烃基较大,其分子中的—OH与水分子的—OH相似因素少,因而高碳醇在水中的溶解度明显减小。
深度思考
应用体验
1.下列有关范德华力的叙述正确的是
A.范德华力的实质也是一种电性作用,所以范德华力是一种特殊的化学键
B.范德华力与化学键的作用力的强弱不同
C.任何分子间在任意情况下都会产生范德华力
D.范德华力非常微弱,故破坏范德华力不需要消耗能量
√
范德华力的实质是一种电性作用,但范德华力是分子间较弱的作用力,不是化学键,A错误;
化学键是相邻原子间的强烈的相互作用,范德华力是分子间较弱的作用力,B正确;
若分子间的距离足够远,则分子间没有范德华力,C错误;
虽然范德华力非常微弱,但破坏它时也要消耗能量,D错误。
2.下列物质中,分子内和分子间均可形成氢键的是
A.NH3 B.
C.H2O D.C2H5OH
√
形成氢键的分子含有N—H、H—O或H—F。NH3、H2O、CH3CH2OH都能形成氢键但只存在于分子间。B中 的O—H与O—H
间可形成分子间氢键,O—H与 间可形成分子内氢键。
3.(2022·湖北孝感高二期中)下列现象不能用“相似相溶”规律解释的是
A.氨极易溶于水
B.氯气易溶于NaOH溶液
C.酒精与水以任意比互溶
D.苯萃取碘水中的I2
√
氨属于极性分子,水也属于极性分子,且氨能与水形成分子间氢键,根据“相似相溶”规律,氨极易溶于水,故A不符合题意;
氯气能与NaOH溶液反应生成可溶于水的NaCl和NaClO,不符合“相似相溶”规律,故B符合题意;
CH3CH2OH和水分子均属于极性分子,根据“相似相溶”规律,酒精易溶于水,故C不符合题意;
碘单质和苯均属于非极性分子,根据“相似相溶”规律,碘单质易溶于苯,故D不符合题意。
归纳总结
影响物质溶解性的因素
(1)外界条件——温度、压强等。
(2)分子结构——“相似相溶”规律。
(3)如果溶剂和溶质间存在氢键,其溶解度增大。
(4)溶质与溶剂发生反应可增大其溶解度。
返回
分子的手性
二
1.概念
(1)手性异构体:具有完全相同的 和 的一对分子,如同左手与右手一样互为镜像,却在三维空间里不能叠合,互称手性异构体(或对映异构体)。
(2)手性分子:具有 的分子。
组成
原子排列
手性异构体
2.手性分子的判断
(1)判断方法:有机物分子中是否存在手性碳原子。
(2)手性碳原子:有机物分子中连有四个各不相同的原子或基团的碳原
子。如 ,R1、R2、R3、R4互不相同,即 是手性碳原子。
1.乳酸的结构式为 ,其分子结构中有几个手性碳原子?
用*将手性碳原子标出来。
提示 只有一个手性碳原子: 。
深度思考
2.有机物 具有手性,若它与H2发生加成反应后,其
产物还有手性吗?
提示 该有机物与H2加成的产物是 ,该物质不存在手性碳原子,无手性。
深度思考
应用体验
1.下列说法不正确的是
A.互为手性异构体的分子互为镜像
B.利用手性催化剂可主要得到一种手性分子
C.手性异构体分子组成相同
D.手性异构体性质相同
√
互为手性异构体的分子互为镜像,故A正确;
在手性合成中,与催化剂手性匹配的分子在反应过程中会与手性催化剂形成一种最稳定的过渡态,从而只会诱导生成一种手性分子,故B正确;
手性异构体分子组成相同,故C正确。
2.有机物碳原子上连接的四个原子或原子团不相同,则这个碳原子称为手性碳原子,下列分子中含有手性碳原子的是
A.CH2Cl2
B.CH3CH2OH
C.CH3CH(CH3)2
D.CH3CH(CH3)CHClCOOH
CH3CH(CH3)CHClCOOH分子中,有一个碳原子所连的四个基团分别是羧基、异丙基、氢原子和氯原子,该碳原子具有手性,选项D正确。
√
返回
随堂演练 知识落实
1.下列说法正确的是
A.范德华力越大,分子越稳定
B.范德华力越大,物质的熔、沸点越高
C.相对分子质量越大,其范德华力越大
D.分子间只存在范德华力
1
2
3
4
5
√
1
2
3
范德华力主要影响物质的物理性质,化学键主要影响物质的化学性质,范德华力越大,物质的熔、沸点越高,B正确、A不正确;
分子的组成和结构相似时,相对分子质量越大,其范德华力越大,C不正确。
4
5
2.甲醛( )在Ni催化作用下加氢可得甲醇(CH3OH),以下说法正确的是
A.甲醛分子间可以形成氢键
B.甲醛分子和甲醇分子内C原子均采取sp2杂化
C.甲醛为极性分子
D.甲醇的沸点远低于甲醛的沸点
1
2
3
4
5
√
1
2
3
4
5
甲醛分子中,H原子与C原子相连,碳元素的电负性相对较小,甲醛分子间不能形成氢键,故A错误;
HCHO中C原子采取sp2杂化,CH3OH分子中C原子采取sp3杂化,故B错误;
甲醛分子是平面三角形,碳原子位于三角形内部,结构不对称,为极性分子,故C正确;
甲醇分子之间形成氢键,甲醛分子之间不能形成氢键,故甲醇的沸点高于甲醛的沸点,故D错误。
3.下列与氢键有关的说法错误的是
A.卤化氢中HF沸点较高,是由于HF分子间存在氢键
B.邻羟基苯甲醛( )的熔、沸点比对羟基苯甲醛( )
的熔、沸点低
C.氨水中存在分子间氢键
D.形成氢键A—H…B—的三个原子总在一条直线上
1
2
3
4
5
√
1
2
3
4
5
HF分子间存在氢键F—H…F—,使氟化氢分子间的作用力增大,所以卤化氢中氟化氢的沸点较高,A正确;
邻羟基苯甲醛可形成分子内氢键,而对羟基苯甲醛可形成分子间氢键,所以邻羟基苯甲醛的熔、沸点比对羟基苯甲醛的熔、沸点低,B正确;
氨水中氨分子之间、水分子之间以及氨分子与水分子之间都存在氢键,C正确;
氢键具有一定的方向性,但形成氢键的原子不一定在一条直线上,如 ,故D错误。
4.维生素C的结构简式是 ,它能防治坏血病,该
分子中有几个手性碳原子
A.1 B.2 C.3 D.4
1
2
3
4
5
√
该分子中属于手性碳原子的是左边第二号、三号碳,它们均连接四个不同原子或原子团,所以该分子中含有2个手性碳原子。
5.试用有关知识解释下列现象:
(1)乙醚(C2H5OC2H5)的相对分子质量远大于乙醇,但乙醇的沸点却比乙醚高很多,原因:______________________________________________
_________________________________。
(2)从氨合成塔里出来的H2、N2、NH3的混合物中分离出NH3,常采用加压使NH3液化的方法:__________________________________________
_____________________________________________________。
1
2
3
4
5
乙醇分子之间形成的氢键作用远大于乙醚分子间的范德华力,故乙醇的沸点比乙醚高很多
NH3分子间可以形成氢键,而N2、H2分子间的范德华力很小,故NH3可采用加压液化的方法从混合物中分离
(3)水在常温下,其组成的化学式可用(H2O)m表示,原因: ___________
______________________________________________________________________________________。
1
2
3
4
5
常温下,液态水中水分子间通过氢键缔合成较大分子团,所以用(H2O)m表示,而不是以单个分子形式存在
返回
课时对点练
题组一 分子间的作用力的理解及应用
1.下列有关物质性质判断正确且可以用范德华力来解释的是
A.沸点:HBr>HCl
B.沸点:CH3CH2Br<C2H5OH
C.稳定性:HF>HCl
D.—OH上氢原子的活泼性:H—O—H>C2H5—O—H
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
HBr与HCl结构相似,HBr的相对分子质量比HCl大,HBr分子间的范德华力比HCl大,所以其沸点比HCl高;C2H5Br的沸点比C2H5OH低是由于C2H5OH分子间形成氢键而增大了分子间的作用力;HF比HCl稳定是由于H—F的键能比H—Cl的键能大;H2O分子中—OH的氢原子比C2H5OH中—OH的氢原子更活泼是由于—C2H5是推电子基团,使O—H极性减弱。
2.关于氢键,下列说法正确的是
A.由于冰中的水分子间存在氢键,所以其密度大于液态水
B.可以用氢键解释接近沸点的水蒸气的相对分子质量测定值比用化学式
(H2O)计算出来的相对分子质量大
C.分子间氢键和分子内氢键都会使熔、沸点升高
D.水加热到很高的温度都难以分解,这是由于氢键所致
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
A项,由于冰中的水分子间存在氢键,增大了分子之间的距离,所以其密度小于液态水,错误;
B项,由于水分子之间存在氢键,使水分子通常以几个分子缔合的形式存在,所以接近沸点的水蒸气的相对分子质量测定值比用化学式(H2O)计算出来的相对分子质量大,正确;
C项,分子间氢键使熔、沸点升高,而分子内氢键则会使熔、沸点降低,错误;
D项,水加热到很高的温度都难以分解,这是由于分子内的H—O共价键强的缘故,与分子间的氢键无关,错误。
3.比较下列化合物的沸点,前者低于后者的是
A.乙醇与氯乙烷
B.邻羟基苯甲酸 与对羟基苯甲酸
C.对羟基苯甲醇 与邻羟基苯甲醇
D.H2O与H2Te
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
氢键分为两类:分子间氢键和分子内氢键。同类物质相比,分子内形成氢键的物质的熔、沸点要低于分子间形成氢键的物质的熔、沸点。如邻羟基苯甲酸、邻羟基苯甲醇等容易形成分子内氢键,沸点较低,而对羟基苯甲酸、对羟基苯甲醇则容易形成分子间氢键,沸点较高,所以B选项符合题意,C选项不符合题意;
对于A选项,由于乙醇存在分子间氢键,而氯乙烷不存在氢键,所以乙醇的沸点高于氯乙烷的沸点;
D选项中,H2O的沸点高于H2Te的沸点。
4.已知各种硝基苯酚的性质如下表:
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
名称 结构式 25 ℃水中溶解度/g 熔点/℃ 沸点/℃
邻硝基苯酚 0.2 45 100
间硝基苯酚 1.4 96 194
对硝基苯酚 1.7 114 295
下列关于三种硝基苯酚的叙述不正确的是
A.邻硝基苯酚分子内形成氢键,使其熔、沸点低于另外两种硝基苯酚
B.间硝基苯酚不仅分子间能形成氢键,也能与水分子形成氢键
C.对硝基苯酚分子间能形成氢键,使其熔、沸点较高
D.三种硝基苯酚都能形成分子内氢键
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
当分子形成分子内氢键时,熔、沸点降低,A正确;
间硝基苯酚中与N原子相连的O原子易与水分子中的H原子形成氢键,B正确、D错误;
对硝基苯酚能形成分子间氢键,使其熔、沸点升高,C正确。
题组二 物质的溶解性
5.根据“相似相溶”规律和实际经验,下列叙述不正确的是
A.卤化氢易溶于水,也易溶于CCl4
B.白磷(P4)易溶于CS2,但难溶于水
C.碘易溶于苯,微溶于水
D.NaCl易溶于水,难溶于CCl4
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
卤化氢、水是极性分子,CCl4、P4、碘、苯都是非极性分子,根据“相似相溶”规律,卤化氢难溶于CCl4。
6.某同学在所收到的信封上发现有收藏价值的邮票,便将邮票剪下来浸入水中,以去掉邮票背面的黏合剂。根据“相似相溶”规律,该黏合剂的成分可能是
A.?CH2—CH2? B.
C. D.
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
根据选项中物质的结构可以知道,四种物质中只有 中含有亲水基团羟基(—OH),故与水相溶。
7.已知O3分子为V形结构,O3在水中的溶解度和O2相比
A.一样大 B.O3比O2小
C.O3比O2大 D.无法比较
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
因O3分子为V形结构,是极性分子,O2为非极性分子,根据“相似相溶”规律可知O3在水中的溶解度比O2大,C项正确。
8.物质在不同溶剂中的溶解性一般都遵循“相似相溶”规律。下列装置不宜用于HCl尾气吸收的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
HCl是极性分子,易溶于水而不溶于CCl4。
C项装置易发生倒吸,A、D项装置分别使用了倒置漏斗和球形干燥管,能防止倒吸;
B项装置中HCl气体先通过CCl4,由于HCl不溶于CCl4,HCl经过CCl4后再被上层的水吸收,也可以有效防止倒吸。
题组三 手性碳原子及手性异构
9.当一个碳原子连接四个不同的原子或基团时,该碳原子叫“手性碳原子”。下列化合物中含有2个手性碳原子的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
A. B.
C. D.
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
A、B、D三项中化合物均只含有1个手性碳原子,C项中
标*的为化合物中含有的手性碳原子。
10.下列关于丙氨酸的说法正确的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
A.Ⅰ和Ⅱ的结构和性质完全不同
B.Ⅰ和Ⅱ呈镜面对称,具有不同的分子极性
C.Ⅰ和Ⅱ都属于非极性分子
D.Ⅰ和Ⅱ中化学键的种类与数目完全相同
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
从题图可看出,丙氨酸的分子中有1个碳原子与—H、—CH3、—NH2和—COOH相连,是手性碳原子,故丙氨酸分子有手性异构体。Ⅰ和
Ⅱ的结构不同,但由于其所含官能团相同,化学性质相似,A项错误;
Ⅰ和Ⅱ呈镜面对称,且分子的极性相同,B项错误;
Ⅰ和Ⅱ的空间结构不对称,故均是极性分子,C项错误;
Ⅰ和Ⅱ中化学键的种类(极性键和非极性键、σ键和π键、单键和双键)和数目完全相同,D项正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
11.下列各项比较中前者高于(或大于或强于)后者的是
A.CH4在水中的溶解度和NH3在水中的溶解度
B.I2在水中的溶解度和I2在CCl4中的溶解度
C.I与H形成共价键的极性和F与H形成共价键的极性
D.乙酸(CH3COOH)的沸点和丙醇(CH3CH2CH2OH)的沸点
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
NH3和水分子间可形成氢键,NH3在水中的溶解度大于CH4在水中的溶解度,故A错误;
I2是非极性分子,水是极性分子,CCl4是非极性分子,根据“相似相溶”规律,I2在水中的溶解度小于I2在CCl4中的溶解度,故B错误;
氟的电负性大于碘的电负性,所以I与H形成共价键的极性小于F与H形成共价键的极性,故C错误。
12.通常情况下,NCl3是一种油状液体,其分子空间结构与NH3相似,下列对NCl3和NH3的有关叙述错误的是
A.NCl3分子中N—Cl的键长与CCl4分子中C—Cl的键长不相等
B.NCl3分子是极性分子
C.NBr3比NCl3易挥发
D.在氨水中,大部分NH3与H2O以氢键(用“…”表示)结合形成NH3·H2O
分子,则NH3·H2O的结构式主要为
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
C原子的原子半径大于N原子的原子半径,所以CCl4中C—Cl的键长比NCl3中N—Cl的键长长,故A正确;
NCl3的分子空间结构与NH3相似,都是三角锥形,NH3分子是极性分子,所以NCl3分子也是极性分子,故B正确;
共价化合物中物质的熔、沸点与相对分子质量有关,一般来说,对于组成和结构相似的物质,相对分子质量越大其熔、沸点越高,所以NBr3比NCl3的熔、沸点高,NCl3比NBr3易挥发,故C错误;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
在氨水中,NH3与H2O以氢键(用“…”表示)结合形成NH3·H2O分子,则NH3·H2O的结构式主要为 ,故D正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
13.(2022·湖南高中学业水平仿真模拟)我国科学家发现大脑进入“梦乡”的钥匙——多巴胺(DA),DA的结构简式如图所示。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
下列说法正确的是
A.DA是只含极性键的共价化合物
B.DA分子能溶于水、乙醇等溶剂
C.键能大小决定DA的熔点和沸点
D.DA中所有元素均位于同一周期
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
由DA的结构简式可知,DA含有N—H、N—C、C—O、H—O、C—H等极性键,同时还含有C—C非极性键的共价化合物,A错误;
DA分子中含有氨基和酚羟基,这两种官能团均能与水、乙醇形成分子间氢键,且DA属于极性分子,故可推知DA能溶于水、乙醇等溶剂,B正确;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
熔、沸点是物理性质,键能的大小决定物质的化学性质,故DA的熔、沸点高低与其分子中的键能大小无关,与分子间作用力大小有关,C错误;
DA中含有H、C、N、O,其中C、N、O元素同位于第二周期,而H位于第一周期,D错误。
14.(2022·湖南新宁县第一中学高二期中)白磷的结构为 ,下列有关白磷的说法错误的是
A.31 g P4含有1.5NA个P—P
B.P4为正四面体形结构,键角为109°28′
C.P4中P原子为sp3杂化
D.P4能保存在水中,因为P4是非极性分子,H2O是极性分子,且密度大
于H2O
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
1个白磷分子含有6个P—P,31 g P4的物质的量是0.25 mol,则含有1.5NA个P—P,A正确;
P4为正四面体形结构,键角为60°,B错误;
P4中P原子形成3个单键,含有一个孤电子对,为sp3杂化,C正确;
P4是非极性分子,H2O是极性分子,且密度大于H2O,依据“相似相溶”规律可知P4能保存在水中,D正确。
15.双氧水(H2O2)是一种医用消毒杀菌剂,已知H2O2分子的结构如图所示:
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
H2O2分子不是直线形的,两个H原子犹如在半展开的书的两面纸上,书面角为93°52′,而两个O—H与O—O的夹角均为96°52′。试回答:
(1)H2O2分子的电子式为______________,结构式为______________。
(2)H2O2分子中存在_____键和________键,为______分子(填“极性”或“非极性”)。
H—O—O—H
极性
非极性
极性
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
H2O2分子的空间结构不对称,为极性分子,含有O—O非极性键和O—H极性键。
(3)H2O2难溶于CS2,其原因是____________________________________
_________________________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
根据“相似相溶”规律可知,H2O2为极性分子,难溶于非极性溶剂CS2。
H2O2为极性分子,CS2为非极性分子,根据“相似相溶”规律可知H2O2难溶于CS2
(4)H2O2分子中氧元素的化合价为____,原因是_____________________
_____________________________________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
-1
共用电子对的偏移决定了元素在化合物中的化合价。
O—O为非极性键,O—H为极性键,共用电子对偏向于氧,故氧元素显-1价
16.(1)已知苯酚( )具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子 能形成分子内氢键。据此判断,相
同温度下电离平衡常数Ka2(水杨酸)_____(填“>”或“<”)Ka(苯酚),
其原因是______________________________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
<
中形成分子内氢键,使其更难电离出H+
当 形成分子内氢键后,导致酚羟基的电离能力减弱,故其电离能力比苯酚的弱。
(2)CO2由固态变为气态所需克服的微粒间作用力是__________;氢、碳、氧元素的原子可共同形成多种分子,写出其中一种能形成同种分子间氢键的物质名称:___________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
范德华力
固态CO2中存在范德华力;根据氢键的形成条件,由H、C、O构成的能形成分子间氢键的分子,可联想到HCOOH、CH3COOH等。
乙酸(合理答案均可)
(3)下图中曲线表示卤素某种性质随核电荷数的变化趋势,正确的是___
(填字母)。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
a
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
同主族元素从上到下,元素的电负性逐渐减小,a正确;
F元素无正价,b错误;
由于氟化氢中存在分子间氢键,所以其沸点高于溴化氢,c错误;
随着相对分子质量的增大,范德华力增大,卤素单质的熔点升高,d错误。
(4)O的氢化物(H2O)在乙醇中的溶解度大于H2S在乙醇中的溶解度,其原因是_______________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
水分子与乙醇分子之间形成氢键
水与乙醇可形成分子间氢键,使得水与乙醇互溶;而硫化氢与乙醇不能形成分子间氢键,所以硫化氢在乙醇中的溶解度小于水。
(5)化合物NH3的沸点比化合物CH4的高,其主要原因是______________
________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
NH3分子间可形成氢键,使其沸点高于CH4的沸点。
NH3分子间可形
返回
成氢键
本课结束
第二章
分子间的作用力 / 分子的手性 / 随堂演练 知识落实 / 课时对点练
分子间的作用力 分子的手性
第二章
第2课时
核心素养
发展目标
1.掌握范德华力、氢键的概念。
2.通过范德华力、氢键对物质性质影响的探析,形成“结构决定性质”的认知模型。
3.能从微观角度理解分子的手性,形成判断手性分子的思维模型。
内容索引
一、分子间的作用力
二、分子的手性
随堂演练 知识落实
课时对点练
分子间的作用力
一
1.范德华力及其对物质性质的影响
(1)概念:是 间普遍存在的 ,它使得许多物质能以一定的凝聚态(固态和液态)存在。
(2)特征:很 ,比化学键的键能小1~2个数量级。
(3)影响因素:分子的极性越大,范德华力 ;组成和结构相似的物质,相对分子质量越大,范德华力 。
(4)对物质性质的影响:范德华力主要影响物质的 性质,如熔、沸点,组成和结构相似的物质,范德华力越大,物质熔、沸点 。
分子
相互作用力
弱
越大
越大
物理
越高
特别提醒
(1)范德华力的正确理解
范德华力很弱,比化学键的键能小1~2个数量级,范德华力的实质是电性作用,其主要特征有以下几个方面:
①广泛存在于分子之间;
②只有分子间充分接近时才有分子间的相互作用力(范德华力),如固体和液体物质中;
③范德华力无方向性和饱和性。只要分子周围空间允许,分子总是尽可能多地吸引其他分子。
(2)键能大小影响分子的热稳定性,范德华力的大小影响物质的熔、沸点。
(3)相对分子质量接近时,分子的极性越大,范德华力越大。
(4)相对分子质量、极性相似的分子,分子的对称性越强,范德华力越弱,如正丁烷>异丁烷,邻二甲苯>间二甲苯>对二甲苯。
2.氢键及其对物质性质的影响
(1)概念:由已经与 很大的原子形成共价键的 (如水分子中的氢)与另一个 很大的原子(如水分子中的氧)之间的作用力。
(2)表示方法:氢键通常用 表示,其中X、Y为 ,“—”表示 ,“…”表示形成的 。
电负性
氢原子
电负性
X—H…Y—
N、O、F
共价键
氢键
(3)氢键的本质和性质
氢键的本质是静电相互作用,它比化学键弱得多,通常把氢键看作是一种比较强的分子间作用力。
氢键具有方向性和饱和性,但本质上与共价键的方向性和饱和性不同。
①方向性:X—H…Y—三个原子一般在同一方向上。原因是在这样的方向上成键两原子电子云之间的排斥力最小,形成的氢键最强,体系最稳定。
②饱和性:每一个X—H只能与一个Y原子形成氢键,原因是H原子半径很小,再有一个原子接近时,会受到X、Y原子电子云的排斥。
(4)分类:氢键可分为 氢键和 氢键两类。
存在 氢键, 存在 氢键。前者的沸点 后者的沸点。
(5)氢键对物质性质的影响
①对物质熔、沸点的影响
a.某些氢化物分子间存在氢键,如H2O、NH3、HF等,使其熔、沸点高于同族元素氢化物。
分子间
分子内
分子内
分子间
低于
b.同分异构体中分子间形成氢键的物质比分子内形成氢键的物质熔、沸点高,如熔、沸点:邻羟基苯甲酸( )<对羟基苯甲酸( )。
②对物质溶解度的影响
溶剂和溶质之间形成氢键使溶质的溶解度增大,如氨、甲醇、甲醛、甲酸等易溶于水。
③对物质密度的影响
如图所示,在冰中水分子间以氢键互相联结,形成相当疏松的晶体,从而在结构中有许多空隙,造成体积膨胀,密度减小。
3.溶解性
(1)“相似相溶”规律
非极性溶质一般能溶于 溶剂,极性溶质一般能溶于 溶剂,如蔗糖和氨 溶于水, 溶于四氯化碳;萘和碘 溶于四氯化碳,
溶于水。
非极性
极性
易
难
易
难
(2)影响物质溶解性的因素
①外界因素:主要有 等。
②氢键:溶剂和溶质之间的氢键作用力越大,溶解性越 。
③分子结构的相似性:溶质和溶剂的分子结构相似程度越大,其溶解性越 ,如乙醇与水 ,而戊醇在水中的溶解度明显减小。
温度、压强
好
大
互溶
正误判断
(1)HI分子间的范德华力大于HCl分子间的范德华力,故HI的沸点比HCl的高( )
(2)CO的沸点大于N2( )
(3)氢键的键长是指“X—H…Y”中“H…Y”的长度( )
(4)H2O的热稳定性大于H2S,是因为H2O分子间存在氢键( )
(5)冰融化成水,仅仅破坏氢键( )
(6)氢键均能使物质的熔、沸点升高( )
(7)I2在酒精中易溶,故可用酒精萃取碘水中的碘( )
(8)配制碘水时,为了增大碘的溶解性,常加入KI溶液( )
√
√
×
×
×
×
×
√
1.根据下表,怎样解释卤素单质从F2~I2的熔点和沸点越来越高?
提示 卤素单质分子(都是非极性分子)的结构相似,F2~I2相对分子质量依次增大,范德华力依次增大,其熔、沸点依次升高。
深度思考
单质 熔点/℃ 沸点/℃
F2 -219.6 -188.1
Cl2 -101 -34.6
Br2 -7.2 58.78
I2 113.5 184.4
2.(1)试表示HF水溶液中的氢键。
提示 F—H…F、O—H…F、F—H…O、O—H…O。
深度思考
(2)甲酸可通过氢键形成二聚物,HNO3可形成分子内氢键。试在下图中画出氢键。
提示
深度思考
3.比较NH3和CH4在水中的溶解度。怎样用“相似相溶”规律理解它们的溶解度不同?
提示 NH3为极性分子,CH4为非极性分子,而水是极性分子,根据“相似相溶”规律,NH3易溶于水,而CH4不易溶于水,且NH3与水分子之间可形成氢键,使得氨更易溶于水。
深度思考
4.怎样理解低碳醇与水互溶,而高碳醇在水中的溶解度却很小?
提示 “相似相溶”也适用于分子结构的相似性。低碳醇中的烃基较小,分子中的—OH与水分子中的—OH相近,因而低碳醇能与水互溶;而高碳醇的烃基较大,其分子中的—OH与水分子的—OH相似因素少,因而高碳醇在水中的溶解度明显减小。
深度思考
应用体验
1.下列有关范德华力的叙述正确的是
A.范德华力的实质也是一种电性作用,所以范德华力是一种特殊的化学键
B.范德华力与化学键的作用力的强弱不同
C.任何分子间在任意情况下都会产生范德华力
D.范德华力非常微弱,故破坏范德华力不需要消耗能量
√
范德华力的实质是一种电性作用,但范德华力是分子间较弱的作用力,不是化学键,A错误;
化学键是相邻原子间的强烈的相互作用,范德华力是分子间较弱的作用力,B正确;
若分子间的距离足够远,则分子间没有范德华力,C错误;
虽然范德华力非常微弱,但破坏它时也要消耗能量,D错误。
2.下列物质中,分子内和分子间均可形成氢键的是
A.NH3 B.
C.H2O D.C2H5OH
√
形成氢键的分子含有N—H、H—O或H—F。NH3、H2O、CH3CH2OH都能形成氢键但只存在于分子间。B中 的O—H与O—H
间可形成分子间氢键,O—H与 间可形成分子内氢键。
3.(2022·湖北孝感高二期中)下列现象不能用“相似相溶”规律解释的是
A.氨极易溶于水
B.氯气易溶于NaOH溶液
C.酒精与水以任意比互溶
D.苯萃取碘水中的I2
√
氨属于极性分子,水也属于极性分子,且氨能与水形成分子间氢键,根据“相似相溶”规律,氨极易溶于水,故A不符合题意;
氯气能与NaOH溶液反应生成可溶于水的NaCl和NaClO,不符合“相似相溶”规律,故B符合题意;
CH3CH2OH和水分子均属于极性分子,根据“相似相溶”规律,酒精易溶于水,故C不符合题意;
碘单质和苯均属于非极性分子,根据“相似相溶”规律,碘单质易溶于苯,故D不符合题意。
归纳总结
影响物质溶解性的因素
(1)外界条件——温度、压强等。
(2)分子结构——“相似相溶”规律。
(3)如果溶剂和溶质间存在氢键,其溶解度增大。
(4)溶质与溶剂发生反应可增大其溶解度。
返回
分子的手性
二
1.概念
(1)手性异构体:具有完全相同的 和 的一对分子,如同左手与右手一样互为镜像,却在三维空间里不能叠合,互称手性异构体(或对映异构体)。
(2)手性分子:具有 的分子。
组成
原子排列
手性异构体
2.手性分子的判断
(1)判断方法:有机物分子中是否存在手性碳原子。
(2)手性碳原子:有机物分子中连有四个各不相同的原子或基团的碳原
子。如 ,R1、R2、R3、R4互不相同,即 是手性碳原子。
1.乳酸的结构式为 ,其分子结构中有几个手性碳原子?
用*将手性碳原子标出来。
提示 只有一个手性碳原子: 。
深度思考
2.有机物 具有手性,若它与H2发生加成反应后,其
产物还有手性吗?
提示 该有机物与H2加成的产物是 ,该物质不存在手性碳原子,无手性。
深度思考
应用体验
1.下列说法不正确的是
A.互为手性异构体的分子互为镜像
B.利用手性催化剂可主要得到一种手性分子
C.手性异构体分子组成相同
D.手性异构体性质相同
√
互为手性异构体的分子互为镜像,故A正确;
在手性合成中,与催化剂手性匹配的分子在反应过程中会与手性催化剂形成一种最稳定的过渡态,从而只会诱导生成一种手性分子,故B正确;
手性异构体分子组成相同,故C正确。
2.有机物碳原子上连接的四个原子或原子团不相同,则这个碳原子称为手性碳原子,下列分子中含有手性碳原子的是
A.CH2Cl2
B.CH3CH2OH
C.CH3CH(CH3)2
D.CH3CH(CH3)CHClCOOH
CH3CH(CH3)CHClCOOH分子中,有一个碳原子所连的四个基团分别是羧基、异丙基、氢原子和氯原子,该碳原子具有手性,选项D正确。
√
返回
随堂演练 知识落实
1.下列说法正确的是
A.范德华力越大,分子越稳定
B.范德华力越大,物质的熔、沸点越高
C.相对分子质量越大,其范德华力越大
D.分子间只存在范德华力
1
2
3
4
5
√
1
2
3
范德华力主要影响物质的物理性质,化学键主要影响物质的化学性质,范德华力越大,物质的熔、沸点越高,B正确、A不正确;
分子的组成和结构相似时,相对分子质量越大,其范德华力越大,C不正确。
4
5
2.甲醛( )在Ni催化作用下加氢可得甲醇(CH3OH),以下说法正确的是
A.甲醛分子间可以形成氢键
B.甲醛分子和甲醇分子内C原子均采取sp2杂化
C.甲醛为极性分子
D.甲醇的沸点远低于甲醛的沸点
1
2
3
4
5
√
1
2
3
4
5
甲醛分子中,H原子与C原子相连,碳元素的电负性相对较小,甲醛分子间不能形成氢键,故A错误;
HCHO中C原子采取sp2杂化,CH3OH分子中C原子采取sp3杂化,故B错误;
甲醛分子是平面三角形,碳原子位于三角形内部,结构不对称,为极性分子,故C正确;
甲醇分子之间形成氢键,甲醛分子之间不能形成氢键,故甲醇的沸点高于甲醛的沸点,故D错误。
3.下列与氢键有关的说法错误的是
A.卤化氢中HF沸点较高,是由于HF分子间存在氢键
B.邻羟基苯甲醛( )的熔、沸点比对羟基苯甲醛( )
的熔、沸点低
C.氨水中存在分子间氢键
D.形成氢键A—H…B—的三个原子总在一条直线上
1
2
3
4
5
√
1
2
3
4
5
HF分子间存在氢键F—H…F—,使氟化氢分子间的作用力增大,所以卤化氢中氟化氢的沸点较高,A正确;
邻羟基苯甲醛可形成分子内氢键,而对羟基苯甲醛可形成分子间氢键,所以邻羟基苯甲醛的熔、沸点比对羟基苯甲醛的熔、沸点低,B正确;
氨水中氨分子之间、水分子之间以及氨分子与水分子之间都存在氢键,C正确;
氢键具有一定的方向性,但形成氢键的原子不一定在一条直线上,如 ,故D错误。
4.维生素C的结构简式是 ,它能防治坏血病,该
分子中有几个手性碳原子
A.1 B.2 C.3 D.4
1
2
3
4
5
√
该分子中属于手性碳原子的是左边第二号、三号碳,它们均连接四个不同原子或原子团,所以该分子中含有2个手性碳原子。
5.试用有关知识解释下列现象:
(1)乙醚(C2H5OC2H5)的相对分子质量远大于乙醇,但乙醇的沸点却比乙醚高很多,原因:______________________________________________
_________________________________。
(2)从氨合成塔里出来的H2、N2、NH3的混合物中分离出NH3,常采用加压使NH3液化的方法:__________________________________________
_____________________________________________________。
1
2
3
4
5
乙醇分子之间形成的氢键作用远大于乙醚分子间的范德华力,故乙醇的沸点比乙醚高很多
NH3分子间可以形成氢键,而N2、H2分子间的范德华力很小,故NH3可采用加压液化的方法从混合物中分离
(3)水在常温下,其组成的化学式可用(H2O)m表示,原因: ___________
______________________________________________________________________________________。
1
2
3
4
5
常温下,液态水中水分子间通过氢键缔合成较大分子团,所以用(H2O)m表示,而不是以单个分子形式存在
返回
课时对点练
题组一 分子间的作用力的理解及应用
1.下列有关物质性质判断正确且可以用范德华力来解释的是
A.沸点:HBr>HCl
B.沸点:CH3CH2Br<C2H5OH
C.稳定性:HF>HCl
D.—OH上氢原子的活泼性:H—O—H>C2H5—O—H
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
HBr与HCl结构相似,HBr的相对分子质量比HCl大,HBr分子间的范德华力比HCl大,所以其沸点比HCl高;C2H5Br的沸点比C2H5OH低是由于C2H5OH分子间形成氢键而增大了分子间的作用力;HF比HCl稳定是由于H—F的键能比H—Cl的键能大;H2O分子中—OH的氢原子比C2H5OH中—OH的氢原子更活泼是由于—C2H5是推电子基团,使O—H极性减弱。
2.关于氢键,下列说法正确的是
A.由于冰中的水分子间存在氢键,所以其密度大于液态水
B.可以用氢键解释接近沸点的水蒸气的相对分子质量测定值比用化学式
(H2O)计算出来的相对分子质量大
C.分子间氢键和分子内氢键都会使熔、沸点升高
D.水加热到很高的温度都难以分解,这是由于氢键所致
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
A项,由于冰中的水分子间存在氢键,增大了分子之间的距离,所以其密度小于液态水,错误;
B项,由于水分子之间存在氢键,使水分子通常以几个分子缔合的形式存在,所以接近沸点的水蒸气的相对分子质量测定值比用化学式(H2O)计算出来的相对分子质量大,正确;
C项,分子间氢键使熔、沸点升高,而分子内氢键则会使熔、沸点降低,错误;
D项,水加热到很高的温度都难以分解,这是由于分子内的H—O共价键强的缘故,与分子间的氢键无关,错误。
3.比较下列化合物的沸点,前者低于后者的是
A.乙醇与氯乙烷
B.邻羟基苯甲酸 与对羟基苯甲酸
C.对羟基苯甲醇 与邻羟基苯甲醇
D.H2O与H2Te
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
氢键分为两类:分子间氢键和分子内氢键。同类物质相比,分子内形成氢键的物质的熔、沸点要低于分子间形成氢键的物质的熔、沸点。如邻羟基苯甲酸、邻羟基苯甲醇等容易形成分子内氢键,沸点较低,而对羟基苯甲酸、对羟基苯甲醇则容易形成分子间氢键,沸点较高,所以B选项符合题意,C选项不符合题意;
对于A选项,由于乙醇存在分子间氢键,而氯乙烷不存在氢键,所以乙醇的沸点高于氯乙烷的沸点;
D选项中,H2O的沸点高于H2Te的沸点。
4.已知各种硝基苯酚的性质如下表:
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
名称 结构式 25 ℃水中溶解度/g 熔点/℃ 沸点/℃
邻硝基苯酚 0.2 45 100
间硝基苯酚 1.4 96 194
对硝基苯酚 1.7 114 295
下列关于三种硝基苯酚的叙述不正确的是
A.邻硝基苯酚分子内形成氢键,使其熔、沸点低于另外两种硝基苯酚
B.间硝基苯酚不仅分子间能形成氢键,也能与水分子形成氢键
C.对硝基苯酚分子间能形成氢键,使其熔、沸点较高
D.三种硝基苯酚都能形成分子内氢键
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
当分子形成分子内氢键时,熔、沸点降低,A正确;
间硝基苯酚中与N原子相连的O原子易与水分子中的H原子形成氢键,B正确、D错误;
对硝基苯酚能形成分子间氢键,使其熔、沸点升高,C正确。
题组二 物质的溶解性
5.根据“相似相溶”规律和实际经验,下列叙述不正确的是
A.卤化氢易溶于水,也易溶于CCl4
B.白磷(P4)易溶于CS2,但难溶于水
C.碘易溶于苯,微溶于水
D.NaCl易溶于水,难溶于CCl4
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
卤化氢、水是极性分子,CCl4、P4、碘、苯都是非极性分子,根据“相似相溶”规律,卤化氢难溶于CCl4。
6.某同学在所收到的信封上发现有收藏价值的邮票,便将邮票剪下来浸入水中,以去掉邮票背面的黏合剂。根据“相似相溶”规律,该黏合剂的成分可能是
A.?CH2—CH2? B.
C. D.
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
根据选项中物质的结构可以知道,四种物质中只有 中含有亲水基团羟基(—OH),故与水相溶。
7.已知O3分子为V形结构,O3在水中的溶解度和O2相比
A.一样大 B.O3比O2小
C.O3比O2大 D.无法比较
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
因O3分子为V形结构,是极性分子,O2为非极性分子,根据“相似相溶”规律可知O3在水中的溶解度比O2大,C项正确。
8.物质在不同溶剂中的溶解性一般都遵循“相似相溶”规律。下列装置不宜用于HCl尾气吸收的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
HCl是极性分子,易溶于水而不溶于CCl4。
C项装置易发生倒吸,A、D项装置分别使用了倒置漏斗和球形干燥管,能防止倒吸;
B项装置中HCl气体先通过CCl4,由于HCl不溶于CCl4,HCl经过CCl4后再被上层的水吸收,也可以有效防止倒吸。
题组三 手性碳原子及手性异构
9.当一个碳原子连接四个不同的原子或基团时,该碳原子叫“手性碳原子”。下列化合物中含有2个手性碳原子的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
A. B.
C. D.
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
A、B、D三项中化合物均只含有1个手性碳原子,C项中
标*的为化合物中含有的手性碳原子。
10.下列关于丙氨酸的说法正确的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
A.Ⅰ和Ⅱ的结构和性质完全不同
B.Ⅰ和Ⅱ呈镜面对称,具有不同的分子极性
C.Ⅰ和Ⅱ都属于非极性分子
D.Ⅰ和Ⅱ中化学键的种类与数目完全相同
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
从题图可看出,丙氨酸的分子中有1个碳原子与—H、—CH3、—NH2和—COOH相连,是手性碳原子,故丙氨酸分子有手性异构体。Ⅰ和
Ⅱ的结构不同,但由于其所含官能团相同,化学性质相似,A项错误;
Ⅰ和Ⅱ呈镜面对称,且分子的极性相同,B项错误;
Ⅰ和Ⅱ的空间结构不对称,故均是极性分子,C项错误;
Ⅰ和Ⅱ中化学键的种类(极性键和非极性键、σ键和π键、单键和双键)和数目完全相同,D项正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
11.下列各项比较中前者高于(或大于或强于)后者的是
A.CH4在水中的溶解度和NH3在水中的溶解度
B.I2在水中的溶解度和I2在CCl4中的溶解度
C.I与H形成共价键的极性和F与H形成共价键的极性
D.乙酸(CH3COOH)的沸点和丙醇(CH3CH2CH2OH)的沸点
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
NH3和水分子间可形成氢键,NH3在水中的溶解度大于CH4在水中的溶解度,故A错误;
I2是非极性分子,水是极性分子,CCl4是非极性分子,根据“相似相溶”规律,I2在水中的溶解度小于I2在CCl4中的溶解度,故B错误;
氟的电负性大于碘的电负性,所以I与H形成共价键的极性小于F与H形成共价键的极性,故C错误。
12.通常情况下,NCl3是一种油状液体,其分子空间结构与NH3相似,下列对NCl3和NH3的有关叙述错误的是
A.NCl3分子中N—Cl的键长与CCl4分子中C—Cl的键长不相等
B.NCl3分子是极性分子
C.NBr3比NCl3易挥发
D.在氨水中,大部分NH3与H2O以氢键(用“…”表示)结合形成NH3·H2O
分子,则NH3·H2O的结构式主要为
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
C原子的原子半径大于N原子的原子半径,所以CCl4中C—Cl的键长比NCl3中N—Cl的键长长,故A正确;
NCl3的分子空间结构与NH3相似,都是三角锥形,NH3分子是极性分子,所以NCl3分子也是极性分子,故B正确;
共价化合物中物质的熔、沸点与相对分子质量有关,一般来说,对于组成和结构相似的物质,相对分子质量越大其熔、沸点越高,所以NBr3比NCl3的熔、沸点高,NCl3比NBr3易挥发,故C错误;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
在氨水中,NH3与H2O以氢键(用“…”表示)结合形成NH3·H2O分子,则NH3·H2O的结构式主要为 ,故D正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
13.(2022·湖南高中学业水平仿真模拟)我国科学家发现大脑进入“梦乡”的钥匙——多巴胺(DA),DA的结构简式如图所示。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
下列说法正确的是
A.DA是只含极性键的共价化合物
B.DA分子能溶于水、乙醇等溶剂
C.键能大小决定DA的熔点和沸点
D.DA中所有元素均位于同一周期
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
由DA的结构简式可知,DA含有N—H、N—C、C—O、H—O、C—H等极性键,同时还含有C—C非极性键的共价化合物,A错误;
DA分子中含有氨基和酚羟基,这两种官能团均能与水、乙醇形成分子间氢键,且DA属于极性分子,故可推知DA能溶于水、乙醇等溶剂,B正确;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
熔、沸点是物理性质,键能的大小决定物质的化学性质,故DA的熔、沸点高低与其分子中的键能大小无关,与分子间作用力大小有关,C错误;
DA中含有H、C、N、O,其中C、N、O元素同位于第二周期,而H位于第一周期,D错误。
14.(2022·湖南新宁县第一中学高二期中)白磷的结构为 ,下列有关白磷的说法错误的是
A.31 g P4含有1.5NA个P—P
B.P4为正四面体形结构,键角为109°28′
C.P4中P原子为sp3杂化
D.P4能保存在水中,因为P4是非极性分子,H2O是极性分子,且密度大
于H2O
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
1个白磷分子含有6个P—P,31 g P4的物质的量是0.25 mol,则含有1.5NA个P—P,A正确;
P4为正四面体形结构,键角为60°,B错误;
P4中P原子形成3个单键,含有一个孤电子对,为sp3杂化,C正确;
P4是非极性分子,H2O是极性分子,且密度大于H2O,依据“相似相溶”规律可知P4能保存在水中,D正确。
15.双氧水(H2O2)是一种医用消毒杀菌剂,已知H2O2分子的结构如图所示:
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
H2O2分子不是直线形的,两个H原子犹如在半展开的书的两面纸上,书面角为93°52′,而两个O—H与O—O的夹角均为96°52′。试回答:
(1)H2O2分子的电子式为______________,结构式为______________。
(2)H2O2分子中存在_____键和________键,为______分子(填“极性”或“非极性”)。
H—O—O—H
极性
非极性
极性
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
H2O2分子的空间结构不对称,为极性分子,含有O—O非极性键和O—H极性键。
(3)H2O2难溶于CS2,其原因是____________________________________
_________________________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
根据“相似相溶”规律可知,H2O2为极性分子,难溶于非极性溶剂CS2。
H2O2为极性分子,CS2为非极性分子,根据“相似相溶”规律可知H2O2难溶于CS2
(4)H2O2分子中氧元素的化合价为____,原因是_____________________
_____________________________________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
-1
共用电子对的偏移决定了元素在化合物中的化合价。
O—O为非极性键,O—H为极性键,共用电子对偏向于氧,故氧元素显-1价
16.(1)已知苯酚( )具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子 能形成分子内氢键。据此判断,相
同温度下电离平衡常数Ka2(水杨酸)_____(填“>”或“<”)Ka(苯酚),
其原因是______________________________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
<
中形成分子内氢键,使其更难电离出H+
当 形成分子内氢键后,导致酚羟基的电离能力减弱,故其电离能力比苯酚的弱。
(2)CO2由固态变为气态所需克服的微粒间作用力是__________;氢、碳、氧元素的原子可共同形成多种分子,写出其中一种能形成同种分子间氢键的物质名称:___________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
范德华力
固态CO2中存在范德华力;根据氢键的形成条件,由H、C、O构成的能形成分子间氢键的分子,可联想到HCOOH、CH3COOH等。
乙酸(合理答案均可)
(3)下图中曲线表示卤素某种性质随核电荷数的变化趋势,正确的是___
(填字母)。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
a
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
同主族元素从上到下,元素的电负性逐渐减小,a正确;
F元素无正价,b错误;
由于氟化氢中存在分子间氢键,所以其沸点高于溴化氢,c错误;
随着相对分子质量的增大,范德华力增大,卤素单质的熔点升高,d错误。
(4)O的氢化物(H2O)在乙醇中的溶解度大于H2S在乙醇中的溶解度,其原因是_______________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
水分子与乙醇分子之间形成氢键
水与乙醇可形成分子间氢键,使得水与乙醇互溶;而硫化氢与乙醇不能形成分子间氢键,所以硫化氢在乙醇中的溶解度小于水。
(5)化合物NH3的沸点比化合物CH4的高,其主要原因是______________
________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
NH3分子间可形成氢键,使其沸点高于CH4的沸点。
NH3分子间可形
返回
成氢键
本课结束
第二章
