化学人教版(2019)必修第一册1.3.3氧化剂和还原剂(共31张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册1.3.3氧化剂和还原剂(共31张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 26.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-18 21:49:44 | ||
图片预览







文档简介
(共31张PPT)
氧化还原反应
课时3 氧化剂和还原剂
食品包装中的
切开的苹果慢慢变黄腐坏
什么是氧化剂?什么是还原剂?
生活中的脱氧剂
氧气—氧化剂
脱氧剂—还原剂
氧化剂、还原剂及相关概念
① 氧化剂与还原剂的概念
② 氧化 产物与还原产物的概念
③ 常见的氧化剂与还原剂
④对应的氧化产物与还原产物
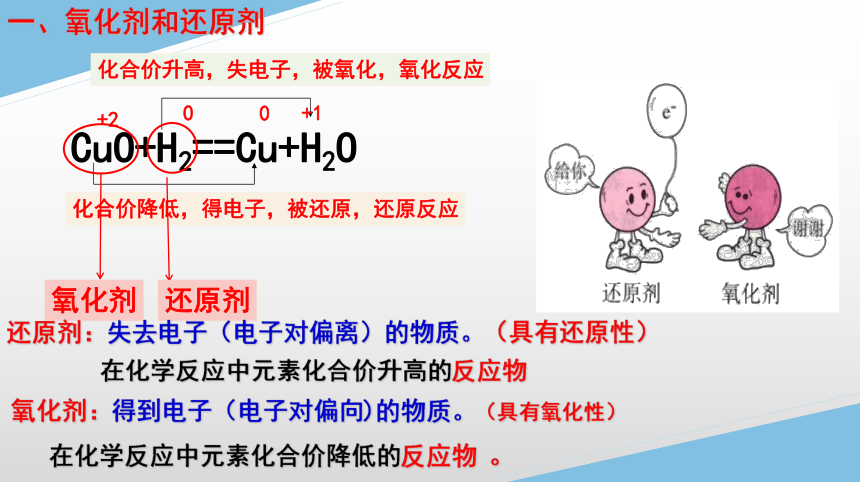
CuO+H2==Cu+H2O
0
+2
+1
0
化合价降低,得电子,被还原,还原反应
化合价升高,失电子,被氧化,氧化反应
氧化剂
还原剂
还原剂:失去电子(电子对偏离)的物质。(具有还原性)
一、氧化剂和还原剂
在化学反应中元素化合价升高的反应物
氧化剂:得到电子(电子对偏向)的物质。(具有氧化性)
在化学反应中元素化合价降低的反应物 。
二、氧化产物和还原产物
氧化产物:被氧化后(还原剂对应)的生成物
还原产物:被还原后(氧化剂对应)的生成物
CuO + H2 == Cu + H2O
0
+2
+1
0
(氧化剂)
化合价降低,得到电子,被还原,还原反应
化合价升高,失去电子,被氧化,氧化反应
(还原产物)
(氧化产物)
(还原剂)
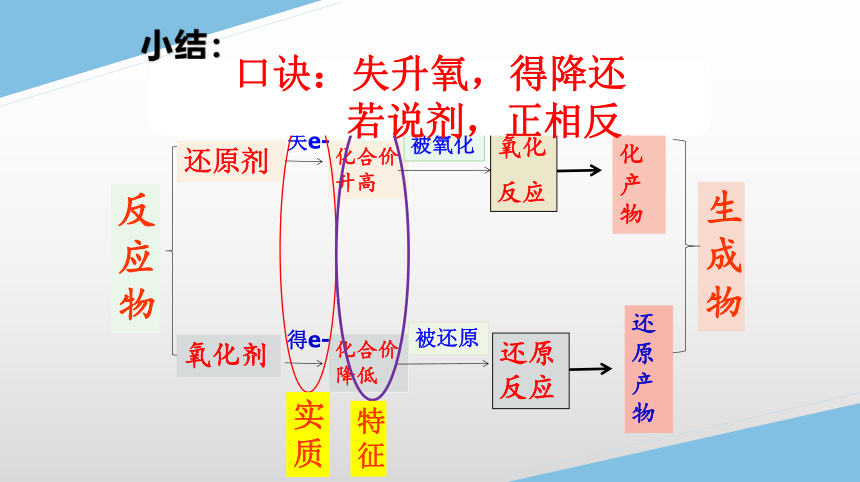
小结:
氧化剂
还原剂
氧化
反应
化合价升高
失e-
化合价降低
得e-
还原反应
还原产物
反应物
被氧化
被还原
氧化产物
生成物
实质
特征
口诀:失升氧,得降还
若说剂,正相反
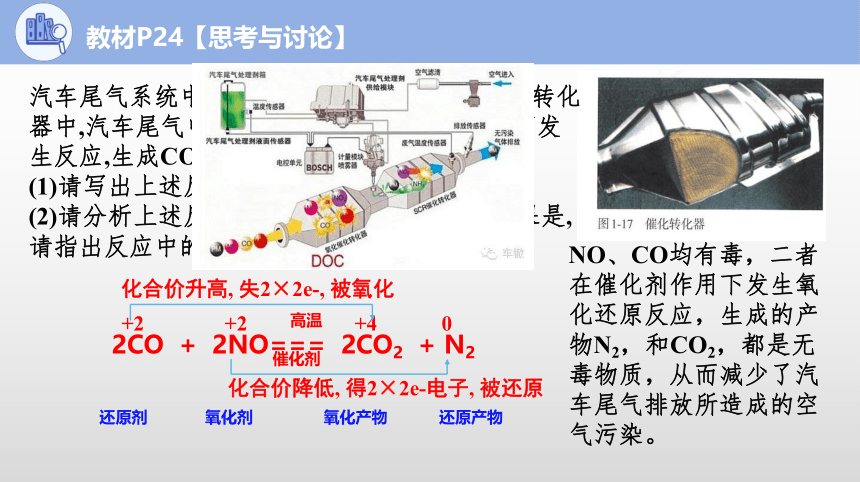
2CO + 2NO=== 2CO2 + N2
高温
催化剂
还原剂
氧化剂
汽车尾气系统中均安装了催化转化器。在催化转化器中,汽车尾气中的CO和NO在催化剂的作用下发生反应,生成CO2和N2。
(1)请写出上述反应的化学方程式。
(2)请分析上述反应是否为氧化还原反应。 如果是,请指出反应中的氧化剂和还原剂。
+2 +2 +4 0
化合价升高, 失2×2e-, 被氧化
化合价降低, 得2×2e-电子, 被还原
氧化产物
还原产物
教材P24【思考与讨论】
NO、CO均有毒,二者在催化剂作用下发生氧化还原反应,生成的产物N2,和CO2,都是无毒物质,从而减少了汽车尾气排放所造成的空气污染。
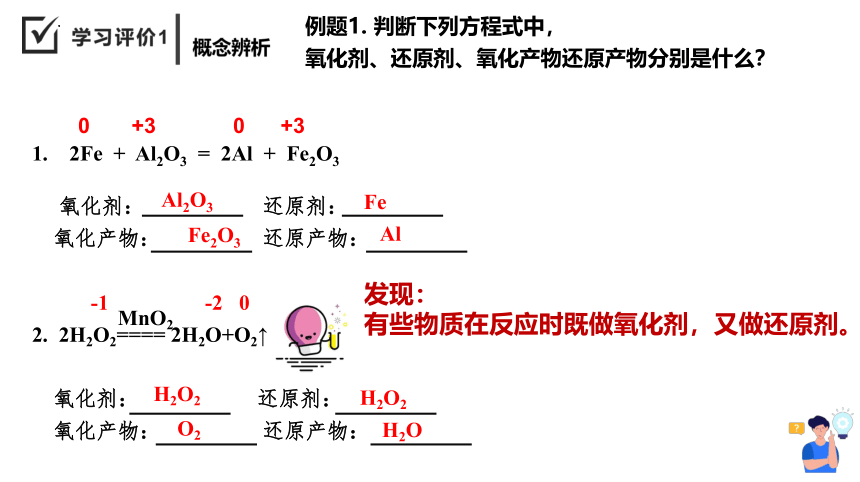
1. 2Fe + Al2O3 = 2Al + Fe2O3
氧化剂: 还原剂:
氧化产物: 还原产物:
-1 -2 0
2. 2H2O2==== 2H2O+O2↑
氧化剂: 还原剂:
氧化产物: 还原产物:
MnO2
0 +3 0 +3
Fe
Al2O3
Fe2O3
Al
H2O2
H2O2
H2O
O2
例题1. 判断下列方程式中,
氧化剂、还原剂、氧化产物还原产物分别是什么?
发现:
有些物质在反应时既做氧化剂,又做还原剂。
3.在2FeS+6H2SO4(浓)=Fe2(SO4)3+3SO2 +2S+6H2O的反应中:
(1)氧化剂是 ,(2)还原剂是 。
(3)氧化产物是 ,
(4)还原产物是___________,
(5)被氧化的元素是_______,
( 6)被还原的元素是 ,
(7)氧化过程是 ,
(8) 还原过程是 。
H2SO4
FeS
Fe2(SO4)3和S。
SO2
Fe和S
H2SO4中的S元素
FeS →Fe2(SO4)3+S
H2SO4→SO2
-2
+2
+6
+3
+4
0
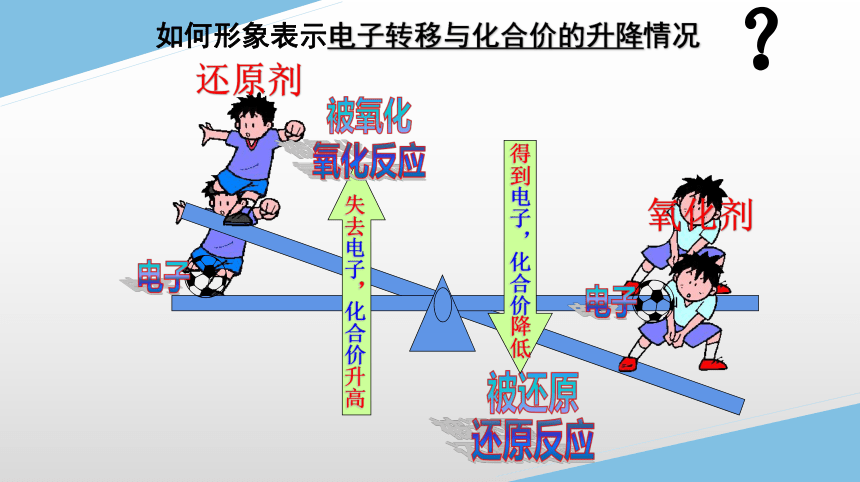
电子
电子
被氧化
氧化反应
失去电子,化合价升高
被还原
还原反应
得到电子,化合价降低
?
如何形象表示电子转移与化合价的升降情况
还原剂
氧化剂
三、常见的氧化剂和还原剂
(1)常见的氧化剂:
(2)常见的还原剂:
具有氧化性,化合价降低,得电子,被还原。
具有还原性,化合价升高,失电子,被氧化。
如MnO4-、NO3-(H+) 、ClO- 、 Fe3+具有氧化性
如S2-(或HS- )、SO32-(或HSO3-)、I-、Fe2+具有还原性
①活泼的非金属单质:O2、Cl2、F2、Br2、O3等
②含高价金属阳离子的化合物:FeCl3。
③含某些较高化合价元素的化合物:浓H2SO4、HNO3、KMnO4、K2Cr2O7等
①活泼金属单质:Al、Zn、Fe等
②某些非金属单质:C、H2等
③含低价金属阳离子的化合物:FeCl2、CuCl等
④含较低化合价元素的化合物等:HCl、H2S等
常见的氧化剂 常见的还原剂
活泼非金属单质 活泼金属单质
高价态化合物 低价态化合物
过氧化物 某些非金属单质
Cl2、O2
Al、Fe、Zn
浓硫酸、KMnO4、HNO3、 FeCl3
CO、SO2、KI
Na2O2、H2O2
C、H2、S
这些氧化剂/还原剂,在发生氧化还原反应后,会变成什么物质?
常见的氧化剂与还原剂
常见铁粉 氧化还原反应
思考:购买的商品中脱氧剂成分是什么?脱氧剂通过发生什么反应来实现吸收氧气的目的?
脱氧剂= 抗氧化剂=还原剂
①Fe+CuSO4=Cu+FeSO4
②MnO2 + 4HCl MnCl2+Cl2↑+2H2O
③3NO2+H2O=2HNO3+NO
④2H2S+SO2=3S+2H2O
⑤2KMnO4 K2MnO4+MnO2+O2↑
(氧化剂:CuSO4,还原剂:Fe,氧化产物:FeSO4,还原产物:Cu)
(氧化剂:MnO2,还原剂:HCl,氧化产物:Cl2,还原产物:MnCl2)
(氧化剂:NO2,还原剂:NO2,氧化产物:HNO3,还原产物:NO)
(氧化剂:SO2,还原剂:H2S,氧化产物:S,还原产物:S)
(氧化剂:KMnO4,还原剂:KMnO4,氧化产物:O2,还原产物:K2MnO4和MnO2)
某种物质没有“身份”
某种物质有两种“身份”
某些物质“身份”相同
例题2. 判断下列方程式中,
氧化剂、还原剂、氧化产物还原产物分别是什么?
①Fe → FeCl2,需加_______剂,如____________
②CuO→ Cu, 需加_______ 剂,如____________
③HCl→ Cl2 ,是 _______ 反应,HCl是_______剂
④HCl→ H2 ,是 ________ 反应,HCl是_______剂
⑤Fe3+→ Fe,需加________剂,Fe3+具有______性。
氧 化
HCl
还 原
H2 、C、CO
氧化
还 原
还 原
氧 化
还 原
氧化
例题3. 分析下列变化过程是氧化还是还原,再填空。
1.对于反应3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,
①氧化剂和还原剂的物质的量之比为__________。
②被还原的HNO3和起酸性作用的HNO3的物质的量之比为_______。
2.对于此反应:3Cl2 + 6KOH = KClO3 + 5KCl + 3H2O,氧化剂和还原剂的比例为__________。
8:3
1:3
5:1
3、在浓盐酸中加入少量KMnO4,剧烈反应,产生黄绿色有刺激性气味的气体,溶液紫红色褪去,已知该反应的化学方程式2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O 。①请用双线桥法表示此反应电子转移的方向和数目_______。②其中氧化剂是_______,氧化产物是_______,每生成a个氯气,转移电子数为_______个。
KMnO4
Cl2
2a
五. 生活中的氧化还原反应:
SO2是有毒的气体,
为什么葡萄酒中还要加入SO2呢
二氧化硫在葡萄酒中起到抑菌、抗氧化的作用,可以抑制微生物和酶的活性,防止葡萄酒变酸。二氧化硫在食品中还起到漂白剂、防腐剂、抗氧化剂和护色剂等。在葡萄酒中,二氧化硫是抗氧化剂,体现了二氧化硫的还原性。
红酒中添加二氧化硫的原因:
红酒的某些成分在储存的过程中会被氧气氧化,而使红酒的口感变差。所以我们应该在红酒中加入一些什么剂呢?
还原剂
二氧化硫就是这种加入的还原剂,所以我们说二氧化硫应该具有还原性
焦亚硫酸钾是用来代替二氧化硫的一种抗氧化剂
抗氧化剂就是还原剂
练习1. 某种飞船以N2H4和N2O4为动力源,发生反应:2N2H4+N2O4===3N2+4H2O,反应温度可高达2 700 ℃,对于该反应,下列说法中正确的是( )
A.该反应属于置换反应
B.N2H4是氧化剂
C.N2O4是还原剂
D.N2既是氧化产物又是还原产物
√
练习2. 氢化钙可作为生氢剂,反应的化学方程式为CaH2+2H2O===Ca(OH)2+2H2↑。下列说法错误的是( )
A.氢化钙既是氧化剂又是还原剂
B.氢气既是氧化产物又是还原产物
C.氢化钙是还原剂,水是氧化剂
D.氧化产物与还原产物的质量比为1∶1
√
1.根据氧化还原反应原理来判断
(1)氧化性强弱:氧化剂>氧化产物。
(2)还原性强弱:还原剂>还原产物。
氧化性、还原性强弱的判断
2.根据元素的活动性顺序来判断
(1)金属单质越活泼,其还原性越强;非金属单质越活泼,其氧化性越强。
(2)“单强离弱”——金属单质还原性越强,其阳离子的氧化性越弱;
非金属单质的氧化性越强,其阴离子的还原性越弱。
如:Fe+CuSO4===FeSO4+Cu
氧化性、还原性强弱的判断
3. 根据反应条件的难易来判断
反应的条件越简单,反应就越容易发生,说明物质氧化性(或还原性)越强。
2KMnO4 + 16HCl(浓) === 2KCl + 2MnCl2 + 8H2O + 5Cl2↑
MnO2 + 4HCl(浓) MnCl2 + 2H2O + Cl2↑
O2 + 4HCl(浓) 2Cl2+2H2O
氧化性:_____________________________
△
△
KMnO4>MnO2>O2
氧化性、还原性强弱的判断
4. 根据元素被氧化/还原的程度来判断
某还原剂被不同氧化剂氧化时,元素化合价升得越高,说明氧化剂的氧化性越强。
2Fe + 3Cl2 2FeCl3 Fe + S FeS 氧化性:__________
Cu + 2Fe3+ == Cu2+ + 2Fe2+ 3Zn + 2Fe3+ == 3Zn2+ + 2Fe 还原性:__________
点燃
Cl2 > S
Zn > Cu
△
氧化性、还原性强弱的判断
氧化性、还原性强弱的判断
还原剂
化合价升高
失电子
被氧化
发生氧化反应
氧化产物
氧化剂
化合价降低
得电子
被还原
发生还原反应
还原产物
还原剂 + 氧化剂 = 还原产物 + 氧化产物
反应物
生成物
升失氧 降得还
氧化还原反应基本概念间的联系
学习总结
思维课堂
THANKS
谢谢聆听
氧化还原反应
课时3 氧化剂和还原剂
食品包装中的
切开的苹果慢慢变黄腐坏
什么是氧化剂?什么是还原剂?
生活中的脱氧剂
氧气—氧化剂
脱氧剂—还原剂
氧化剂、还原剂及相关概念
① 氧化剂与还原剂的概念
② 氧化 产物与还原产物的概念
③ 常见的氧化剂与还原剂
④对应的氧化产物与还原产物
CuO+H2==Cu+H2O
0
+2
+1
0
化合价降低,得电子,被还原,还原反应
化合价升高,失电子,被氧化,氧化反应
氧化剂
还原剂
还原剂:失去电子(电子对偏离)的物质。(具有还原性)
一、氧化剂和还原剂
在化学反应中元素化合价升高的反应物
氧化剂:得到电子(电子对偏向)的物质。(具有氧化性)
在化学反应中元素化合价降低的反应物 。
二、氧化产物和还原产物
氧化产物:被氧化后(还原剂对应)的生成物
还原产物:被还原后(氧化剂对应)的生成物
CuO + H2 == Cu + H2O
0
+2
+1
0
(氧化剂)
化合价降低,得到电子,被还原,还原反应
化合价升高,失去电子,被氧化,氧化反应
(还原产物)
(氧化产物)
(还原剂)
小结:
氧化剂
还原剂
氧化
反应
化合价升高
失e-
化合价降低
得e-
还原反应
还原产物
反应物
被氧化
被还原
氧化产物
生成物
实质
特征
口诀:失升氧,得降还
若说剂,正相反
2CO + 2NO=== 2CO2 + N2
高温
催化剂
还原剂
氧化剂
汽车尾气系统中均安装了催化转化器。在催化转化器中,汽车尾气中的CO和NO在催化剂的作用下发生反应,生成CO2和N2。
(1)请写出上述反应的化学方程式。
(2)请分析上述反应是否为氧化还原反应。 如果是,请指出反应中的氧化剂和还原剂。
+2 +2 +4 0
化合价升高, 失2×2e-, 被氧化
化合价降低, 得2×2e-电子, 被还原
氧化产物
还原产物
教材P24【思考与讨论】
NO、CO均有毒,二者在催化剂作用下发生氧化还原反应,生成的产物N2,和CO2,都是无毒物质,从而减少了汽车尾气排放所造成的空气污染。
1. 2Fe + Al2O3 = 2Al + Fe2O3
氧化剂: 还原剂:
氧化产物: 还原产物:
-1 -2 0
2. 2H2O2==== 2H2O+O2↑
氧化剂: 还原剂:
氧化产物: 还原产物:
MnO2
0 +3 0 +3
Fe
Al2O3
Fe2O3
Al
H2O2
H2O2
H2O
O2
例题1. 判断下列方程式中,
氧化剂、还原剂、氧化产物还原产物分别是什么?
发现:
有些物质在反应时既做氧化剂,又做还原剂。
3.在2FeS+6H2SO4(浓)=Fe2(SO4)3+3SO2 +2S+6H2O的反应中:
(1)氧化剂是 ,(2)还原剂是 。
(3)氧化产物是 ,
(4)还原产物是___________,
(5)被氧化的元素是_______,
( 6)被还原的元素是 ,
(7)氧化过程是 ,
(8) 还原过程是 。
H2SO4
FeS
Fe2(SO4)3和S。
SO2
Fe和S
H2SO4中的S元素
FeS →Fe2(SO4)3+S
H2SO4→SO2
-2
+2
+6
+3
+4
0
电子
电子
被氧化
氧化反应
失去电子,化合价升高
被还原
还原反应
得到电子,化合价降低
?
如何形象表示电子转移与化合价的升降情况
还原剂
氧化剂
三、常见的氧化剂和还原剂
(1)常见的氧化剂:
(2)常见的还原剂:
具有氧化性,化合价降低,得电子,被还原。
具有还原性,化合价升高,失电子,被氧化。
如MnO4-、NO3-(H+) 、ClO- 、 Fe3+具有氧化性
如S2-(或HS- )、SO32-(或HSO3-)、I-、Fe2+具有还原性
①活泼的非金属单质:O2、Cl2、F2、Br2、O3等
②含高价金属阳离子的化合物:FeCl3。
③含某些较高化合价元素的化合物:浓H2SO4、HNO3、KMnO4、K2Cr2O7等
①活泼金属单质:Al、Zn、Fe等
②某些非金属单质:C、H2等
③含低价金属阳离子的化合物:FeCl2、CuCl等
④含较低化合价元素的化合物等:HCl、H2S等
常见的氧化剂 常见的还原剂
活泼非金属单质 活泼金属单质
高价态化合物 低价态化合物
过氧化物 某些非金属单质
Cl2、O2
Al、Fe、Zn
浓硫酸、KMnO4、HNO3、 FeCl3
CO、SO2、KI
Na2O2、H2O2
C、H2、S
这些氧化剂/还原剂,在发生氧化还原反应后,会变成什么物质?
常见的氧化剂与还原剂
常见铁粉 氧化还原反应
思考:购买的商品中脱氧剂成分是什么?脱氧剂通过发生什么反应来实现吸收氧气的目的?
脱氧剂= 抗氧化剂=还原剂
①Fe+CuSO4=Cu+FeSO4
②MnO2 + 4HCl MnCl2+Cl2↑+2H2O
③3NO2+H2O=2HNO3+NO
④2H2S+SO2=3S+2H2O
⑤2KMnO4 K2MnO4+MnO2+O2↑
(氧化剂:CuSO4,还原剂:Fe,氧化产物:FeSO4,还原产物:Cu)
(氧化剂:MnO2,还原剂:HCl,氧化产物:Cl2,还原产物:MnCl2)
(氧化剂:NO2,还原剂:NO2,氧化产物:HNO3,还原产物:NO)
(氧化剂:SO2,还原剂:H2S,氧化产物:S,还原产物:S)
(氧化剂:KMnO4,还原剂:KMnO4,氧化产物:O2,还原产物:K2MnO4和MnO2)
某种物质没有“身份”
某种物质有两种“身份”
某些物质“身份”相同
例题2. 判断下列方程式中,
氧化剂、还原剂、氧化产物还原产物分别是什么?
①Fe → FeCl2,需加_______剂,如____________
②CuO→ Cu, 需加_______ 剂,如____________
③HCl→ Cl2 ,是 _______ 反应,HCl是_______剂
④HCl→ H2 ,是 ________ 反应,HCl是_______剂
⑤Fe3+→ Fe,需加________剂,Fe3+具有______性。
氧 化
HCl
还 原
H2 、C、CO
氧化
还 原
还 原
氧 化
还 原
氧化
例题3. 分析下列变化过程是氧化还是还原,再填空。
1.对于反应3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,
①氧化剂和还原剂的物质的量之比为__________。
②被还原的HNO3和起酸性作用的HNO3的物质的量之比为_______。
2.对于此反应:3Cl2 + 6KOH = KClO3 + 5KCl + 3H2O,氧化剂和还原剂的比例为__________。
8:3
1:3
5:1
3、在浓盐酸中加入少量KMnO4,剧烈反应,产生黄绿色有刺激性气味的气体,溶液紫红色褪去,已知该反应的化学方程式2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O 。①请用双线桥法表示此反应电子转移的方向和数目_______。②其中氧化剂是_______,氧化产物是_______,每生成a个氯气,转移电子数为_______个。
KMnO4
Cl2
2a
五. 生活中的氧化还原反应:
SO2是有毒的气体,
为什么葡萄酒中还要加入SO2呢
二氧化硫在葡萄酒中起到抑菌、抗氧化的作用,可以抑制微生物和酶的活性,防止葡萄酒变酸。二氧化硫在食品中还起到漂白剂、防腐剂、抗氧化剂和护色剂等。在葡萄酒中,二氧化硫是抗氧化剂,体现了二氧化硫的还原性。
红酒中添加二氧化硫的原因:
红酒的某些成分在储存的过程中会被氧气氧化,而使红酒的口感变差。所以我们应该在红酒中加入一些什么剂呢?
还原剂
二氧化硫就是这种加入的还原剂,所以我们说二氧化硫应该具有还原性
焦亚硫酸钾是用来代替二氧化硫的一种抗氧化剂
抗氧化剂就是还原剂
练习1. 某种飞船以N2H4和N2O4为动力源,发生反应:2N2H4+N2O4===3N2+4H2O,反应温度可高达2 700 ℃,对于该反应,下列说法中正确的是( )
A.该反应属于置换反应
B.N2H4是氧化剂
C.N2O4是还原剂
D.N2既是氧化产物又是还原产物
√
练习2. 氢化钙可作为生氢剂,反应的化学方程式为CaH2+2H2O===Ca(OH)2+2H2↑。下列说法错误的是( )
A.氢化钙既是氧化剂又是还原剂
B.氢气既是氧化产物又是还原产物
C.氢化钙是还原剂,水是氧化剂
D.氧化产物与还原产物的质量比为1∶1
√
1.根据氧化还原反应原理来判断
(1)氧化性强弱:氧化剂>氧化产物。
(2)还原性强弱:还原剂>还原产物。
氧化性、还原性强弱的判断
2.根据元素的活动性顺序来判断
(1)金属单质越活泼,其还原性越强;非金属单质越活泼,其氧化性越强。
(2)“单强离弱”——金属单质还原性越强,其阳离子的氧化性越弱;
非金属单质的氧化性越强,其阴离子的还原性越弱。
如:Fe+CuSO4===FeSO4+Cu
氧化性、还原性强弱的判断
3. 根据反应条件的难易来判断
反应的条件越简单,反应就越容易发生,说明物质氧化性(或还原性)越强。
2KMnO4 + 16HCl(浓) === 2KCl + 2MnCl2 + 8H2O + 5Cl2↑
MnO2 + 4HCl(浓) MnCl2 + 2H2O + Cl2↑
O2 + 4HCl(浓) 2Cl2+2H2O
氧化性:_____________________________
△
△
KMnO4>MnO2>O2
氧化性、还原性强弱的判断
4. 根据元素被氧化/还原的程度来判断
某还原剂被不同氧化剂氧化时,元素化合价升得越高,说明氧化剂的氧化性越强。
2Fe + 3Cl2 2FeCl3 Fe + S FeS 氧化性:__________
Cu + 2Fe3+ == Cu2+ + 2Fe2+ 3Zn + 2Fe3+ == 3Zn2+ + 2Fe 还原性:__________
点燃
Cl2 > S
Zn > Cu
△
氧化性、还原性强弱的判断
氧化性、还原性强弱的判断
还原剂
化合价升高
失电子
被氧化
发生氧化反应
氧化产物
氧化剂
化合价降低
得电子
被还原
发生还原反应
还原产物
还原剂 + 氧化剂 = 还原产物 + 氧化产物
反应物
生成物
升失氧 降得还
氧化还原反应基本概念间的联系
学习总结
思维课堂
THANKS
谢谢聆听
