第三章第三节 金属晶体与离子晶体 第2课时 过渡晶体与混合型晶体、晶体类型的比较(共79张ppt)
文档属性
| 名称 | 第三章第三节 金属晶体与离子晶体 第2课时 过渡晶体与混合型晶体、晶体类型的比较(共79张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-18 21:53:06 | ||
图片预览











文档简介
(共79张PPT)
过渡晶体与混合型晶体 / 晶体类型的比较 / 随堂演练 知识落实 / 课时对点练
过渡晶体与混合型晶体、晶体类型的比较
第三章
第2课时
核心素养
发展目标
1.从化学键变化上认识过渡晶体,理解纯粹的典型晶体在自然界中是不多的。
2.从结构和性质上认识典型的混合型晶体——石墨。
3.了解晶体类型的比较与判断方法。
内容索引
一、过渡晶体与混合型晶体
二、晶体类型的比较
随堂演练 知识落实
课时对点练
过渡晶体与混合型晶体
一
1.过渡晶体
(1)四类典型晶体是 、 、 、 。
(2)离子晶体和共价晶体的过渡标准是化学键中离子键成分的百分数。离子键成分的百分数大,作为离子晶体处理,离子键成分的百分数小,作为共价晶体处理。
分子晶体
共价晶体
金属晶体
离子晶体
提示 离子键的百分数是依据电负性的差值计算出来的,差值越大,离子键的百分数越大。
(3)Na2O、MgO、Al2O3、SiO2、P2O5、SO3、Cl2O7七种氧化物中从左到右,离子键成分的百分数越来越 ,其中作为离子晶体处理的是
;作为共价晶体处理的是 ;作为分子晶体处理的是 。
小
Na2O、MgO
Al2O3、SiO2
P2O5、SO3、Cl2O7
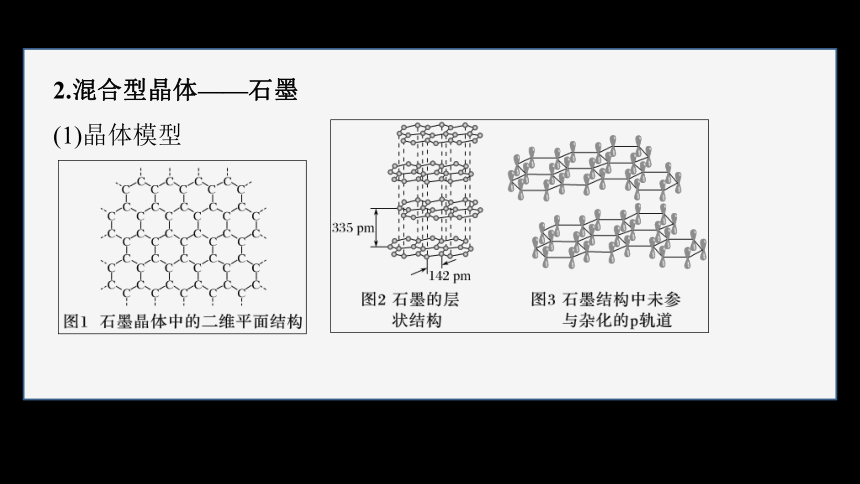
2.混合型晶体——石墨
(1)晶体模型
(2)结构特点——层状结构
①同层内,碳原子采用 杂化,以 相结合形成____________
结构。所有碳原子的p轨道相互平行且相互重叠,p轨道中的电子可在整个碳原子平面中运动。
②层与层之间以 相结合。
(3)晶体类型
石墨晶体中,既有 ,又有 ,且有类似金属晶体的导电性,属于 。
(4)物理性质:①导电性,②导热性,③润滑性。
sp2
共价键
平面六元并环
范德华力
共价键
范德华力
混合型晶体
正误判断
(1)纯粹的典型晶体是没有的( )
(2)在共价晶体中可以认为共价键贯穿整个晶体,而在分子晶体中共价键仅限于晶体微观空间的一个个分子中( )
(3)四类晶体都有过渡型( )
(4)石墨的二维结构内,每个碳原子的配位数为3( )
(5)石墨的导电只能沿石墨平面的方向进行( )
(6)石墨晶体层与层之间距离较大,所以石墨的熔点不高( )
√
×
×
√
√
√
1.石墨晶体中,层内C—C的键长为142 pm,而金刚石中C—C的键长为154 pm,回答下列问题。
(1)熔点:石墨____(填“>”“<”或“=”)金刚石。
(2)石墨中C—C的键长小于金刚石中C—C的键长的原因:_____________
___________________________________________________________________________________________________。
深度思考
>
金刚石中只存在C—C间的σ键,而石墨中层内的C—C间不仅存在σ键,还存在π键,电子层重叠程度大,所以C—C间的键长短
2.石墨晶体中,每个C原子参与___个C—C和___个六元环的形成,而每个键被___个C原子共用,故每一个六元环平均占有____个C原子,C原子数与C—C数之比为_______。
深度思考
3
3
2
2
2∶3
应用体验
1.下列晶体最能体现过渡晶体结构与性质的是
A.金刚石 B.CsCl
C.Al2O3 D.KF
金刚石是典型的共价晶体;CsCl、KF是典型的离子晶体;Al2O3晶体中离子键成分的百分数只有41%,最能体现过渡晶体的结构与性质。
√
2.石墨晶体是层状结构(如图),以下有关石墨晶体的说法正确的一组是
①石墨层与层间靠范德华力维系 ②石墨中的C为sp2杂化 ③石墨的熔点、沸点都比金刚石低 ④石墨和金刚石的硬度相同 ⑤石墨层内导电性和层间导电性不同
A.全对 B.①②③
C.①②⑤ D.②③④
√
③不正确,石墨的熔点比金刚石高;
④不正确,石墨质软,金刚石的硬度大。
3.下列有关石墨晶体的说法正确的是
A.由于石墨晶体导电,所以它是金属晶体
B.由于石墨的熔点很高,所以它是共价晶体
C.由于石墨质软,所以它是分子晶体
D.石墨晶体是一种混合型晶体
√
返回
晶体类型的比较
二
1.四种晶体的比较
晶体类型 分子晶体 离子晶体 金属晶体 共价晶体
构成微粒 分子 阴、阳离子 金属离子、自由电子 原子
微粒间作用力 范德华力(少数有氢键) 离子键 金属键 共价键
性质 熔、沸点 较低 较高 一般较高 很高
硬度 小 略硬而脆 一般较大 很大
溶解性 相似相溶 多数溶于水 不溶,有些与水反应 不溶
机械加工性能 不良 不良 良好 不良
性质 导电性 固态、液态均不导电,部分溶于水时导电 固态时不导电,熔融时导电,能溶于水的溶于水时导电 固态、熔融态时导电 大部分固态、熔融时都不导电
作用力大小 规律 组成和结构相似的分子,相对分子质量大的范德华力大 离子所带电荷数多、半径小的离子键强 金属原子的价电子数多、半径小的金属离子与自由电子间的作用力强 共价键键长短(电子云重叠多)、原子半径小的共价键稳定
2.晶体类型的判断方法
(1)依据组成晶体的微观粒子和粒子间的作用判断
分子间通过 形成的晶体属于分子晶体;由原子通过共价键形成的晶体属于共价晶体;由阴、阳离子通过离子键形成的晶体属于离子晶体;由金属阳离子和自由电子通过金属键形成的晶体属于金属晶体。
分子间作用力
(2)依据物质的分类判断
①活泼金属的 (如 、MgO等)、 [如KOH、Ba(OH)2等]和绝大多数的 是离子晶体。
②大多数非金属单质(除金刚石、石墨、晶体硼、晶体硅等外)、_____
、 (除SiO2外)、几乎所有的酸、绝大多数有机物(除有机盐外)是分子晶体。
③常见的共价晶体单质有金刚石、晶体硼、晶体硅等;常见的共价晶体化合物有碳化硅、SiO2等。
④ 单质(除汞外)与 均属于金属晶体。
Na2O
氧化物
强碱
盐类
非金
属氢化物
非金属氧化物
金属
合金
(3)依据晶体的熔点判断
离子晶体的熔点较高,常在数百至几千摄氏度;共价晶体的熔点高,常在一千至几千摄氏度;分子晶体的熔点较低,常在数百摄氏度以下或很低温度;金属晶体多数熔点高,但也有熔点相当低的。
(4)依据导电性判断
离子晶体在水溶液中和熔融状态下都导电;共价晶体一般为非导体,但晶体硅能导电;分子晶体为非导体,而分子晶体中的电解质(主要是酸)溶于水,使分子内的化学键断裂形成自由离子,也能导电;金属晶体是电的良导体。
(5)依据硬度和机械性能判断
离子晶体硬度较大或略硬而脆;共价晶体硬度大;分子晶体硬度小且较脆;金属晶体多数硬度大,但也有硬度较小的,且具有延展性。
应用体验
1.下列关于晶体的叙述正确的是
A.共价晶体中,共价键的键能越大,熔、沸点越高
B.分子晶体中,共价键的键能越大,熔、沸点越高
C.存在自由电子的晶体一定是金属晶体,存在阳离子的晶体一定是离子
晶体
D.离子晶体中可能存在共价键,分子晶体中可能存在离子键
√
共价晶体中,共价键的键能越大,熔、沸点越高,A正确;
分子晶体中,分子间作用力越大,熔、沸点越高,分子间作用力影响物质的熔、沸点,共价键影响物质的热稳定性,B错误;
存在自由电子的晶体不一定是金属晶体,如石墨中也含有自由电子,它是一种混合型晶体,存在阳离子的晶体不一定是离子晶体,如金属晶体中存在阳离子和自由电子,C错误;
离子晶体中可能存在共价键,如NaOH属于离子晶体,其中含有H—O共价键,分子晶体中一定不存在离子键,全部是共价键,D错误。
2.下列各组物质的沸点按由低到高的顺序排列的是
A.NH3、CH4、NaCl、Na
B.H2O、H2S、MgSO4、SO2
C.CH4、H2O、NaCl、SiO2
D.Li、Na、K、Rb、Cs
√
C项中SiO2是共价晶体,NaCl是离子晶体,CH4、H2O都是分子晶体,且常温下水为液态,CH4是气态。
3.四种物质的一些性质如下表:
物质 熔点/℃ 沸点/℃ 其他性质
单质硫 120.5 271.5 —
单质硼 2 300 2 550 硬度大
氯化铝 190 182.7 177.8 ℃升华
苛性钾 300 1 320 晶体不导电,熔融态导电
晶体类型:单质硫是_______晶体;单质硼是_____晶体;氯化铝是_____晶体;苛性钾是_____晶体。
分子
共价
分子
离子
单质硫为非金属单质,其熔、沸点都较低,为分子晶体;单质硼为非金属单质,其熔、沸点都很高,为共价晶体;氯化铝为化合物,其熔、沸点都较低,并能在较低温度下升华,为分子晶体;苛性钾为化合物,其熔点较高,沸点很高,晶体不导电,熔融态导电,为离子晶体。
归纳总结
比较不同晶体熔、沸点的基本思路
首先看物质的状态,一般情况下是固体>液体>气体;再看物质所属类型,一般是共价晶体>离子晶体>分子晶体(注意:不是绝对的,如氧化铝的熔点大于晶体硅),结构类型相同时再根据相应规律进行判断。同类晶体熔、沸点比较思路:共价晶体→共价键键能→键长→原子半径;分子晶体→分子间作用力→相对分子质量;离子晶体→离子键强弱→离子所带电荷数、离子半径;金属晶体→金属键强弱→金属阳离子所带电荷数、金属阳离子半径。
返回
随堂演练 知识落实
1.下列氧化物中所含离子键成分的百分数最小的是
A.N2O3 B.P2O3 C.As2O3 D.Bi2O3
1
2
3
4
√
电负性差值越大,离子键成分的百分数越大。
2.某化学兴趣小组,在学习分子晶体后,查阅了几种氯化物的熔、沸点,记录如下:
1
2
3
4
根据这些数据分析,属于分子晶体的是
A.NaCl、MgCl2、CaCl2 B.SiCl4
C.NaCl、CaCl2 D.全部
√
NaCl MgCl2 SiCl4 CaCl2
熔点/℃ 801 712 -68 782
沸点/℃ 1 413 1 412 57 1 600
1
2
3
4
由分子构成的晶体,分子间以分子间作用力相互作用,而分子间作用力较小,克服分子间作用力所需能量较低,故分子晶体的熔、沸点较低,表中的MgCl2、NaCl、CaCl2的熔、沸点很高,很明显不属于分子晶体,SiCl4的熔、沸点较低,应为分子晶体,B项正确。
3.石墨烯是从石墨材料中剥离出来,由碳原子组成的只有一层原子厚度的二维晶体。下列关于石墨与石墨烯的说法正确的是
A.从石墨中剥离石墨烯需要破坏化学键
B.石墨中的碳原子采取sp3杂化
C.石墨属于混合型晶体,层与层之间存在分
子间作用力;层内碳原子间存在共价键;
石墨有类似金属晶体的导电性
D.石墨烯中平均每个六元碳环含有3个碳原子
1
2
3
4
√
1
2
3
4
石墨晶体中,层与层之间的作用力为分子间作用力,从石墨中剥离石墨烯需要破坏分子间作用力,故A错误;
石墨中的碳原子采取sp2杂化,故B错误;
石墨属于混合型晶体,层与层之间存在分子间作用力,层内碳原子间存在共价键,石墨有类似金属晶体的导电性,故C正确;
每个C原子为3个环共有,则石墨烯中平均每个六元碳环含有的碳原子数为6× =2,故D错误。
4.下列各组物质中,按熔、沸点由低到高顺序排列正确的是___(填字母)。
A.KCl、NaCl、MgO B.金刚石、SiC、SiO2、硅
C.H2O、H2S、H2Se、H2Te D.Na、K、Rb、Al
E.CO2、Na、KCl、SiO2 F.O2、I2、Hg、MgCl2
G.钠、钾、钠钾合金 H.CH4、H2O、HF、NH3
I.CH4、C2H6、C4H10、C3H8
J.CH3CH2CH2CH2CH3、(CH3)2CHCH2CH3、C(CH3)4
1
2
3
4
AE
A中离子半径:K+>Na+>Mg2+,O2-<Cl-,离子所带电荷数:K+=Na+<Mg2+,O2->Cl-,离子所带电荷数越少,离子半径越大,熔、沸点越低,正确;
B中键长:C—C<Si—O<Si—C<Si—Si,键长越长,熔、沸点越低,错误;
C中相对分子质量逐渐增大,熔、沸点应该逐渐升高,但水分子间形成氢键,导致其熔、沸点较高,错误;
D中原子半径:Al<Na<K<Rb,半径越大,熔、沸点越低,错误;
1
2
3
4
E中常温下,CO2为气体,Na为金属晶体,KCl为离子晶体,SiO2为共价晶体,正确;
F中常温下,O2为气态,I2为固态,Hg为液态,MgCl2为离子晶体,错误;
G中合金的熔、沸点低于任何一种组分金属,错误;
H中H2O、HF、NH3分子间分别会形成氢键,它们的沸点均高于CH4的沸点,常温下H2O为液态,沸点最高,错误;
I中的几种物质互为同系物,它们都是分子晶体,其熔、沸点随着碳原子数增多(即相对分子质量增大)而逐渐升高,错误;
1
2
3
4
J中的几种物质互为同分异构体,支链越多,分子对称性越好,范德华力越弱,熔、沸点越低,错误。
1
2
3
4
返回
课时对点练
题组一 过渡晶体与混合型晶体
1.下列关于过渡晶体的说法正确的是
A.石墨属于过渡晶体
B.SiO2属于过渡晶体,但当作共价晶体来处理
C.绝大多数含有离子键的晶体都是典型的离子晶体
D.Na2O晶体中离子键的百分数为100%
1
2
3
4
5
6
7
8
9
10
11
12
13
√
1
2
3
4
5
6
7
8
9
10
11
12
13
石墨属于混合型晶体,A项错误;
SiO2属于过渡晶体,但一般按共价晶体来处理,B项正确;
大多数含有离子键的晶体不是典型的离子晶体,而是过渡晶体,C项错误;
Na2O晶体中离子键的百分数为62%,D项错误。
2.下列说法不正确的是
A.MgO中离子键的百分数为50%,则MgO不是纯粹的离子晶体,是离子
晶体与共价晶体之间的过渡晶体
B.Na2O通常当作离子晶体来处理,因为Na2O是偏向离子晶体的过渡晶
体,在许多性质上与纯粹的离子晶体接近
C.Al2O3是偏向离子晶体的过渡晶体,当作离子晶体来处理;SiO2是偏向
共价晶体的过渡晶体,当作共价晶体来处理
D.分子晶体、共价晶体、金属晶体和离子晶体都有过渡型
1
2
3
4
5
6
7
8
9
10
11
12
13
√
1
2
3
4
5
6
7
8
9
10
11
12
13
Al2O3、SiO2均是偏向共价晶体的过渡晶体,当作共价晶体来处理,C项不正确。
3.石墨炔是由1,3-二炔键与苯环形成的平面网状结构的全碳分子,具有优良的化学稳定性和半导体性能。下列关于石墨炔的说法不正确的是
1
2
3
4
5
6
7
8
9
10
11
12
13
A.石墨炔属于碳氢化合物
B.石墨炔与金刚石互为同素异形体
C.石墨炔有望代替半导体材料硅在电子产
品中得到广泛应用
D.实验测得石墨炔孔径略大于H2分子的直径,因此可以用石墨炔做H2
提纯薄膜
√
1
2
3
4
5
6
7
8
9
10
11
12
13
石墨炔是全碳分子,不属于碳氢化合物,A不正确;
石墨炔与金刚石都是由碳元素组成的单质,二者互为同素异形体,B正确;
石墨炔具有优良的化学稳定性和半导体性能,有望代替半导体材料硅,C正确;
石墨炔孔径略大于H2分子直径,可用石墨炔
去除杂质,做H2提纯薄膜,D正确。
4.石墨能与熔融金属钾作用,形成石墨间隙化合物,钾原子填充在石墨各层原子中。比较常见的石墨间隙化合物是青铜色的化合物,其化学式可写为CxK,其平面图形如图所示。x的值为
A.8 B.12
C.24 D.60
1
2
3
4
5
6
7
8
9
10
11
12
13
√
1
2
3
4
5
6
7
8
9
10
11
12
13
可选取题图中6个钾原子围成的正六边形为结构单元,每个钾原子被3个正六边形共用,则该结构单元中实际含有的钾原子数为6× +1=3,该六边形内的碳原子数为24,故钾原子数与碳原子数之比为1∶8。
题组二 晶体类型的比较
5.在解释下列物质的变化规律与物质结构间的因果关系时,与化学键的强弱无关的是
A.钠、镁、铝的熔点和沸点逐渐升高,硬度逐渐增大
B.金刚石的硬度大于晶体硅的硬度,其熔点也高于晶体硅的熔点
C.KF、KCl、KBr、KI的熔点依次降低
D.F2、Cl2、Br2、I2的熔点和沸点逐渐升高
1
2
3
4
5
6
7
8
9
10
11
12
13
√
1
2
3
4
5
6
7
8
9
10
11
12
13
钠、镁、铝的熔点和沸点逐渐升高,硬度逐渐增大,这是因为它们中的金属键逐渐增强,与化学键的强弱有关;金刚石的硬度大于晶体硅的硬度,其熔点也高于晶体硅的熔点,这是因为C—C的键长比Si—Si的键长短,C—C的键能比Si—Si的键能大,也与化学键的强弱有关;KF、KCl、KBr、KI的熔点依次降低,这是因为它们中离子键的强度逐渐减弱,与化学键的强弱有关。
6.下列数据是对应物质的熔点(℃):
1
2
3
4
5
6
7
8
9
10
11
12
13
据此做出的下列判断错误的是
A.铝的化合物的晶体中有的不是分子晶体
B.表中只有BCl3和干冰是分子晶体
C.同族元素的氧化物可形成不同类型的晶体
D.不同族元素的氧化物可形成相同类型的晶体
√
BCl3 Al2O3 Na2O NaCl AlF3 AlCl3 干冰 SiO2
-170 2 073 920 801 1 291 190 -51 1 723
1
2
3
4
5
6
7
8
9
10
11
12
13
由表中数据分析,氧化铝和氟化铝的熔点很高,两者不是分子晶体,故A正确;
表中氯化铝、氯化硼和干冰的熔点都较低,是分子晶体,故B错误;
碳和硅同主族,但氧化物的晶体类型不同,分别属于分子晶体和共价晶体,故C正确;
硅和铝不同主族,但对应的氧化物都为共价晶体,说明不同族元素的氧化物可能形成相同类型的晶体,故D正确。
BCl3 Al2O3 Na2O NaCl AlF3 AlCl3 干冰 SiO2
-170 2 073 920 801 1 291 190 -51 1 723
7.科学家艾哈迈德·泽维尔使“运用激光技术观测化学反应时原子的运动”成为可能。泽维尔研究发现,当激光脉冲照射NaI时,Na+和I-两核间距在10~15 (埃,1 =1×10-10 m),呈现离子键;当两核靠近约2.8 时,呈现共价键。根据泽维尔的研究成果能得出的结论是
A.NaI晶体是离子晶体和分子晶体的混合物
B.共价键和离子键没有明显的界限
C.NaI晶体中既有离子键,又有共价键
D.离子晶体可能含有共价键
1
2
3
4
5
6
7
8
9
10
11
12
13
√
1
2
3
4
5
6
7
8
9
10
11
12
13
NaI晶体是离子化合物,如改变离子的核间距,可能为共价化合物,但为纯净物,不是混合物,故A错误;
当激光脉冲照射NaI时,Na+和I-两核间距在10~15 ,呈现离子键;当两核靠近约2.8 时,呈现共价键,由此可知共价键和离子键没有严格的界限,但不存在既有离子键,又有共价键的情形,故B正确、C错误;
NaOH晶体中就有离子键和共价键,但不是泽维尔的研究成果,故D错误。
8.下表给出几种物质的熔、沸点:
1
2
3
4
5
6
7
8
9
10
11
12
13
NaCl MgCl2 AlCl3 SiCl4 单质B
熔点/℃ 801 712 190 -70 2 300
沸点/℃ 1 413 1 412 182.7 57.6 2 550
判断下列有关说法错误的是
①MgCl2属于离子晶体 ②SiCl4是分子晶体 ③单质B可能是共价晶体 ④AlCl3加热能升华 ⑤MgCl2水溶液不能导电 ⑥1 500 ℃时,NaCl可形成气态分子
A.仅⑤ B.④⑥ C.①④ D.②③⑤
√
1
2
3
4
5
6
7
8
9
10
11
12
13
①MgCl2由活泼的金属元素和活泼的非金属元素形成,所以是离子化合物,形成离子晶体,根据其熔点也能判断其为离子晶体,故正确;
②由表中数据可知,SiCl4的熔、沸点较低,属于分子晶体,故正确;
③单质B的熔、沸点很高,可能是共价晶体,故正确;
④由表中数据可知,AlCl3的沸点比熔点低,所以AlCl3加热能升华,故正确;
⑤MgCl2属于离子晶体,在熔融状态或水溶液中均能电离出自由移动的离子,所以在熔融状态或水溶液中均能导电,故错误;
⑥1 500 ℃时,高于NaCl的沸点,可形成气态分子,故正确。
9.磷及其化合物在电池、催化等领域有重要应用。黑磷与石墨类似,也具有层状结构(如图。为大幅度提高锂电池的充电速率,科学家最近研发了黑磷——石墨复合负极材料,其单层结构俯视图如图2所示。
1
2
3
4
5
6
7
8
9
10
11
12
13
根据图1和图2的信息,下列说法不
正确的是
A.黑磷区中P—P的键能不完全相同
B.黑磷与石墨都属于混合型晶体
C.图2黑磷区中P原子的杂化方式为sp3,石墨区中C原子的杂化方式为sp2
D.石墨与黑磷的结合区中,P原子与C原子不共平面
√
1
2
3
4
5
6
7
8
9
10
11
12
13
据图可知黑磷区中P—P的键长不完全相等,
所以键能不完全相同,故A正确;
黑磷与石墨,每一层原子之间由共价键组成六元环结构,层与层之间由范德华力互相吸引,所以为混合型晶体,故B正确;
黑磷晶体中六元环不是平面结构,P原子形成3个P—P,有1个孤电子对,价层电子对数为4,P原子采取sp3杂化;石墨中C原子的杂化方式为sp2杂化,故C正确;
石墨中C原子为sp2杂化,所以与六元环中C原子相连的原子与六元环共面,所以石墨与黑磷的结合区中,P原子与C原子共平面,故D错误。
10.C元素有多种同素异形体。而石墨烯是目前科技研究的热点,可看作将石墨的层状结构一层一层的剥开得到的单层碳原子。将氢气加入石墨烯中可得石墨烷。根据下列四图其中描述合理的是
A.四者互为同素异形体
B.石墨烯和石墨化学性
质和物理性质都相同
C.四晶体的化学键只有共价键
D.四者都是共价晶体
1
2
3
4
5
6
7
8
9
10
11
12
13
√
1
2
3
4
5
6
7
8
9
10
11
12
13
石墨烷不是单质,故A错误;
石墨烯和石墨的化学性质和物理性质不同,故B错误;
四晶体都是非金属元素形成的晶体,化学键只有共价键,故C正确;
只有金刚石是共价晶体,故D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
11.石墨烯(图甲)是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯(图乙)。
(1)图甲中,1号C与相邻C形成σ键的个数为_____。
3
1
2
3
4
5
6
7
8
9
10
11
12
13
图甲中1号C与相邻C形成3个C—C,形成σ键的个数为3。
1
2
3
4
5
6
7
8
9
10
11
12
13
(2)图乙中,1号C的杂化方式是_____,该C与相邻C形成的键角_____(填“>”“<”或“=”)图甲中1号C与相邻C形成的键角。
sp3
<
1
2
3
4
5
6
7
8
9
10
11
12
13
图乙中,1号C形成3个C—C及1个C—O,则1号C的杂化方式为sp3,为四面体结构,而石墨烯中C原子的杂化方式均为sp2,为平面结构,键角为120°,则图乙中1号C与相邻C形成的键角小于图甲中1号C与相邻C形成的键角。
1
2
3
4
5
6
7
8
9
10
11
12
13
(3)若将图乙所示的氧化石墨烯分散在H2O中,则氧化石墨烯中可与H2O形成氢键的原子有________(填元素符号)。
O、H
1
2
3
4
5
6
7
8
9
10
11
12
13
H2O中O的电负性较强,易与氧化石墨烯中O—H上的H形成氢键,氧化石墨烯中的O易与H2O中的H形成氢键。
12.Ⅰ.现有5种固态物质:四氯化硅、硼、石墨、锑、氖。将符合信息的物质名称和所属晶体类型填在表格中。
1
2
3
4
5
6
7
8
9
10
11
12
13
编号 信息 物质名称 晶体类型
(1) 熔点:120.5 ℃,沸点:271.5 ℃,易水解
(2) 熔点:630.74 ℃,沸点:1 750 ℃,导电
(3) 由分子间作用力结合而成,熔点很低,化学性质稳定
四氯化硅
分子晶体
锑
金属晶体
氖
分子晶体
1
2
3
4
5
6
7
8
9
10
11
12
13
(4) 由共价键结合成空间网状结构的晶体,熔点:2 300 ℃,沸点:2 550 ℃,硬度大
(5) 由共价键结合成层状结构的晶体,熔点高、能导电,具有滑腻感
硼
共价晶体
石墨
混合型晶体
1
2
3
4
5
6
7
8
9
10
11
12
13
共价晶体的熔、沸点大于分子晶体的熔、沸点,共价晶体的硬度大于分子晶体的硬度,金属晶体的熔、沸点及硬度差别较大;共价晶体和分子晶体在固态和熔化时不导电,金属晶体具有良好的导电性;氖化学性质很稳定;石墨是层状结构的混合型晶体,具有滑腻感。
Ⅱ.(1)碳化硅(SiC)是一种晶体,具有类似金刚石的结构,其中碳原子和硅原子的位置是交替的。下列各种晶体:①晶体硅 ②硝酸钾 ③金刚石 ④碳化硅 ⑤干冰 ⑥冰,它们的熔点由高到低的顺序是________________(填序号)。
1
2
3
4
5
6
7
8
9
10
11
12
13
③④①②⑥⑤
这些晶体中属于共价晶体的有①③④,属于离子晶体的有②,属于分子晶体的有⑤⑥。一般来说,熔点高低顺序为共价晶体>离子晶体>分子晶体。
(2)继C60后,科学家又合成了Si60、N60。请解释如下现象:熔点:Si60>N60>C60,而破坏分子所需要的能量:N60>C60>Si60,其原因是______________________________________________________________________________________________________________________________________________________________________________________________________________________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
结构相似的分子晶体的相对分子质量越大,分子间作用力(或范德华力)越强,熔化所需的能量越多,故熔点:Si60>N60>C60;而破坏分子需断开化学键,元素电负性越强其形成的化学键越稳定,断键时所需能量越多,故破坏分子需要的能量:N60>C60>Si60
分子晶体的熔点与分子间作用力大小有关,而破坏分子则是破坏分子内的共价键。
13.现有几组物质的熔点(℃)数据:
1
2
3
4
5
6
7
8
9
10
11
12
13
A组 B组 C组 D组
金刚石:3 550 Li:181 HF:-83 NaCl:801
晶体硅:1 410 Na:98 HCl:-115 KCl:776
晶体硼:2 573 K:64 HBr:-89 RbCl:718
二氧化硅:1 710 Rb:39 HI:-51 CsCl:645
据此回答下列问题:
(1)A组属于______晶体,其熔化时克服的微粒间作用力是________。
共价
共价键
1
2
3
4
5
6
7
8
9
10
11
12
13
A组物质熔点均很高,且均由非金属元素组成,故为共价晶体,熔化时需克服共价键。
(2)B组晶体共同的物理性质是___________(填序号)。
①有金属光泽 ②易导电 ③易导热 ④有延展性
1
2
3
4
5
6
7
8
9
10
11
12
13
①②③④
B组晶体均为金属单质,属于金属晶体,金属晶体的物理通性:有金属光泽,易导电、导热,有延展性。
(3)C组中HF的熔点反常是由于___________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
HF分子间形成氢键
C组物质均属于分子晶体,由于HF分子间存在氢键,故HF的熔点较高,出现反常。
(4)D组晶体可能具有的性质是______(填序号)。
①硬度小 ②水溶液能导电 ③固体能导电 ④熔融状态能导电
1
2
3
4
5
6
7
8
9
10
11
12
13
②④
D组物质均属于离子晶体,一般来说,具有硬度较大、水溶液中能导电、固态不导电、熔融状态能导电的特点。
(5)D组晶体的熔点由高到低的顺序为NaCl>KCl>RbCl>CsCl,其原因为_________________________________________________________
___________________________________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
D组晶体都为离子晶体,且r(Na+)<r(K+)<r(Rb+)<r(Cs+),在离子所带电荷数相同的情况下,离子半径越小,熔点越高
离子半径越小,离子所带电荷数越多,离子晶体的熔点越高。
返回
本课结束
第三章
过渡晶体与混合型晶体 / 晶体类型的比较 / 随堂演练 知识落实 / 课时对点练
过渡晶体与混合型晶体、晶体类型的比较
第三章
第2课时
核心素养
发展目标
1.从化学键变化上认识过渡晶体,理解纯粹的典型晶体在自然界中是不多的。
2.从结构和性质上认识典型的混合型晶体——石墨。
3.了解晶体类型的比较与判断方法。
内容索引
一、过渡晶体与混合型晶体
二、晶体类型的比较
随堂演练 知识落实
课时对点练
过渡晶体与混合型晶体
一
1.过渡晶体
(1)四类典型晶体是 、 、 、 。
(2)离子晶体和共价晶体的过渡标准是化学键中离子键成分的百分数。离子键成分的百分数大,作为离子晶体处理,离子键成分的百分数小,作为共价晶体处理。
分子晶体
共价晶体
金属晶体
离子晶体
提示 离子键的百分数是依据电负性的差值计算出来的,差值越大,离子键的百分数越大。
(3)Na2O、MgO、Al2O3、SiO2、P2O5、SO3、Cl2O7七种氧化物中从左到右,离子键成分的百分数越来越 ,其中作为离子晶体处理的是
;作为共价晶体处理的是 ;作为分子晶体处理的是 。
小
Na2O、MgO
Al2O3、SiO2
P2O5、SO3、Cl2O7
2.混合型晶体——石墨
(1)晶体模型
(2)结构特点——层状结构
①同层内,碳原子采用 杂化,以 相结合形成____________
结构。所有碳原子的p轨道相互平行且相互重叠,p轨道中的电子可在整个碳原子平面中运动。
②层与层之间以 相结合。
(3)晶体类型
石墨晶体中,既有 ,又有 ,且有类似金属晶体的导电性,属于 。
(4)物理性质:①导电性,②导热性,③润滑性。
sp2
共价键
平面六元并环
范德华力
共价键
范德华力
混合型晶体
正误判断
(1)纯粹的典型晶体是没有的( )
(2)在共价晶体中可以认为共价键贯穿整个晶体,而在分子晶体中共价键仅限于晶体微观空间的一个个分子中( )
(3)四类晶体都有过渡型( )
(4)石墨的二维结构内,每个碳原子的配位数为3( )
(5)石墨的导电只能沿石墨平面的方向进行( )
(6)石墨晶体层与层之间距离较大,所以石墨的熔点不高( )
√
×
×
√
√
√
1.石墨晶体中,层内C—C的键长为142 pm,而金刚石中C—C的键长为154 pm,回答下列问题。
(1)熔点:石墨____(填“>”“<”或“=”)金刚石。
(2)石墨中C—C的键长小于金刚石中C—C的键长的原因:_____________
___________________________________________________________________________________________________。
深度思考
>
金刚石中只存在C—C间的σ键,而石墨中层内的C—C间不仅存在σ键,还存在π键,电子层重叠程度大,所以C—C间的键长短
2.石墨晶体中,每个C原子参与___个C—C和___个六元环的形成,而每个键被___个C原子共用,故每一个六元环平均占有____个C原子,C原子数与C—C数之比为_______。
深度思考
3
3
2
2
2∶3
应用体验
1.下列晶体最能体现过渡晶体结构与性质的是
A.金刚石 B.CsCl
C.Al2O3 D.KF
金刚石是典型的共价晶体;CsCl、KF是典型的离子晶体;Al2O3晶体中离子键成分的百分数只有41%,最能体现过渡晶体的结构与性质。
√
2.石墨晶体是层状结构(如图),以下有关石墨晶体的说法正确的一组是
①石墨层与层间靠范德华力维系 ②石墨中的C为sp2杂化 ③石墨的熔点、沸点都比金刚石低 ④石墨和金刚石的硬度相同 ⑤石墨层内导电性和层间导电性不同
A.全对 B.①②③
C.①②⑤ D.②③④
√
③不正确,石墨的熔点比金刚石高;
④不正确,石墨质软,金刚石的硬度大。
3.下列有关石墨晶体的说法正确的是
A.由于石墨晶体导电,所以它是金属晶体
B.由于石墨的熔点很高,所以它是共价晶体
C.由于石墨质软,所以它是分子晶体
D.石墨晶体是一种混合型晶体
√
返回
晶体类型的比较
二
1.四种晶体的比较
晶体类型 分子晶体 离子晶体 金属晶体 共价晶体
构成微粒 分子 阴、阳离子 金属离子、自由电子 原子
微粒间作用力 范德华力(少数有氢键) 离子键 金属键 共价键
性质 熔、沸点 较低 较高 一般较高 很高
硬度 小 略硬而脆 一般较大 很大
溶解性 相似相溶 多数溶于水 不溶,有些与水反应 不溶
机械加工性能 不良 不良 良好 不良
性质 导电性 固态、液态均不导电,部分溶于水时导电 固态时不导电,熔融时导电,能溶于水的溶于水时导电 固态、熔融态时导电 大部分固态、熔融时都不导电
作用力大小 规律 组成和结构相似的分子,相对分子质量大的范德华力大 离子所带电荷数多、半径小的离子键强 金属原子的价电子数多、半径小的金属离子与自由电子间的作用力强 共价键键长短(电子云重叠多)、原子半径小的共价键稳定
2.晶体类型的判断方法
(1)依据组成晶体的微观粒子和粒子间的作用判断
分子间通过 形成的晶体属于分子晶体;由原子通过共价键形成的晶体属于共价晶体;由阴、阳离子通过离子键形成的晶体属于离子晶体;由金属阳离子和自由电子通过金属键形成的晶体属于金属晶体。
分子间作用力
(2)依据物质的分类判断
①活泼金属的 (如 、MgO等)、 [如KOH、Ba(OH)2等]和绝大多数的 是离子晶体。
②大多数非金属单质(除金刚石、石墨、晶体硼、晶体硅等外)、_____
、 (除SiO2外)、几乎所有的酸、绝大多数有机物(除有机盐外)是分子晶体。
③常见的共价晶体单质有金刚石、晶体硼、晶体硅等;常见的共价晶体化合物有碳化硅、SiO2等。
④ 单质(除汞外)与 均属于金属晶体。
Na2O
氧化物
强碱
盐类
非金
属氢化物
非金属氧化物
金属
合金
(3)依据晶体的熔点判断
离子晶体的熔点较高,常在数百至几千摄氏度;共价晶体的熔点高,常在一千至几千摄氏度;分子晶体的熔点较低,常在数百摄氏度以下或很低温度;金属晶体多数熔点高,但也有熔点相当低的。
(4)依据导电性判断
离子晶体在水溶液中和熔融状态下都导电;共价晶体一般为非导体,但晶体硅能导电;分子晶体为非导体,而分子晶体中的电解质(主要是酸)溶于水,使分子内的化学键断裂形成自由离子,也能导电;金属晶体是电的良导体。
(5)依据硬度和机械性能判断
离子晶体硬度较大或略硬而脆;共价晶体硬度大;分子晶体硬度小且较脆;金属晶体多数硬度大,但也有硬度较小的,且具有延展性。
应用体验
1.下列关于晶体的叙述正确的是
A.共价晶体中,共价键的键能越大,熔、沸点越高
B.分子晶体中,共价键的键能越大,熔、沸点越高
C.存在自由电子的晶体一定是金属晶体,存在阳离子的晶体一定是离子
晶体
D.离子晶体中可能存在共价键,分子晶体中可能存在离子键
√
共价晶体中,共价键的键能越大,熔、沸点越高,A正确;
分子晶体中,分子间作用力越大,熔、沸点越高,分子间作用力影响物质的熔、沸点,共价键影响物质的热稳定性,B错误;
存在自由电子的晶体不一定是金属晶体,如石墨中也含有自由电子,它是一种混合型晶体,存在阳离子的晶体不一定是离子晶体,如金属晶体中存在阳离子和自由电子,C错误;
离子晶体中可能存在共价键,如NaOH属于离子晶体,其中含有H—O共价键,分子晶体中一定不存在离子键,全部是共价键,D错误。
2.下列各组物质的沸点按由低到高的顺序排列的是
A.NH3、CH4、NaCl、Na
B.H2O、H2S、MgSO4、SO2
C.CH4、H2O、NaCl、SiO2
D.Li、Na、K、Rb、Cs
√
C项中SiO2是共价晶体,NaCl是离子晶体,CH4、H2O都是分子晶体,且常温下水为液态,CH4是气态。
3.四种物质的一些性质如下表:
物质 熔点/℃ 沸点/℃ 其他性质
单质硫 120.5 271.5 —
单质硼 2 300 2 550 硬度大
氯化铝 190 182.7 177.8 ℃升华
苛性钾 300 1 320 晶体不导电,熔融态导电
晶体类型:单质硫是_______晶体;单质硼是_____晶体;氯化铝是_____晶体;苛性钾是_____晶体。
分子
共价
分子
离子
单质硫为非金属单质,其熔、沸点都较低,为分子晶体;单质硼为非金属单质,其熔、沸点都很高,为共价晶体;氯化铝为化合物,其熔、沸点都较低,并能在较低温度下升华,为分子晶体;苛性钾为化合物,其熔点较高,沸点很高,晶体不导电,熔融态导电,为离子晶体。
归纳总结
比较不同晶体熔、沸点的基本思路
首先看物质的状态,一般情况下是固体>液体>气体;再看物质所属类型,一般是共价晶体>离子晶体>分子晶体(注意:不是绝对的,如氧化铝的熔点大于晶体硅),结构类型相同时再根据相应规律进行判断。同类晶体熔、沸点比较思路:共价晶体→共价键键能→键长→原子半径;分子晶体→分子间作用力→相对分子质量;离子晶体→离子键强弱→离子所带电荷数、离子半径;金属晶体→金属键强弱→金属阳离子所带电荷数、金属阳离子半径。
返回
随堂演练 知识落实
1.下列氧化物中所含离子键成分的百分数最小的是
A.N2O3 B.P2O3 C.As2O3 D.Bi2O3
1
2
3
4
√
电负性差值越大,离子键成分的百分数越大。
2.某化学兴趣小组,在学习分子晶体后,查阅了几种氯化物的熔、沸点,记录如下:
1
2
3
4
根据这些数据分析,属于分子晶体的是
A.NaCl、MgCl2、CaCl2 B.SiCl4
C.NaCl、CaCl2 D.全部
√
NaCl MgCl2 SiCl4 CaCl2
熔点/℃ 801 712 -68 782
沸点/℃ 1 413 1 412 57 1 600
1
2
3
4
由分子构成的晶体,分子间以分子间作用力相互作用,而分子间作用力较小,克服分子间作用力所需能量较低,故分子晶体的熔、沸点较低,表中的MgCl2、NaCl、CaCl2的熔、沸点很高,很明显不属于分子晶体,SiCl4的熔、沸点较低,应为分子晶体,B项正确。
3.石墨烯是从石墨材料中剥离出来,由碳原子组成的只有一层原子厚度的二维晶体。下列关于石墨与石墨烯的说法正确的是
A.从石墨中剥离石墨烯需要破坏化学键
B.石墨中的碳原子采取sp3杂化
C.石墨属于混合型晶体,层与层之间存在分
子间作用力;层内碳原子间存在共价键;
石墨有类似金属晶体的导电性
D.石墨烯中平均每个六元碳环含有3个碳原子
1
2
3
4
√
1
2
3
4
石墨晶体中,层与层之间的作用力为分子间作用力,从石墨中剥离石墨烯需要破坏分子间作用力,故A错误;
石墨中的碳原子采取sp2杂化,故B错误;
石墨属于混合型晶体,层与层之间存在分子间作用力,层内碳原子间存在共价键,石墨有类似金属晶体的导电性,故C正确;
每个C原子为3个环共有,则石墨烯中平均每个六元碳环含有的碳原子数为6× =2,故D错误。
4.下列各组物质中,按熔、沸点由低到高顺序排列正确的是___(填字母)。
A.KCl、NaCl、MgO B.金刚石、SiC、SiO2、硅
C.H2O、H2S、H2Se、H2Te D.Na、K、Rb、Al
E.CO2、Na、KCl、SiO2 F.O2、I2、Hg、MgCl2
G.钠、钾、钠钾合金 H.CH4、H2O、HF、NH3
I.CH4、C2H6、C4H10、C3H8
J.CH3CH2CH2CH2CH3、(CH3)2CHCH2CH3、C(CH3)4
1
2
3
4
AE
A中离子半径:K+>Na+>Mg2+,O2-<Cl-,离子所带电荷数:K+=Na+<Mg2+,O2->Cl-,离子所带电荷数越少,离子半径越大,熔、沸点越低,正确;
B中键长:C—C<Si—O<Si—C<Si—Si,键长越长,熔、沸点越低,错误;
C中相对分子质量逐渐增大,熔、沸点应该逐渐升高,但水分子间形成氢键,导致其熔、沸点较高,错误;
D中原子半径:Al<Na<K<Rb,半径越大,熔、沸点越低,错误;
1
2
3
4
E中常温下,CO2为气体,Na为金属晶体,KCl为离子晶体,SiO2为共价晶体,正确;
F中常温下,O2为气态,I2为固态,Hg为液态,MgCl2为离子晶体,错误;
G中合金的熔、沸点低于任何一种组分金属,错误;
H中H2O、HF、NH3分子间分别会形成氢键,它们的沸点均高于CH4的沸点,常温下H2O为液态,沸点最高,错误;
I中的几种物质互为同系物,它们都是分子晶体,其熔、沸点随着碳原子数增多(即相对分子质量增大)而逐渐升高,错误;
1
2
3
4
J中的几种物质互为同分异构体,支链越多,分子对称性越好,范德华力越弱,熔、沸点越低,错误。
1
2
3
4
返回
课时对点练
题组一 过渡晶体与混合型晶体
1.下列关于过渡晶体的说法正确的是
A.石墨属于过渡晶体
B.SiO2属于过渡晶体,但当作共价晶体来处理
C.绝大多数含有离子键的晶体都是典型的离子晶体
D.Na2O晶体中离子键的百分数为100%
1
2
3
4
5
6
7
8
9
10
11
12
13
√
1
2
3
4
5
6
7
8
9
10
11
12
13
石墨属于混合型晶体,A项错误;
SiO2属于过渡晶体,但一般按共价晶体来处理,B项正确;
大多数含有离子键的晶体不是典型的离子晶体,而是过渡晶体,C项错误;
Na2O晶体中离子键的百分数为62%,D项错误。
2.下列说法不正确的是
A.MgO中离子键的百分数为50%,则MgO不是纯粹的离子晶体,是离子
晶体与共价晶体之间的过渡晶体
B.Na2O通常当作离子晶体来处理,因为Na2O是偏向离子晶体的过渡晶
体,在许多性质上与纯粹的离子晶体接近
C.Al2O3是偏向离子晶体的过渡晶体,当作离子晶体来处理;SiO2是偏向
共价晶体的过渡晶体,当作共价晶体来处理
D.分子晶体、共价晶体、金属晶体和离子晶体都有过渡型
1
2
3
4
5
6
7
8
9
10
11
12
13
√
1
2
3
4
5
6
7
8
9
10
11
12
13
Al2O3、SiO2均是偏向共价晶体的过渡晶体,当作共价晶体来处理,C项不正确。
3.石墨炔是由1,3-二炔键与苯环形成的平面网状结构的全碳分子,具有优良的化学稳定性和半导体性能。下列关于石墨炔的说法不正确的是
1
2
3
4
5
6
7
8
9
10
11
12
13
A.石墨炔属于碳氢化合物
B.石墨炔与金刚石互为同素异形体
C.石墨炔有望代替半导体材料硅在电子产
品中得到广泛应用
D.实验测得石墨炔孔径略大于H2分子的直径,因此可以用石墨炔做H2
提纯薄膜
√
1
2
3
4
5
6
7
8
9
10
11
12
13
石墨炔是全碳分子,不属于碳氢化合物,A不正确;
石墨炔与金刚石都是由碳元素组成的单质,二者互为同素异形体,B正确;
石墨炔具有优良的化学稳定性和半导体性能,有望代替半导体材料硅,C正确;
石墨炔孔径略大于H2分子直径,可用石墨炔
去除杂质,做H2提纯薄膜,D正确。
4.石墨能与熔融金属钾作用,形成石墨间隙化合物,钾原子填充在石墨各层原子中。比较常见的石墨间隙化合物是青铜色的化合物,其化学式可写为CxK,其平面图形如图所示。x的值为
A.8 B.12
C.24 D.60
1
2
3
4
5
6
7
8
9
10
11
12
13
√
1
2
3
4
5
6
7
8
9
10
11
12
13
可选取题图中6个钾原子围成的正六边形为结构单元,每个钾原子被3个正六边形共用,则该结构单元中实际含有的钾原子数为6× +1=3,该六边形内的碳原子数为24,故钾原子数与碳原子数之比为1∶8。
题组二 晶体类型的比较
5.在解释下列物质的变化规律与物质结构间的因果关系时,与化学键的强弱无关的是
A.钠、镁、铝的熔点和沸点逐渐升高,硬度逐渐增大
B.金刚石的硬度大于晶体硅的硬度,其熔点也高于晶体硅的熔点
C.KF、KCl、KBr、KI的熔点依次降低
D.F2、Cl2、Br2、I2的熔点和沸点逐渐升高
1
2
3
4
5
6
7
8
9
10
11
12
13
√
1
2
3
4
5
6
7
8
9
10
11
12
13
钠、镁、铝的熔点和沸点逐渐升高,硬度逐渐增大,这是因为它们中的金属键逐渐增强,与化学键的强弱有关;金刚石的硬度大于晶体硅的硬度,其熔点也高于晶体硅的熔点,这是因为C—C的键长比Si—Si的键长短,C—C的键能比Si—Si的键能大,也与化学键的强弱有关;KF、KCl、KBr、KI的熔点依次降低,这是因为它们中离子键的强度逐渐减弱,与化学键的强弱有关。
6.下列数据是对应物质的熔点(℃):
1
2
3
4
5
6
7
8
9
10
11
12
13
据此做出的下列判断错误的是
A.铝的化合物的晶体中有的不是分子晶体
B.表中只有BCl3和干冰是分子晶体
C.同族元素的氧化物可形成不同类型的晶体
D.不同族元素的氧化物可形成相同类型的晶体
√
BCl3 Al2O3 Na2O NaCl AlF3 AlCl3 干冰 SiO2
-170 2 073 920 801 1 291 190 -51 1 723
1
2
3
4
5
6
7
8
9
10
11
12
13
由表中数据分析,氧化铝和氟化铝的熔点很高,两者不是分子晶体,故A正确;
表中氯化铝、氯化硼和干冰的熔点都较低,是分子晶体,故B错误;
碳和硅同主族,但氧化物的晶体类型不同,分别属于分子晶体和共价晶体,故C正确;
硅和铝不同主族,但对应的氧化物都为共价晶体,说明不同族元素的氧化物可能形成相同类型的晶体,故D正确。
BCl3 Al2O3 Na2O NaCl AlF3 AlCl3 干冰 SiO2
-170 2 073 920 801 1 291 190 -51 1 723
7.科学家艾哈迈德·泽维尔使“运用激光技术观测化学反应时原子的运动”成为可能。泽维尔研究发现,当激光脉冲照射NaI时,Na+和I-两核间距在10~15 (埃,1 =1×10-10 m),呈现离子键;当两核靠近约2.8 时,呈现共价键。根据泽维尔的研究成果能得出的结论是
A.NaI晶体是离子晶体和分子晶体的混合物
B.共价键和离子键没有明显的界限
C.NaI晶体中既有离子键,又有共价键
D.离子晶体可能含有共价键
1
2
3
4
5
6
7
8
9
10
11
12
13
√
1
2
3
4
5
6
7
8
9
10
11
12
13
NaI晶体是离子化合物,如改变离子的核间距,可能为共价化合物,但为纯净物,不是混合物,故A错误;
当激光脉冲照射NaI时,Na+和I-两核间距在10~15 ,呈现离子键;当两核靠近约2.8 时,呈现共价键,由此可知共价键和离子键没有严格的界限,但不存在既有离子键,又有共价键的情形,故B正确、C错误;
NaOH晶体中就有离子键和共价键,但不是泽维尔的研究成果,故D错误。
8.下表给出几种物质的熔、沸点:
1
2
3
4
5
6
7
8
9
10
11
12
13
NaCl MgCl2 AlCl3 SiCl4 单质B
熔点/℃ 801 712 190 -70 2 300
沸点/℃ 1 413 1 412 182.7 57.6 2 550
判断下列有关说法错误的是
①MgCl2属于离子晶体 ②SiCl4是分子晶体 ③单质B可能是共价晶体 ④AlCl3加热能升华 ⑤MgCl2水溶液不能导电 ⑥1 500 ℃时,NaCl可形成气态分子
A.仅⑤ B.④⑥ C.①④ D.②③⑤
√
1
2
3
4
5
6
7
8
9
10
11
12
13
①MgCl2由活泼的金属元素和活泼的非金属元素形成,所以是离子化合物,形成离子晶体,根据其熔点也能判断其为离子晶体,故正确;
②由表中数据可知,SiCl4的熔、沸点较低,属于分子晶体,故正确;
③单质B的熔、沸点很高,可能是共价晶体,故正确;
④由表中数据可知,AlCl3的沸点比熔点低,所以AlCl3加热能升华,故正确;
⑤MgCl2属于离子晶体,在熔融状态或水溶液中均能电离出自由移动的离子,所以在熔融状态或水溶液中均能导电,故错误;
⑥1 500 ℃时,高于NaCl的沸点,可形成气态分子,故正确。
9.磷及其化合物在电池、催化等领域有重要应用。黑磷与石墨类似,也具有层状结构(如图。为大幅度提高锂电池的充电速率,科学家最近研发了黑磷——石墨复合负极材料,其单层结构俯视图如图2所示。
1
2
3
4
5
6
7
8
9
10
11
12
13
根据图1和图2的信息,下列说法不
正确的是
A.黑磷区中P—P的键能不完全相同
B.黑磷与石墨都属于混合型晶体
C.图2黑磷区中P原子的杂化方式为sp3,石墨区中C原子的杂化方式为sp2
D.石墨与黑磷的结合区中,P原子与C原子不共平面
√
1
2
3
4
5
6
7
8
9
10
11
12
13
据图可知黑磷区中P—P的键长不完全相等,
所以键能不完全相同,故A正确;
黑磷与石墨,每一层原子之间由共价键组成六元环结构,层与层之间由范德华力互相吸引,所以为混合型晶体,故B正确;
黑磷晶体中六元环不是平面结构,P原子形成3个P—P,有1个孤电子对,价层电子对数为4,P原子采取sp3杂化;石墨中C原子的杂化方式为sp2杂化,故C正确;
石墨中C原子为sp2杂化,所以与六元环中C原子相连的原子与六元环共面,所以石墨与黑磷的结合区中,P原子与C原子共平面,故D错误。
10.C元素有多种同素异形体。而石墨烯是目前科技研究的热点,可看作将石墨的层状结构一层一层的剥开得到的单层碳原子。将氢气加入石墨烯中可得石墨烷。根据下列四图其中描述合理的是
A.四者互为同素异形体
B.石墨烯和石墨化学性
质和物理性质都相同
C.四晶体的化学键只有共价键
D.四者都是共价晶体
1
2
3
4
5
6
7
8
9
10
11
12
13
√
1
2
3
4
5
6
7
8
9
10
11
12
13
石墨烷不是单质,故A错误;
石墨烯和石墨的化学性质和物理性质不同,故B错误;
四晶体都是非金属元素形成的晶体,化学键只有共价键,故C正确;
只有金刚石是共价晶体,故D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
11.石墨烯(图甲)是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯(图乙)。
(1)图甲中,1号C与相邻C形成σ键的个数为_____。
3
1
2
3
4
5
6
7
8
9
10
11
12
13
图甲中1号C与相邻C形成3个C—C,形成σ键的个数为3。
1
2
3
4
5
6
7
8
9
10
11
12
13
(2)图乙中,1号C的杂化方式是_____,该C与相邻C形成的键角_____(填“>”“<”或“=”)图甲中1号C与相邻C形成的键角。
sp3
<
1
2
3
4
5
6
7
8
9
10
11
12
13
图乙中,1号C形成3个C—C及1个C—O,则1号C的杂化方式为sp3,为四面体结构,而石墨烯中C原子的杂化方式均为sp2,为平面结构,键角为120°,则图乙中1号C与相邻C形成的键角小于图甲中1号C与相邻C形成的键角。
1
2
3
4
5
6
7
8
9
10
11
12
13
(3)若将图乙所示的氧化石墨烯分散在H2O中,则氧化石墨烯中可与H2O形成氢键的原子有________(填元素符号)。
O、H
1
2
3
4
5
6
7
8
9
10
11
12
13
H2O中O的电负性较强,易与氧化石墨烯中O—H上的H形成氢键,氧化石墨烯中的O易与H2O中的H形成氢键。
12.Ⅰ.现有5种固态物质:四氯化硅、硼、石墨、锑、氖。将符合信息的物质名称和所属晶体类型填在表格中。
1
2
3
4
5
6
7
8
9
10
11
12
13
编号 信息 物质名称 晶体类型
(1) 熔点:120.5 ℃,沸点:271.5 ℃,易水解
(2) 熔点:630.74 ℃,沸点:1 750 ℃,导电
(3) 由分子间作用力结合而成,熔点很低,化学性质稳定
四氯化硅
分子晶体
锑
金属晶体
氖
分子晶体
1
2
3
4
5
6
7
8
9
10
11
12
13
(4) 由共价键结合成空间网状结构的晶体,熔点:2 300 ℃,沸点:2 550 ℃,硬度大
(5) 由共价键结合成层状结构的晶体,熔点高、能导电,具有滑腻感
硼
共价晶体
石墨
混合型晶体
1
2
3
4
5
6
7
8
9
10
11
12
13
共价晶体的熔、沸点大于分子晶体的熔、沸点,共价晶体的硬度大于分子晶体的硬度,金属晶体的熔、沸点及硬度差别较大;共价晶体和分子晶体在固态和熔化时不导电,金属晶体具有良好的导电性;氖化学性质很稳定;石墨是层状结构的混合型晶体,具有滑腻感。
Ⅱ.(1)碳化硅(SiC)是一种晶体,具有类似金刚石的结构,其中碳原子和硅原子的位置是交替的。下列各种晶体:①晶体硅 ②硝酸钾 ③金刚石 ④碳化硅 ⑤干冰 ⑥冰,它们的熔点由高到低的顺序是________________(填序号)。
1
2
3
4
5
6
7
8
9
10
11
12
13
③④①②⑥⑤
这些晶体中属于共价晶体的有①③④,属于离子晶体的有②,属于分子晶体的有⑤⑥。一般来说,熔点高低顺序为共价晶体>离子晶体>分子晶体。
(2)继C60后,科学家又合成了Si60、N60。请解释如下现象:熔点:Si60>N60>C60,而破坏分子所需要的能量:N60>C60>Si60,其原因是______________________________________________________________________________________________________________________________________________________________________________________________________________________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
结构相似的分子晶体的相对分子质量越大,分子间作用力(或范德华力)越强,熔化所需的能量越多,故熔点:Si60>N60>C60;而破坏分子需断开化学键,元素电负性越强其形成的化学键越稳定,断键时所需能量越多,故破坏分子需要的能量:N60>C60>Si60
分子晶体的熔点与分子间作用力大小有关,而破坏分子则是破坏分子内的共价键。
13.现有几组物质的熔点(℃)数据:
1
2
3
4
5
6
7
8
9
10
11
12
13
A组 B组 C组 D组
金刚石:3 550 Li:181 HF:-83 NaCl:801
晶体硅:1 410 Na:98 HCl:-115 KCl:776
晶体硼:2 573 K:64 HBr:-89 RbCl:718
二氧化硅:1 710 Rb:39 HI:-51 CsCl:645
据此回答下列问题:
(1)A组属于______晶体,其熔化时克服的微粒间作用力是________。
共价
共价键
1
2
3
4
5
6
7
8
9
10
11
12
13
A组物质熔点均很高,且均由非金属元素组成,故为共价晶体,熔化时需克服共价键。
(2)B组晶体共同的物理性质是___________(填序号)。
①有金属光泽 ②易导电 ③易导热 ④有延展性
1
2
3
4
5
6
7
8
9
10
11
12
13
①②③④
B组晶体均为金属单质,属于金属晶体,金属晶体的物理通性:有金属光泽,易导电、导热,有延展性。
(3)C组中HF的熔点反常是由于___________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
HF分子间形成氢键
C组物质均属于分子晶体,由于HF分子间存在氢键,故HF的熔点较高,出现反常。
(4)D组晶体可能具有的性质是______(填序号)。
①硬度小 ②水溶液能导电 ③固体能导电 ④熔融状态能导电
1
2
3
4
5
6
7
8
9
10
11
12
13
②④
D组物质均属于离子晶体,一般来说,具有硬度较大、水溶液中能导电、固态不导电、熔融状态能导电的特点。
(5)D组晶体的熔点由高到低的顺序为NaCl>KCl>RbCl>CsCl,其原因为_________________________________________________________
___________________________________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
D组晶体都为离子晶体,且r(Na+)<r(K+)<r(Rb+)<r(Cs+),在离子所带电荷数相同的情况下,离子半径越小,熔点越高
离子半径越小,离子所带电荷数越多,离子晶体的熔点越高。
返回
本课结束
第三章
