第三章第三节 金属晶体与离子晶体 第3课时 常见晶体结构的比较与分析 晶体结构的计算(共89张ppt)
文档属性
| 名称 | 第三章第三节 金属晶体与离子晶体 第3课时 常见晶体结构的比较与分析 晶体结构的计算(共89张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-18 00:00:00 | ||
图片预览










文档简介
(共89张PPT)
常见晶体结构的比较与分析 / 晶体结构的计算 / 随堂演练 知识落实 / 课时对点练
常见晶体结构的比较与分析
晶体结构的计算
第三章
第3课时
核心素养
发展目标
1.熟知共价、分子、离子晶体的典型代表的结构。
2.学会晶体结构的相关分析。
内容索引
一、常见晶体结构的比较与分析
二、晶体结构的计算
随堂演练 知识落实
课时对点练
常见晶体结构的比较与分析
一
1.常见共价晶体结构的分析
晶体 晶胞结构 结构分析
金 刚 石 (1)每个C与相邻 个C以共价键结合,形成正四面体结构。每个晶胞中含 个C原子
(2)键角均为__________
(3)最小碳环由 个C组成且6个C不在同一平面内,每个C原子被12个六元环共用
(4)每个C参与 个C—C的形成,C原子数与C—C数之比为_____
(5)ρ= _______g·cm-3键长= a(a为晶胞边长,NA为阿伏加
德罗常数的值)
4
8
109°28′
6
4
1∶2
SiO2 (1)每个Si与 个O以共价键结合,形成正四面体结构
(2)每个正四面体占有1个Si,4个“ O”,因此二氧化硅晶体中Si与O的个数比为______
(3)最小环上有 个原子,即 个O, 个Si
(4)ρ=________ g·cm-3(a为晶胞边长,NA为阿伏加德罗常数的值)
4
1∶2
6
12
6
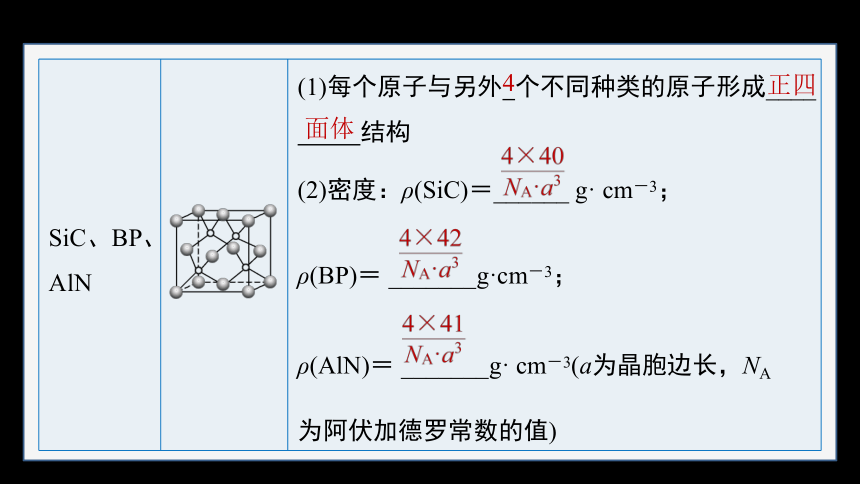
SiC、BP、AlN (1)每个原子与另外 个不同种类的原子形成____
结构
(2)密度:ρ(SiC)=______ g· cm-3;
ρ(BP)= _______g·cm-3;
ρ(AlN)= _______g· cm-3(a为晶胞边长,NA
为阿伏加德罗常数的值)
正四
面体
4
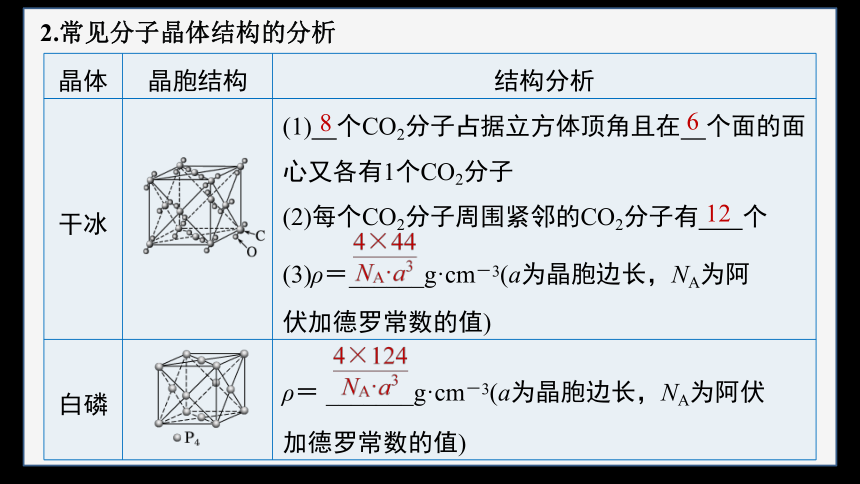
2.常见分子晶体结构的分析
晶体 晶胞结构 结构分析
干冰 (1) 个CO2分子占据立方体顶角且在 个面的面心又各有1个CO2分子
(2)每个CO2分子周围紧邻的CO2分子有 个
(3)ρ=______g·cm-3(a为晶胞边长,NA为阿
伏加德罗常数的值)
白磷 ρ= _______g·cm-3(a为晶胞边长,NA为阿伏
加德罗常数的值)
8
6
12
3.常见离子晶体结构的分析
晶体 晶胞结构 结构分析(a为晶胞边长)
NaCl (1)在晶体中,每个Na+同时吸引 个Cl-,每个Cl-同时吸引 个Na+,配位数为6。每个晶胞含 个Na+和 个Cl-
(2)在每个Cl-周围最近且等距离( a)的Cl-有 个,在每个Cl-周围最近且等距离( a)的Na+有___个
(3)ρ= g·cm-3
6
6
4
4
12
6
CsCl (1)在晶体中,每个Cl-吸引 个Cs+,每个Cs+吸引 个Cl-,配位数为 。每个晶胞含 个Cs+和 个Cl-
(2)在每个Cs+周围最近且等距离( a)的Cl-有 个,在每个Cl-周围最近且等距离(a)的Cl-有 个
(3)ρ= g·cm-3
8
8
8
1
1
8
6
ZnS (1)Zn2+、S2-的配位数均为 。每个晶胞含 个Zn2+、 个S2-
(2)与Zn2+紧邻的 个S2-构成一个正四面体
(3)Zn2+与S2-之间最短的距离为晶胞体对角线长
的
(4)ρ= g·cm-3
4
4
4
4
CaF2 (1)Ca2+的配位数为 ,F-的配位数为 ,每个晶胞含 个Ca2+、 个F-
(2)与F-紧邻的 个Ca2+构成一个正四面体
(3)F-与Ca2+之间最短的距离为晶胞体对角线长
的____
(4)ρ= g·cm-3
8
4
4
8
4
应用体验
(1)Na2S的晶胞如图所示,设S2-的半径为r1 cm,Na+半径为r2 cm。试计
算Na2S晶体的密度为______________________(阿伏加德罗常数的值用
NA表示,写出表达式,不用化简)。
(2)Na3OCl是一种良好的离子导体,其晶胞结构如图所示。已知:晶胞参数为a nm,密度为d g·cm-3。
①Na3OCl晶胞中,Cl-位于各顶点位置,Na+位于______位置,两个Na+
之间的最短距离为________ nm。
面心
②用a、d表示阿伏加德罗常数的值NA=____________(列计算式)。
返回
晶体结构的计算
二
1.均摊法计算晶胞中微粒个数
(1)计算原则
晶胞任意位置上的一个粒子如果是被n个晶胞所共有,那么,每个晶胞分得该粒子的份额是 。
(2)常考实例
正方体或长方体晶胞示意图
微粒位置 顶点 面上 棱上 内部
侧棱 上下棱 共用该微粒的晶胞数 8 2 4 4 1
每个晶胞分摊的微粒数 1
正六棱柱晶胞示意图
微粒位置 顶点 面上 棱上 内部
侧棱 上下棱 共用该微粒 的晶胞数 6 2 3 4 1
每个晶胞分 摊的微粒数 1
(3)审题时一定要注意是“分子结构”还是“晶体结构”,若是分子结构,其化学式由图中所有实际存在的原子个数决定,原子个数比不约简。
(4)计算晶胞中微粒的数目,进而求化学式
根据均摊法计算出一个晶胞中所含微粒数目,求出晶胞所含微粒个数的最简整数比,从而写出晶体的化学式。
2.原子分数坐标的确定方法
(1)依据已知原子的坐标确定坐标系取向。
(2)一般以坐标轴所在正方体的棱长为1个单位。
(3)从原子所在位置分别向x、y、z轴作垂线,所得坐标轴上的截距即为该原子的分数坐标。
如位于晶胞原点(顶点)的原子的分数坐标为(0,0,0);位于晶胞体心的原子的分数坐标为( , , );位于xOz面心的原子的分数坐标为( ,0, )等(如图所示)。
3.晶体密度的计算
(3)晶胞的体积:V=a3(立方体)=abc(长方体)
4.金属晶体中原子间距离和晶胞参数
(1)思维流程
根据密度求晶胞中原子之间的距离时,可首先由密度计算出晶胞体积(晶胞质量由晶胞含有的微粒数计算),再根据晶胞结构判断微粒间距与棱长的关系。
(2)立方晶胞参数a计算公式
5.金属晶体中原子空间利用率
(1)思维流程
空间利用率是指构成晶体的原子在整个晶体空间中所占有的体积百分比,首先分析晶胞中原子个数和原子半径,计算出晶胞中所有原子的体积,其次根据立体几何知识计算出晶胞的棱长,计算出晶胞的体积,即可顺利解答此类问题。
(2)计算公式
应用体验
CaF2的晶胞为立方晶胞,结构如下图所示:
(1)CaF2晶胞中,Ca2+的配位数为__。
8
以面心Ca2+为研究对象,在一个晶胞中连接4个F-,通过该Ca2+可形成2个晶胞,所以与该Ca2+距离相等且最近的F-共有8个,因此Ca2+的配位数是8。
(2)“原子坐标参数”可表示晶胞内部各原子的相对位置,已知A、B两
点的原子坐标参数如图所示,则C点的原子坐标参数为(____,___, )。
(3)晶胞中两个F-的最近距离为273.1 pm,用NA表示阿伏加德罗常数的值,
则晶胞的密度为___________________g·cm-3(列出计算式即可)。
返回
随堂演练 知识落实
1.AB型化合物形成的晶体结构多种多样。如图所示的几种结构所表示的物质最有可能是分子晶体的是
1
2
3
4
A.①③ B.②⑤
C.⑤⑥ D.③④⑤⑥
√
1
2
3
4
从各图中可以看出②⑤都不能再以化学键与其他原子结合,所以最有可能是分子晶体。
2.金属晶体钠的晶胞如图所示,下列关于钠晶体的判断合理的是
1
2
3
4
A.其熔点比金属铝的熔点高
B.一个钠的晶胞中,平均含有4个钠原子
C.该晶体中的自由电子在外加电场作用下可发生定向移动
D.该晶体中的钠离子在外加电场的作用下可发生定向移动
√
1
2
3
4
金属的原子半径越小,金属离子所带电荷数越多,金属键越强,金属熔化时破坏金属键,所以Al的金属键比大于Na的金属键强,所以Na的熔点比金属Al的熔点低,故A错误。
3.(2022·云南昆明一中高二期中)在下列离子晶体的空间结构示意图中,
代表阳离子,?代表阴离子。若M代表阳离子,N代表阴离子,则化学式为MN2的晶体结构是
1
2
3
4
√
1
2
3
4
1
2
3
4
4.(2022·山东高二期中)磷化硼(BP)是一种半导体材料,熔点:1 100 ℃,其结构与氮化硼相似,晶胞结构如图1,下列说法正确的是
A.熔点:BP>BN
B.晶体中P周围距离最近且相等的P有8个
C.若图中①处磷原子坐标为(0,0,0),则②
处的B原子坐标为
D.磷化硼晶胞在y轴方向的投影图为图2
1
2
3
4
√
磷化硼(BP)结构与氮化硼相似,均为共价晶体,N原子半径小,B—N键长短,键能大,故BN熔点高,A错误;
若图中①处磷原子坐标为(0,0,0),将晶胞均分为8个小立方体,则②处的B原子在前左下角小立方体体心的位置,坐标为 ,C错误;
磷化硼晶胞中顶角和面心全部为P原子,在y轴方向的投影落在顶角和棱心;4个小立方体体心位置为B原子,
在y轴方向的投影均匀落在内部,在y轴
方向的投影图为图2,D正确。
1
2
3
4
返回
课时对点练
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
题组一 常见晶体结构的比较与分析
1.如图所示是从NaCl或CsCl的晶胞结构中分割出来的部分结构图,其中属于从NaCl晶胞中分割出来的结构图是
A.图(1)和(3) B.图(2)和(3)
C.图(1)和(4) D.只有图(4)
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
NaCl晶体中,每个Na+周围最邻近的Cl-有6个,构成正八面体,同理,每个Cl-周围最邻近的6个Na+也构成正八面体,由此可知图(1)和(4)是从NaCl晶体中分割出来的结构图,C项正确。
2.C60的晶胞(C60分子分别位于立方体的顶点和面心)如图所示。下列说法正确的是
A.C60的摩尔质量是720
B.C60与苯互为同素异形体
C.在C60晶胞中有4个C60分子
D.每个C60分子周围与它距离最近的C60分子有6个
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
C60的摩尔质量为720 g·mol-1,A项错误;
由同种元素形成的不同单质互为同素异形体,苯是由
碳氢两种元素形成的化合物,B项错误;
根据晶胞的结构,以晶胞中顶点上的C60分子为研究对象,与它距离最近的C60分子分布在立方体的面心上,每个C60分子被8个立方体共用,故有12个面与之相连,所以每个C60分子周围与它距离最近且等距离的C60分子有12个,D项错误。
3.有关晶体(或晶胞)的结构如图所示,下列说法不正确的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
A.在NaCl晶体中,距Na+最近的Cl-有6个
B.在CaF2晶体中,每个晶胞平均占有4个Ca2+
C.在金刚石晶体中,碳原子数与碳碳键个数之比为1∶2
D.该气态团簇分子的分子式为EF或FE
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
在NaCl晶体中,距Na+最近的Cl-有6个,故A正确;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
气态团簇分子不同于晶胞,气态团簇分子中含有4个E原子,4个F原子,则分子式为E4F4或F4E4,故D错误。
4.硅材料在工业生产中具有重要的应用,下列说法正确的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
A.熔、沸点比较:金刚石B.SiC中Si原子的配位数为4
C.Si12与单晶硅互为同分异构体
D.1 mol SiO2中含有2 mol Si—O
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
金刚石和SiC均为共价晶体,原子半径越小,共价键键能越大,共价晶体的熔、沸点越高,原子半径:C SiC,故A错误;
碳化硅晶体中每个Si原子连接4个C原子,则SiC中Si原子的配位数为4,故B正确;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
Si12是分子晶体,单晶硅是共价晶体,是同种元素形成的不同单质,互为同素异形体,故C错误;
二氧化硅晶体中每个Si原子连接4个O原子,形成4个Si—O,则1 mol SiO2中含有4 mol Si—O,故D错误。
题组二 晶体结构的计算
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
6.(2022·山西柳林县鑫飞中学高二期中)根据如图几种晶体结构,下列说法错误的是
A.钛酸钙的化学式为CaTiO3
B.在金刚石晶体中,碳原子与碳碳键
(C—C)数目之比为1∶2
C.硒化锌晶体中与一个Se2-距离最近
且相等的Se2-有8个
D.CaF2中F-与距离最近的Ca2+所形成的键的夹角为109°28′
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
金刚石中1个C原子连接4个碳原子形成4个C—C,1个C—C被两个碳原子共有,因此C原子与C—C数目之比是1∶2,故B正确;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
硒化锌晶体中,与一个Se2-距离最近且相等的Se2-有12个,故C错误;
由氟化钙的晶胞可看出一个F与4个Ca可以形成正四面体结构,键角为109°28′,故D正确。
7.由K、I、O构成的立方晶胞如图所示。下列叙述错误的是
A.该化合物的化学式为KIO3
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
D.该晶胞的另一种表示中,I处于各顶角,则K处于体心位置
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
8.分析化学中常用X射线研究晶体结构,有一种蓝色晶体可表示为MxFey(CN)z,研究表明它的结构特性是Fe2+、Fe3+分别占据立方体的顶点,自身互不相邻,而CN-位于立方体的棱上,其晶体中的阴离子结构如图所示。下列说法正确的是
A.该晶体是共价晶体
B.M的离子位于上述立方体的面心,呈+2价
C.M的离子位于上述立方体的体心,且M+的空缺
率(体心中没有M+的占总体心的百分比)为50%
D.晶体的化学式可表示为MFe2(CN)3,且M为+1价
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
所以Fe2+、Fe3+、CN-的个数比为1∶1∶6,根据化合价代数和为零可知,M的化合价为+1价,则
每个晶胞平均含有M也是0.5个,而M的离子位于上述立方体的体心上,所以两个晶胞中一个有M+,而另一个必无M+,所以M+空缺率为50%,故B错误、C正确;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
由以上分析可知,晶体的化学式可表示为MFe2(CN)6,且M为+1价,故D错误。
9.某研究小组发现首例带结晶水的晶体在5 K下呈现超导性。据报道,该晶体中含有最简式为CoO2的层状结构,结构如图(小球表示Co,大球表示O)。下列用粗线画出的CoO2层状结构的晶胞示意图不符合化学式的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
10.CaF2的晶胞为立方晶胞,结构如图所示:
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
“原子分数坐标”可以表示晶胞内部各原子的相对位置,其中A原子分数坐标为(0,0,0),B原子分数坐标为(1,1,1),下列说法正确的是
A.CaF2晶胞中,Ca2+的配位数为4
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
以面心Ca2+为研究对象,在一个晶胞中连接4个F-,通过该Ca2+可形成2个晶胞,所以与该Ca2+距离相等且最近的F-共有8个,因此Ca2+的配位数是8,A错误;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
11.金晶体是面心立方堆积,晶胞面对角线为金原子半径的4倍,已知立方体的每个面上5个金原子紧密堆砌,金原子半径为r cm,则金晶体的空间利用率为
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
12.已知冰晶石(Na3AlF6)熔融时的电离方程式为Na3AlF6===3Na++ 。现有冰晶石的结构单元如图所示, 位于大立方体顶点和面心, 位于大立方体的12条棱的中点和8个小立方体的体心,?是图中 、 中的一种。下列说法正确的是
A.冰晶石是共价晶体
B.大立方体的体心处?代表Al3+
C.与Na+距离相等且最近的Na+有6个
D.冰晶石晶体的密度约为 g·cm-3
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
由冰晶石熔融时能发生电离,可知冰晶石是离子晶体,A项错误;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
与Na+距离相等且最近的Na+有8个,C项错误;
13.[2020·山东,17(4)]以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。四方晶系CdSnAs2的晶胞结构如图所示,晶胞棱边夹角均为90°,晶胞中部分原子的分数坐标如表所示。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
坐标 原子 x y z
Cd 0 0 0
Sn 0 0 0.5
As 0.25 0.25 0.125
一个晶胞中有__个Sn,找出距离Cd(0,0,0)最近的Sn__________________
(用分数坐标表示)。CdSnAs2晶体中与单个Sn键合的As有__个。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
坐标 原子 x y z
Cd 0 0 0
Sn 0 0 0.5
As 0.25 0.25 0.125
4
(0.5,0,0.25)、(0.5,0.5,0)
4
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
由题给原子的分数坐标和晶胞图可知,小白球表示的是Sn原子,Sn原子位于面上和棱上,因此一个晶胞中含Sn原子个数为6× +4× =4。由Sn和As的原子分数坐标可知,x、y轴上a pm长的分数坐标为1,z轴上2a pm长的分数坐标为1。小黑球
表示的是Cd原子,与Cd(0,0,0)最近的Sn有两个,其分数坐标分别为(0.5,0,0.25)和(0.5,0.5,0)。大灰球表示的是As原子,每个Sn周围与Sn等距离的As原子有4个,即与单个Sn键合的As有4个。
14.如图为CaF2、H3BO3(层状结构,层内的H3BO3分子通过氢键结合)、金属铜三种晶体(或晶胞)的结构示意图,请回答下列问题:
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
(1)图Ⅰ所示的CaF2晶体中与Ca2+最近且等距离的F-数为____,图Ⅲ中一个铜原子周围紧邻的铜原子数为____。
8
12
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
从图Ⅰ可看出面心上的一个Ca2+连接四个F-,若将旁边的晶胞画出,也应连四个F-,则一个Ca2+连8个F-。
(2)图Ⅱ所示的物质结构中最外电子层已达8电子结构的原子是_____,H3BO3晶体中B原子个数与极性键个数之比为______。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
O
1∶6
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
H原子的最外电子层是2电子,从图Ⅱ看,B原子只形成三个共价键,最外电子层应为6个电子,只有O原子的最外电子层为8电子结构。H3BO3属于分子晶体,一个B连有三个O原子,三个O原子又连有三个H原子,所以一个B原子对应6个极性键。
(3)三种晶体中熔点最低的是________,其晶体受热熔化时,克服的微粒之间的相互作用为_____________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
H3BO3
分子间作用力
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
熔点大小一般规律:共价晶体>离子晶体>分子晶体,金属晶体看具体情况,此题H3BO3为分子晶体,熔点最低,熔化时破坏分子间作用力。
15.(2021·郑州高二期中)石墨晶体的结构如图1所示,石墨的一个六方晶胞如图2所示。
请回答下列问题:
(1)每个晶胞中的碳原子个数为___。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
4
(2)画出晶胞沿c轴的投影_____________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
根据晶胞结构可知其沿c轴的投影为 。
(3)某石墨嵌入化合物中,每个六元环都对应一个Li+,写出它的化学式:______。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
LiC2
石墨中平均每个六元环含有2个碳原子,某石墨嵌入化合物中的每个六元环都对应一个Li+,故化学式为LiC2。
(4)若该晶胞底面边长为m pm,高为n pm,
则石墨晶体中碳碳键的键长为________pm,
密度为______________g·cm-3(设阿伏加德
罗常数的值为NA)。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
返回
本课结束
第三章
常见晶体结构的比较与分析 / 晶体结构的计算 / 随堂演练 知识落实 / 课时对点练
常见晶体结构的比较与分析
晶体结构的计算
第三章
第3课时
核心素养
发展目标
1.熟知共价、分子、离子晶体的典型代表的结构。
2.学会晶体结构的相关分析。
内容索引
一、常见晶体结构的比较与分析
二、晶体结构的计算
随堂演练 知识落实
课时对点练
常见晶体结构的比较与分析
一
1.常见共价晶体结构的分析
晶体 晶胞结构 结构分析
金 刚 石 (1)每个C与相邻 个C以共价键结合,形成正四面体结构。每个晶胞中含 个C原子
(2)键角均为__________
(3)最小碳环由 个C组成且6个C不在同一平面内,每个C原子被12个六元环共用
(4)每个C参与 个C—C的形成,C原子数与C—C数之比为_____
(5)ρ= _______g·cm-3键长= a(a为晶胞边长,NA为阿伏加
德罗常数的值)
4
8
109°28′
6
4
1∶2
SiO2 (1)每个Si与 个O以共价键结合,形成正四面体结构
(2)每个正四面体占有1个Si,4个“ O”,因此二氧化硅晶体中Si与O的个数比为______
(3)最小环上有 个原子,即 个O, 个Si
(4)ρ=________ g·cm-3(a为晶胞边长,NA为阿伏加德罗常数的值)
4
1∶2
6
12
6
SiC、BP、AlN (1)每个原子与另外 个不同种类的原子形成____
结构
(2)密度:ρ(SiC)=______ g· cm-3;
ρ(BP)= _______g·cm-3;
ρ(AlN)= _______g· cm-3(a为晶胞边长,NA
为阿伏加德罗常数的值)
正四
面体
4
2.常见分子晶体结构的分析
晶体 晶胞结构 结构分析
干冰 (1) 个CO2分子占据立方体顶角且在 个面的面心又各有1个CO2分子
(2)每个CO2分子周围紧邻的CO2分子有 个
(3)ρ=______g·cm-3(a为晶胞边长,NA为阿
伏加德罗常数的值)
白磷 ρ= _______g·cm-3(a为晶胞边长,NA为阿伏
加德罗常数的值)
8
6
12
3.常见离子晶体结构的分析
晶体 晶胞结构 结构分析(a为晶胞边长)
NaCl (1)在晶体中,每个Na+同时吸引 个Cl-,每个Cl-同时吸引 个Na+,配位数为6。每个晶胞含 个Na+和 个Cl-
(2)在每个Cl-周围最近且等距离( a)的Cl-有 个,在每个Cl-周围最近且等距离( a)的Na+有___个
(3)ρ= g·cm-3
6
6
4
4
12
6
CsCl (1)在晶体中,每个Cl-吸引 个Cs+,每个Cs+吸引 个Cl-,配位数为 。每个晶胞含 个Cs+和 个Cl-
(2)在每个Cs+周围最近且等距离( a)的Cl-有 个,在每个Cl-周围最近且等距离(a)的Cl-有 个
(3)ρ= g·cm-3
8
8
8
1
1
8
6
ZnS (1)Zn2+、S2-的配位数均为 。每个晶胞含 个Zn2+、 个S2-
(2)与Zn2+紧邻的 个S2-构成一个正四面体
(3)Zn2+与S2-之间最短的距离为晶胞体对角线长
的
(4)ρ= g·cm-3
4
4
4
4
CaF2 (1)Ca2+的配位数为 ,F-的配位数为 ,每个晶胞含 个Ca2+、 个F-
(2)与F-紧邻的 个Ca2+构成一个正四面体
(3)F-与Ca2+之间最短的距离为晶胞体对角线长
的____
(4)ρ= g·cm-3
8
4
4
8
4
应用体验
(1)Na2S的晶胞如图所示,设S2-的半径为r1 cm,Na+半径为r2 cm。试计
算Na2S晶体的密度为______________________(阿伏加德罗常数的值用
NA表示,写出表达式,不用化简)。
(2)Na3OCl是一种良好的离子导体,其晶胞结构如图所示。已知:晶胞参数为a nm,密度为d g·cm-3。
①Na3OCl晶胞中,Cl-位于各顶点位置,Na+位于______位置,两个Na+
之间的最短距离为________ nm。
面心
②用a、d表示阿伏加德罗常数的值NA=____________(列计算式)。
返回
晶体结构的计算
二
1.均摊法计算晶胞中微粒个数
(1)计算原则
晶胞任意位置上的一个粒子如果是被n个晶胞所共有,那么,每个晶胞分得该粒子的份额是 。
(2)常考实例
正方体或长方体晶胞示意图
微粒位置 顶点 面上 棱上 内部
侧棱 上下棱 共用该微粒的晶胞数 8 2 4 4 1
每个晶胞分摊的微粒数 1
正六棱柱晶胞示意图
微粒位置 顶点 面上 棱上 内部
侧棱 上下棱 共用该微粒 的晶胞数 6 2 3 4 1
每个晶胞分 摊的微粒数 1
(3)审题时一定要注意是“分子结构”还是“晶体结构”,若是分子结构,其化学式由图中所有实际存在的原子个数决定,原子个数比不约简。
(4)计算晶胞中微粒的数目,进而求化学式
根据均摊法计算出一个晶胞中所含微粒数目,求出晶胞所含微粒个数的最简整数比,从而写出晶体的化学式。
2.原子分数坐标的确定方法
(1)依据已知原子的坐标确定坐标系取向。
(2)一般以坐标轴所在正方体的棱长为1个单位。
(3)从原子所在位置分别向x、y、z轴作垂线,所得坐标轴上的截距即为该原子的分数坐标。
如位于晶胞原点(顶点)的原子的分数坐标为(0,0,0);位于晶胞体心的原子的分数坐标为( , , );位于xOz面心的原子的分数坐标为( ,0, )等(如图所示)。
3.晶体密度的计算
(3)晶胞的体积:V=a3(立方体)=abc(长方体)
4.金属晶体中原子间距离和晶胞参数
(1)思维流程
根据密度求晶胞中原子之间的距离时,可首先由密度计算出晶胞体积(晶胞质量由晶胞含有的微粒数计算),再根据晶胞结构判断微粒间距与棱长的关系。
(2)立方晶胞参数a计算公式
5.金属晶体中原子空间利用率
(1)思维流程
空间利用率是指构成晶体的原子在整个晶体空间中所占有的体积百分比,首先分析晶胞中原子个数和原子半径,计算出晶胞中所有原子的体积,其次根据立体几何知识计算出晶胞的棱长,计算出晶胞的体积,即可顺利解答此类问题。
(2)计算公式
应用体验
CaF2的晶胞为立方晶胞,结构如下图所示:
(1)CaF2晶胞中,Ca2+的配位数为__。
8
以面心Ca2+为研究对象,在一个晶胞中连接4个F-,通过该Ca2+可形成2个晶胞,所以与该Ca2+距离相等且最近的F-共有8个,因此Ca2+的配位数是8。
(2)“原子坐标参数”可表示晶胞内部各原子的相对位置,已知A、B两
点的原子坐标参数如图所示,则C点的原子坐标参数为(____,___, )。
(3)晶胞中两个F-的最近距离为273.1 pm,用NA表示阿伏加德罗常数的值,
则晶胞的密度为___________________g·cm-3(列出计算式即可)。
返回
随堂演练 知识落实
1.AB型化合物形成的晶体结构多种多样。如图所示的几种结构所表示的物质最有可能是分子晶体的是
1
2
3
4
A.①③ B.②⑤
C.⑤⑥ D.③④⑤⑥
√
1
2
3
4
从各图中可以看出②⑤都不能再以化学键与其他原子结合,所以最有可能是分子晶体。
2.金属晶体钠的晶胞如图所示,下列关于钠晶体的判断合理的是
1
2
3
4
A.其熔点比金属铝的熔点高
B.一个钠的晶胞中,平均含有4个钠原子
C.该晶体中的自由电子在外加电场作用下可发生定向移动
D.该晶体中的钠离子在外加电场的作用下可发生定向移动
√
1
2
3
4
金属的原子半径越小,金属离子所带电荷数越多,金属键越强,金属熔化时破坏金属键,所以Al的金属键比大于Na的金属键强,所以Na的熔点比金属Al的熔点低,故A错误。
3.(2022·云南昆明一中高二期中)在下列离子晶体的空间结构示意图中,
代表阳离子,?代表阴离子。若M代表阳离子,N代表阴离子,则化学式为MN2的晶体结构是
1
2
3
4
√
1
2
3
4
1
2
3
4
4.(2022·山东高二期中)磷化硼(BP)是一种半导体材料,熔点:1 100 ℃,其结构与氮化硼相似,晶胞结构如图1,下列说法正确的是
A.熔点:BP>BN
B.晶体中P周围距离最近且相等的P有8个
C.若图中①处磷原子坐标为(0,0,0),则②
处的B原子坐标为
D.磷化硼晶胞在y轴方向的投影图为图2
1
2
3
4
√
磷化硼(BP)结构与氮化硼相似,均为共价晶体,N原子半径小,B—N键长短,键能大,故BN熔点高,A错误;
若图中①处磷原子坐标为(0,0,0),将晶胞均分为8个小立方体,则②处的B原子在前左下角小立方体体心的位置,坐标为 ,C错误;
磷化硼晶胞中顶角和面心全部为P原子,在y轴方向的投影落在顶角和棱心;4个小立方体体心位置为B原子,
在y轴方向的投影均匀落在内部,在y轴
方向的投影图为图2,D正确。
1
2
3
4
返回
课时对点练
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
题组一 常见晶体结构的比较与分析
1.如图所示是从NaCl或CsCl的晶胞结构中分割出来的部分结构图,其中属于从NaCl晶胞中分割出来的结构图是
A.图(1)和(3) B.图(2)和(3)
C.图(1)和(4) D.只有图(4)
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
NaCl晶体中,每个Na+周围最邻近的Cl-有6个,构成正八面体,同理,每个Cl-周围最邻近的6个Na+也构成正八面体,由此可知图(1)和(4)是从NaCl晶体中分割出来的结构图,C项正确。
2.C60的晶胞(C60分子分别位于立方体的顶点和面心)如图所示。下列说法正确的是
A.C60的摩尔质量是720
B.C60与苯互为同素异形体
C.在C60晶胞中有4个C60分子
D.每个C60分子周围与它距离最近的C60分子有6个
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
C60的摩尔质量为720 g·mol-1,A项错误;
由同种元素形成的不同单质互为同素异形体,苯是由
碳氢两种元素形成的化合物,B项错误;
根据晶胞的结构,以晶胞中顶点上的C60分子为研究对象,与它距离最近的C60分子分布在立方体的面心上,每个C60分子被8个立方体共用,故有12个面与之相连,所以每个C60分子周围与它距离最近且等距离的C60分子有12个,D项错误。
3.有关晶体(或晶胞)的结构如图所示,下列说法不正确的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
A.在NaCl晶体中,距Na+最近的Cl-有6个
B.在CaF2晶体中,每个晶胞平均占有4个Ca2+
C.在金刚石晶体中,碳原子数与碳碳键个数之比为1∶2
D.该气态团簇分子的分子式为EF或FE
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
在NaCl晶体中,距Na+最近的Cl-有6个,故A正确;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
气态团簇分子不同于晶胞,气态团簇分子中含有4个E原子,4个F原子,则分子式为E4F4或F4E4,故D错误。
4.硅材料在工业生产中具有重要的应用,下列说法正确的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
A.熔、沸点比较:金刚石
C.Si12与单晶硅互为同分异构体
D.1 mol SiO2中含有2 mol Si—O
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
金刚石和SiC均为共价晶体,原子半径越小,共价键键能越大,共价晶体的熔、沸点越高,原子半径:C
碳化硅晶体中每个Si原子连接4个C原子,则SiC中Si原子的配位数为4,故B正确;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
Si12是分子晶体,单晶硅是共价晶体,是同种元素形成的不同单质,互为同素异形体,故C错误;
二氧化硅晶体中每个Si原子连接4个O原子,形成4个Si—O,则1 mol SiO2中含有4 mol Si—O,故D错误。
题组二 晶体结构的计算
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
6.(2022·山西柳林县鑫飞中学高二期中)根据如图几种晶体结构,下列说法错误的是
A.钛酸钙的化学式为CaTiO3
B.在金刚石晶体中,碳原子与碳碳键
(C—C)数目之比为1∶2
C.硒化锌晶体中与一个Se2-距离最近
且相等的Se2-有8个
D.CaF2中F-与距离最近的Ca2+所形成的键的夹角为109°28′
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
金刚石中1个C原子连接4个碳原子形成4个C—C,1个C—C被两个碳原子共有,因此C原子与C—C数目之比是1∶2,故B正确;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
硒化锌晶体中,与一个Se2-距离最近且相等的Se2-有12个,故C错误;
由氟化钙的晶胞可看出一个F与4个Ca可以形成正四面体结构,键角为109°28′,故D正确。
7.由K、I、O构成的立方晶胞如图所示。下列叙述错误的是
A.该化合物的化学式为KIO3
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
D.该晶胞的另一种表示中,I处于各顶角,则K处于体心位置
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
8.分析化学中常用X射线研究晶体结构,有一种蓝色晶体可表示为MxFey(CN)z,研究表明它的结构特性是Fe2+、Fe3+分别占据立方体的顶点,自身互不相邻,而CN-位于立方体的棱上,其晶体中的阴离子结构如图所示。下列说法正确的是
A.该晶体是共价晶体
B.M的离子位于上述立方体的面心,呈+2价
C.M的离子位于上述立方体的体心,且M+的空缺
率(体心中没有M+的占总体心的百分比)为50%
D.晶体的化学式可表示为MFe2(CN)3,且M为+1价
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
所以Fe2+、Fe3+、CN-的个数比为1∶1∶6,根据化合价代数和为零可知,M的化合价为+1价,则
每个晶胞平均含有M也是0.5个,而M的离子位于上述立方体的体心上,所以两个晶胞中一个有M+,而另一个必无M+,所以M+空缺率为50%,故B错误、C正确;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
由以上分析可知,晶体的化学式可表示为MFe2(CN)6,且M为+1价,故D错误。
9.某研究小组发现首例带结晶水的晶体在5 K下呈现超导性。据报道,该晶体中含有最简式为CoO2的层状结构,结构如图(小球表示Co,大球表示O)。下列用粗线画出的CoO2层状结构的晶胞示意图不符合化学式的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
10.CaF2的晶胞为立方晶胞,结构如图所示:
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
“原子分数坐标”可以表示晶胞内部各原子的相对位置,其中A原子分数坐标为(0,0,0),B原子分数坐标为(1,1,1),下列说法正确的是
A.CaF2晶胞中,Ca2+的配位数为4
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
以面心Ca2+为研究对象,在一个晶胞中连接4个F-,通过该Ca2+可形成2个晶胞,所以与该Ca2+距离相等且最近的F-共有8个,因此Ca2+的配位数是8,A错误;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
11.金晶体是面心立方堆积,晶胞面对角线为金原子半径的4倍,已知立方体的每个面上5个金原子紧密堆砌,金原子半径为r cm,则金晶体的空间利用率为
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
12.已知冰晶石(Na3AlF6)熔融时的电离方程式为Na3AlF6===3Na++ 。现有冰晶石的结构单元如图所示, 位于大立方体顶点和面心, 位于大立方体的12条棱的中点和8个小立方体的体心,?是图中 、 中的一种。下列说法正确的是
A.冰晶石是共价晶体
B.大立方体的体心处?代表Al3+
C.与Na+距离相等且最近的Na+有6个
D.冰晶石晶体的密度约为 g·cm-3
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
由冰晶石熔融时能发生电离,可知冰晶石是离子晶体,A项错误;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
与Na+距离相等且最近的Na+有8个,C项错误;
13.[2020·山东,17(4)]以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。四方晶系CdSnAs2的晶胞结构如图所示,晶胞棱边夹角均为90°,晶胞中部分原子的分数坐标如表所示。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
坐标 原子 x y z
Cd 0 0 0
Sn 0 0 0.5
As 0.25 0.25 0.125
一个晶胞中有__个Sn,找出距离Cd(0,0,0)最近的Sn__________________
(用分数坐标表示)。CdSnAs2晶体中与单个Sn键合的As有__个。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
坐标 原子 x y z
Cd 0 0 0
Sn 0 0 0.5
As 0.25 0.25 0.125
4
(0.5,0,0.25)、(0.5,0.5,0)
4
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
由题给原子的分数坐标和晶胞图可知,小白球表示的是Sn原子,Sn原子位于面上和棱上,因此一个晶胞中含Sn原子个数为6× +4× =4。由Sn和As的原子分数坐标可知,x、y轴上a pm长的分数坐标为1,z轴上2a pm长的分数坐标为1。小黑球
表示的是Cd原子,与Cd(0,0,0)最近的Sn有两个,其分数坐标分别为(0.5,0,0.25)和(0.5,0.5,0)。大灰球表示的是As原子,每个Sn周围与Sn等距离的As原子有4个,即与单个Sn键合的As有4个。
14.如图为CaF2、H3BO3(层状结构,层内的H3BO3分子通过氢键结合)、金属铜三种晶体(或晶胞)的结构示意图,请回答下列问题:
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
(1)图Ⅰ所示的CaF2晶体中与Ca2+最近且等距离的F-数为____,图Ⅲ中一个铜原子周围紧邻的铜原子数为____。
8
12
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
从图Ⅰ可看出面心上的一个Ca2+连接四个F-,若将旁边的晶胞画出,也应连四个F-,则一个Ca2+连8个F-。
(2)图Ⅱ所示的物质结构中最外电子层已达8电子结构的原子是_____,H3BO3晶体中B原子个数与极性键个数之比为______。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
O
1∶6
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
H原子的最外电子层是2电子,从图Ⅱ看,B原子只形成三个共价键,最外电子层应为6个电子,只有O原子的最外电子层为8电子结构。H3BO3属于分子晶体,一个B连有三个O原子,三个O原子又连有三个H原子,所以一个B原子对应6个极性键。
(3)三种晶体中熔点最低的是________,其晶体受热熔化时,克服的微粒之间的相互作用为_____________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
H3BO3
分子间作用力
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
熔点大小一般规律:共价晶体>离子晶体>分子晶体,金属晶体看具体情况,此题H3BO3为分子晶体,熔点最低,熔化时破坏分子间作用力。
15.(2021·郑州高二期中)石墨晶体的结构如图1所示,石墨的一个六方晶胞如图2所示。
请回答下列问题:
(1)每个晶胞中的碳原子个数为___。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
4
(2)画出晶胞沿c轴的投影_____________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
根据晶胞结构可知其沿c轴的投影为 。
(3)某石墨嵌入化合物中,每个六元环都对应一个Li+,写出它的化学式:______。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
LiC2
石墨中平均每个六元环含有2个碳原子,某石墨嵌入化合物中的每个六元环都对应一个Li+,故化学式为LiC2。
(4)若该晶胞底面边长为m pm,高为n pm,
则石墨晶体中碳碳键的键长为________pm,
密度为______________g·cm-3(设阿伏加德
罗常数的值为NA)。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
返回
本课结束
第三章
