高中化学人教版(2019)必修第一册1.3.1氧化还原反应(共22张ppt)
文档属性
| 名称 | 高中化学人教版(2019)必修第一册1.3.1氧化还原反应(共22张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-19 08:11:05 | ||
图片预览






文档简介
(共22张PPT)
第一章 第三节 氧化还原反应
1.3.1 氧化还原反应
第一课时 认识氧化还原反应
生活中发生氧化还原反应的现象:
情境引入
苹果变黄
钢铁生锈
皮肤衰老
物质燃烧
1、从得氧失氧角度认识氧化还原反应
2、从化合价升降角度认识氧化还原反应
3、从电子得失角度认识氧化还原反应
多角度认识氧化还原反应
阅读课本25页科学史话:(2min)
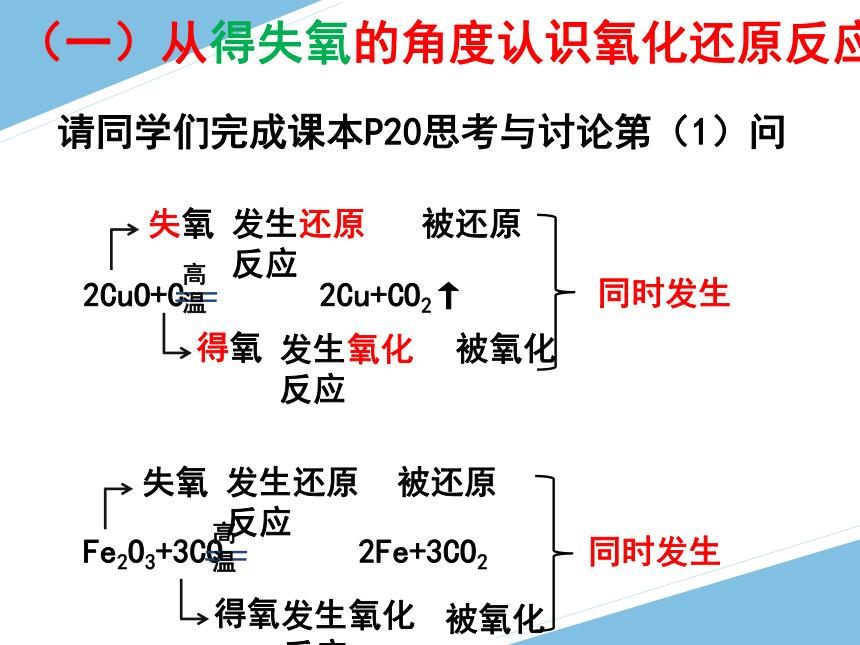
(一)从得失氧的角度认识氧化还原反应
请同学们完成课本P20思考与讨论第(1)问
2CuO+C 2Cu+CO2↑
高温
失氧
发生还原反应
得氧
发生氧化反应
被还原
被氧化
Fe2O3+3CO 2Fe+3CO2
高温
失氧
发生还原反应
得氧
发生氧化反应
被还原
被氧化
同时发生
同时发生
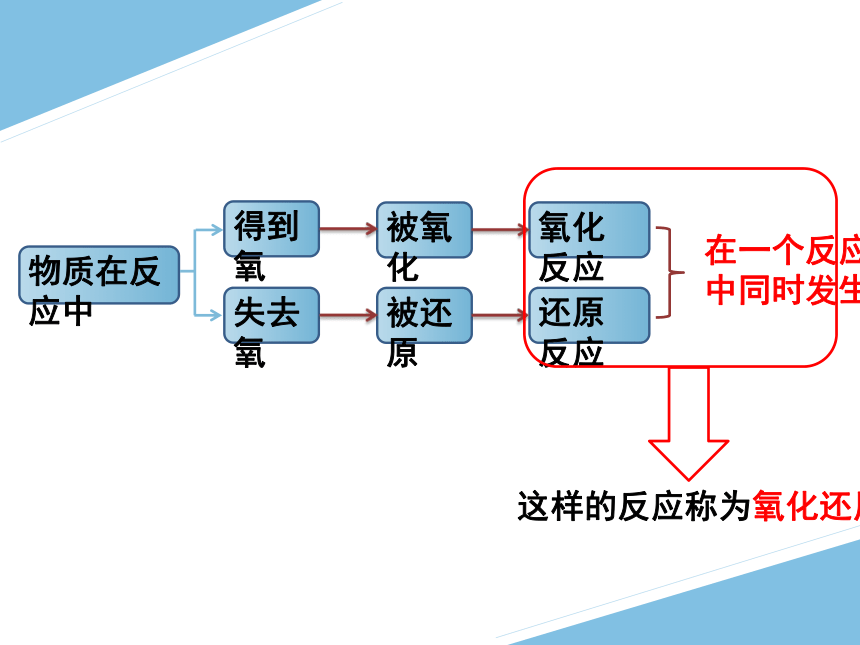
物质在反应中
得到氧
失去氧
被氧化
被还原
氧化反应
还原反应
在一个反应
中同时发生
这样的反应称为氧化还原反应
(二)从元素化合价变化的角度认识氧化还原反应
继续完成课本P20思考与讨论第(2)、(3)问。
失氧,被还原,还原反应
失氧,被还原,还原反应
2CuO + C
高温
2Cu + CO2
Fe2O 3 + 3CO
高温
2Fe + 3CO2
+2 -2 0 0 +4 -2
+3 -2 +2 -2 0 +4 -2
得氧,被氧化,氧化反应
得氧,被氧化,氧化反应
氧化反应:
元素化合价升高的反应
还原反应:
元素化合价降低的反应
化合价降低,
化合价升高,
化合价降低,
化合价升高,
思考与交流:下列两个反应是否属于氧化还原反应,如果是,请说明理由,并说一说你对氧化还原反应有什么新的认识?
+2
0
化合价降低,被还原,发生还原反应
0
+2
化合价升高,被氧化,发生氧化反应
0
+1
-1
0
化合价升高,被氧化,发生氧化反应
化合价降低,被还原,发生还原反应
有元素化合价变化(升降)是氧化还原反应的特征
从得失氧角度分析一个反应是否为氧化还原反应,仅局限于有得失氧的反应,所以此种方法是有局限性、片面性的。
判断依据
2.下列变化过程中,属于还原反应的是( )
A.HCl→Cl2 B.Na→Na+
C.CO→CO2 D.Fe3+→Fe
D
D
随堂练习
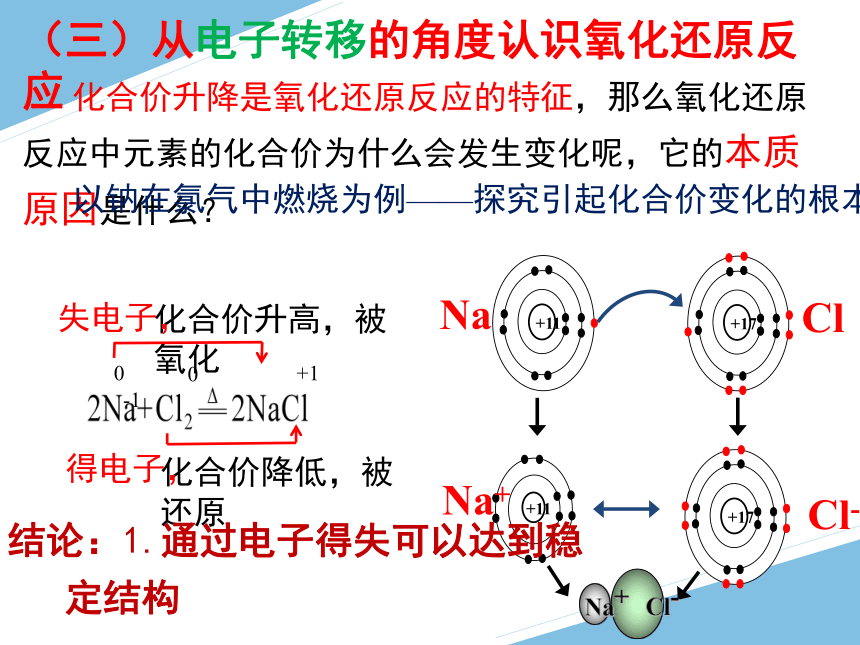
(三)从电子转移的角度认识氧化还原反应
化合价升降是氧化还原反应的特征,那么氧化还原反应中元素的化合价为什么会发生变化呢,它的本质原因是什么?
+17
+11
+17
+11
Na+ Cl-
Na
Cl
Cl-
Na+
0 +1
化合价升高,被氧化
化合价降低,被还原
以钠在氯气中燃烧为例——探究引起化合价变化的根本原因?
失电子,
得电子,
0 -1
结论:1.通过电子得失可以达到稳定结构
2.电子得失导致元素化合价升降
+1 -1
H
Cl
均不容易失去e-
0 0 +1 -1
电子对偏离,化合价升高
电子对偏向,化合价降低
微观探析
+17
+1
形成共用电子对,双方都达到稳定结构——共赢
H Cl
以氢气在氯气中燃烧为例——探究引起化合价变化的根本原因?
+1
+17
结论:
1.通过形成共用电子对达到稳定结构
2.共用电子对的偏移(偏向或偏离)导致元素化合价升降
H Cl
(三)从电子转移的角度认识氧化还原反应
思考?到底是什么引起了化合价变化?
电子的得失、
共用电子对的偏移(偏向或偏离)!
统称为电子的转移!
有电子转移(得失或偏移)的化学反应都是氧化还原反应。
氧化反应 还原反应 氧化还原反应
得失氧角度
元素化合价升降角度
电子转移角度
失去(或偏离)电子
得到(或偏向)电子
本质
归纳
得氧
失氧
局限性
化合价 升高
化合价 降低
特征
口诀:失升氧,得降还
失去电子,化合价升高,被氧化,发生氧化反应;
得到电子,化合价降低,被还原,发生还原反应。
化学反应(反应条件未标) 基本类型 是否氧化还原反应
CaCO3=CaO+CO2↑
2H2O=2H2↑+O2↑
AgNO3+NaCl=AgCl↓+NaNO3
BaCl2 + Na2SO4 = 2NaCl + BaSO4 ↓
Fe+CuSO4=FeSO4+Cu
Fe+H2SO4=FeSO4+H2↑
2Na+Cl2=2NaCl
H2O+CaO=Ca(OH) 2
分解反应
否
分解反应
是
复分解反应
否
复分解反应
否
置换反应
是
是
氧化还原反应与四种基本类型反应有什么联系 ?
置换反应
是
否
化合反应
化合反应
二、氧化还原反应与四种基本反应类型的关系
氧化还原反应
置换反应
化合反应
分解反应
复分解反应
有单质参加
有单质生成
分解
化合
氧化还原反应
置换
复分解反应
(1)H2O 、 H2O2 氧元素化合价分别为_______、_______
(2)NaH、NH3氢元素化合价分别为________、_______
(3)HCl、KClO3、ClO2中氯元素化合价分别为______、____、______
(4)MnO2、KMnO4中锰元素化合价分别为_______、_______
(5)Fe3O4中铁元素化合价为______
拓展练习
-2
-1
-1
+1
-1
+5
+4
+4
+7
+2、+3
注意事项:
(1)氧在过氧化物中(例:H2O2 、Na2O2 )显-1价。
(2)氢在金属氢化物中(例:NaH 、CaH2)显-1价。
(3)像Cl、N、S、Mn等具有可变价态的元素,根据化合物中各元素化合价代数和为0进行求算。
定义:氧化反应和还原反应同时发生的反应
四种基本反应类型与氧化还原反应的关系
特征:元素的化合价在反应前后发生变化
课后作业:
课本P27 第1、2、5、6题
小结
本质:电子的转移
1.氧化还原反应的本质是( )
A.有氧元素参与反应
B.有电子转移
C.物质状态发生变化
D.质量保持不变
B
A
2.人们常用图示的方法表示不同反应类型之间的关系。如分解反应和氧化还原反应可用图表示。如图为离子反应、氧化还原反应和置换反应三者之间的关系,则C表示( )
A.离子反应 B.氧化还原反应 C.置换反应 D.三者都可以
3.下列属于氧化还原反应的是( )
A.CaCO3==CaO+CO2↑
B.Mg3N2+3H2O=3Mg(OH)2↓+2NH3↑C.Zn+H2SO4= ZnSO4+H2↑
D.NaHCO3+HCl= NaCl+CO2↑+H2O
C
4.关于氧化还原反应的说法正确的是( )
A.置换反应一定属于氧化还原反应
B.具有氧化性的物质在化学反应中一定作氧化剂
C.一种物质被氧化一定有另一种物质被还原
D.氧化还原反应的实质是化合价发生变化
A
得氧失氧角度
A
化合价变化角度
B
微观角度
C
本质与特征
D
四种基本反应类型
E
反应类型之间的关系
E
F
第一章 第三节 氧化还原反应
1.3.1 氧化还原反应
第一课时 认识氧化还原反应
生活中发生氧化还原反应的现象:
情境引入
苹果变黄
钢铁生锈
皮肤衰老
物质燃烧
1、从得氧失氧角度认识氧化还原反应
2、从化合价升降角度认识氧化还原反应
3、从电子得失角度认识氧化还原反应
多角度认识氧化还原反应
阅读课本25页科学史话:(2min)
(一)从得失氧的角度认识氧化还原反应
请同学们完成课本P20思考与讨论第(1)问
2CuO+C 2Cu+CO2↑
高温
失氧
发生还原反应
得氧
发生氧化反应
被还原
被氧化
Fe2O3+3CO 2Fe+3CO2
高温
失氧
发生还原反应
得氧
发生氧化反应
被还原
被氧化
同时发生
同时发生
物质在反应中
得到氧
失去氧
被氧化
被还原
氧化反应
还原反应
在一个反应
中同时发生
这样的反应称为氧化还原反应
(二)从元素化合价变化的角度认识氧化还原反应
继续完成课本P20思考与讨论第(2)、(3)问。
失氧,被还原,还原反应
失氧,被还原,还原反应
2CuO + C
高温
2Cu + CO2
Fe2O 3 + 3CO
高温
2Fe + 3CO2
+2 -2 0 0 +4 -2
+3 -2 +2 -2 0 +4 -2
得氧,被氧化,氧化反应
得氧,被氧化,氧化反应
氧化反应:
元素化合价升高的反应
还原反应:
元素化合价降低的反应
化合价降低,
化合价升高,
化合价降低,
化合价升高,
思考与交流:下列两个反应是否属于氧化还原反应,如果是,请说明理由,并说一说你对氧化还原反应有什么新的认识?
+2
0
化合价降低,被还原,发生还原反应
0
+2
化合价升高,被氧化,发生氧化反应
0
+1
-1
0
化合价升高,被氧化,发生氧化反应
化合价降低,被还原,发生还原反应
有元素化合价变化(升降)是氧化还原反应的特征
从得失氧角度分析一个反应是否为氧化还原反应,仅局限于有得失氧的反应,所以此种方法是有局限性、片面性的。
判断依据
2.下列变化过程中,属于还原反应的是( )
A.HCl→Cl2 B.Na→Na+
C.CO→CO2 D.Fe3+→Fe
D
D
随堂练习
(三)从电子转移的角度认识氧化还原反应
化合价升降是氧化还原反应的特征,那么氧化还原反应中元素的化合价为什么会发生变化呢,它的本质原因是什么?
+17
+11
+17
+11
Na+ Cl-
Na
Cl
Cl-
Na+
0 +1
化合价升高,被氧化
化合价降低,被还原
以钠在氯气中燃烧为例——探究引起化合价变化的根本原因?
失电子,
得电子,
0 -1
结论:1.通过电子得失可以达到稳定结构
2.电子得失导致元素化合价升降
+1 -1
H
Cl
均不容易失去e-
0 0 +1 -1
电子对偏离,化合价升高
电子对偏向,化合价降低
微观探析
+17
+1
形成共用电子对,双方都达到稳定结构——共赢
H Cl
以氢气在氯气中燃烧为例——探究引起化合价变化的根本原因?
+1
+17
结论:
1.通过形成共用电子对达到稳定结构
2.共用电子对的偏移(偏向或偏离)导致元素化合价升降
H Cl
(三)从电子转移的角度认识氧化还原反应
思考?到底是什么引起了化合价变化?
电子的得失、
共用电子对的偏移(偏向或偏离)!
统称为电子的转移!
有电子转移(得失或偏移)的化学反应都是氧化还原反应。
氧化反应 还原反应 氧化还原反应
得失氧角度
元素化合价升降角度
电子转移角度
失去(或偏离)电子
得到(或偏向)电子
本质
归纳
得氧
失氧
局限性
化合价 升高
化合价 降低
特征
口诀:失升氧,得降还
失去电子,化合价升高,被氧化,发生氧化反应;
得到电子,化合价降低,被还原,发生还原反应。
化学反应(反应条件未标) 基本类型 是否氧化还原反应
CaCO3=CaO+CO2↑
2H2O=2H2↑+O2↑
AgNO3+NaCl=AgCl↓+NaNO3
BaCl2 + Na2SO4 = 2NaCl + BaSO4 ↓
Fe+CuSO4=FeSO4+Cu
Fe+H2SO4=FeSO4+H2↑
2Na+Cl2=2NaCl
H2O+CaO=Ca(OH) 2
分解反应
否
分解反应
是
复分解反应
否
复分解反应
否
置换反应
是
是
氧化还原反应与四种基本类型反应有什么联系 ?
置换反应
是
否
化合反应
化合反应
二、氧化还原反应与四种基本反应类型的关系
氧化还原反应
置换反应
化合反应
分解反应
复分解反应
有单质参加
有单质生成
分解
化合
氧化还原反应
置换
复分解反应
(1)H2O 、 H2O2 氧元素化合价分别为_______、_______
(2)NaH、NH3氢元素化合价分别为________、_______
(3)HCl、KClO3、ClO2中氯元素化合价分别为______、____、______
(4)MnO2、KMnO4中锰元素化合价分别为_______、_______
(5)Fe3O4中铁元素化合价为______
拓展练习
-2
-1
-1
+1
-1
+5
+4
+4
+7
+2、+3
注意事项:
(1)氧在过氧化物中(例:H2O2 、Na2O2 )显-1价。
(2)氢在金属氢化物中(例:NaH 、CaH2)显-1价。
(3)像Cl、N、S、Mn等具有可变价态的元素,根据化合物中各元素化合价代数和为0进行求算。
定义:氧化反应和还原反应同时发生的反应
四种基本反应类型与氧化还原反应的关系
特征:元素的化合价在反应前后发生变化
课后作业:
课本P27 第1、2、5、6题
小结
本质:电子的转移
1.氧化还原反应的本质是( )
A.有氧元素参与反应
B.有电子转移
C.物质状态发生变化
D.质量保持不变
B
A
2.人们常用图示的方法表示不同反应类型之间的关系。如分解反应和氧化还原反应可用图表示。如图为离子反应、氧化还原反应和置换反应三者之间的关系,则C表示( )
A.离子反应 B.氧化还原反应 C.置换反应 D.三者都可以
3.下列属于氧化还原反应的是( )
A.CaCO3==CaO+CO2↑
B.Mg3N2+3H2O=3Mg(OH)2↓+2NH3↑C.Zn+H2SO4= ZnSO4+H2↑
D.NaHCO3+HCl= NaCl+CO2↑+H2O
C
4.关于氧化还原反应的说法正确的是( )
A.置换反应一定属于氧化还原反应
B.具有氧化性的物质在化学反应中一定作氧化剂
C.一种物质被氧化一定有另一种物质被还原
D.氧化还原反应的实质是化合价发生变化
A
得氧失氧角度
A
化合价变化角度
B
微观角度
C
本质与特征
D
四种基本反应类型
E
反应类型之间的关系
E
F
