高中化学人教版(2019)必修第一册2.3.1物质的量(共24张ppt)
文档属性
| 名称 | 高中化学人教版(2019)必修第一册2.3.1物质的量(共24张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 47.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-19 08:11:53 | ||
图片预览



文档简介
(共24张PPT)
第三节
—物质的量(课时1)
2019人教版新教材必修第一册
认识物质的量
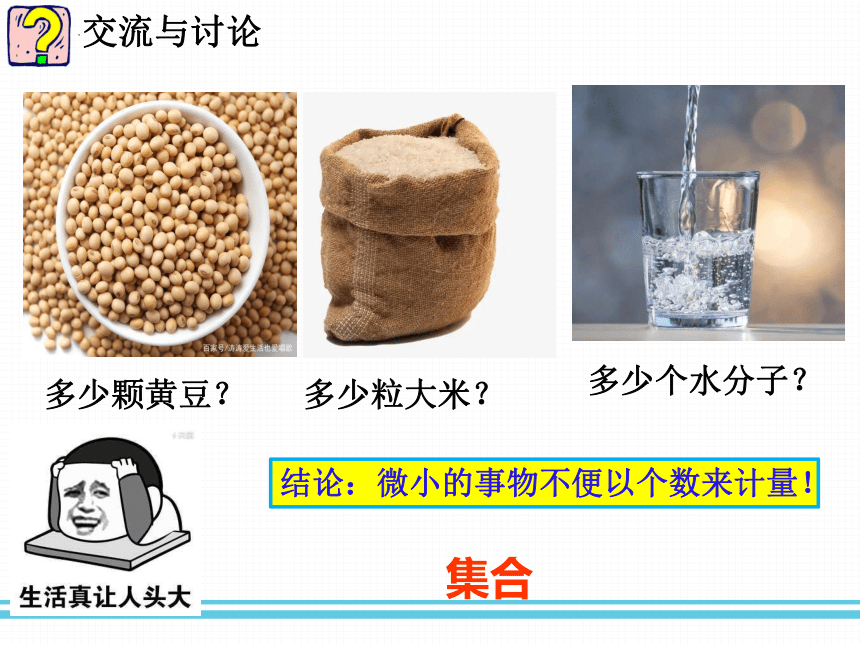
交流与讨论
结论:微小的事物不便以个数来计量!
多少颗黄豆?
多少粒大米?
集合
多少个水分子?
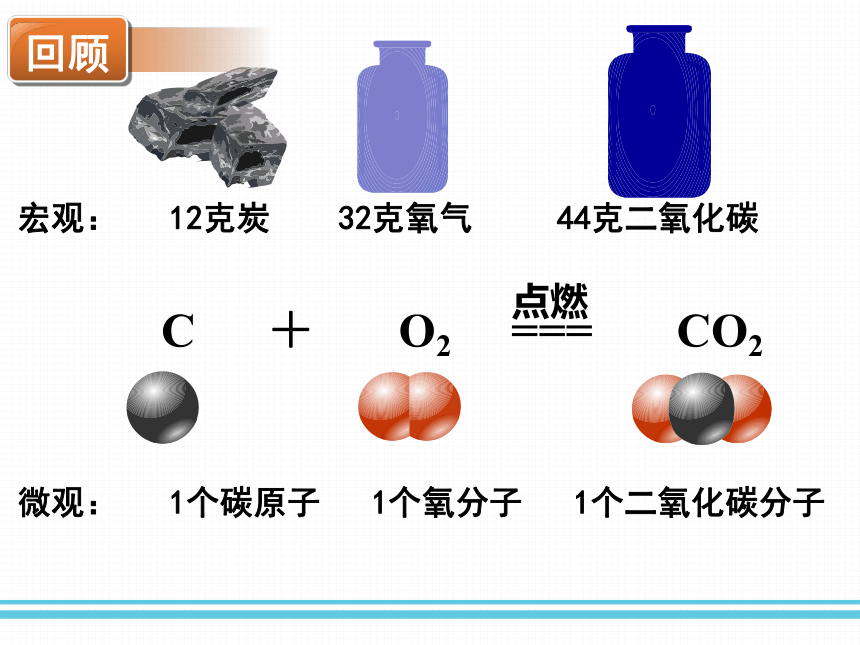
微观: 1个碳原子 1个氧分子 1个二氧化碳分子
C + O2 === CO2
点燃
宏观: 12克炭 32克氧气 44克二氧化碳
回顾
物质的量
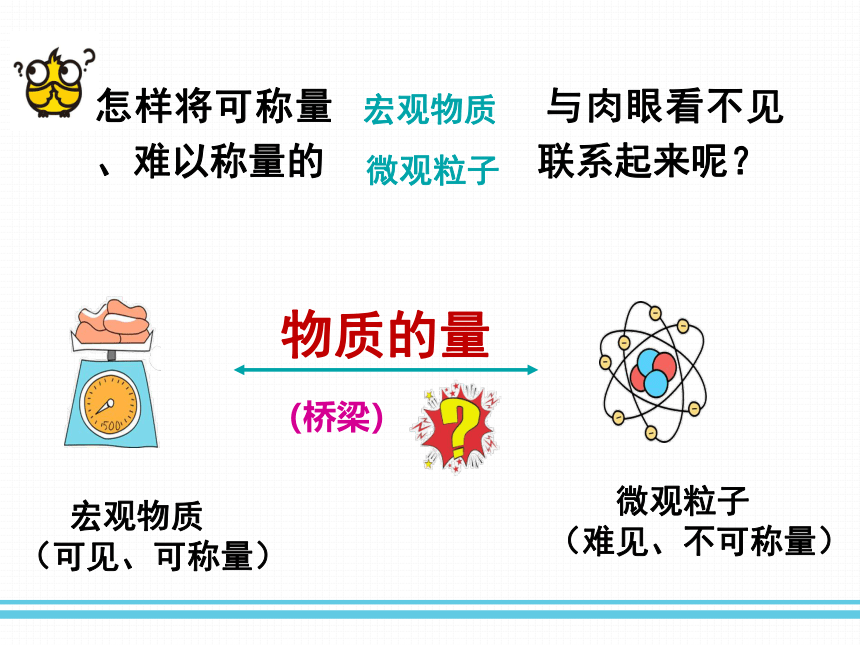
怎样将可称量 与肉眼看不见、难以称量的 联系起来呢?
宏观物质
微观粒子
(桥梁)
宏观物质
(可见、可称量)
微观粒子
(难见、不可称量)
一、物质的量
1、定义:表示含有一定数目粒子的集合体的物理量。
2、单位:
符号:n
摩尔,简称:摩
符号:mol
{
分子,原子(团),离子,
电子,质子 ,中子等
国际单位制的7个基本单位
lm
t
I
T
n
3、注意点
①专有名称,是一个整体,不能说成:物质的质量,物质的数量或物质量等
②计量对象:微观粒子(如分子、原子、离子、质子、中子、电子等)及它们的特定组合(如NaCl),不能用于计量宏观物体,如1mol苹果、0.5mol大米等。
③使用物质的量时,必须指明微粒的具体种类,一般用化学式表示如1molH,不能写成1mol氢
专有化、微观化、具体化
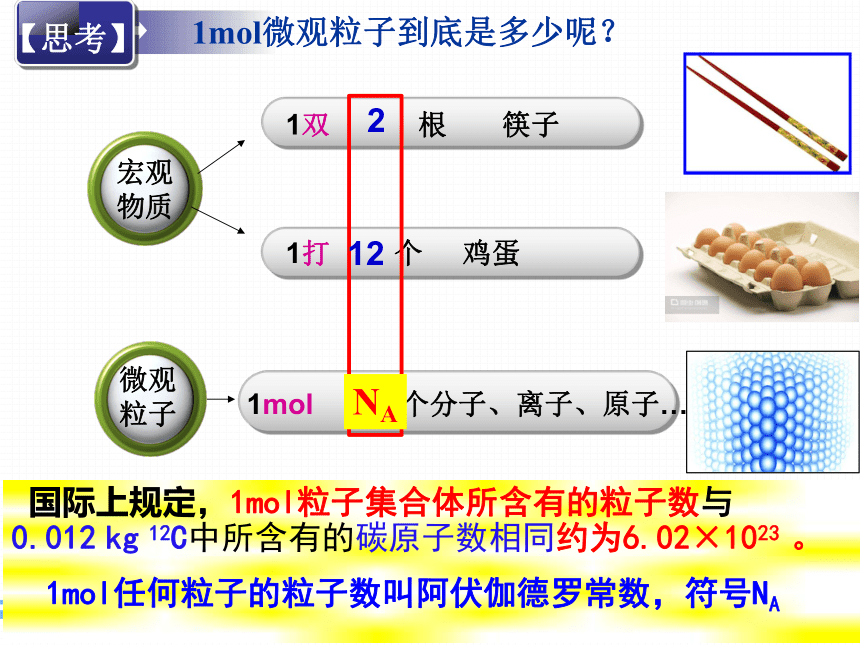
1双 根 筷子
宏观
物质
微观
粒子
1mol 个分子、离子、原子……
【思考】
1mol微观粒子到底是多少呢?
1打 个 鸡蛋
2
12
国际上规定,1mol粒子集合体所含有的粒子数与0.012 kg 12C中所含有的碳原子数相同约为6.02×1023 。
1mol任何粒子的粒子数叫阿伏伽德罗常数,符号NA
NA
2、符号: NA
单位: mol-1 (每摩尔)
近似值:6.02×1023mol-1
二、阿伏加德罗常数 :
1、定义:1 mol 任何粒子的粒子数。
感受阿伏加德罗常数
1mol任何粒子的粒子数
=
阿伏加德罗常数(NA)
≈
6.02×1023
不能认为 6.02×1023就是阿伏加德罗常数
【注意】
=
12g12C中所含碳原子数
正是由于阿伏伽德罗常数的如此庞大,故物质的量只用来表示原子、分子、离子等微观粒子,不适用宏观物质。
NA =
N
n
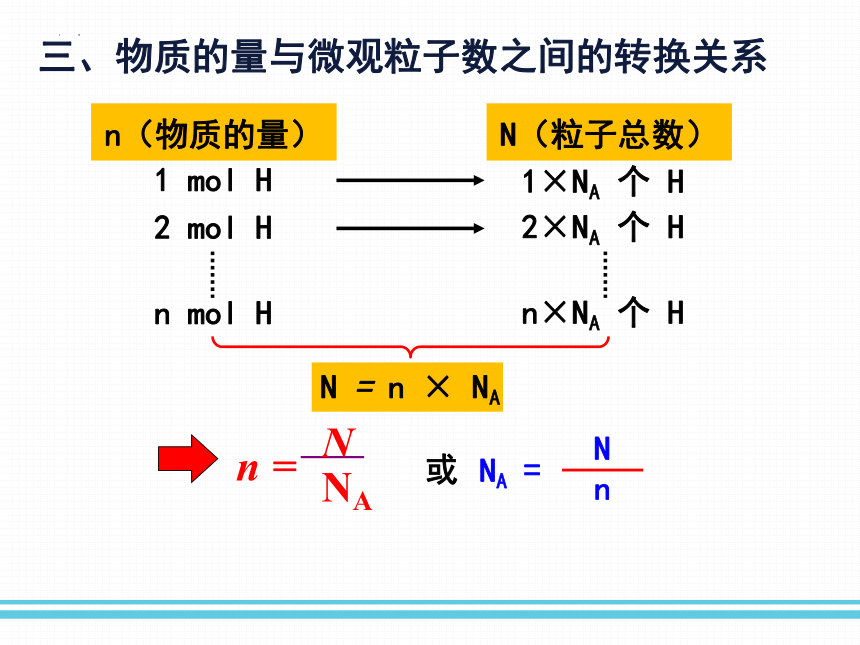
n(物质的量)
N(粒子总数)
1 mol H
2 mol H
1×NA 个 H
2×NA 个 H
n mol H
n×NA 个 H
N = n × NA
或
三、物质的量与微观粒子数之间的转换关系
n
=
N
NA
①摩尔是七个基本物理量之一 ( )
②1mol氢约含6.02×1023个氢原子 ( )
③摩尔是物质的数量单位 ( )
④NA就是6.02×1023mol-1 ( )
⑤1molH的数目约为6.02×1023 个 ( )
⑥1mol大米的数目约为6.02×1023 个 ( )
×
√
1 、判断下列说法是否正确
×
×
×
×
练一练:
练习1: 6.02×1023 个H的“物质的量”是_____
练习2: 1.204×1024 个H+的“物质的量”是_____
练习3: 1.806×1024 个e-的“物质的量”是_____
练习4: 1.204×1024 个H2O中
水分子的“物质的量”是_________,
氢原子的“物质的量”是________,
氧原子的“物质的量”是_________,
原子核的“物质的量”是_________,
电子的“物质的量”是_________。
质子的“物质的量”是_________。
1mol
2mol
3mol
2mol
4mol
2mol
6mol
20mol
练一练:
20mol
练习5:1molC中约含有————————个碳原子
练习6:2molH2O中约含有———————个水分子
练习7:0.5molSO42-中含有————————个SO42-离子
6.02×1023
练习9:
含3.01×1023个Na+的 Na2SO4中约含SO42-_____ mol。
0.25
练习8: 2mol Na2SO4 中有 个 Na+,有 个SO42-
一共 个离子
4NA
2NA
6NA
1.204×1024
0.5NA
“见量化摩”
n =
NA
N
物质的量
n
阿伏伽德罗常数
NA
总结
微观角度
宏观角度
1个
1个
1个
NA
NA
NA
12g 32g 44g
1mol 1mol 1mol
同时扩大NA倍
C + O2 == CO2
点燃
物质的量
化学方程式中,物质的物质的量之比等于其计量数之比
(2)有1 mol Cl2与足量氢氧化钠溶液反应,生成 mol NaCl,转移 mol电子。
1
1
(3)过氧化钠与水反应,当转移0.2 mol电子时得到 mol氧气。
0.1
(1)反应2Al +3H2SO4 =Al2 (SO4) 3 +3H2↑中,每2个Al与足量的H2SO4反应生成____个H2,每2 mol与足量的H2SO4反应生成H2 _____ mol 。
3
3
练习:
粒子 符号 物质的 相对分子质量 每个粒子的质量(g/个) 1mol物质含有的粒子数(个) 1摩物质质量(g)
C 12 1.993×10-23
H2O 18 2.990×10-23
Na+ 23 3.821×10-23
OH- 17 2.824×10-23
NA
NA
NA
NA
12
18
23
17
1mol不同物质的质量有什么规律?
(计算结果保留整数)
结论:
1mol任何粒子构成的物质的质量以克为单位时,在数值上等于该微粒的相对原子质量或相对分子质量。
1molFe的质量是: 、1molO2的质量是: 、
1molH2SO4的质量是: 、1molFe2+的质量是: 。
56 g
32 g
98 g
56 g
【课堂练习】
四、摩尔质量
1、概念:
单位物质的量的物质所具有的质量叫做摩尔质量
符号:M
如Fe的摩尔质量为 、
H2SO4的摩尔质量为 、
Na+的摩尔质量为 。
56 g·mol-1
23 g·mol-1
98 g·mol-1
单位:g/mol ( g·mol-1) 或kg/mol(kg·mol-1)
2、计算公式:
m= n × M
M
m
n =
大量实验证明:
若以克/摩(g/mol或g·mol-1 )为单位,物质的摩尔质量在数值上与该粒子的相对原子质量或相对分子质量相等。
【注意细节 】
1molCa的质量为 ,Ca的摩尔质量
为____ 。其相对原子质量为
40g
40g·mol-1
40
1molH2O的摩尔质量为 ,2molH2O的摩尔质量为 。
O原子的摩尔质量为________1molO含有 ______个O原子,这些O的质量为 ,
18g·mol-1
18g·mol-1
16g
16g·mol-1
NA
对于指定的物质来说,其摩尔质量的值是一个定值,与物质的量或质量无关!
【例题1】26.5gNa2CO3的物质的量是多少?
【解】Na2CO3的相对分子质量为106,摩尔质量为106g/mol。
n(Na2CO3)=
m(Na2CO3)
M(Na2CO3)
26.5g
106g/mol
=
=0.25mol
答:26.5gNa2CO3的物质的量是0.25mol。
练习1、抗疫时期,过氧乙酸(C2H4O3)是被人们广泛使用的消毒剂。
相对原子质量:C:12 H:1 O:16
①过氧乙酸的式量是_____;
摩尔质量是 ;
则0.5mol过氧乙酸是 g;
②22.8g过氧乙酸是____mol。
76
76g/mol
38
0.3
2. 54ml水中约含有 个水分子。
3NA
3、1.5mol 硫酸的质量是 ,其中含有 mol O ,其质量是 克;
147g
6
96
1、 1.204×1024个Mg变成Mg2+失去____ mol eˉ。
2、 mol H2O中含有的氧原子数与1.5mol CO2中含有的氧原子数相同
3、0.5molCO和N2的混合气体中含有原子数为_______,含有质子数为_______。
3
7NA
NA
4、1个Na2SO4中有 个Na+ ,有 个SO42-;
2mol Na2SO4 中有 mol Na+,有 mol SO42-
1mol SO42-中有 个质子;有 个电子
有 mol质子;有 mol电子
2mol Na+有 mol质子;有 mol电子
2
1
48
4
2
48NA
50NA
50
22
20
4
【巩固练习】
5.计算填空:
(1)2 mol CO2中含 mol碳原子, 个氧原子(用NA表示阿伏加德罗常数的值,下同), 个质子,质量是 g。
(2)已知0.4 mol的CO和CO2的混合气体共14.4 g,则
①CO的物质的量为 ;
②混合气体的平均摩尔质量为 。
2
44NA
4NA
88
0.2mol
36 g·mol-1
6.计算下列物质的摩尔质量。
(1)1.28 g某气体含有的分子数目为1.204×1022,则该气体的摩尔质量为_________。
(2)已知一个铁原子的质量为b g,则铁的摩尔质量为____________。
(3)NA为阿伏加德罗常数,已知a g某气体中含分子数为b,则该气体的摩尔质量为_____________。
64 g·mol-1
bNA g·mol-1
(4)40.5 g某金属氯化物RCl2含有0.6 mol氯离子,则金属R的摩尔质量为 。
64 g·mol-1
n =
NA
N
物质的量
n
阿伏伽德罗常数
NA
摩尔质量
M
总结
第三节
—物质的量(课时1)
2019人教版新教材必修第一册
认识物质的量
交流与讨论
结论:微小的事物不便以个数来计量!
多少颗黄豆?
多少粒大米?
集合
多少个水分子?
微观: 1个碳原子 1个氧分子 1个二氧化碳分子
C + O2 === CO2
点燃
宏观: 12克炭 32克氧气 44克二氧化碳
回顾
物质的量
怎样将可称量 与肉眼看不见、难以称量的 联系起来呢?
宏观物质
微观粒子
(桥梁)
宏观物质
(可见、可称量)
微观粒子
(难见、不可称量)
一、物质的量
1、定义:表示含有一定数目粒子的集合体的物理量。
2、单位:
符号:n
摩尔,简称:摩
符号:mol
{
分子,原子(团),离子,
电子,质子 ,中子等
国际单位制的7个基本单位
lm
t
I
T
n
3、注意点
①专有名称,是一个整体,不能说成:物质的质量,物质的数量或物质量等
②计量对象:微观粒子(如分子、原子、离子、质子、中子、电子等)及它们的特定组合(如NaCl),不能用于计量宏观物体,如1mol苹果、0.5mol大米等。
③使用物质的量时,必须指明微粒的具体种类,一般用化学式表示如1molH,不能写成1mol氢
专有化、微观化、具体化
1双 根 筷子
宏观
物质
微观
粒子
1mol 个分子、离子、原子……
【思考】
1mol微观粒子到底是多少呢?
1打 个 鸡蛋
2
12
国际上规定,1mol粒子集合体所含有的粒子数与0.012 kg 12C中所含有的碳原子数相同约为6.02×1023 。
1mol任何粒子的粒子数叫阿伏伽德罗常数,符号NA
NA
2、符号: NA
单位: mol-1 (每摩尔)
近似值:6.02×1023mol-1
二、阿伏加德罗常数 :
1、定义:1 mol 任何粒子的粒子数。
感受阿伏加德罗常数
1mol任何粒子的粒子数
=
阿伏加德罗常数(NA)
≈
6.02×1023
不能认为 6.02×1023就是阿伏加德罗常数
【注意】
=
12g12C中所含碳原子数
正是由于阿伏伽德罗常数的如此庞大,故物质的量只用来表示原子、分子、离子等微观粒子,不适用宏观物质。
NA =
N
n
n(物质的量)
N(粒子总数)
1 mol H
2 mol H
1×NA 个 H
2×NA 个 H
n mol H
n×NA 个 H
N = n × NA
或
三、物质的量与微观粒子数之间的转换关系
n
=
N
NA
①摩尔是七个基本物理量之一 ( )
②1mol氢约含6.02×1023个氢原子 ( )
③摩尔是物质的数量单位 ( )
④NA就是6.02×1023mol-1 ( )
⑤1molH的数目约为6.02×1023 个 ( )
⑥1mol大米的数目约为6.02×1023 个 ( )
×
√
1 、判断下列说法是否正确
×
×
×
×
练一练:
练习1: 6.02×1023 个H的“物质的量”是_____
练习2: 1.204×1024 个H+的“物质的量”是_____
练习3: 1.806×1024 个e-的“物质的量”是_____
练习4: 1.204×1024 个H2O中
水分子的“物质的量”是_________,
氢原子的“物质的量”是________,
氧原子的“物质的量”是_________,
原子核的“物质的量”是_________,
电子的“物质的量”是_________。
质子的“物质的量”是_________。
1mol
2mol
3mol
2mol
4mol
2mol
6mol
20mol
练一练:
20mol
练习5:1molC中约含有————————个碳原子
练习6:2molH2O中约含有———————个水分子
练习7:0.5molSO42-中含有————————个SO42-离子
6.02×1023
练习9:
含3.01×1023个Na+的 Na2SO4中约含SO42-_____ mol。
0.25
练习8: 2mol Na2SO4 中有 个 Na+,有 个SO42-
一共 个离子
4NA
2NA
6NA
1.204×1024
0.5NA
“见量化摩”
n =
NA
N
物质的量
n
阿伏伽德罗常数
NA
总结
微观角度
宏观角度
1个
1个
1个
NA
NA
NA
12g 32g 44g
1mol 1mol 1mol
同时扩大NA倍
C + O2 == CO2
点燃
物质的量
化学方程式中,物质的物质的量之比等于其计量数之比
(2)有1 mol Cl2与足量氢氧化钠溶液反应,生成 mol NaCl,转移 mol电子。
1
1
(3)过氧化钠与水反应,当转移0.2 mol电子时得到 mol氧气。
0.1
(1)反应2Al +3H2SO4 =Al2 (SO4) 3 +3H2↑中,每2个Al与足量的H2SO4反应生成____个H2,每2 mol与足量的H2SO4反应生成H2 _____ mol 。
3
3
练习:
粒子 符号 物质的 相对分子质量 每个粒子的质量(g/个) 1mol物质含有的粒子数(个) 1摩物质质量(g)
C 12 1.993×10-23
H2O 18 2.990×10-23
Na+ 23 3.821×10-23
OH- 17 2.824×10-23
NA
NA
NA
NA
12
18
23
17
1mol不同物质的质量有什么规律?
(计算结果保留整数)
结论:
1mol任何粒子构成的物质的质量以克为单位时,在数值上等于该微粒的相对原子质量或相对分子质量。
1molFe的质量是: 、1molO2的质量是: 、
1molH2SO4的质量是: 、1molFe2+的质量是: 。
56 g
32 g
98 g
56 g
【课堂练习】
四、摩尔质量
1、概念:
单位物质的量的物质所具有的质量叫做摩尔质量
符号:M
如Fe的摩尔质量为 、
H2SO4的摩尔质量为 、
Na+的摩尔质量为 。
56 g·mol-1
23 g·mol-1
98 g·mol-1
单位:g/mol ( g·mol-1) 或kg/mol(kg·mol-1)
2、计算公式:
m= n × M
M
m
n =
大量实验证明:
若以克/摩(g/mol或g·mol-1 )为单位,物质的摩尔质量在数值上与该粒子的相对原子质量或相对分子质量相等。
【注意细节 】
1molCa的质量为 ,Ca的摩尔质量
为____ 。其相对原子质量为
40g
40g·mol-1
40
1molH2O的摩尔质量为 ,2molH2O的摩尔质量为 。
O原子的摩尔质量为________1molO含有 ______个O原子,这些O的质量为 ,
18g·mol-1
18g·mol-1
16g
16g·mol-1
NA
对于指定的物质来说,其摩尔质量的值是一个定值,与物质的量或质量无关!
【例题1】26.5gNa2CO3的物质的量是多少?
【解】Na2CO3的相对分子质量为106,摩尔质量为106g/mol。
n(Na2CO3)=
m(Na2CO3)
M(Na2CO3)
26.5g
106g/mol
=
=0.25mol
答:26.5gNa2CO3的物质的量是0.25mol。
练习1、抗疫时期,过氧乙酸(C2H4O3)是被人们广泛使用的消毒剂。
相对原子质量:C:12 H:1 O:16
①过氧乙酸的式量是_____;
摩尔质量是 ;
则0.5mol过氧乙酸是 g;
②22.8g过氧乙酸是____mol。
76
76g/mol
38
0.3
2. 54ml水中约含有 个水分子。
3NA
3、1.5mol 硫酸的质量是 ,其中含有 mol O ,其质量是 克;
147g
6
96
1、 1.204×1024个Mg变成Mg2+失去____ mol eˉ。
2、 mol H2O中含有的氧原子数与1.5mol CO2中含有的氧原子数相同
3、0.5molCO和N2的混合气体中含有原子数为_______,含有质子数为_______。
3
7NA
NA
4、1个Na2SO4中有 个Na+ ,有 个SO42-;
2mol Na2SO4 中有 mol Na+,有 mol SO42-
1mol SO42-中有 个质子;有 个电子
有 mol质子;有 mol电子
2mol Na+有 mol质子;有 mol电子
2
1
48
4
2
48NA
50NA
50
22
20
4
【巩固练习】
5.计算填空:
(1)2 mol CO2中含 mol碳原子, 个氧原子(用NA表示阿伏加德罗常数的值,下同), 个质子,质量是 g。
(2)已知0.4 mol的CO和CO2的混合气体共14.4 g,则
①CO的物质的量为 ;
②混合气体的平均摩尔质量为 。
2
44NA
4NA
88
0.2mol
36 g·mol-1
6.计算下列物质的摩尔质量。
(1)1.28 g某气体含有的分子数目为1.204×1022,则该气体的摩尔质量为_________。
(2)已知一个铁原子的质量为b g,则铁的摩尔质量为____________。
(3)NA为阿伏加德罗常数,已知a g某气体中含分子数为b,则该气体的摩尔质量为_____________。
64 g·mol-1
bNA g·mol-1
(4)40.5 g某金属氯化物RCl2含有0.6 mol氯离子,则金属R的摩尔质量为 。
64 g·mol-1
n =
NA
N
物质的量
n
阿伏伽德罗常数
NA
摩尔质量
M
总结
