高中化学人教版(2019)必修第一册1.1 物质的分类及转化(共41张ppt)
文档属性
| 名称 | 高中化学人教版(2019)必修第一册1.1 物质的分类及转化(共41张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 10.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-19 08:13:08 | ||
图片预览




文档简介
(共41张PPT)
人教版化学必修一 第一章 第一节
物质的分类及转化
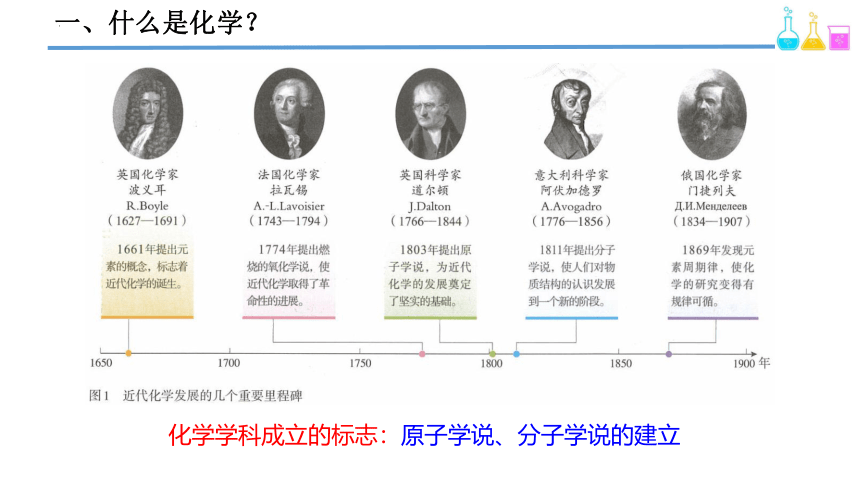
一、什么是化学?
化学学科成立的标志:原子学说、分子学说的建立
一、什么是化学?
历史上曾多次将“诺贝尔化学奖”授予与生物或医学相关的研究、甚至还有物理学家:
2012年,诺贝尔化学奖获得者,两位科学家分别是罗伯特·洛夫科维茨(美国霍华德·休斯医学研究所研究员,美国杜克大学医学中心担任詹姆斯·杜克医学教授,生物化学教授)和布莱恩·克比尔卡(美国斯坦福大学医学院医学教授以及分子和细胞生物学教授)。
2014年诺贝尔化学奖得主为美国科学家埃里克·白兹格(神经科学家、发明家、应用物理学家、霍华德·休斯医学研究所的研究带头人),美国科学家威廉姆·艾斯科·莫尔纳尔(康奈尔大学物理学博士、单分子光谱和荧光光谱领域的著名专家)和德国科学家斯特凡·W·赫尔(海德堡大学物理学博士,物理学家、马克斯·普朗克生物物理化学研究所所长之一),以表彰他们在超分辨率荧光显微技术领域取得的成就。超分辨率荧光显微技术,用于分子生物学、神经科学的光学成像。
2015年诺贝尔化学奖,托马斯·罗伯特·林达尔(瑞典医学家,专门从事癌症研究)、保罗·莫德里奇(斯坦福大学博士、杜克大学生物化学教授,霍华德·休斯医学研究所的研究人员、阿齐兹·桑贾尔(土耳其生物学家,专门从事DNA修复、细胞周期检查点、生物钟方面的研究) 。获奖理由是因为他们从分子水平上揭示了细胞是如何修复损伤的DNA以及保护遗传信息的(即“DNA修复的机制研究”)
一、什么是化学?
化学、物理
科学的尺度
原子结构
化学
分子结构
生物
医学
建筑
地理、物理
细胞结构
人体结构
建筑结构
天体结构
一、什么是化学?
化学是在原子、分子水平上研究物质组成、结构、性质、转化及其应用的基础自然科学。
化学是一门以实验为基础的科学。
化学的任务和使命:认识、合成、创造更多物质。
化学的学习方法:边记边理解
先记再理解
多记自然理解
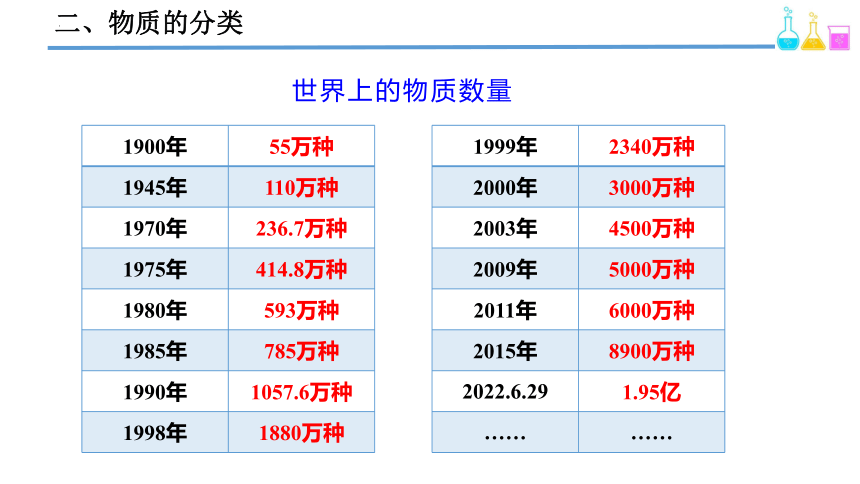
二、物质的分类
1900年 55万种
1945年 110万种
1970年 236.7万种
1975年 414.8万种
1980年 593万种
1985年 785万种
1990年 1057.6万种
1998年 1880万种
世界上的物质数量
1999年 2340万种
2000年 3000万种
2003年 4500万种
2009年 5000万种
2011年 6000万种
2015年 8900万种
2022.6.29 1.95亿
…… ……
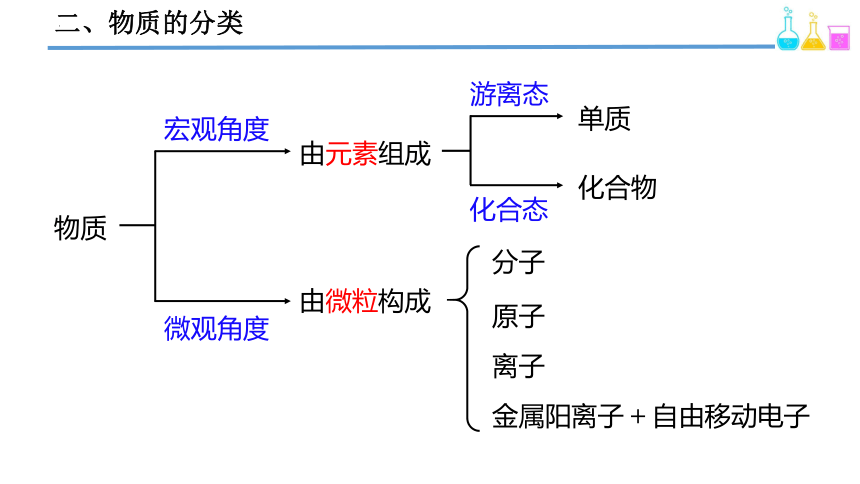
二、物质的分类
物质
宏观角度
微观角度
由元素组成
由微粒构成
游离态
化合态
单质
化合物
分子
原子
离子
金属阳离子 + 自由移动电子
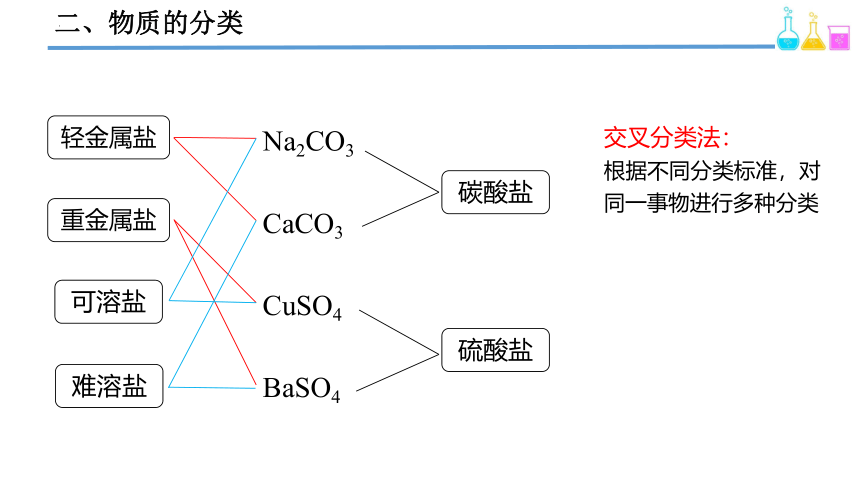
二、物质的分类
Na2CO3
CaCO3
CuSO4
BaSO4
碳酸盐
硫酸盐
可溶盐
难溶盐
重金属盐
轻金属盐
交叉分类法:
根据不同分类标准,对同一事物进行多种分类
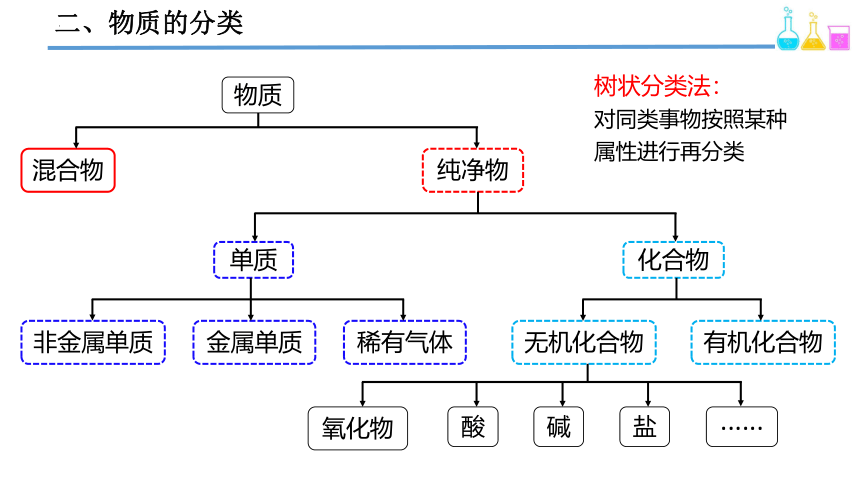
二、物质的分类
物质
混合物
纯净物
单质
化合物
非金属单质
金属单质
稀有气体
无机化合物
有机化合物
氧化物
酸
碱
盐
······
树状分类法:
对同类事物按照某种属性进行再分类
二、物质的分类
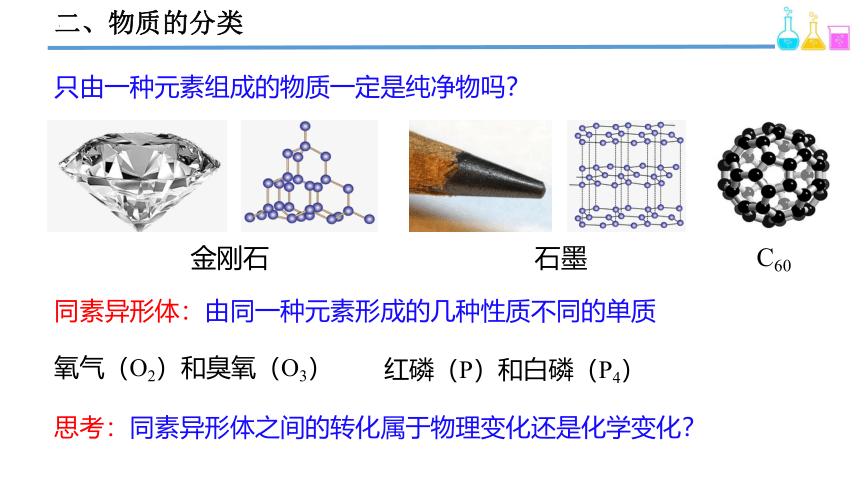
金刚石
石墨
C60
只由一种元素组成的物质一定是纯净物吗?
同素异形体:由同一种元素形成的几种性质不同的单质
氧气(O2)和臭氧(O3)
红磷(P)和白磷(P4)
思考:同素异形体之间的转化属于物理变化还是化学变化?
三、氧化物的再认识
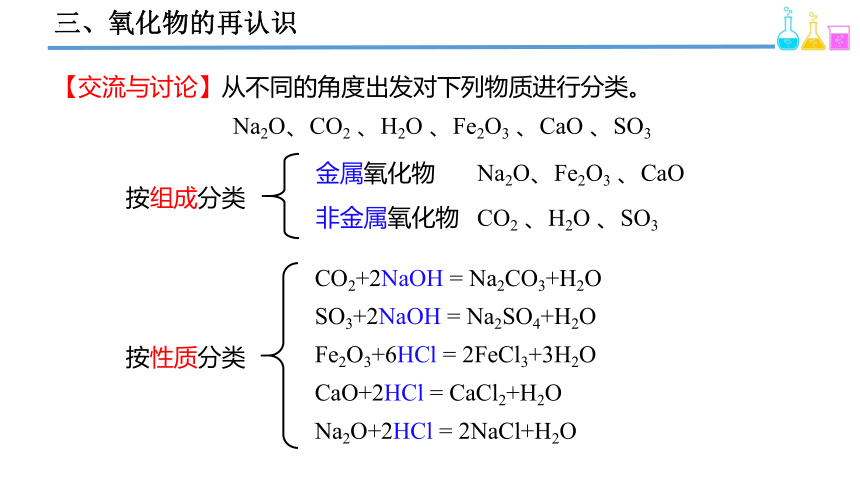
【交流与讨论】从不同的角度出发对下列物质进行分类。
Na2O、CO2 、H2O 、Fe2O3 、CaO 、SO3
按组成分类
金属氧化物
非金属氧化物
Na2O、Fe2O3 、CaO
CO2 、H2O 、SO3
按性质分类
CO2+2NaOH = Na2CO3+H2O
SO3+2NaOH = Na2SO4+H2O
Fe2O3+6HCl = 2FeCl3+3H2O
CaO+2HCl = CaCl2+H2O
Na2O+2HCl = 2NaCl+H2O
三、氧化物的再认识
CO2+2NaOH = Na2CO3+H2O
SO3+2NaOH = Na2SO4+H2O
Fe2O3+6HCl = 2FeCl3+3H2O
CaO+2HCl = CaCl2+H2O
Na2O+2HCl = 2NaCl+H2O
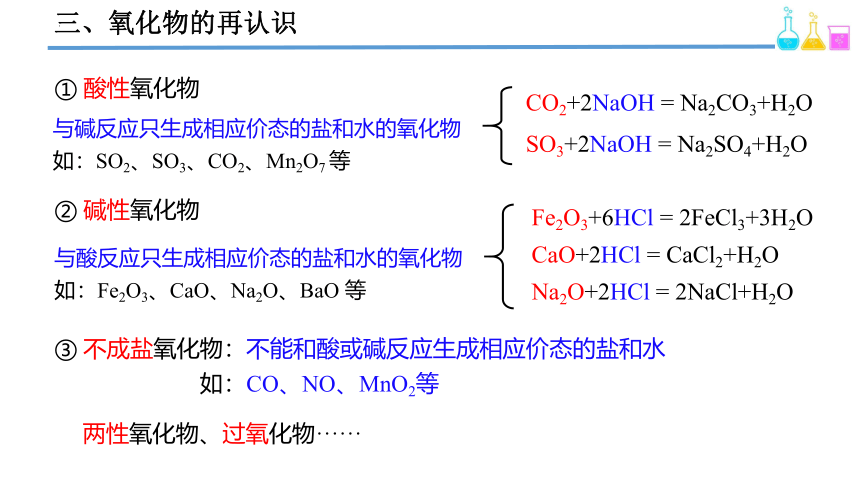
① 酸性氧化物
与碱反应只生成相应价态的盐和水的氧化物
如:SO2、SO3、CO2、Mn2O7 等
② 碱性氧化物
与酸反应只生成相应价态的盐和水的氧化物
如:Fe2O3、CaO、Na2O、BaO 等
③ 不成盐氧化物:不能和酸或碱反应生成相应价态的盐和水
如:CO、NO、MnO2等
两性氧化物、过氧化物······
三、氧化物的再认识
酸酐:某含氧酸脱去一分子或几分子水,所剩下的部分称为该酸的酸酐
无机酸:一分子的该酸,直接失去一分子的水就形成该酸的酸酐
有机酸:两分子该酸或多分子该酸,通过分子间的脱水反应而形成该酸的酸酐。如:乙酸酐(CH3CO)2O
注意:只有含氧酸才有酸酐,无氧酸是没有酸酐的。许多酸酐能再与水作用而生成原来的酸,且反应前后化合价不变。
一般而言:
H2CO3=CO2+H2O
2HNO3=N2O5+H2O
H2SO4=SO3+H2O
2CH3COOH=H2O+(CH3CO)2O
乙酸酐
三、氧化物的再认识
【概念辨析】判断正误
酸性氧化物 酸酐
都是
都是
√
×
非金属氧化物 酸性氧化物
都是
都是
×
×
金属氧化物 碱性氧化物
都是
都是
×
√
四、酸的再认识
酸:电离时生成的阳离子全部都是H+的化合物
① 按是否含有氧元素
含氧酸:H2SO4、HNO3、H2CO3、H3PO4
无氧酸:HCl、HBr、HF、H2S
② 按电离出氢离子的个数
一元酸:HCl、HNO3、HF、CH3COOH
二元酸:H2SO4、H2CO3、H2S
三元酸:H3PO4
③ 按性质分类
易挥发酸:HCl、HNO3
难挥发酸:H2SO4、H3PO4
易分解酸:H2CO3、H2SO3
强氧化性酸:浓H2SO4、HNO3
四、酸的再认识
④ 按酸性强弱
强酸:HCl、HBr、HI、H2SO4、HNO3、HClO4等
中强酸:H3PO4、H2SO3 等
弱酸:H2CO3、CH3COOH、HF、H2S 等
五、碱的再认识
碱:电离时生成的阴离子全部都是OH-的化合物
① 按其在水溶液中是否溶解
可溶性碱:KOH、NaOH、Ba(OH)2、Ca(OH)2
可溶性碱对应的氧化物 + 水 = 碱
如:Na2O + H2O = 2NaOH
难溶性碱:Cu(OH)2、Fe(OH)3、Mg(OH)2、Zn(OH)2
难溶性碱加热易分解
如:Cu(OH)2
CuO + H2O
五、碱的再认识
② 按碱性强弱
强碱:NaOH、KOH、Ba(OH)2、Ca(OH)2等
弱碱:NH3·H2O、Fe(OH)3等
③ 按电离出氢氧根的个数
一元碱:NaOH、NH3·H2O 等
二元碱:Ba(OH)2、Ca(OH)2 等
三元碱:Fe(OH)3 等
六、盐的再认识
盐:金属阳离子(或NH4+)和酸根离子构成的化合物
① 按组成分类:
正盐
NaCl、FeS、MgCl2
NaNO3、CuSO4、CaCO3
酸式盐
NaHCO3、Ca(HCO3)2
NaH2PO4
碱式盐:Cu2(OH)2CO3、Mg(OH)Cl
某化某
某酸某
某酸氢某
某酸几氢某
碱式某酸某
复盐:由两种或两种以上金属阳离子(或NH4+)和一种酸根离子构成的盐。
KAl(SO4)2、(NH4)2Fe(SO4)2
混盐:由一种金属阳离子(或NH4+)和两种或以上酸根离子构成的盐。
Ca(NO3)Cl、Ca(ClO)Cl
六、盐的再认识
③ 按是否可溶于水:
可溶性盐:KCl、CuSO4、NH4NO3
难溶性盐:AgCl、BaSO4
② 按酸根是否含氧:
含氧酸盐:KNO3、FeSO4、KMnO4
无氧酸盐:NaCl、KBr、ZnS
含Na+、K+、NH4+、Cl-、SO42-、NO3-的盐一般均可溶
(除AgCl、BaSO4、PbSO4、CaSO4(微溶) 、Ag2SO4(微溶) )
七、物质的转化
思考:如何从单质出发,制备Na2CO3?
Na →Na2O → NaOH → Na2CO3
①
②
③
C →CO2 → H2CO3 → Na2CO3
①
②
③
金属单质
碱性氧化物
O2
碱
H2O
盐
酸或酸性氧化物
非金属单质
酸性氧化物
O2
酸
H2O
盐
碱或碱性氧化物
七、物质的转化
酸+活泼金属单质=盐+氢气
酸+碱性氧化物=盐+水
酸+碱=盐+水
酸+盐=新盐+新酸
碱+盐=新盐+新碱
碱+酸=盐+水
碱+酸性氧化物=盐+水
盐+金属=新盐+新金属
盐+碱=新盐+新碱
盐+酸=新盐+新酸
盐+盐=新盐+新新
八、分散系及其分类
纯净物:
(1)定义:由同类单质或者化合物组成的物质
(2)特点:有固定的组成和性质(固定的熔沸点等)
(3)特殊名称的纯净物:胆矾、纯碱、酒精、干冰、醋酸、硫酸、硝酸
混合物:
(1)定义:由几种不同单质或者化合物组成的物质
(2)特点:无固定的组成和性质,随混合物中各成分含量不同而改变
八、分散系及其分类
① 溶液是一种或几种物质分散到另一种物质里, 形成的均一、稳定的混合物
② 乳浊液是液体小液滴分散到液体里形成的混合物
③ 悬浊液是固体小颗粒悬浮于液体里形成的混合物
CuSO4溶液
油水混合物
泥浆水
比较它们的异同点
八、分散系及其分类
1. 分散系的概念:一种(或多种)物质以粒子形式分散到另一种(或多种)物质中所形成的混合物
2. 组成
分散质:被分散的物质
分散剂:分散其他物质的物质
分别指出CuSO4溶液、油水混合物、泥沙水、碘酒中的分散质和分散剂
八、分散系及其分类
分散质
分散剂
气
液
固
气
液
固
分散质 分散剂 实例
气 气
液
固
气 液
液
固
气 固
液
固
空气
云、雾
烟
气泡
牛奶
泥沙水
泡沫塑料
珍珠
合金
八、分散系及其分类
3. 分散系的分类:根据分散质粒子的直径大小分类
分散系
溶液:分散质粒子直径<1 nm
胶体:分散质粒子直径为1~100 nm
浊液:分散质粒子直径>100 nm
注:1 nm = 10-9 m 1 μm = 10-6 m 1 mm = 10-3 m
八、分散系及其分类
分散系 浊液 胶体 溶液
粒子直径 >100nm 1~100nm <1nm
举例 泥浆水、油水 Fe(OH)3胶体 NaCl溶液
外观特征
滤纸
半透膜
4. 溶液、胶体、浊液的比较:
不均一、不稳定、不透明
均一、较稳定、透明
均一、稳定、透明
透不过
可透过
可透过
透不过
透不过
可透过
渗析
八、分散系及其分类
5. 胶体的分类:按分散剂的不同分类
分散剂
液溶胶:分散剂为液体,如:Fe(OH)3胶体、淀粉溶液、蛋白质溶液、血液、豆浆、墨水等
气溶胶:分散剂为气体,如:烟、雾、云等
固溶胶:分散剂为固体,如:有色玻璃、合金等
八、分散系及其分类
6. 胶体的制备:
取40 mL蒸馏水于烧杯,加热至沸腾,向沸水中逐滴加入5~6滴FeCl3饱和溶液。继续煮沸至液体呈红褐色,停止加热。
7. 溶液与胶体的鉴别:
CuSO4溶液
Fe(OH)3胶体
丁达尔效应:当光束通过胶体时,在垂直光束的方向可以看到一条光亮的通路
应用:鉴别溶液和胶体
FeCl3+3H2O Fe(OH)3(胶体)+3HCl
八、分散系及其分类
八、分散系及其分类
8. 胶体的应用:
Fe(OH)3、Al(OH)3等胶体具有吸附性:
胶体表面积大、吸附能力强,可吸附水中的悬浮颗粒并沉降,具有净水作用
如:自来水厂常用明矾或含铁化合物作净水剂,因为它们在水中可生成 Fe(OH)3 胶体或 Al(OH)3 胶体
九、电解质
物质 NaCl固体 KNO3固体 蒸馏水 NaCl溶液 KNO3溶液
小灯泡
是否导电
不亮
不亮
不亮
亮
亮
不导电
不导电
不导电
导电
导电
九、电解质
NaCl固体为什么不导电?
虽然有离子,但不能自由移动
金属、石墨导电的原因:
电子能在电场的作用下定向移动,形成电流
九、电解质
为什么NaCl、KNO3等电解质,在干燥时不导电,而溶于水后却能导电?
电流是由带电荷的粒子按一定方向移动而形成的
九、电解质
电解熔融NaCl
只有在水溶液中才能导电吗?
升温,加快离子运动,克服离子间的相互作用,产生自由移动的离子
九、电解质
所有物质溶于水或受热熔化都能得到自由移动的离子吗?
九、电解质
电解质:在水溶液中或熔融状态下能够导电的化合物
非电解质:在水溶液中和熔融状态下都不导电的化合物
酸、碱、盐、活泼金属氧化物、水等,
如:HCl、H2SO4、NaOH、Ca(OH)2、NaCl、KNO3、Na2O
大多数有机物、非金属氧化物等,
如:酒精、蔗糖、CO2、SO2、NH3
九、电解质
物质
混合物
纯净物
单质
化合物
电解质
非电解质
既不是电解质,也不是非电解质
九、电解质
下列物质中:①氢氧化钠固体 ②铜 ③氢氧化钠溶液 ④盐酸 ⑤熔融的碳酸钾 ⑥硫酸钡 ⑦蔗糖 ⑧二氧化碳 ⑨氨气
属于电解质的是哪些?属于非电解质的是哪些?
电解质:①⑤⑥ 非电解质:⑦⑧⑨
注意:
1. 能导电的物质不一定是电解质;
2. 电解质的导电需要条件:水溶液或熔融状态;
3. 电解质导电必须是化合物本身的导电作用。
九、电解质
电离:电解质溶于水或受热熔化时,形成自由移动的离子的过程
如何用化学用语表示物质的电离过程?
NaCl = Na+ + Cl-
化学式
电离
离子符号(代表水合离子)
电离方程式:
① 阴阳离子拆开写,但原子团不能拆,如:OH-、CO32-、SO42-、NO3-等
② 弱酸的酸式根不能拆,如:HCO3-、HSO3-等
③ 原子个数守恒,电子守恒
人教版化学必修一 第一章 第一节
物质的分类及转化
一、什么是化学?
化学学科成立的标志:原子学说、分子学说的建立
一、什么是化学?
历史上曾多次将“诺贝尔化学奖”授予与生物或医学相关的研究、甚至还有物理学家:
2012年,诺贝尔化学奖获得者,两位科学家分别是罗伯特·洛夫科维茨(美国霍华德·休斯医学研究所研究员,美国杜克大学医学中心担任詹姆斯·杜克医学教授,生物化学教授)和布莱恩·克比尔卡(美国斯坦福大学医学院医学教授以及分子和细胞生物学教授)。
2014年诺贝尔化学奖得主为美国科学家埃里克·白兹格(神经科学家、发明家、应用物理学家、霍华德·休斯医学研究所的研究带头人),美国科学家威廉姆·艾斯科·莫尔纳尔(康奈尔大学物理学博士、单分子光谱和荧光光谱领域的著名专家)和德国科学家斯特凡·W·赫尔(海德堡大学物理学博士,物理学家、马克斯·普朗克生物物理化学研究所所长之一),以表彰他们在超分辨率荧光显微技术领域取得的成就。超分辨率荧光显微技术,用于分子生物学、神经科学的光学成像。
2015年诺贝尔化学奖,托马斯·罗伯特·林达尔(瑞典医学家,专门从事癌症研究)、保罗·莫德里奇(斯坦福大学博士、杜克大学生物化学教授,霍华德·休斯医学研究所的研究人员、阿齐兹·桑贾尔(土耳其生物学家,专门从事DNA修复、细胞周期检查点、生物钟方面的研究) 。获奖理由是因为他们从分子水平上揭示了细胞是如何修复损伤的DNA以及保护遗传信息的(即“DNA修复的机制研究”)
一、什么是化学?
化学、物理
科学的尺度
原子结构
化学
分子结构
生物
医学
建筑
地理、物理
细胞结构
人体结构
建筑结构
天体结构
一、什么是化学?
化学是在原子、分子水平上研究物质组成、结构、性质、转化及其应用的基础自然科学。
化学是一门以实验为基础的科学。
化学的任务和使命:认识、合成、创造更多物质。
化学的学习方法:边记边理解
先记再理解
多记自然理解
二、物质的分类
1900年 55万种
1945年 110万种
1970年 236.7万种
1975年 414.8万种
1980年 593万种
1985年 785万种
1990年 1057.6万种
1998年 1880万种
世界上的物质数量
1999年 2340万种
2000年 3000万种
2003年 4500万种
2009年 5000万种
2011年 6000万种
2015年 8900万种
2022.6.29 1.95亿
…… ……
二、物质的分类
物质
宏观角度
微观角度
由元素组成
由微粒构成
游离态
化合态
单质
化合物
分子
原子
离子
金属阳离子 + 自由移动电子
二、物质的分类
Na2CO3
CaCO3
CuSO4
BaSO4
碳酸盐
硫酸盐
可溶盐
难溶盐
重金属盐
轻金属盐
交叉分类法:
根据不同分类标准,对同一事物进行多种分类
二、物质的分类
物质
混合物
纯净物
单质
化合物
非金属单质
金属单质
稀有气体
无机化合物
有机化合物
氧化物
酸
碱
盐
······
树状分类法:
对同类事物按照某种属性进行再分类
二、物质的分类
金刚石
石墨
C60
只由一种元素组成的物质一定是纯净物吗?
同素异形体:由同一种元素形成的几种性质不同的单质
氧气(O2)和臭氧(O3)
红磷(P)和白磷(P4)
思考:同素异形体之间的转化属于物理变化还是化学变化?
三、氧化物的再认识
【交流与讨论】从不同的角度出发对下列物质进行分类。
Na2O、CO2 、H2O 、Fe2O3 、CaO 、SO3
按组成分类
金属氧化物
非金属氧化物
Na2O、Fe2O3 、CaO
CO2 、H2O 、SO3
按性质分类
CO2+2NaOH = Na2CO3+H2O
SO3+2NaOH = Na2SO4+H2O
Fe2O3+6HCl = 2FeCl3+3H2O
CaO+2HCl = CaCl2+H2O
Na2O+2HCl = 2NaCl+H2O
三、氧化物的再认识
CO2+2NaOH = Na2CO3+H2O
SO3+2NaOH = Na2SO4+H2O
Fe2O3+6HCl = 2FeCl3+3H2O
CaO+2HCl = CaCl2+H2O
Na2O+2HCl = 2NaCl+H2O
① 酸性氧化物
与碱反应只生成相应价态的盐和水的氧化物
如:SO2、SO3、CO2、Mn2O7 等
② 碱性氧化物
与酸反应只生成相应价态的盐和水的氧化物
如:Fe2O3、CaO、Na2O、BaO 等
③ 不成盐氧化物:不能和酸或碱反应生成相应价态的盐和水
如:CO、NO、MnO2等
两性氧化物、过氧化物······
三、氧化物的再认识
酸酐:某含氧酸脱去一分子或几分子水,所剩下的部分称为该酸的酸酐
无机酸:一分子的该酸,直接失去一分子的水就形成该酸的酸酐
有机酸:两分子该酸或多分子该酸,通过分子间的脱水反应而形成该酸的酸酐。如:乙酸酐(CH3CO)2O
注意:只有含氧酸才有酸酐,无氧酸是没有酸酐的。许多酸酐能再与水作用而生成原来的酸,且反应前后化合价不变。
一般而言:
H2CO3=CO2+H2O
2HNO3=N2O5+H2O
H2SO4=SO3+H2O
2CH3COOH=H2O+(CH3CO)2O
乙酸酐
三、氧化物的再认识
【概念辨析】判断正误
酸性氧化物 酸酐
都是
都是
√
×
非金属氧化物 酸性氧化物
都是
都是
×
×
金属氧化物 碱性氧化物
都是
都是
×
√
四、酸的再认识
酸:电离时生成的阳离子全部都是H+的化合物
① 按是否含有氧元素
含氧酸:H2SO4、HNO3、H2CO3、H3PO4
无氧酸:HCl、HBr、HF、H2S
② 按电离出氢离子的个数
一元酸:HCl、HNO3、HF、CH3COOH
二元酸:H2SO4、H2CO3、H2S
三元酸:H3PO4
③ 按性质分类
易挥发酸:HCl、HNO3
难挥发酸:H2SO4、H3PO4
易分解酸:H2CO3、H2SO3
强氧化性酸:浓H2SO4、HNO3
四、酸的再认识
④ 按酸性强弱
强酸:HCl、HBr、HI、H2SO4、HNO3、HClO4等
中强酸:H3PO4、H2SO3 等
弱酸:H2CO3、CH3COOH、HF、H2S 等
五、碱的再认识
碱:电离时生成的阴离子全部都是OH-的化合物
① 按其在水溶液中是否溶解
可溶性碱:KOH、NaOH、Ba(OH)2、Ca(OH)2
可溶性碱对应的氧化物 + 水 = 碱
如:Na2O + H2O = 2NaOH
难溶性碱:Cu(OH)2、Fe(OH)3、Mg(OH)2、Zn(OH)2
难溶性碱加热易分解
如:Cu(OH)2
CuO + H2O
五、碱的再认识
② 按碱性强弱
强碱:NaOH、KOH、Ba(OH)2、Ca(OH)2等
弱碱:NH3·H2O、Fe(OH)3等
③ 按电离出氢氧根的个数
一元碱:NaOH、NH3·H2O 等
二元碱:Ba(OH)2、Ca(OH)2 等
三元碱:Fe(OH)3 等
六、盐的再认识
盐:金属阳离子(或NH4+)和酸根离子构成的化合物
① 按组成分类:
正盐
NaCl、FeS、MgCl2
NaNO3、CuSO4、CaCO3
酸式盐
NaHCO3、Ca(HCO3)2
NaH2PO4
碱式盐:Cu2(OH)2CO3、Mg(OH)Cl
某化某
某酸某
某酸氢某
某酸几氢某
碱式某酸某
复盐:由两种或两种以上金属阳离子(或NH4+)和一种酸根离子构成的盐。
KAl(SO4)2、(NH4)2Fe(SO4)2
混盐:由一种金属阳离子(或NH4+)和两种或以上酸根离子构成的盐。
Ca(NO3)Cl、Ca(ClO)Cl
六、盐的再认识
③ 按是否可溶于水:
可溶性盐:KCl、CuSO4、NH4NO3
难溶性盐:AgCl、BaSO4
② 按酸根是否含氧:
含氧酸盐:KNO3、FeSO4、KMnO4
无氧酸盐:NaCl、KBr、ZnS
含Na+、K+、NH4+、Cl-、SO42-、NO3-的盐一般均可溶
(除AgCl、BaSO4、PbSO4、CaSO4(微溶) 、Ag2SO4(微溶) )
七、物质的转化
思考:如何从单质出发,制备Na2CO3?
Na →Na2O → NaOH → Na2CO3
①
②
③
C →CO2 → H2CO3 → Na2CO3
①
②
③
金属单质
碱性氧化物
O2
碱
H2O
盐
酸或酸性氧化物
非金属单质
酸性氧化物
O2
酸
H2O
盐
碱或碱性氧化物
七、物质的转化
酸+活泼金属单质=盐+氢气
酸+碱性氧化物=盐+水
酸+碱=盐+水
酸+盐=新盐+新酸
碱+盐=新盐+新碱
碱+酸=盐+水
碱+酸性氧化物=盐+水
盐+金属=新盐+新金属
盐+碱=新盐+新碱
盐+酸=新盐+新酸
盐+盐=新盐+新新
八、分散系及其分类
纯净物:
(1)定义:由同类单质或者化合物组成的物质
(2)特点:有固定的组成和性质(固定的熔沸点等)
(3)特殊名称的纯净物:胆矾、纯碱、酒精、干冰、醋酸、硫酸、硝酸
混合物:
(1)定义:由几种不同单质或者化合物组成的物质
(2)特点:无固定的组成和性质,随混合物中各成分含量不同而改变
八、分散系及其分类
① 溶液是一种或几种物质分散到另一种物质里, 形成的均一、稳定的混合物
② 乳浊液是液体小液滴分散到液体里形成的混合物
③ 悬浊液是固体小颗粒悬浮于液体里形成的混合物
CuSO4溶液
油水混合物
泥浆水
比较它们的异同点
八、分散系及其分类
1. 分散系的概念:一种(或多种)物质以粒子形式分散到另一种(或多种)物质中所形成的混合物
2. 组成
分散质:被分散的物质
分散剂:分散其他物质的物质
分别指出CuSO4溶液、油水混合物、泥沙水、碘酒中的分散质和分散剂
八、分散系及其分类
分散质
分散剂
气
液
固
气
液
固
分散质 分散剂 实例
气 气
液
固
气 液
液
固
气 固
液
固
空气
云、雾
烟
气泡
牛奶
泥沙水
泡沫塑料
珍珠
合金
八、分散系及其分类
3. 分散系的分类:根据分散质粒子的直径大小分类
分散系
溶液:分散质粒子直径<1 nm
胶体:分散质粒子直径为1~100 nm
浊液:分散质粒子直径>100 nm
注:1 nm = 10-9 m 1 μm = 10-6 m 1 mm = 10-3 m
八、分散系及其分类
分散系 浊液 胶体 溶液
粒子直径 >100nm 1~100nm <1nm
举例 泥浆水、油水 Fe(OH)3胶体 NaCl溶液
外观特征
滤纸
半透膜
4. 溶液、胶体、浊液的比较:
不均一、不稳定、不透明
均一、较稳定、透明
均一、稳定、透明
透不过
可透过
可透过
透不过
透不过
可透过
渗析
八、分散系及其分类
5. 胶体的分类:按分散剂的不同分类
分散剂
液溶胶:分散剂为液体,如:Fe(OH)3胶体、淀粉溶液、蛋白质溶液、血液、豆浆、墨水等
气溶胶:分散剂为气体,如:烟、雾、云等
固溶胶:分散剂为固体,如:有色玻璃、合金等
八、分散系及其分类
6. 胶体的制备:
取40 mL蒸馏水于烧杯,加热至沸腾,向沸水中逐滴加入5~6滴FeCl3饱和溶液。继续煮沸至液体呈红褐色,停止加热。
7. 溶液与胶体的鉴别:
CuSO4溶液
Fe(OH)3胶体
丁达尔效应:当光束通过胶体时,在垂直光束的方向可以看到一条光亮的通路
应用:鉴别溶液和胶体
FeCl3+3H2O Fe(OH)3(胶体)+3HCl
八、分散系及其分类
八、分散系及其分类
8. 胶体的应用:
Fe(OH)3、Al(OH)3等胶体具有吸附性:
胶体表面积大、吸附能力强,可吸附水中的悬浮颗粒并沉降,具有净水作用
如:自来水厂常用明矾或含铁化合物作净水剂,因为它们在水中可生成 Fe(OH)3 胶体或 Al(OH)3 胶体
九、电解质
物质 NaCl固体 KNO3固体 蒸馏水 NaCl溶液 KNO3溶液
小灯泡
是否导电
不亮
不亮
不亮
亮
亮
不导电
不导电
不导电
导电
导电
九、电解质
NaCl固体为什么不导电?
虽然有离子,但不能自由移动
金属、石墨导电的原因:
电子能在电场的作用下定向移动,形成电流
九、电解质
为什么NaCl、KNO3等电解质,在干燥时不导电,而溶于水后却能导电?
电流是由带电荷的粒子按一定方向移动而形成的
九、电解质
电解熔融NaCl
只有在水溶液中才能导电吗?
升温,加快离子运动,克服离子间的相互作用,产生自由移动的离子
九、电解质
所有物质溶于水或受热熔化都能得到自由移动的离子吗?
九、电解质
电解质:在水溶液中或熔融状态下能够导电的化合物
非电解质:在水溶液中和熔融状态下都不导电的化合物
酸、碱、盐、活泼金属氧化物、水等,
如:HCl、H2SO4、NaOH、Ca(OH)2、NaCl、KNO3、Na2O
大多数有机物、非金属氧化物等,
如:酒精、蔗糖、CO2、SO2、NH3
九、电解质
物质
混合物
纯净物
单质
化合物
电解质
非电解质
既不是电解质,也不是非电解质
九、电解质
下列物质中:①氢氧化钠固体 ②铜 ③氢氧化钠溶液 ④盐酸 ⑤熔融的碳酸钾 ⑥硫酸钡 ⑦蔗糖 ⑧二氧化碳 ⑨氨气
属于电解质的是哪些?属于非电解质的是哪些?
电解质:①⑤⑥ 非电解质:⑦⑧⑨
注意:
1. 能导电的物质不一定是电解质;
2. 电解质的导电需要条件:水溶液或熔融状态;
3. 电解质导电必须是化合物本身的导电作用。
九、电解质
电离:电解质溶于水或受热熔化时,形成自由移动的离子的过程
如何用化学用语表示物质的电离过程?
NaCl = Na+ + Cl-
化学式
电离
离子符号(代表水合离子)
电离方程式:
① 阴阳离子拆开写,但原子团不能拆,如:OH-、CO32-、SO42-、NO3-等
② 弱酸的酸式根不能拆,如:HCO3-、HSO3-等
③ 原子个数守恒,电子守恒
