5.1.2《质量守恒定律》(课件17页)-2022—2023学年九年级化学人教版上册
文档属性
| 名称 | 5.1.2《质量守恒定律》(课件17页)-2022—2023学年九年级化学人教版上册 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-21 10:14:52 | ||
图片预览





文档简介
(共17张PPT)
课题1 质量守恒定律
第2课时 化学方程式
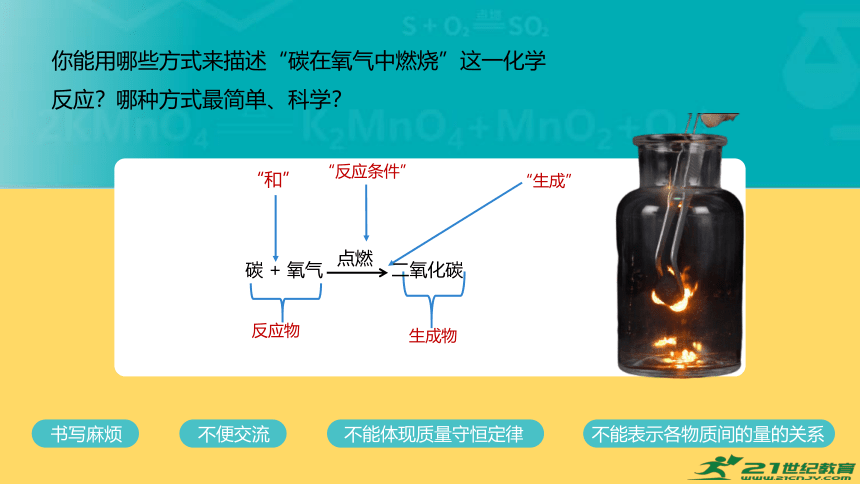
你能用哪些方式来描述“碳在氧气中燃烧”这一化学反应?哪种方式最简单、科学?
1.碳在氧气中燃烧生成二氧化碳
2.碳+氧气 二氧化碳
点燃
3.C+O2 CO2
点燃
语言表达
文字表达式
化学方程式
你能用哪些方式来描述“碳在氧气中燃烧”这一化学反应?哪种方式最简单、科学?
“和”
“反应条件”
“生成”
反应物
生成物
碳 + 氧气 二氧化碳
点燃
书写麻烦
不便交流
不能体现质量守恒定律
不能表示各物质间的量的关系
化学方程式
定 义
用化学式来表示化学反应的式子
定 义
①表示反应物、生成物、反应条件
②表示各物质之间的质量比
12 32 44
C + O2 CO2
点燃
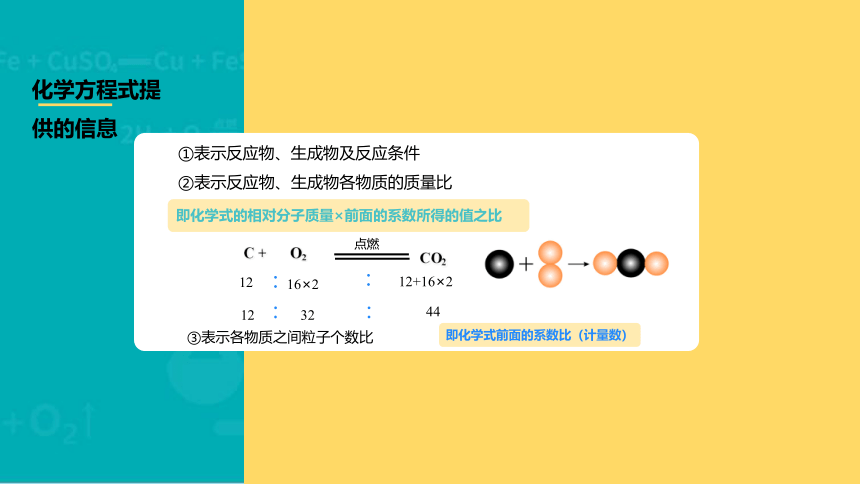
化学方程式提供的信息
①表示反应物、生成物及反应条件
②表示反应物、生成物各物质的质量比
即化学式的相对分子质量×前面的系数所得的值之比
C +
O2
点燃
CO2
:
12
16×2
32
44
:
:
:
12+16×2
12
即化学式前面的系数比(计量数)
③表示各物质之间粒子个数比
化学方程式的读法
C +
O2
点燃
CO2
①直接读出反应物,生成物的名称和反应条件
+读“和、与、跟”
===读“生成”
碳和氧气在点燃条件下反应,生成二氧化碳
②读出反应物和生成物之间各物质的质量比
每多少份质量×××物质与多少份质量
每12份质量的碳与32份质量的氧气反应,点燃生成44份质量的二氧化碳。
③读出反应物和生成物的各粒子个数比
粒子个数比即化学式前面的化学计量数之比
每1个碳原子与1个氧分子反应,生成1个二氧化碳分子
化学方程式的读法
S +
O2
点燃
SO2
硫和氧气点燃生成二氧化硫
每一个硫原子和一个氧分子反应生成一个二氧化硫分子
每32份质量的硫和32份质量的氧气反应生成64份质量的二氧化硫
宏 观
微 观
质 量
化学方程式的读法
S +
O2
点燃
SO2
硫和氧气点燃生成二氧化硫
每一个硫原子和一个氧分子反应生成一个二氧化硫分子
每32份质量的硫和32份质量的氧气反应生成64份质量的二氧化硫
宏 观
微 观
质 量
化学方程式的读法
氧化铜和氢气加热生成铜和水
一个氧化铜分子和一个氢分子加热生成一个铜原子和一个水分子
每80份质量的氧化铜和2份质量的氢气加热生成64份质量的铜和18份质量的水
宏 观
微 观
质 量
CuO+H2 Cu+H2O
△
质量守恒定律的应用
1.推断物质的组成元素
依据:化学反应前后元素的种类和质量不变
例1 某物质M燃烧后生成了水和二氧化碳,则它肯定含有哪些元素?( )
A. C 、H B. C C. C 、H、 O D. H 、O
A
质量守恒定律的应用
1.推断物质的组成元素
依据:化学反应前后元素的种类和质量不变
1. 某有机物在9.6 g氧气中恰好完全燃烧,生成8.8 g CO2和5.4 g H2O,下列说法正确的是( )
A. 该有机物只含碳、氢两种元素
B. 该有机物中一定含有碳、氢元素,可能含有氧元素
C. 该有机物中一定含有碳、氢、氧三种元素
D. 无法确定
C
质量守恒定律的应用
2.推断物质的化学式
依据:化学反应前后原子的种类和数目不变
例2. 铜锈主要成分是Cu2(OH)2CO3。加热分解的化学方程式为Cu2(OH)2CO3 =2X+H2O+CO2↑,其中X的化学式是( )
A. Ca B. CuO
C. Cu(OH)2 D. CuCO3
B
质量守恒定律的应用
2.推断物质的化学式
依据:化学反应前后原子的种类和数目不变
2.“神舟号”系列火箭成功发射,标志着我国载人航天技术达到了世界先进水平,化学学科在其中也作出了巨大贡献,其中火箭使用的一种燃料是偏二甲肼,其化学式为C2H8N2,燃烧时发生如下反应:
C2H8N2+2X = 2CO2+4H2O+3N2,则X的化学式是( )
A. NO B. NO2 C. N2O D. N2O4
D
质量守恒定律的应用
3.有关密闭容器中表格数据处理
例 3 在密闭容器中放入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,一段时间后,测得相关数据如图所示。下列说法正确的是( )
A. x=3.1
B. 该反应中甲、丁的质量变化比为14∶85
C. 该反应属于置换反应
D. 乙一定是该反应的催化剂
B
质量守恒定律的应用
3.有关密闭容器中表格数据处理
表格型质量守恒定律试题的解决方法
(1)某一物质质量的计算:根据反应前后物质的质量总和不变列出等式,求出该物质的质量。
(2)反应物、生成物、催化剂的判定:①反应后质量增大——生成物;②反应后质量减小——反应物;③反应前后质量不变——可能是催化剂,也可能是未参与反应的杂质。
(3)设出参加反应的各物质的化学计量数,再根据化学方程式列出各物质间的质量关系,进而求出化学计量数,写出化学方程式。
质量守恒定律的应用
3.有关密闭容器中表格数据处理
3. 在密闭容器中放入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,一段时间后,测得反应前后各物质的质量分数如图。下列说法不正确的是( )
A. x=16%
B. 乙物质可能是催化剂
C. 该反应是分解反应
D. 参加反应的丙和丁的质量比为5∶8
C
质量守恒定律的应用
4.微观反应示意图
例4 科研人员制备了一种纳米催化剂,二氧化碳和水在其表面发生反应的微观示意图如图,下列说法正确的是( )
A.两种反应物的分子个数比为1:1
B.生成物 的化学式是CH4O
C.催化剂的化学性质在反应前后发生变化
D.原子的种类和数目在反应前后都发生变化
B
课题1 质量守恒定律
第2课时 化学方程式
你能用哪些方式来描述“碳在氧气中燃烧”这一化学反应?哪种方式最简单、科学?
1.碳在氧气中燃烧生成二氧化碳
2.碳+氧气 二氧化碳
点燃
3.C+O2 CO2
点燃
语言表达
文字表达式
化学方程式
你能用哪些方式来描述“碳在氧气中燃烧”这一化学反应?哪种方式最简单、科学?
“和”
“反应条件”
“生成”
反应物
生成物
碳 + 氧气 二氧化碳
点燃
书写麻烦
不便交流
不能体现质量守恒定律
不能表示各物质间的量的关系
化学方程式
定 义
用化学式来表示化学反应的式子
定 义
①表示反应物、生成物、反应条件
②表示各物质之间的质量比
12 32 44
C + O2 CO2
点燃
化学方程式提供的信息
①表示反应物、生成物及反应条件
②表示反应物、生成物各物质的质量比
即化学式的相对分子质量×前面的系数所得的值之比
C +
O2
点燃
CO2
:
12
16×2
32
44
:
:
:
12+16×2
12
即化学式前面的系数比(计量数)
③表示各物质之间粒子个数比
化学方程式的读法
C +
O2
点燃
CO2
①直接读出反应物,生成物的名称和反应条件
+读“和、与、跟”
===读“生成”
碳和氧气在点燃条件下反应,生成二氧化碳
②读出反应物和生成物之间各物质的质量比
每多少份质量×××物质与多少份质量
每12份质量的碳与32份质量的氧气反应,点燃生成44份质量的二氧化碳。
③读出反应物和生成物的各粒子个数比
粒子个数比即化学式前面的化学计量数之比
每1个碳原子与1个氧分子反应,生成1个二氧化碳分子
化学方程式的读法
S +
O2
点燃
SO2
硫和氧气点燃生成二氧化硫
每一个硫原子和一个氧分子反应生成一个二氧化硫分子
每32份质量的硫和32份质量的氧气反应生成64份质量的二氧化硫
宏 观
微 观
质 量
化学方程式的读法
S +
O2
点燃
SO2
硫和氧气点燃生成二氧化硫
每一个硫原子和一个氧分子反应生成一个二氧化硫分子
每32份质量的硫和32份质量的氧气反应生成64份质量的二氧化硫
宏 观
微 观
质 量
化学方程式的读法
氧化铜和氢气加热生成铜和水
一个氧化铜分子和一个氢分子加热生成一个铜原子和一个水分子
每80份质量的氧化铜和2份质量的氢气加热生成64份质量的铜和18份质量的水
宏 观
微 观
质 量
CuO+H2 Cu+H2O
△
质量守恒定律的应用
1.推断物质的组成元素
依据:化学反应前后元素的种类和质量不变
例1 某物质M燃烧后生成了水和二氧化碳,则它肯定含有哪些元素?( )
A. C 、H B. C C. C 、H、 O D. H 、O
A
质量守恒定律的应用
1.推断物质的组成元素
依据:化学反应前后元素的种类和质量不变
1. 某有机物在9.6 g氧气中恰好完全燃烧,生成8.8 g CO2和5.4 g H2O,下列说法正确的是( )
A. 该有机物只含碳、氢两种元素
B. 该有机物中一定含有碳、氢元素,可能含有氧元素
C. 该有机物中一定含有碳、氢、氧三种元素
D. 无法确定
C
质量守恒定律的应用
2.推断物质的化学式
依据:化学反应前后原子的种类和数目不变
例2. 铜锈主要成分是Cu2(OH)2CO3。加热分解的化学方程式为Cu2(OH)2CO3 =2X+H2O+CO2↑,其中X的化学式是( )
A. Ca B. CuO
C. Cu(OH)2 D. CuCO3
B
质量守恒定律的应用
2.推断物质的化学式
依据:化学反应前后原子的种类和数目不变
2.“神舟号”系列火箭成功发射,标志着我国载人航天技术达到了世界先进水平,化学学科在其中也作出了巨大贡献,其中火箭使用的一种燃料是偏二甲肼,其化学式为C2H8N2,燃烧时发生如下反应:
C2H8N2+2X = 2CO2+4H2O+3N2,则X的化学式是( )
A. NO B. NO2 C. N2O D. N2O4
D
质量守恒定律的应用
3.有关密闭容器中表格数据处理
例 3 在密闭容器中放入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,一段时间后,测得相关数据如图所示。下列说法正确的是( )
A. x=3.1
B. 该反应中甲、丁的质量变化比为14∶85
C. 该反应属于置换反应
D. 乙一定是该反应的催化剂
B
质量守恒定律的应用
3.有关密闭容器中表格数据处理
表格型质量守恒定律试题的解决方法
(1)某一物质质量的计算:根据反应前后物质的质量总和不变列出等式,求出该物质的质量。
(2)反应物、生成物、催化剂的判定:①反应后质量增大——生成物;②反应后质量减小——反应物;③反应前后质量不变——可能是催化剂,也可能是未参与反应的杂质。
(3)设出参加反应的各物质的化学计量数,再根据化学方程式列出各物质间的质量关系,进而求出化学计量数,写出化学方程式。
质量守恒定律的应用
3.有关密闭容器中表格数据处理
3. 在密闭容器中放入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,一段时间后,测得反应前后各物质的质量分数如图。下列说法不正确的是( )
A. x=16%
B. 乙物质可能是催化剂
C. 该反应是分解反应
D. 参加反应的丙和丁的质量比为5∶8
C
质量守恒定律的应用
4.微观反应示意图
例4 科研人员制备了一种纳米催化剂,二氧化碳和水在其表面发生反应的微观示意图如图,下列说法正确的是( )
A.两种反应物的分子个数比为1:1
B.生成物 的化学式是CH4O
C.催化剂的化学性质在反应前后发生变化
D.原子的种类和数目在反应前后都发生变化
B
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
