第三章 铁 金属材料 第一节 铁及其化合物 第2课时 铁盐、亚铁盐的性质与转化 课时练(含答案)
文档属性
| 名称 | 第三章 铁 金属材料 第一节 铁及其化合物 第2课时 铁盐、亚铁盐的性质与转化 课时练(含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 175.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-19 09:24:51 | ||
图片预览

文档简介
第2课时 铁盐、亚铁盐的性质与转化
1. 下列物质能通过化合反应直接制得的是( )
①FeCl2 ②FeCl3 ③Fe(OH)3 ④Fe3O4
A. 只有①②③ B. 只有②③
C. 只有①③④ D. 全部
2. 下列离子方程式中,正确的是( )
A. 铁与盐酸反应:2Fe+6H+===2Fe3++3H2↑
B. H2O2溶液与氯化亚铁溶液反应:2Fe2++H2O2+2H+===2Fe3++2H2O
C. 氯化铁溶液与铁反应:Fe3++Fe===2Fe2+
D. 氯化铁溶液与氨水溶液反应:Fe3++3OH-===Fe(OH)3↓
3. 铁的氧化物极为复杂。为测定一种铁的氧化物样本X的化学式,实验过程如下:
根据实验结果,该氧化物X的化学式为( )
A. Fe2O3 B. Fe3O4 C. Fe4O5 D. Fe5O7
4. (2022·石嘴山第三中学高一期末)为了验证Fe3+的性质,某化学兴趣小组设计了如图所示的一组实验,其中实验方案设计错误的是( )
A. 只有④ B. 只有③ C. ③和④均错 D. 全部错误
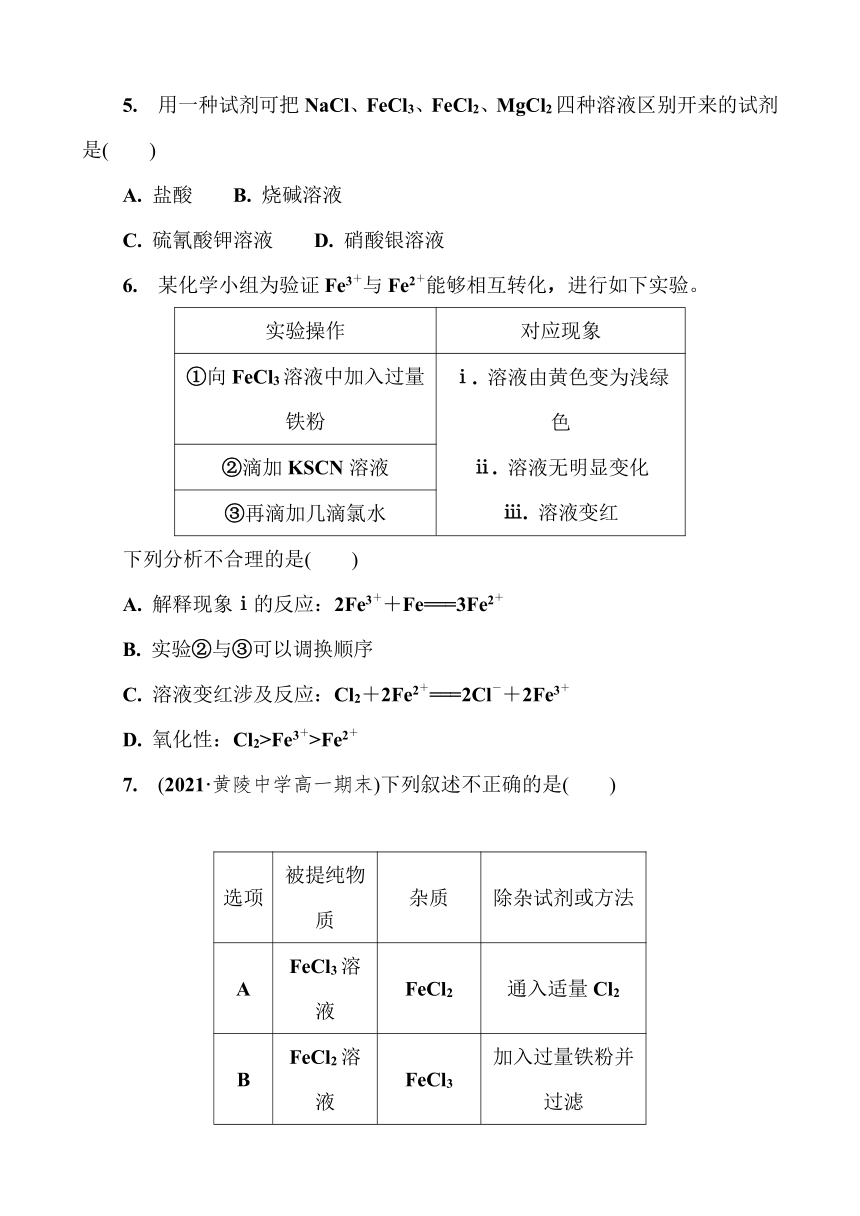
5. 用一种试剂可把NaCl、FeCl3、FeCl2、MgCl2四种溶液区别开来的试剂是( )
A. 盐酸 B. 烧碱溶液
C. 硫氰酸钾溶液 D. 硝酸银溶液
6. 某化学小组为验证Fe3+与Fe2+能够相互转化,进行如下实验。
实验操作 对应现象
①向FeCl3溶液中加入过量铁粉 ⅰ. 溶液由黄色变为浅绿色ⅱ. 溶液无明显变化ⅲ. 溶液变红
②滴加KSCN溶液
③再滴加几滴氯水
下列分析不合理的是( )
A. 解释现象ⅰ的反应:2Fe3++Fe===3Fe2+
B. 实验②与③可以调换顺序
C. 溶液变红涉及反应:Cl2+2Fe2+===2Cl-+2Fe3+
D. 氧化性:Cl2>Fe3+>Fe2+
7. (2021·黄陵中学高一期末)下列叙述不正确的是( )
选项 被提纯物质 杂质 除杂试剂或方法
A FeCl3溶液 FeCl2 通入适量Cl2
B FeCl2溶液 FeCl3 加入过量铁粉并过滤
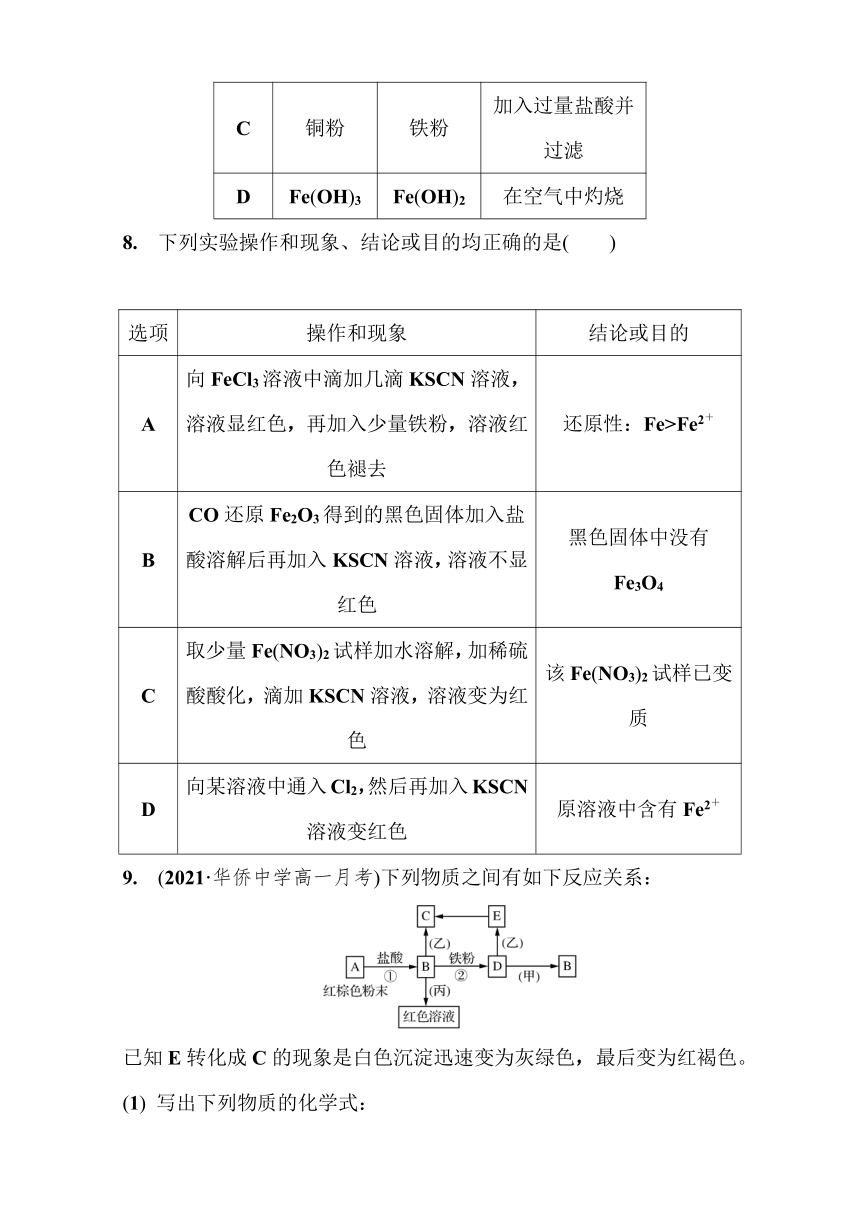
C 铜粉 铁粉 加入过量盐酸并过滤
D Fe(OH)3 Fe(OH)2 在空气中灼烧
8. 下列实验操作和现象、结论或目的均正确的是( )
选项 操作和现象 结论或目的
A 向FeCl3溶液中滴加几滴KSCN溶液,溶液显红色,再加入少量铁粉,溶液红色褪去 还原性:Fe>Fe2+
B CO还原Fe2O3得到的黑色固体加入盐酸溶解后再加入KSCN溶液,溶液不显红色 黑色固体中没有Fe3O4
C 取少量Fe(NO3)2试样加水溶解,加稀硫酸酸化,滴加KSCN溶液,溶液变为红色 该Fe(NO3)2试样已变质
D 向某溶液中通入Cl2,然后再加入KSCN溶液变红色 原溶液中含有Fe2+
9. (2021·华侨中学高一月考)下列物质之间有如下反应关系:
已知E转化成C的现象是白色沉淀迅速变为灰绿色,最后变为红褐色。
(1) 写出下列物质的化学式:
A________,B________,D________,甲________,乙________,丙________。
(2) 写出E→C反应的化学方程式:____________________________。
10. Ⅰ. 铁是生产、生活及生命中的重要元素。
(1) 血红蛋白(Hb)中的铁元素呈正二价,能与O2分子结合成氧合血红蛋白(HbO)从而有输送氧的能力。NaNO2因具有氧化性能使血红蛋白丧失与O2结合的能力。药品美蓝是其有效的解毒剂,解毒时美蓝发生________(填“氧化”或“还原”)反应。
(2) 现有一瓶放置一段时间的某浓度的FeCl2溶液,请设计实验检验其是否含有Fe3+:________________________________________________________。
(3) 普通铁粉与水蒸气在高温下反应生成铁的某种氧化物和氢气,该氧化物和氢气在高温下发生逆反应得到“引火铁”。若一定量的普通铁粉和水蒸气在高温下反应生成44.8 L H2(已换算到标准状况下),则转移的电子数目为________;“引火铁”是一种极细的铁粉,它在空气中可以自燃,其原因是____________________________________________________________。
Ⅱ. 化合物M是某种具有磁学性质的新型电子材料的主要成分,由两种元素组成。为了研究其组成,设计如下实验:
气体甲可使湿润红色石蕊试纸变蓝。请回答:
(4) M的化学式为________,气体甲的化学式为________。
(5) 白色沉淀乙在空气中变成红褐色沉淀丙的原因是________________________(用化学方程式表示)。
(6) 高温条件下,丁与甲反应生成两种单质和水,该反应的化学方程式为______________________________________________________________。
11. (2021·乌鲁木齐第四中学高一期末)同学们用如下实验探究Fe2+、Fe3+的性质。请回答下列问题:
(1) 分别取一定量氯化铁、氯化亚铁固体,均配制成0.1 mol·L-1的溶液。在FeCl2溶液中需加入少量铁屑,其目的是____________________________。
(2) 甲同学取2 mL FeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为____________________。
(3) 乙同学认为甲同学的实验不够严谨,该同学在2 mL FeCl2溶液中先加入0.5 mL煤油,再于液面下依次加入1滴KSCN溶液和几滴氯水,溶液变红,煤油的作用是__________________。
(4) 丙同学取10 mL 0.1mol·L-1 KI溶液,加入6 mL 0.1 mol·L-1 FeCl3溶液混合。取2 mL此溶液于试管中,加入1 mL CCl4充分振荡、静置,CCl4层显紫色,发生反应的离子方程式为________________________。
(5) 丁同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为____________________。
第2课时 铁盐、亚铁盐的性质与转化
1. D 2. B 3. D 4. C 5. B 6. B 7. D 8. A
9. (1) Fe2O3 FeCl3 FeCl2 Cl2(合理即可) NaOH(或KOH等) KSCN
(2) 4Fe(OH)2+O2+2H2O===4Fe(OH)3
10. (1) 氧化
(2) 取少量待测液于试管中,滴加KSCN溶液,若溶液呈红色,说明原溶液中有Fe3+,反之则没有
(3) 4×6.02×1023 “引火铁”表面积很大,加快了与氧气的反应速率
(4) Fe4N NH3
(5) 4Fe(OH)2+O2+2H2O===4Fe(OH)3
(6) Fe2O3+2NH32Fe+N2+3H2O
11. (1) 防止Fe2+被氧化
(2) 2Fe2++Cl2===2Fe3++2Cl-
(3) 隔绝空气(排除氧气对实验的影响)
(4) 2Fe3++2I-===2Fe2++I2
(5) H2O2+2Fe2++2H+===2Fe3++2H2O
1. 下列物质能通过化合反应直接制得的是( )
①FeCl2 ②FeCl3 ③Fe(OH)3 ④Fe3O4
A. 只有①②③ B. 只有②③
C. 只有①③④ D. 全部
2. 下列离子方程式中,正确的是( )
A. 铁与盐酸反应:2Fe+6H+===2Fe3++3H2↑
B. H2O2溶液与氯化亚铁溶液反应:2Fe2++H2O2+2H+===2Fe3++2H2O
C. 氯化铁溶液与铁反应:Fe3++Fe===2Fe2+
D. 氯化铁溶液与氨水溶液反应:Fe3++3OH-===Fe(OH)3↓
3. 铁的氧化物极为复杂。为测定一种铁的氧化物样本X的化学式,实验过程如下:
根据实验结果,该氧化物X的化学式为( )
A. Fe2O3 B. Fe3O4 C. Fe4O5 D. Fe5O7
4. (2022·石嘴山第三中学高一期末)为了验证Fe3+的性质,某化学兴趣小组设计了如图所示的一组实验,其中实验方案设计错误的是( )
A. 只有④ B. 只有③ C. ③和④均错 D. 全部错误
5. 用一种试剂可把NaCl、FeCl3、FeCl2、MgCl2四种溶液区别开来的试剂是( )
A. 盐酸 B. 烧碱溶液
C. 硫氰酸钾溶液 D. 硝酸银溶液
6. 某化学小组为验证Fe3+与Fe2+能够相互转化,进行如下实验。
实验操作 对应现象
①向FeCl3溶液中加入过量铁粉 ⅰ. 溶液由黄色变为浅绿色ⅱ. 溶液无明显变化ⅲ. 溶液变红
②滴加KSCN溶液
③再滴加几滴氯水
下列分析不合理的是( )
A. 解释现象ⅰ的反应:2Fe3++Fe===3Fe2+
B. 实验②与③可以调换顺序
C. 溶液变红涉及反应:Cl2+2Fe2+===2Cl-+2Fe3+
D. 氧化性:Cl2>Fe3+>Fe2+
7. (2021·黄陵中学高一期末)下列叙述不正确的是( )
选项 被提纯物质 杂质 除杂试剂或方法
A FeCl3溶液 FeCl2 通入适量Cl2
B FeCl2溶液 FeCl3 加入过量铁粉并过滤
C 铜粉 铁粉 加入过量盐酸并过滤
D Fe(OH)3 Fe(OH)2 在空气中灼烧
8. 下列实验操作和现象、结论或目的均正确的是( )
选项 操作和现象 结论或目的
A 向FeCl3溶液中滴加几滴KSCN溶液,溶液显红色,再加入少量铁粉,溶液红色褪去 还原性:Fe>Fe2+
B CO还原Fe2O3得到的黑色固体加入盐酸溶解后再加入KSCN溶液,溶液不显红色 黑色固体中没有Fe3O4
C 取少量Fe(NO3)2试样加水溶解,加稀硫酸酸化,滴加KSCN溶液,溶液变为红色 该Fe(NO3)2试样已变质
D 向某溶液中通入Cl2,然后再加入KSCN溶液变红色 原溶液中含有Fe2+
9. (2021·华侨中学高一月考)下列物质之间有如下反应关系:
已知E转化成C的现象是白色沉淀迅速变为灰绿色,最后变为红褐色。
(1) 写出下列物质的化学式:
A________,B________,D________,甲________,乙________,丙________。
(2) 写出E→C反应的化学方程式:____________________________。
10. Ⅰ. 铁是生产、生活及生命中的重要元素。
(1) 血红蛋白(Hb)中的铁元素呈正二价,能与O2分子结合成氧合血红蛋白(HbO)从而有输送氧的能力。NaNO2因具有氧化性能使血红蛋白丧失与O2结合的能力。药品美蓝是其有效的解毒剂,解毒时美蓝发生________(填“氧化”或“还原”)反应。
(2) 现有一瓶放置一段时间的某浓度的FeCl2溶液,请设计实验检验其是否含有Fe3+:________________________________________________________。
(3) 普通铁粉与水蒸气在高温下反应生成铁的某种氧化物和氢气,该氧化物和氢气在高温下发生逆反应得到“引火铁”。若一定量的普通铁粉和水蒸气在高温下反应生成44.8 L H2(已换算到标准状况下),则转移的电子数目为________;“引火铁”是一种极细的铁粉,它在空气中可以自燃,其原因是____________________________________________________________。
Ⅱ. 化合物M是某种具有磁学性质的新型电子材料的主要成分,由两种元素组成。为了研究其组成,设计如下实验:
气体甲可使湿润红色石蕊试纸变蓝。请回答:
(4) M的化学式为________,气体甲的化学式为________。
(5) 白色沉淀乙在空气中变成红褐色沉淀丙的原因是________________________(用化学方程式表示)。
(6) 高温条件下,丁与甲反应生成两种单质和水,该反应的化学方程式为______________________________________________________________。
11. (2021·乌鲁木齐第四中学高一期末)同学们用如下实验探究Fe2+、Fe3+的性质。请回答下列问题:
(1) 分别取一定量氯化铁、氯化亚铁固体,均配制成0.1 mol·L-1的溶液。在FeCl2溶液中需加入少量铁屑,其目的是____________________________。
(2) 甲同学取2 mL FeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为____________________。
(3) 乙同学认为甲同学的实验不够严谨,该同学在2 mL FeCl2溶液中先加入0.5 mL煤油,再于液面下依次加入1滴KSCN溶液和几滴氯水,溶液变红,煤油的作用是__________________。
(4) 丙同学取10 mL 0.1mol·L-1 KI溶液,加入6 mL 0.1 mol·L-1 FeCl3溶液混合。取2 mL此溶液于试管中,加入1 mL CCl4充分振荡、静置,CCl4层显紫色,发生反应的离子方程式为________________________。
(5) 丁同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为____________________。
第2课时 铁盐、亚铁盐的性质与转化
1. D 2. B 3. D 4. C 5. B 6. B 7. D 8. A
9. (1) Fe2O3 FeCl3 FeCl2 Cl2(合理即可) NaOH(或KOH等) KSCN
(2) 4Fe(OH)2+O2+2H2O===4Fe(OH)3
10. (1) 氧化
(2) 取少量待测液于试管中,滴加KSCN溶液,若溶液呈红色,说明原溶液中有Fe3+,反之则没有
(3) 4×6.02×1023 “引火铁”表面积很大,加快了与氧气的反应速率
(4) Fe4N NH3
(5) 4Fe(OH)2+O2+2H2O===4Fe(OH)3
(6) Fe2O3+2NH32Fe+N2+3H2O
11. (1) 防止Fe2+被氧化
(2) 2Fe2++Cl2===2Fe3++2Cl-
(3) 隔绝空气(排除氧气对实验的影响)
(4) 2Fe3++2I-===2Fe2++I2
(5) H2O2+2Fe2++2H+===2Fe3++2H2O
