化学人教版(2019)必修第一册3.1铁及其化合物(共21张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册3.1铁及其化合物(共21张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 2.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-21 13:59:22 | ||
图片预览






文档简介
(共21张PPT)
第1节 铁及其化合物
铁
铁的氧化物
铁的氢氧化物
铁盐和亚铁盐
导入
铁在自然界中主要是以+2价和+3价化合物的形态存在,如赤铁矿、磁铁矿。
人体中的铁含量为4~5g,是人体必需微量元素中含量最多的一种,也是化合物形式。
目前发现最早的人工冶铁制品是甘肃灵台出图的春秋初年秦国的短柄铁剑。
丹霞地貌的岩层因Fe2O3而呈红色
战国时期最大的铁器——长方形铁炉
物理性质:
①有延展性、导热、导电
②能被磁铁吸引。
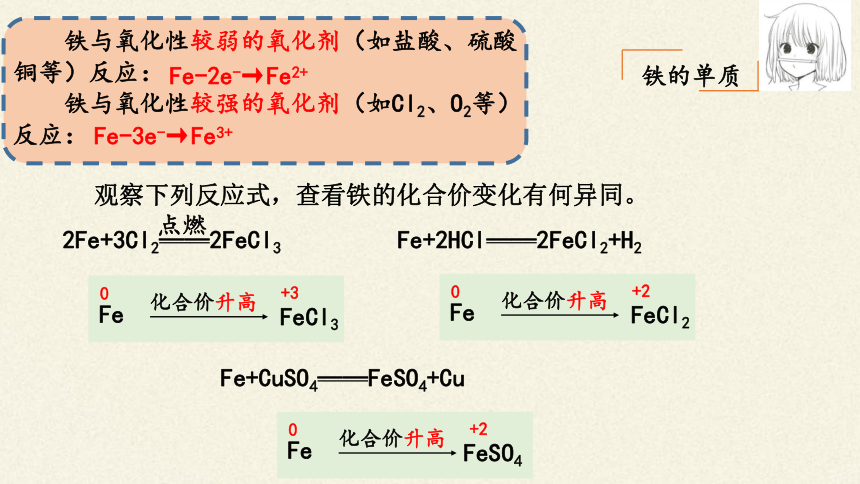
铁的单质
观察下列反应式,查看铁的化合价变化有何异同。
2Fe+3Cl2——2FeCl3
点燃
Fe
FeCl3
化合价升高
0
+3
Fe+2HCl——2FeCl2+H2
Fe
FeCl2
化合价升高
0
+2
Fe+CuSO4——FeSO4+Cu
Fe
FeSO4
化合价升高
0
+2
铁与氧化性较弱的氧化剂(如盐酸、硫酸铜等)反应:
铁与氧化性较强的氧化剂(如Cl2、O2等)反应:
Fe-2e-→Fe2+
Fe-3e-→Fe3+
在钢铁厂的生产中,炽热的铁水或钢水注入模具之前,模具必须进行充分的干燥处理,否则会有嘶嘶响声。
思考·讨论
钢水注入干燥的模具
红热的铁
遇到
气体
水
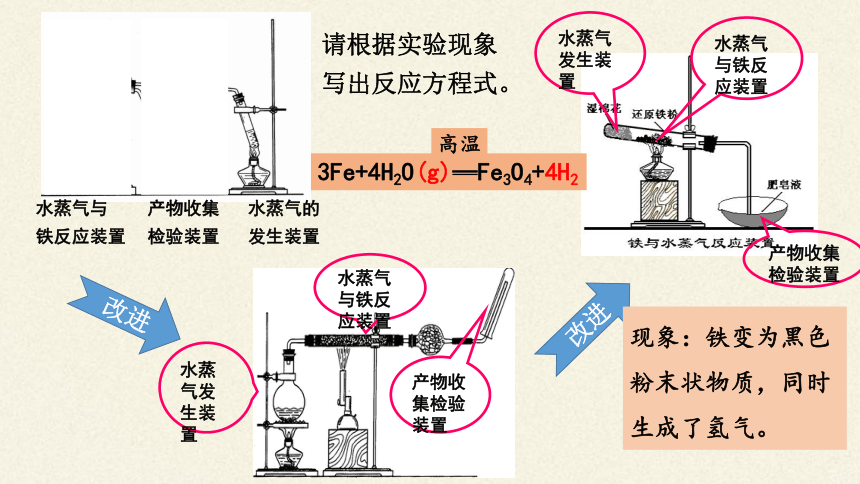
水蒸气发生装置
水蒸气与铁粉反应装置
产物的检验(收集)装置
可是常温下铁与水是不反应的,已知钢水温度
大概1500℃,说明铁与水在什么条件下才能反应?
如何设计实验验证?
水蒸气
发生装置
水蒸气与铁反应装置
产物收集检验装置
水蒸气的
发生装置
水蒸气与
铁反应装置
产物收集
检验装置
水蒸气发生装置
水蒸气与铁反应装置
产物收集检验装置
改进
改进
现象:铁变为黑色粉末状物质,同时生成了氢气。
请根据实验现象
写出反应方程式。
3Fe+4H2O(g)—Fe3O4+4H2
高温
小结:
铁遇弱氧化剂(盐酸、硫酸铜):Fe-2e-→Fe2+
铁遇强氧化剂(Cl2、O2):Fe-3e-→Fe3+
铁与水蒸气:Fe→Fe3O4
名称
化学式
化合价
颜色
俗称
溶解性
与盐酸反应
氧化亚铁
氧化铁
四氧化三铁
FeO
Fe3O4
Fe2O3
+2
+3
+2 、+3
黑色
红棕色
黑色
均不溶于水 ,也不和水反应
----------
铁红
磁性氧化铁
FeO + 2H+=
Fe2+ + H2O
Fe2O3 + 6H+ = 2Fe3+ + 3H2O
黄色
浅绿色
铁的氧化物
FeO和Fe2O3都是碱性氧化物
作业布置
南方:
大本:P50-53
小本:P22
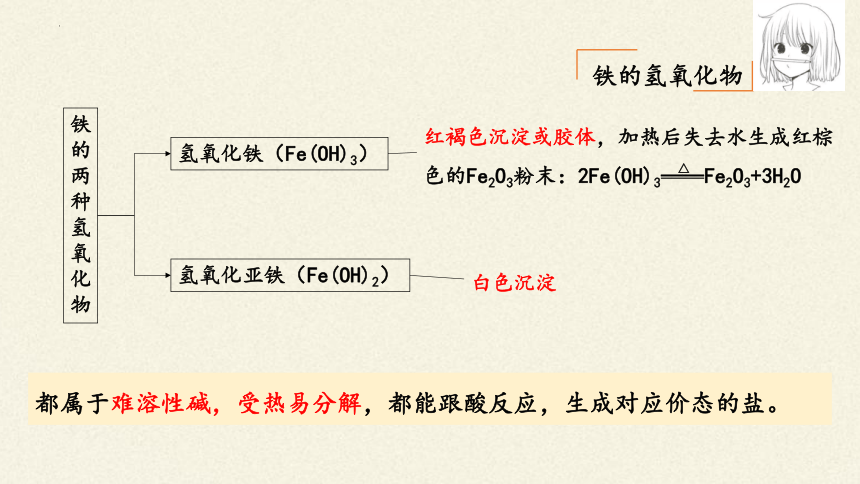
都属于难溶性碱,受热易分解,都能跟酸反应,生成对应价态的盐。
铁的氢氧化物
铁的两种氢氧化物
氢氧化铁(Fe(OH)3)
氢氧化亚铁(Fe(OH)2)
红褐色沉淀或胶体,加热后失去水生成红棕色的Fe2O3粉末:2Fe(OH)3——Fe2O3+3H2O
白色沉淀
△
FeCl3溶液 FeSO4溶液
加NaOH溶液
离子 方程式
Fe2+ +2OH- = Fe(OH)2
Fe3+ +3OH- = Fe(OH)3
白色
沉淀
灰绿色
沉淀
红褐色
沉淀?
如何制备Fe(OH)2和Fe(OH)3
Fe(OH)2
Fe(OH)3
4 Fe(OH)2 + O2 + 2 H2O == 4 Fe(OH)3
极易被氧化
可溶性铁盐/亚铁盐
+
可溶性碱
操作
新制FeSO4溶液
油
NaOH溶液
采取的措施:
(1)用新配制FeSO4溶液(方法)
(2)用煮沸过水(除O2)配制溶液
(3)液面用油封
(4)滴管伸到液面以下
......
如何制备Fe(OH)2和Fe(OH)3
如何得到Fe(OH)2呢?即如何防止Fe(OH)2被氧化?
1、将Fe(OH)2露置在潮湿的空气中加热灼烧所得的产物为
A.FeO B.Fe (OH)3 C.Fe3O4 D.Fe2O3
2、(双选)将Na2O2投入FeCl2溶液中,可观察到的实验现象是
A.有无色气体产生 B.没有沉淀生成
C.有白色沉淀生成 D.有红褐色沉淀生成
D
AD
铁盐和亚铁盐
Fe(OH)2能转化为Fe(OH)3,Fe2+能转换为Fe3+么?
Fe2+ Fe3+
降低
被还原
加入还原剂
升高
被氧化
加入氧化剂
HNO3、Cl2、
H2O2、KMnO4
Fe、Cu、KI...
实验验证:通过什么现象验证Fe3+和Fe2+可以互相转化?
鉴别Fe3+和Fe2+方法
浅绿色
棕黄色
c. KSCN法:
红
b. 碱液法: 色沉淀的含有Fe3+; __色沉淀,迅速转为_____色,
最后变________的含有Fe2+
红褐
白
灰绿
红褐色
a. 颜色:Fe 2+ Fe3+ (浓度太小时不适用)
滴入KSCN(硫氰化钾)溶液,呈_____色的溶液中含有Fe3+
FeCl3中的现象
FeCl2中的现象
铁盐会和KSCN反应:Fe3+ + SCN- — Fe(SCN)2+
(血红色)
(现象最明显,操作最简单)
铁盐和亚铁盐
Fe3+和Fe2+如何相互转换?
Fe2+ Fe3+
降低
被还原
加入还原剂
升高
被氧化
加入氧化剂
HNO3、Cl2、
H2O2、KMnO4
实验验证:用KSCN来证明Fe3+和Fe2+可以互相转化。
原理 实验步骤 实验现象 离子方程式
Fe3+→Fe2+
Fe2+→Fe3+
KSCN溶液→
铁粉
氯水
2Fe3+ + Fe = 3Fe2+
2Fe2+ + Cl2 =
2Fe3+ + 2Cl-
红色→褪去
又变红色
取上层清夜→
Fe、Cu、KI...
小结:Fe、Fe2+和Fe3+的转化关系
Fe2+
Fe3+
Fe
加氧化剂
加氧化剂
加氧化剂
加还原剂
加还原剂
加还原剂
应用1:除杂(括号内是杂质)
应用2:检验离子
FeCl3(FeCl2):
Fe3+(Fe2+):
Fe2+(Fe3+):
万能氧化剂H2O2
Fe
Cl2或H2O2
①如何检验溶液中是否含有Fe3+?
②如何检验溶液中是否含有Fe2+?
加KSCN
先加KSCN
(无明显现象,证明无Fe3+)
再加氯水(变血红色)
③如何检验溶液中是否含有Fe3+(含Fe2+杂质):
④如何检验溶液中是否含有Fe2+(含Fe3+杂质):
加KSCN
酸性KMnO4 溶液
(紫红色褪去)
应用2:检验Fe3+和Fe2+
1、为了防止氯化亚铁溶液久置被氧化变质,常在其溶液中加入( )
A.铁粉 B.铜粉 C.氯化铁 D.盐酸
A
2、人体正常的血红蛋白中应含Fe2+,若误食亚硝酸盐,则导致血红蛋白中Fe2+转化为高铁(Fe3+)血红蛋白而中毒。服用维生素C可解除中毒,下列叙述正确的是( )
A.维生素C是氧化剂
B.维生素将Fe3+还原成Fe2+
C.亚硝酸盐被氧化
D.亚硝酸盐是还原剂
B
3.下列离子的检验方法合理的是( )
A.向某溶液中滴入KSCN溶液呈红色,说明不含Fe2+
B.向某溶液中通入Cl2,然后再加入KSCN溶液变红色,说明原溶液中含有Fe2+
C.向某溶液中加入NaOH溶液,得红褐色沉淀,说明溶液中含有Fe3+
D.向某溶液中加入NaOH溶液得白色沉淀,又观察到颜色逐渐变为红褐色,说明该溶液中只含有Fe2+,不含有Mg2+
C
作业布置
1、南方:
大本:P53-56
小本:P23+P24第1、3、4、6
2、课本P72
改进
改进
第1节 铁及其化合物
铁
铁的氧化物
铁的氢氧化物
铁盐和亚铁盐
导入
铁在自然界中主要是以+2价和+3价化合物的形态存在,如赤铁矿、磁铁矿。
人体中的铁含量为4~5g,是人体必需微量元素中含量最多的一种,也是化合物形式。
目前发现最早的人工冶铁制品是甘肃灵台出图的春秋初年秦国的短柄铁剑。
丹霞地貌的岩层因Fe2O3而呈红色
战国时期最大的铁器——长方形铁炉
物理性质:
①有延展性、导热、导电
②能被磁铁吸引。
铁的单质
观察下列反应式,查看铁的化合价变化有何异同。
2Fe+3Cl2——2FeCl3
点燃
Fe
FeCl3
化合价升高
0
+3
Fe+2HCl——2FeCl2+H2
Fe
FeCl2
化合价升高
0
+2
Fe+CuSO4——FeSO4+Cu
Fe
FeSO4
化合价升高
0
+2
铁与氧化性较弱的氧化剂(如盐酸、硫酸铜等)反应:
铁与氧化性较强的氧化剂(如Cl2、O2等)反应:
Fe-2e-→Fe2+
Fe-3e-→Fe3+
在钢铁厂的生产中,炽热的铁水或钢水注入模具之前,模具必须进行充分的干燥处理,否则会有嘶嘶响声。
思考·讨论
钢水注入干燥的模具
红热的铁
遇到
气体
水
水蒸气发生装置
水蒸气与铁粉反应装置
产物的检验(收集)装置
可是常温下铁与水是不反应的,已知钢水温度
大概1500℃,说明铁与水在什么条件下才能反应?
如何设计实验验证?
水蒸气
发生装置
水蒸气与铁反应装置
产物收集检验装置
水蒸气的
发生装置
水蒸气与
铁反应装置
产物收集
检验装置
水蒸气发生装置
水蒸气与铁反应装置
产物收集检验装置
改进
改进
现象:铁变为黑色粉末状物质,同时生成了氢气。
请根据实验现象
写出反应方程式。
3Fe+4H2O(g)—Fe3O4+4H2
高温
小结:
铁遇弱氧化剂(盐酸、硫酸铜):Fe-2e-→Fe2+
铁遇强氧化剂(Cl2、O2):Fe-3e-→Fe3+
铁与水蒸气:Fe→Fe3O4
名称
化学式
化合价
颜色
俗称
溶解性
与盐酸反应
氧化亚铁
氧化铁
四氧化三铁
FeO
Fe3O4
Fe2O3
+2
+3
+2 、+3
黑色
红棕色
黑色
均不溶于水 ,也不和水反应
----------
铁红
磁性氧化铁
FeO + 2H+=
Fe2+ + H2O
Fe2O3 + 6H+ = 2Fe3+ + 3H2O
黄色
浅绿色
铁的氧化物
FeO和Fe2O3都是碱性氧化物
作业布置
南方:
大本:P50-53
小本:P22
都属于难溶性碱,受热易分解,都能跟酸反应,生成对应价态的盐。
铁的氢氧化物
铁的两种氢氧化物
氢氧化铁(Fe(OH)3)
氢氧化亚铁(Fe(OH)2)
红褐色沉淀或胶体,加热后失去水生成红棕色的Fe2O3粉末:2Fe(OH)3——Fe2O3+3H2O
白色沉淀
△
FeCl3溶液 FeSO4溶液
加NaOH溶液
离子 方程式
Fe2+ +2OH- = Fe(OH)2
Fe3+ +3OH- = Fe(OH)3
白色
沉淀
灰绿色
沉淀
红褐色
沉淀?
如何制备Fe(OH)2和Fe(OH)3
Fe(OH)2
Fe(OH)3
4 Fe(OH)2 + O2 + 2 H2O == 4 Fe(OH)3
极易被氧化
可溶性铁盐/亚铁盐
+
可溶性碱
操作
新制FeSO4溶液
油
NaOH溶液
采取的措施:
(1)用新配制FeSO4溶液(方法)
(2)用煮沸过水(除O2)配制溶液
(3)液面用油封
(4)滴管伸到液面以下
......
如何制备Fe(OH)2和Fe(OH)3
如何得到Fe(OH)2呢?即如何防止Fe(OH)2被氧化?
1、将Fe(OH)2露置在潮湿的空气中加热灼烧所得的产物为
A.FeO B.Fe (OH)3 C.Fe3O4 D.Fe2O3
2、(双选)将Na2O2投入FeCl2溶液中,可观察到的实验现象是
A.有无色气体产生 B.没有沉淀生成
C.有白色沉淀生成 D.有红褐色沉淀生成
D
AD
铁盐和亚铁盐
Fe(OH)2能转化为Fe(OH)3,Fe2+能转换为Fe3+么?
Fe2+ Fe3+
降低
被还原
加入还原剂
升高
被氧化
加入氧化剂
HNO3、Cl2、
H2O2、KMnO4
Fe、Cu、KI...
实验验证:通过什么现象验证Fe3+和Fe2+可以互相转化?
鉴别Fe3+和Fe2+方法
浅绿色
棕黄色
c. KSCN法:
红
b. 碱液法: 色沉淀的含有Fe3+; __色沉淀,迅速转为_____色,
最后变________的含有Fe2+
红褐
白
灰绿
红褐色
a. 颜色:Fe 2+ Fe3+ (浓度太小时不适用)
滴入KSCN(硫氰化钾)溶液,呈_____色的溶液中含有Fe3+
FeCl3中的现象
FeCl2中的现象
铁盐会和KSCN反应:Fe3+ + SCN- — Fe(SCN)2+
(血红色)
(现象最明显,操作最简单)
铁盐和亚铁盐
Fe3+和Fe2+如何相互转换?
Fe2+ Fe3+
降低
被还原
加入还原剂
升高
被氧化
加入氧化剂
HNO3、Cl2、
H2O2、KMnO4
实验验证:用KSCN来证明Fe3+和Fe2+可以互相转化。
原理 实验步骤 实验现象 离子方程式
Fe3+→Fe2+
Fe2+→Fe3+
KSCN溶液→
铁粉
氯水
2Fe3+ + Fe = 3Fe2+
2Fe2+ + Cl2 =
2Fe3+ + 2Cl-
红色→褪去
又变红色
取上层清夜→
Fe、Cu、KI...
小结:Fe、Fe2+和Fe3+的转化关系
Fe2+
Fe3+
Fe
加氧化剂
加氧化剂
加氧化剂
加还原剂
加还原剂
加还原剂
应用1:除杂(括号内是杂质)
应用2:检验离子
FeCl3(FeCl2):
Fe3+(Fe2+):
Fe2+(Fe3+):
万能氧化剂H2O2
Fe
Cl2或H2O2
①如何检验溶液中是否含有Fe3+?
②如何检验溶液中是否含有Fe2+?
加KSCN
先加KSCN
(无明显现象,证明无Fe3+)
再加氯水(变血红色)
③如何检验溶液中是否含有Fe3+(含Fe2+杂质):
④如何检验溶液中是否含有Fe2+(含Fe3+杂质):
加KSCN
酸性KMnO4 溶液
(紫红色褪去)
应用2:检验Fe3+和Fe2+
1、为了防止氯化亚铁溶液久置被氧化变质,常在其溶液中加入( )
A.铁粉 B.铜粉 C.氯化铁 D.盐酸
A
2、人体正常的血红蛋白中应含Fe2+,若误食亚硝酸盐,则导致血红蛋白中Fe2+转化为高铁(Fe3+)血红蛋白而中毒。服用维生素C可解除中毒,下列叙述正确的是( )
A.维生素C是氧化剂
B.维生素将Fe3+还原成Fe2+
C.亚硝酸盐被氧化
D.亚硝酸盐是还原剂
B
3.下列离子的检验方法合理的是( )
A.向某溶液中滴入KSCN溶液呈红色,说明不含Fe2+
B.向某溶液中通入Cl2,然后再加入KSCN溶液变红色,说明原溶液中含有Fe2+
C.向某溶液中加入NaOH溶液,得红褐色沉淀,说明溶液中含有Fe3+
D.向某溶液中加入NaOH溶液得白色沉淀,又观察到颜色逐渐变为红褐色,说明该溶液中只含有Fe2+,不含有Mg2+
C
作业布置
1、南方:
大本:P53-56
小本:P23+P24第1、3、4、6
2、课本P72
改进
改进
