化学人教版(2019)选择性必修1 4.2.1电解原理(共24张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 4.2.1电解原理(共24张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 5.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-19 11:17:03 | ||
图片预览


文档简介
(共24张PPT)
第2节 电解池
第1课时:电解原理
第四章
ΔH =+285.8 kJ·mol-1
生成物 H2(g)+1/2O2(g)
【资料】水常温下很难分解。即使在2 500 K 高温下,分解率也不足25%。
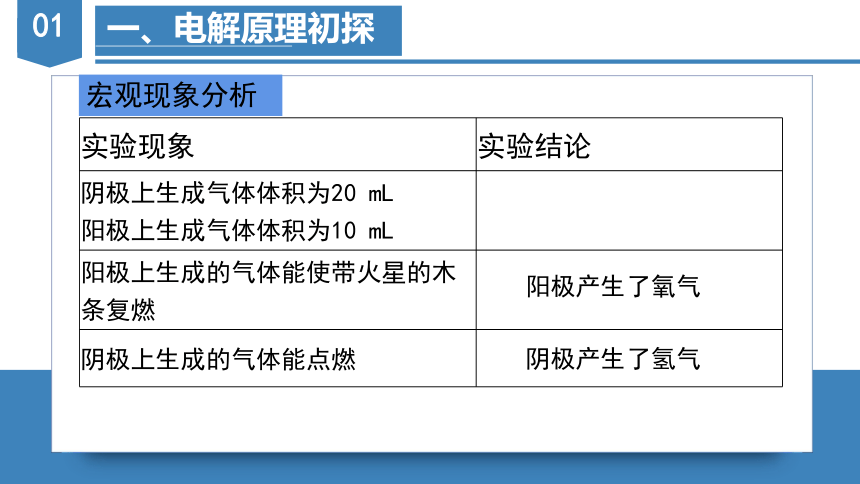
一、电解原理初探
实验现象 实验结论
阴极上生成气体体积为20 mL 阳极上生成气体体积为10 mL
阳极上生成的气体能使带火星的木条复燃
阴极上生成的气体能点燃
宏观现象分析
阳极产生了氧气
阴极产生了氢气
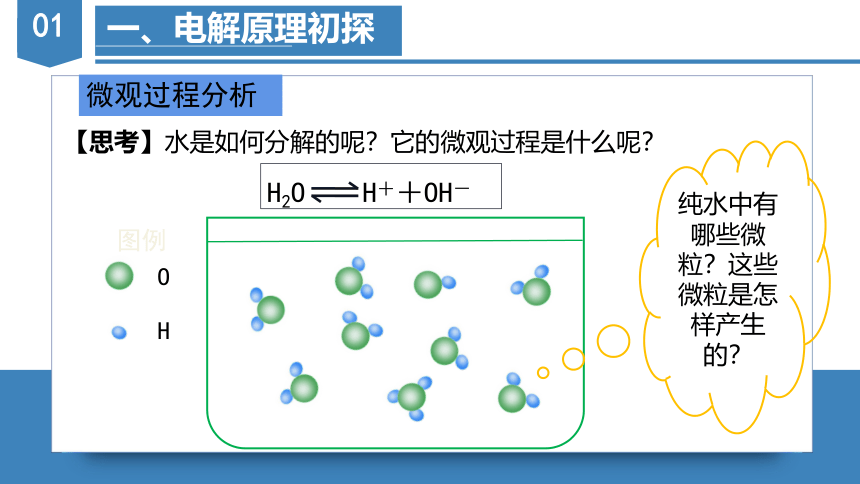
一、电解原理初探
微观过程分析
【思考】水是如何分解的呢?它的微观过程是什么呢?
纯水中有哪些微粒?这些微粒是怎样产生的?
O
H
图例
H2O H++OH-
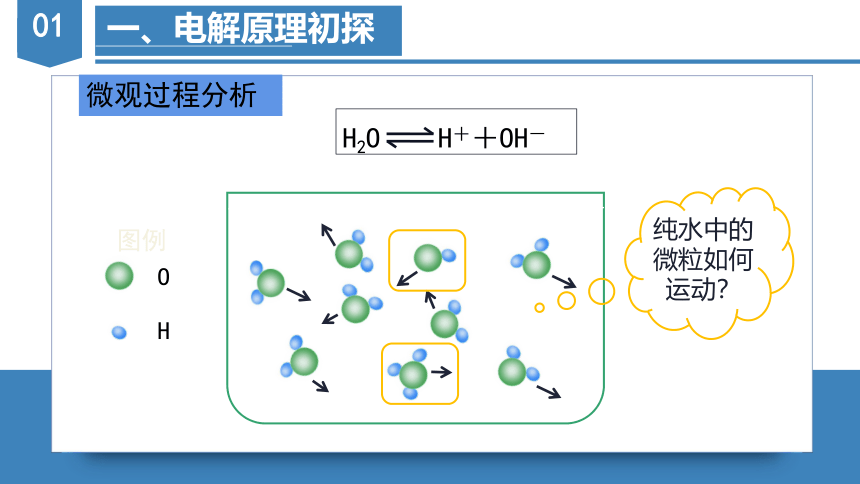
一、电解原理初探
微观过程分析
纯水中的微粒如何运动?
O
H
图例
H2O H++OH-
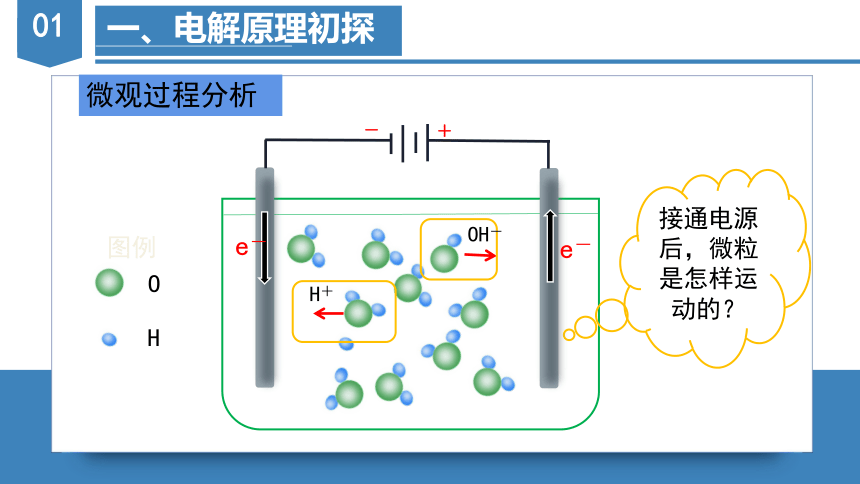
一、电解原理初探
微观过程分析
接通电源后,微粒是怎样运动的?
-
+
O
H
图例
H+
OH-
e-
e-
一、电解原理初探
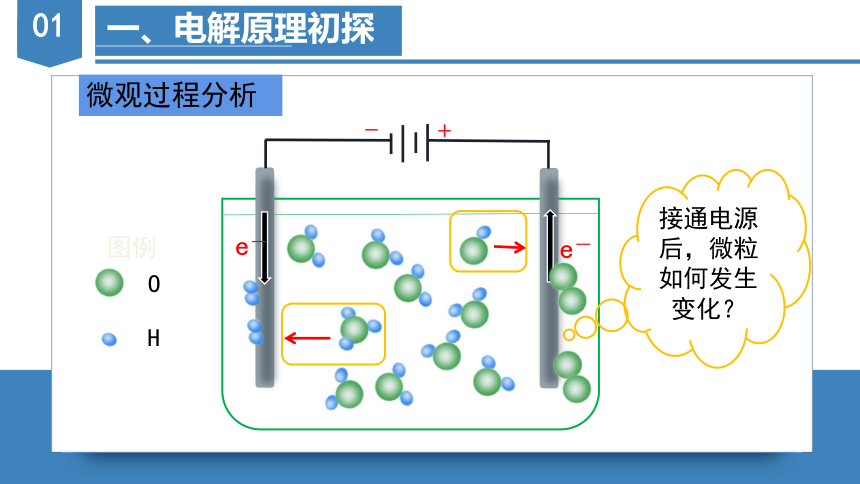
微观过程分析
接通电源后,微粒如何发生变化?
-
+
O
H
图例
e-
e-
一、电解原理初探
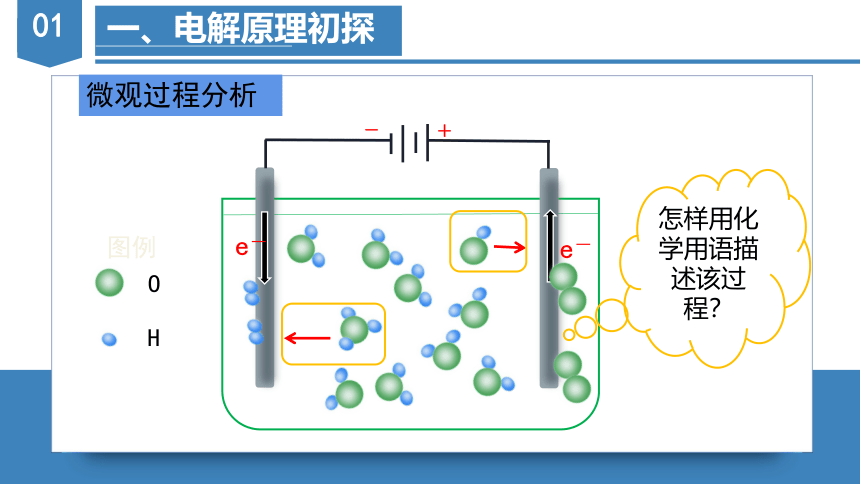
微观过程分析
怎样用化学用语描述该过程?
-
+
O
H
图例
e-
e-
一、电解原理初探
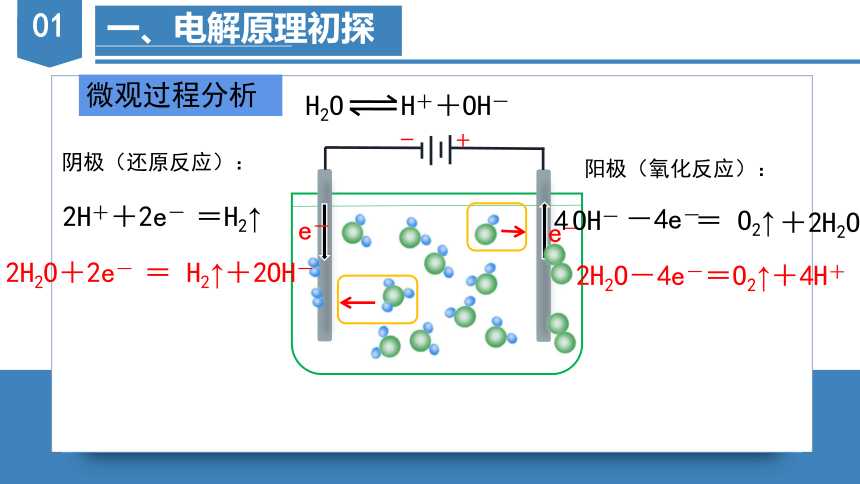
微观过程分析
-
+
e-
e-
H2O H++OH-
阴极(还原反应):
2H++2e- =H2↑
2H2O+2e- = H2↑+2OH-
阳极(氧化反应):
OH- = O2↑
-4e-
4
+2H2O
2H2O-4e-=O2↑+4H+
一、电解原理初探
微观过程分析
H2O H++OH-
阴极(还原反应):
2H++2e- =H2↑
2H2O+2e- = H2↑+2OH-
阳极(氧化反应):
OH- = O2↑
-4e-
4
+2H2O
2H2O-4e-=O2↑+4H+
2H2O 2H2↑+O2↑
电解
总反应::
一、电解原理初探
CuCl2溶液中的微粒如何放电?
一、电解原理初探
[实验4-2]用石墨电极电解CuCl2溶液
一、电解原理初探
[实验4-2]用石墨电极电解CuCl2溶液
实验现象 实验结论
阳极有刺激性气味的气体产生,能使湿润的淀粉 KI试纸变蓝
阴极逐渐覆盖了一层红色物质,溶液颜色变浅
阳极产生了氯气
阴极析出金属铜
一、电解原理初探
思考:电解CuCl2溶液为什么会生成Cu和Cl2呢?
一、电解原理初探
微观过程分析
CuCl2溶液中存在哪些微粒?
Cu2+
Cl-
H3O+
OH-
Cu2+
Cl-
Cl-
Cl-
H2O
H2O
一、电解原理初探
Cu2+
Cl-
H3O+
OH-
Cu2+
Cl-
Cl-
Cl-
H2O
H2O
-
+
确定微粒移动方向
Cl-
OH-
阳
极
Cu2+
H+
阴极
一、电解原理初探
Cu2+
Cl-
H3O+
OH-
Cu2+
Cl-
Cl-
Cl-
H2O
H2O
-
+
确定放电微粒
Cl-
OH-
阳
极
Cu2+
H+
阴极
Cu
Cl2
√
√
一、电解原理初探
电解原理分析
离子到达电极,失去或获得电子,
发生氧化还原反应的过程。
放电:
放电顺序:
阴极:Cu2+ > H+
阳极:Cl- > OH-
一、电解原理初探
Cu2+
Cl-
H3O+
OH-
Cu2+
Cl-
Cl-
Cl-
H2O
H2O
-
+
Cu
Cl2
怎样用化学用语描述该过程?
一、电解原理初探
Cu2+
Cl-
H3O+
OH-
Cu2+
Cl-
Cl-
Cl-
H2O
H2O
-
+
Cu
Cl2
写出电极反应式和总反应
阴极:Cu2++2e-=Cu
阳极:2Cl--2e-=Cl2↑
总反应:
Cu2++2Cl- Cu+Cl2↑
电解
二、电解分析与总结
使电流通过电解质溶液而在阴阳两极引起
氧化还原反应的过程。
电解:
电解法是最强有力的氧化还原手段,借助电解法
可以使非自发的氧化还原反应进行。
借助电流引起氧化还原反应的装置,也
就是把电能转化为化学能的装置。
电解池:
分析与总结
二、电解分析与总结
直流电源:
电解池构成条件
分析与总结
电极材料:
导 线:
电解 质:
提供电能
传输电子
得失电子场所
离子导体
二、电解分析与总结
电解池分析思路
确定微粒种类及移动方向
根据放电顺序确定放电微粒
写出电极反应式和总反应
阴极:放电顺序与阳离子氧化性强弱有关,氧化性越强,越先得到电子:Ag+ > Cu2+ > H+ > Na+
阳极:放电顺序与阴离子还原性强弱有关,还原性越强,越先失去电子: S2->I->Cl-> OH-> SO42-
知识点都掌握了吗?来做几道题检测下~
用石墨作电极电解硫酸溶液,写出电极反应及总反应。
阴极
阳极
生成H2
阳极: H2O - 2e- = O2 ↑
+ 2H +
阴极: 2H ++ 2e- = H2 ↑
H2O H2 ↑ + O2 ↑
通电
第2节 电解池
第1课时:电解原理
第四章
ΔH =+285.8 kJ·mol-1
生成物 H2(g)+1/2O2(g)
【资料】水常温下很难分解。即使在2 500 K 高温下,分解率也不足25%。
一、电解原理初探
实验现象 实验结论
阴极上生成气体体积为20 mL 阳极上生成气体体积为10 mL
阳极上生成的气体能使带火星的木条复燃
阴极上生成的气体能点燃
宏观现象分析
阳极产生了氧气
阴极产生了氢气
一、电解原理初探
微观过程分析
【思考】水是如何分解的呢?它的微观过程是什么呢?
纯水中有哪些微粒?这些微粒是怎样产生的?
O
H
图例
H2O H++OH-
一、电解原理初探
微观过程分析
纯水中的微粒如何运动?
O
H
图例
H2O H++OH-
一、电解原理初探
微观过程分析
接通电源后,微粒是怎样运动的?
-
+
O
H
图例
H+
OH-
e-
e-
一、电解原理初探
微观过程分析
接通电源后,微粒如何发生变化?
-
+
O
H
图例
e-
e-
一、电解原理初探
微观过程分析
怎样用化学用语描述该过程?
-
+
O
H
图例
e-
e-
一、电解原理初探
微观过程分析
-
+
e-
e-
H2O H++OH-
阴极(还原反应):
2H++2e- =H2↑
2H2O+2e- = H2↑+2OH-
阳极(氧化反应):
OH- = O2↑
-4e-
4
+2H2O
2H2O-4e-=O2↑+4H+
一、电解原理初探
微观过程分析
H2O H++OH-
阴极(还原反应):
2H++2e- =H2↑
2H2O+2e- = H2↑+2OH-
阳极(氧化反应):
OH- = O2↑
-4e-
4
+2H2O
2H2O-4e-=O2↑+4H+
2H2O 2H2↑+O2↑
电解
总反应::
一、电解原理初探
CuCl2溶液中的微粒如何放电?
一、电解原理初探
[实验4-2]用石墨电极电解CuCl2溶液
一、电解原理初探
[实验4-2]用石墨电极电解CuCl2溶液
实验现象 实验结论
阳极有刺激性气味的气体产生,能使湿润的淀粉 KI试纸变蓝
阴极逐渐覆盖了一层红色物质,溶液颜色变浅
阳极产生了氯气
阴极析出金属铜
一、电解原理初探
思考:电解CuCl2溶液为什么会生成Cu和Cl2呢?
一、电解原理初探
微观过程分析
CuCl2溶液中存在哪些微粒?
Cu2+
Cl-
H3O+
OH-
Cu2+
Cl-
Cl-
Cl-
H2O
H2O
一、电解原理初探
Cu2+
Cl-
H3O+
OH-
Cu2+
Cl-
Cl-
Cl-
H2O
H2O
-
+
确定微粒移动方向
Cl-
OH-
阳
极
Cu2+
H+
阴极
一、电解原理初探
Cu2+
Cl-
H3O+
OH-
Cu2+
Cl-
Cl-
Cl-
H2O
H2O
-
+
确定放电微粒
Cl-
OH-
阳
极
Cu2+
H+
阴极
Cu
Cl2
√
√
一、电解原理初探
电解原理分析
离子到达电极,失去或获得电子,
发生氧化还原反应的过程。
放电:
放电顺序:
阴极:Cu2+ > H+
阳极:Cl- > OH-
一、电解原理初探
Cu2+
Cl-
H3O+
OH-
Cu2+
Cl-
Cl-
Cl-
H2O
H2O
-
+
Cu
Cl2
怎样用化学用语描述该过程?
一、电解原理初探
Cu2+
Cl-
H3O+
OH-
Cu2+
Cl-
Cl-
Cl-
H2O
H2O
-
+
Cu
Cl2
写出电极反应式和总反应
阴极:Cu2++2e-=Cu
阳极:2Cl--2e-=Cl2↑
总反应:
Cu2++2Cl- Cu+Cl2↑
电解
二、电解分析与总结
使电流通过电解质溶液而在阴阳两极引起
氧化还原反应的过程。
电解:
电解法是最强有力的氧化还原手段,借助电解法
可以使非自发的氧化还原反应进行。
借助电流引起氧化还原反应的装置,也
就是把电能转化为化学能的装置。
电解池:
分析与总结
二、电解分析与总结
直流电源:
电解池构成条件
分析与总结
电极材料:
导 线:
电解 质:
提供电能
传输电子
得失电子场所
离子导体
二、电解分析与总结
电解池分析思路
确定微粒种类及移动方向
根据放电顺序确定放电微粒
写出电极反应式和总反应
阴极:放电顺序与阳离子氧化性强弱有关,氧化性越强,越先得到电子:Ag+ > Cu2+ > H+ > Na+
阳极:放电顺序与阴离子还原性强弱有关,还原性越强,越先失去电子: S2->I->Cl-> OH-> SO42-
知识点都掌握了吗?来做几道题检测下~
用石墨作电极电解硫酸溶液,写出电极反应及总反应。
阴极
阳极
生成H2
阳极: H2O - 2e- = O2 ↑
+ 2H +
阴极: 2H ++ 2e- = H2 ↑
H2O H2 ↑ + O2 ↑
通电
