专题1 有机化学的发展及研究思路 体系构建 体验高考(共29张ppt)
文档属性
| 名称 | 专题1 有机化学的发展及研究思路 体系构建 体验高考(共29张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 5.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-20 13:56:32 | ||
图片预览








文档简介
(共29张PPT)
体系构建 理清脉络 / 体验高考 素养提升
体系构建 体验高考
专题1
内容索引
体系构建 理清脉络
体验高考 素养提升
体系构建 理清脉络
2.科学家怎样
研究有机物
返回
体验高考 素养提升
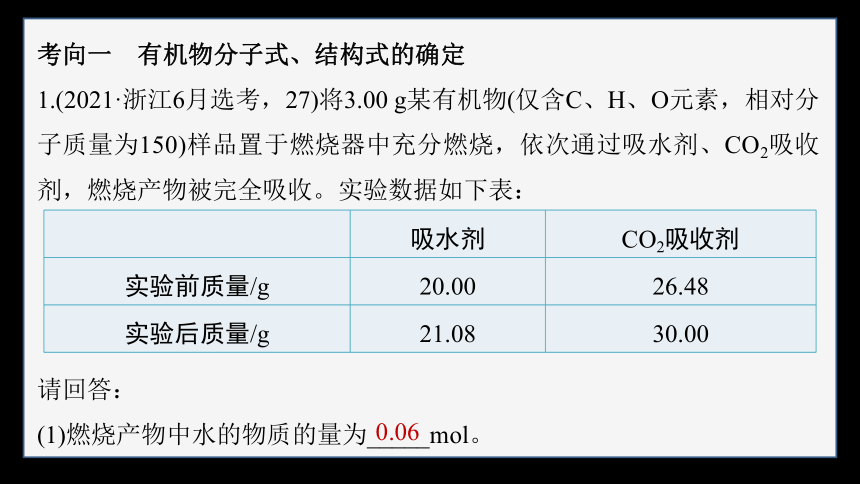
考向一 有机物分子式、结构式的确定
1.(2021·浙江6月选考,27)将3.00 g某有机物(仅含C、H、O元素,相对分子质量为150)样品置于燃烧器中充分燃烧,依次通过吸水剂、CO2吸收剂,燃烧产物被完全吸收。实验数据如下表:
吸水剂 CO2吸收剂
实验前质量/g 20.00 26.48
实验后质量/g 21.08 30.00
请回答:
(1)燃烧产物中水的物质的量为_____mol。
0.06
根据表格中的数据,吸水剂增加的质量全部为有机物完全燃烧生成水
的质量,则生成水的物质的量n(H2O)= =0.06 mol。
(2)该有机物的分子式为________________(写出计算过程)。
考向二 有机物的分离与提纯
2.(2021·湖北,7)某兴趣小组为制备1-氯-2-甲基丙烷(沸点69 ℃),将2-甲基-1-丙醇和POCl3溶于CH2Cl2中,加热回流(伴有HCl气体产生)。反应完全后倒入冰水中分解残余的POCl3,分液收集CH2Cl2层,无水MgSO4干燥、过滤、蒸馏后得到目标产物。上述过程中涉及的装置或操作错误的是(夹持及加热装置略)
A B C D
√
依题意,制备产品需要“搅拌、加热回流”,A项正确;
副产物氯化氢极易溶于氢氧化钠溶液,不能直接将尾气通入氢氧化钠溶液中,这样易发生倒吸现象,B项错误;
分液收集二氯甲烷层需用到分液漏斗,振荡时需将分液漏斗倒转过来放气,避免分液漏斗内气压过大,发生危险,C项正确;
蒸馏时需要用温度计指示温度,冷凝水从下口进、上口出,提高冷凝效率,D项正确。
3.(2020·海南,2)古籍《天工开物》收录了井盐的生产过程。其中“汲水而上,入于釜中煎炼,顷刻结盐,色成至白”的描述,涉及的物质分离操作为
A.趁热过滤 B.萃取分液
C.常压蒸馏 D.浓缩结晶
√
根据文中描述,将海水倒在锅中加热煮沸,看见白色的固体出现,就得到盐,操作方法为浓缩结晶,故D正确。
4.(2020·江苏,21B)羟基乙酸钠易溶于热水,微溶于冷水,不溶于醇、醚等有机溶剂。制备少量羟基乙酸钠的反应为ClCH2COOH+2NaOH
―→HOCH2COONa+NaCl+H2O ΔH<0
实验步骤如下:
步骤1:在图中所示装置的反应瓶中,加入40 g氯乙酸、50 mL水,搅拌。逐步加入40% NaOH溶液,在95 ℃继续搅拌反应2小时,反应过程中控制pH约为9。
步骤2:蒸出部分水至液面有薄膜,加少量热水,趁热过滤。滤液冷却至15 ℃,过滤得粗产品。
步骤3:粗产品溶解于适量热水中,加活性炭脱色,分离掉活性炭。
步骤4:将去除活性炭后的溶液加到适量乙醇中,冷却至15 ℃以下,结晶、过滤、干燥,得羟基乙酸钠。
(1)步骤1中,图中所示的装置中仪器A的名称是____________;逐步加入NaOH溶液的目的是______________________________。
(球形)冷凝管
防止升温太快、控制反应体系pH
由仪器的结构可知,A为(球形)冷凝管。制备羟基乙酸钠的反应放热,步骤1中要求控制反应温度为95 ℃,控制pH约为9,逐步加入NaOH溶液,可防止反应物升温太快,并控制反应体系的pH。
(2)步骤2中,蒸馏烧瓶中加入沸石或碎瓷片的目的是__________。
(3)步骤3中,粗产品溶解于过量水会导致产率______(填“增大”或“减小”);去除活性炭的操作名称是__________。
防止暴沸
减小
趁热过滤
由于羟基乙酸钠能水解生成羟基乙酸,若溶解于过量水会导致产率减小。固体与液体的分离方法为过滤,由于羟基乙酸钠易溶于热水而微溶于冷水,为防止羟基乙酸钠析出,应趁热过滤。
(4)步骤4中,将去除活性炭后的溶液加到适量乙醇中的目的是________
_______________________。
提高羟
基乙酸钠的析出量(产率)
因羟基乙酸钠不溶于乙醇,加到适量乙醇中,可降低羟基乙酸钠的溶解度,有利于羟基乙酸钠的析出。
考向三 有机反应机理
5.(2021·山东,14)18O标记的乙酸甲酯在足量NaOH溶液中发生水解,部
分反应历程可表示为: +OH-
CH3O-能量变化如图所示。
+
已知 为快速平衡,下列说法正确的是
A.反应Ⅱ、Ⅲ为决速步
B.反应结束后,溶液中存在18OH-
C.反应结束后,溶液中存在CH318OH
D.反应Ⅰ与反应Ⅳ活化能的差值等
于图示总反应的焓变
√
一般来说,反应的活化能越高,反应速率越慢,由图可知,反应Ⅰ和反应Ⅳ的活化能较高,因此反应的决速步为反应Ⅰ、Ⅳ,故A错误;
反应Ⅰ为加成反应,而
为快速平衡,反应Ⅱ的成键
和断键方式为 或 ,后者能生成18OH-,
因此反应结束后,溶液中存在18OH-,故B正确;
反应Ⅲ的成键和断键方式为
或 ,因此反应结束后溶液中
不会存在CH318OH,故C错误;
该总反应对应反应物的总能量高于生成物的总能量,总反应为放热反
应,因此 和CH3O-的总能量与 和OH-的总能量之差等于图示总反应的焓变,故D错误。
6.(2021·浙江6月选考,24)制备苯甲酸甲酯的一种反应机理如图(其中Ph—代表苯基)。下列说法不正确的是
A.可以用苯甲醛和甲醇为原料制备苯
甲酸甲酯
B.反应过程涉及氧化反应
C.化合物3和4互为同分异构体
D.化合物1直接催化反应的进行
√
由图中信息可知,苯甲醛和甲醇分子
在化合物2的催化作用下,参与催化
循环,最后得到产物苯甲酸甲酯,故
A项正确;
由图中信息可知,化合物4在H2O2的
作用下转化为化合物5,即醇转化为
酮,该过程是失氢的氧化反应,故B项正确;
化合物3和化合物4所含原子种类及
数目均相同,结构不同,两者互为
同分异构体,故C项正确;
由图中信息可知,化合物1在NaH
的作用下形成化合物2,化合物2再
参与催化循环,所以直接催化反应
进行的是化合物2,化合物1间接催化反应的进行,故D项错误。
7.(2021·湖北,12)甲烷单加氧酶(s- mmo)含有双核铁活性中心,是O2氧化CH4生成CH3OH的催化剂,反应过程如图所示。下列叙述错误的是
A.基态Fe原子的电子排布式为
[Ar]3d64s2
B.步骤③有非极性键的断裂和
极性键的形成
C.每一步骤都存在铁和氧元素
之间的电子转移
D.图中的总过程可表示为CH4
+O2+2H++2e-
CH3OH+H2O
√
返回
基态Fe原子核外有26个电子,其电子排布式为[Ar]3d64s2,A项正确;
步骤③中断裂O—O非极性键,形成O—Fe(Ⅳ)极性键,B项正确;
步骤④中电子转移发生在Fe和C元素之间,C项错误;
根据图示,该总反应的反应物为氧气、甲烷和H+,生成物为甲醇和水,D项正确。
本课结束
专题1
体系构建 理清脉络 / 体验高考 素养提升
体系构建 体验高考
专题1
内容索引
体系构建 理清脉络
体验高考 素养提升
体系构建 理清脉络
2.科学家怎样
研究有机物
返回
体验高考 素养提升
考向一 有机物分子式、结构式的确定
1.(2021·浙江6月选考,27)将3.00 g某有机物(仅含C、H、O元素,相对分子质量为150)样品置于燃烧器中充分燃烧,依次通过吸水剂、CO2吸收剂,燃烧产物被完全吸收。实验数据如下表:
吸水剂 CO2吸收剂
实验前质量/g 20.00 26.48
实验后质量/g 21.08 30.00
请回答:
(1)燃烧产物中水的物质的量为_____mol。
0.06
根据表格中的数据,吸水剂增加的质量全部为有机物完全燃烧生成水
的质量,则生成水的物质的量n(H2O)= =0.06 mol。
(2)该有机物的分子式为________________(写出计算过程)。
考向二 有机物的分离与提纯
2.(2021·湖北,7)某兴趣小组为制备1-氯-2-甲基丙烷(沸点69 ℃),将2-甲基-1-丙醇和POCl3溶于CH2Cl2中,加热回流(伴有HCl气体产生)。反应完全后倒入冰水中分解残余的POCl3,分液收集CH2Cl2层,无水MgSO4干燥、过滤、蒸馏后得到目标产物。上述过程中涉及的装置或操作错误的是(夹持及加热装置略)
A B C D
√
依题意,制备产品需要“搅拌、加热回流”,A项正确;
副产物氯化氢极易溶于氢氧化钠溶液,不能直接将尾气通入氢氧化钠溶液中,这样易发生倒吸现象,B项错误;
分液收集二氯甲烷层需用到分液漏斗,振荡时需将分液漏斗倒转过来放气,避免分液漏斗内气压过大,发生危险,C项正确;
蒸馏时需要用温度计指示温度,冷凝水从下口进、上口出,提高冷凝效率,D项正确。
3.(2020·海南,2)古籍《天工开物》收录了井盐的生产过程。其中“汲水而上,入于釜中煎炼,顷刻结盐,色成至白”的描述,涉及的物质分离操作为
A.趁热过滤 B.萃取分液
C.常压蒸馏 D.浓缩结晶
√
根据文中描述,将海水倒在锅中加热煮沸,看见白色的固体出现,就得到盐,操作方法为浓缩结晶,故D正确。
4.(2020·江苏,21B)羟基乙酸钠易溶于热水,微溶于冷水,不溶于醇、醚等有机溶剂。制备少量羟基乙酸钠的反应为ClCH2COOH+2NaOH
―→HOCH2COONa+NaCl+H2O ΔH<0
实验步骤如下:
步骤1:在图中所示装置的反应瓶中,加入40 g氯乙酸、50 mL水,搅拌。逐步加入40% NaOH溶液,在95 ℃继续搅拌反应2小时,反应过程中控制pH约为9。
步骤2:蒸出部分水至液面有薄膜,加少量热水,趁热过滤。滤液冷却至15 ℃,过滤得粗产品。
步骤3:粗产品溶解于适量热水中,加活性炭脱色,分离掉活性炭。
步骤4:将去除活性炭后的溶液加到适量乙醇中,冷却至15 ℃以下,结晶、过滤、干燥,得羟基乙酸钠。
(1)步骤1中,图中所示的装置中仪器A的名称是____________;逐步加入NaOH溶液的目的是______________________________。
(球形)冷凝管
防止升温太快、控制反应体系pH
由仪器的结构可知,A为(球形)冷凝管。制备羟基乙酸钠的反应放热,步骤1中要求控制反应温度为95 ℃,控制pH约为9,逐步加入NaOH溶液,可防止反应物升温太快,并控制反应体系的pH。
(2)步骤2中,蒸馏烧瓶中加入沸石或碎瓷片的目的是__________。
(3)步骤3中,粗产品溶解于过量水会导致产率______(填“增大”或“减小”);去除活性炭的操作名称是__________。
防止暴沸
减小
趁热过滤
由于羟基乙酸钠能水解生成羟基乙酸,若溶解于过量水会导致产率减小。固体与液体的分离方法为过滤,由于羟基乙酸钠易溶于热水而微溶于冷水,为防止羟基乙酸钠析出,应趁热过滤。
(4)步骤4中,将去除活性炭后的溶液加到适量乙醇中的目的是________
_______________________。
提高羟
基乙酸钠的析出量(产率)
因羟基乙酸钠不溶于乙醇,加到适量乙醇中,可降低羟基乙酸钠的溶解度,有利于羟基乙酸钠的析出。
考向三 有机反应机理
5.(2021·山东,14)18O标记的乙酸甲酯在足量NaOH溶液中发生水解,部
分反应历程可表示为: +OH-
CH3O-能量变化如图所示。
+
已知 为快速平衡,下列说法正确的是
A.反应Ⅱ、Ⅲ为决速步
B.反应结束后,溶液中存在18OH-
C.反应结束后,溶液中存在CH318OH
D.反应Ⅰ与反应Ⅳ活化能的差值等
于图示总反应的焓变
√
一般来说,反应的活化能越高,反应速率越慢,由图可知,反应Ⅰ和反应Ⅳ的活化能较高,因此反应的决速步为反应Ⅰ、Ⅳ,故A错误;
反应Ⅰ为加成反应,而
为快速平衡,反应Ⅱ的成键
和断键方式为 或 ,后者能生成18OH-,
因此反应结束后,溶液中存在18OH-,故B正确;
反应Ⅲ的成键和断键方式为
或 ,因此反应结束后溶液中
不会存在CH318OH,故C错误;
该总反应对应反应物的总能量高于生成物的总能量,总反应为放热反
应,因此 和CH3O-的总能量与 和OH-的总能量之差等于图示总反应的焓变,故D错误。
6.(2021·浙江6月选考,24)制备苯甲酸甲酯的一种反应机理如图(其中Ph—代表苯基)。下列说法不正确的是
A.可以用苯甲醛和甲醇为原料制备苯
甲酸甲酯
B.反应过程涉及氧化反应
C.化合物3和4互为同分异构体
D.化合物1直接催化反应的进行
√
由图中信息可知,苯甲醛和甲醇分子
在化合物2的催化作用下,参与催化
循环,最后得到产物苯甲酸甲酯,故
A项正确;
由图中信息可知,化合物4在H2O2的
作用下转化为化合物5,即醇转化为
酮,该过程是失氢的氧化反应,故B项正确;
化合物3和化合物4所含原子种类及
数目均相同,结构不同,两者互为
同分异构体,故C项正确;
由图中信息可知,化合物1在NaH
的作用下形成化合物2,化合物2再
参与催化循环,所以直接催化反应
进行的是化合物2,化合物1间接催化反应的进行,故D项错误。
7.(2021·湖北,12)甲烷单加氧酶(s- mmo)含有双核铁活性中心,是O2氧化CH4生成CH3OH的催化剂,反应过程如图所示。下列叙述错误的是
A.基态Fe原子的电子排布式为
[Ar]3d64s2
B.步骤③有非极性键的断裂和
极性键的形成
C.每一步骤都存在铁和氧元素
之间的电子转移
D.图中的总过程可表示为CH4
+O2+2H++2e-
CH3OH+H2O
√
返回
基态Fe原子核外有26个电子,其电子排布式为[Ar]3d64s2,A项正确;
步骤③中断裂O—O非极性键,形成O—Fe(Ⅳ)极性键,B项正确;
步骤④中电子转移发生在Fe和C元素之间,C项错误;
根据图示,该总反应的反应物为氧气、甲烷和H+,生成物为甲醇和水,D项正确。
本课结束
专题1
