专题3 第一单元 脂肪烃的性质及应用 第1课时 脂肪烃的类别 烷烃的性质(共68张ppt)
文档属性
| 名称 | 专题3 第一单元 脂肪烃的性质及应用 第1课时 脂肪烃的类别 烷烃的性质(共68张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-20 14:38:43 | ||
图片预览











文档简介
(共68张PPT)
第1课时
DIYIKESHI
烃的类别及脂肪烃的物理性质 / 烷烃的化学性质 / 课时对点练
脂肪烃的类别 烷烃的性质
专题3
核心素养
发展目标
1.能从化学键的饱和性等微观角度认识脂肪烃的结构及分类,能写出典型代表物的结构简式。
2.能通过CH4的性质,理解烷烃的化学性质,能书写相关反应的化学方程式。
内容索引
一、烃的类别及脂肪烃的物理性质
二、烷烃的化学性质
课时对点练
烃的类别及脂肪烃的物理性质
一
1.烃的组成、结构及其分类
(1)烃:仅由 两种元素组成的有机物。
(2)烃的分类
①根据分子中是否含有苯环,烃分为 和 。
②根据烃的结构,脂肪烃分为 脂肪烃(如烯烃、炔烃)和 脂
肪烃(如烷烃)。
碳、氢
脂肪烃
芳香烃
不饱和
饱和
2.脂肪烃的物理性质
(1)烷烃的物理性质
物理性质 变化规律
状态 随碳原子数的增加,常温下存在的状态由 态逐渐过渡
到 态、 态。当碳原子数小于或等于 时,烷烃在常温下呈气态
溶解性 都难溶于 ,易溶于________
气
液
固
4
水
有机溶剂
熔、沸点 随碳原子数的增加,熔、沸点逐渐 ,同种烷烃的
中,支链越多,熔、沸点越___
密度 随碳原子数的增加,密度逐渐 ,但比水的___
升高
不同异构体
低
增大
小
(2)烯烃、炔烃的物理性质
烯烃、炔烃的物理性质和烷烃相似。
(1)烷烃、烯烃、炔烃和苯的同系物都属于脂肪烃( )
(2)分子中含有苯环的烃一定属于芳香烃( )
(3)碳原子数小于4的烃常温下一定是气体( )
(4)碳原子数相同的烷烃、烯烃、炔烃,沸点相同( )
(5)丙烷分子中的三个碳原子一定不在同一直线上( )
(6)1-戊烯比2-甲基-1-戊烯的沸点高( )
×
正误判断
√
√
×
√
×
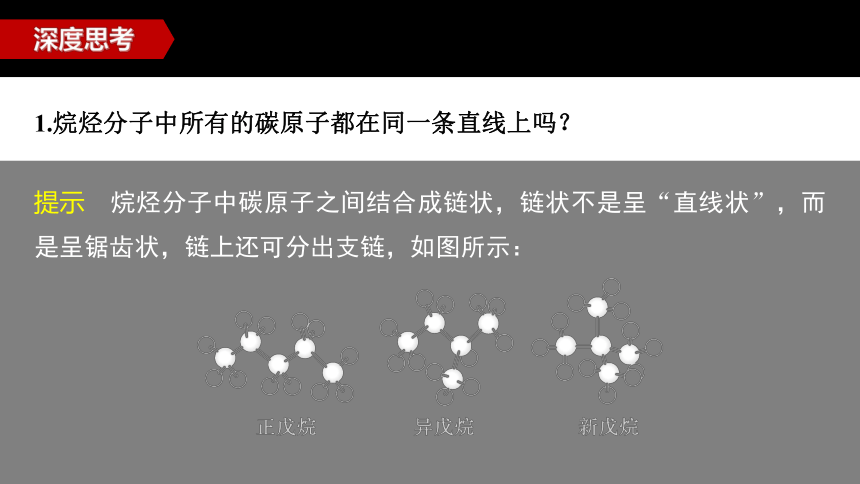
1.烷烃分子中所有的碳原子都在同一条直线上吗?
深度思考
提示 烷烃分子中碳原子之间结合成链状,链状不是呈“直线状”,而是呈锯齿状,链上还可分出支链,如图所示:
2.分子式符合通式CnH2n+2的两种有机物一定互为同系物吗?
提示 不一定。分子式符合通式CnH2n+2的有机物都属于烷烃,若碳原子数不同,结构相似,互为同系物;若碳原子数相同,碳架结构不同,则互为同分异构体。
深度思考
应用体验
1.下列有关脂肪烃的分类及物理性质,描述错误的是______(填字母)。
A.随着碳原子数的增加,烷烃中碳的质量分数逐渐增大,无限接近
B.随着碳原子数的增加,烯烃和炔烃中碳的质量分数逐渐减小,无限接近
C.脂肪烃及其同系物随着分子的相对分子质量的增大,熔、沸点逐渐增大
D.烷烃、烯烃、炔烃分类的根本依据是脂肪烃分子内的碳链长短
E.含有碳碳双键的不饱和烃一定属于不饱和脂肪烃
F.芳香烃一定含有苯环,含苯环的有机物一定属于芳香族化合物
G.烷烃、烯烃和炔烃都是随着碳原子数的增加,相对密度逐渐增大
BDE
脂肪烃的密度、熔、沸点都是随着碳原子数的增加而逐渐增大,故C、G正确;烷烃、烯烃和炔烃的分类依据为分子内碳原子的成键方式,故D错误;
含碳碳双键的不饱和烃,如 ,就不属于不饱和脂肪烃,而属于芳香烃,故E错误;
芳香烃一定含有苯环,含苯环的有机物属于芳香族化合物,故F正确。
2.有下列几种烷烃,其沸点由高到低的顺序为_______________________
________。
①丁烷 ②2-甲基丙烷 ③戊烷 ④2-甲基丁烷 ⑤2,2-二甲基丙烷
⑥2,2-二甲基丁烷 ⑦正己烷
对于烷烃而言,碳原子数越多、相对分子质量越大,分子间作用力越大,沸点越高,即沸点:⑥⑦>③④⑤>①②;对于含有相同碳原子数的烷烃,支链越多,沸点越低,即⑦>⑥、③>④>⑤、①>②,故有⑦>⑥>③>④>⑤>①>②。
⑦>⑥>③>④>⑤>
①>②
返回
烷烃的化学性质
二
1.烷烃及其结构
(1)烷烃:烷烃是一种 烃。
(2)结构特点
分子中碳原子之间以 结合,碳原子剩余的价键被 原子饱和。
(3)链烷烃的通式: 。
饱和
单键
氢
CnH2n+2(n≥1)
2.烷烃的化学性质
(1)稳定性:常温下烷烃很不活泼,与 、 、 等都不发生反应。
(2)特征反应——卤代反应
烷烃可与卤素单质在光照下发生取代反应生成卤代烃和卤化氢。
如丙烷和氯气的卤代反应:CH3CH2CH3+Cl2
_____________+HCl
CH3CH2CH2Cl
__________+HCl。
强酸
强碱
强氧化剂
(3)氧化反应——可燃性
烷烃可在空气或氧气中完全燃烧生成CO2和H2O,链烷烃燃烧的通式为
_____________________________________。
写出丙烷完全燃烧的化学方程式:___________________________。
(1)丙烷在光照条件下与氯气反应,只生成两种氯代物( )
(2)甲烷、乙烷和丙烷具有相似的化学性质( )
(3)在光照条件下,丙烷不但和氯气发生取代反应,也可以和氯水发生反应
( )
(4)烷烃的稳定性是相对的,有些含碳原子数多的烷烃可以使酸性KMnO4溶液褪色( )
(5)要制备纯净的CH3CH2Cl,可用CH3CH3和Cl2按物质的量之比1∶1反应
( )
(6)正丁烷和Cl2反应可生成2种一氯代物,两者互为同分异构体( )
×
正误判断
√
×
×
×
√
1.在光照条件下,等物质的量的乙烷和Cl2混合发生取代反应生成的有机产物只有一氯乙烷吗?
深度思考
提示 不是。乙烷与Cl2的取代反应是连续发生的,有机产物是一氯乙烷至六氯乙烷的混合物。
2.烷烃发生取代反应需要什么条件吗?产物有什么特点?
提示 (1)烷烃与卤素单质在室温下的黑暗环境中不发生反应,而在光照条件下能发生反应。
(2)烷烃发生取代反应时,分子中的氢原子能逐个被取代,得到不同卤代物的混合物。
(3)取代反应是“链式”反应。如乙烷与Cl2反应,生成的一氯乙烷可以继续与氯气在光照条件下发生取代反应,生成二氯乙烷……直至生成六氯乙烷。各步反应同时发生,每步只取代一个氢原子,难以得到纯净的有机物。
深度思考
应用体验
1.已知烷烃A的密度是相同条件下H2密度的36倍。
(1)烷烃A的分子式为_______。
(2)写出A可能存在的结构简式:
________________________________________________。
C5H12
CH3CH2CH2CH2CH3、CH3CH(CH3)CH2CH3、C(CH3)4
应用体验
(3)若A的某种同分异构体B的一氯代物只有一种。
①用系统命名法命名,B的名称为_______________。
②B与Cl2发生反应生成一氯代物的化学方程式为__________________
___________________。
③B燃烧的化学方程式为_______________________________。
2,2-二甲基丙烷
C(CH3)3CH2Cl+HCl
根据A的密度是相同条件下H2密度的36倍,推知其相对分子质量为72,设其分子式为CnH2n+2,求得n=5,则分子式为C5H12。
2.1 mol某烷烃完全燃烧消耗的O2为11 mol,则其主链上含有5个碳原子的同分异构体(不考虑立体异构)有
A.3种 B.6种 C.5种 D.7种
链烷烃的燃烧通式为CnH2n+2 nCO2+(n+1)H2O,1 mol某烷烃完全燃烧消耗的O2为11 mol,则 =11,解得n=7,该烷
烃的分子式为C7H16,主链有5个碳原子时,取代基是2个甲基的同分异构体有4种,取代基是乙基的同分异构体有1种,所以共有5种同分异构体。
√
返回
课时对点练
题组一 烃的分类
1.如图所示的有机物因为酷似奥运五元环而被称为奥运分子,则该有机物属于
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
A.苯的同系物 B.烃的衍生物
C.高分子化合物 D.芳香烃
√
有机物含有多个苯环、侧链也不是烷基,所以不是苯的同系物,故A错误;
有机物是烃类物质,不符合烃的衍生物的概念,故B错误;
该有机物不是高分子化合物,故C错误;
有机物仅有C、H两种元素的化合物,且含有苯环,属于芳香烃,故D正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
2.(2022·青岛高二期中)下列对烃的分类错误的是
A.乙烯、甲苯、环己烷都属于脂肪烃
B. 、 和 同属于环烷烃,也属于饱和烃
C.乙烯、乙炔、1,3-丁二烯同属于不饱和烃
D. 、 和 都属于芳香烃,但不都互为同系物
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
A项,乙烯、环己烷分子中不含有苯环,属于脂肪烃,甲苯分子中含有苯环,属于芳香烃,错误;
D项, 、 和 分子内都含苯环,属于芳香烃,但 分子内含一个不饱和的碳碳双键,且通式和苯的同系
物不同,与 、 不互为同系物,正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
题组二 烷烃的物理性质及变化规律
3.根据以下数据推断丙烷的沸点可能是
烷烃的熔、沸点随分子中碳原子数的增加而升高,丙烷的沸点应介于乙烷和正丁烷之间。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
物质 甲烷 乙烷 正丁烷 正戊烷
沸点 -164 ℃ -89 ℃ -0.5 ℃ 36 ℃
A.约-40 ℃ B.低于-164 ℃
C.低于-89 ℃ D.高于36 ℃
√
4.城市居民所用液化石油气的主要成分是丙烷、丁烷、丙烯和丁烯等,在使用过程中,常有一些液态杂质沉积于钢瓶底部,这些杂质可能是
A.甲烷和乙烷 B.乙烷和乙醇
C.乙烷和丁烷 D.戊烷和己烷
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
5.在1.01×105 Pa下,测得某些烷烃的沸点如表所示。据表分析,下列说法正确的是
A.在标准状况下新戊烷是气体
B.在1.01×105 Pa、20 ℃时,
C5H12都是液体
C.随着碳原子数的增加,烷烃
的沸点逐渐降低
D.随着C5H12支链的增加,沸点
逐渐降低
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
物质名称 沸点/℃
正丁烷CH3(CH2)2CH3 -0.5
正戊烷CH3(CH2)3CH3 36.1
异戊烷CH3CH2CH(CH3)2 27.9
新戊烷C(CH3)4 9.5
正己烷CH3(CH2)4CH3 68.7
由表中数据可知,新戊烷的沸点为9.5 ℃,所以在标准状况下其为液体,在1.01×105 Pa、20 ℃时新戊烷为气体,A、B项错误;
随着碳原子数的增加,烷烃的沸点逐渐升高,C项错误;
由C5H12同分异构体的沸点可知,随着烷烃支链的增加,沸点逐渐降低,D项正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
6.已知链烷烃A和B,A比B多一个碳原子,则下列说法正确的是
A.A的沸点比B高
B.A的相对密度比B小
C.一般情况下,同碳原子数的烷烃的沸点和密度低于烯烃
D.已知A在常温下为液态,则B也一定为液态
√
烷烃分子中碳原子数越多,则分子间作用力越大,沸点越高,密度越大。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
题组三 烷烃的结构与化学性质
7.下列关于烷烃的叙述正确的是
A.燃烧产物一定为二氧化碳和水
B.烷烃分子中碳原子不可能在同一平面上
C.在烷烃分子中,所有的化学键都为单键
D.任何烷烃分子中碳、氢原子个数之比都是相同的
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
烷烃中含有碳、氢元素,完全燃烧的产物为二氧化碳和水,但如果氧气不足,烷烃不完全燃烧,产物有可能为一氧化碳和水;烷烃中乙烷的2个碳原子可以在同一直线上,除此之外,多碳烷烃主链是锯齿形,碳原子可能在同一平面上;烷烃属于饱和烃,不存在不饱和键,分子中所有的化学键都为单键;链烷烃的通式为CnH2n+2,碳、氢原子个数之比为n∶(2n+2),碳原子数不同时碳、氢原子个数之比不同。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
8.实验室中用如图所示的装置进行甲烷与氯气在光照下反应的实验。
光照下反应一段时间后,下列装置示意图中能正确反映实验现象的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
甲烷与氯气在光照条件下发生取代反应,
故黄绿色的氯气减少,因此试管内气体颜
色逐渐变浅;反应生成的HCl极易溶于水,
使试管内气体压强减小,因此试管内液
面上升;生成的CH2Cl2、CHCl3、CCl4均为无色油状液体,附着在试管壁上,因此试管壁上出现无色油状液滴;生成的HCl气体遇到水蒸气溶解生成盐酸小液滴,形成白雾,因此试管中有少量白雾。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
9.在120 ℃、1.01×105 Pa时,将两种气态烃和足量的氧气混合点燃,相同条件下测得反应前后气体体积没有发生变化,这两种气体是
A.CH4、C2H4 B.CH4、C2H6
C.C2H2、C2H4 D.C6H6、C2H6
√
在温度高于或等于100 ℃条件下,当气态烃分子中含有4个氢原子时,该烃完全燃烧前后气体体积不变,结合选项可判断A项符合题意。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
10.在光照条件下,CH4与Cl2能发生取代反应。使1 mol CH4与Cl2反应,待反应完全后测得四种有机取代产物的物质的量之比n(CH3Cl)∶ n(CH2Cl2)∶n(CHCl3)∶n(CCl4)=3∶2∶1∶4,则消耗的Cl2的物质的量为
A.1.0 mol B.1.8 mol
C.2.2 mol D.2.6 mol
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
在光照条件下,1 mol CH4与Cl2能发生取代反应,测得四种有机取代产物的物质的量之比n(CH3Cl)∶n(CH2Cl2)∶n(CHCl3)∶n(CCl4)=3∶2∶1∶4,由碳原子守恒可知:n(CH3Cl)+n(CH2Cl2)+n(CHCl3)+n(CCl4)=1 mol,所以n(CH3Cl)=0.3 mol,n(CH2Cl2)=0.2 mol,n(CHCl3)=0.1 mol,n(CCl4)=0.4 mol,该四种取代产物中取代的n(H)=n(Cl)=0.3 mol×1+0.2 mol×2+0.1 mol×3+0.4 mol×4=2.6 mol,根据取代反应的特点可知,取代1 mol H,消耗1 mol Cl2,则消耗的n(Cl2)=n(H)=2.6 mol,D正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
11.分子中含有2~5个碳原子的直链烷烃沸点和标准燃烧热的数据见下表:
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
烷烃名称 乙烷 丙烷 丁烷 戊烷
沸点/℃ -89 -42 -0.5 36.0
标准燃烧热/ (kJ·mol-1) -1 559.8 -2 217.8 -2 653 -3 245
根据表中数据,下列判断错误的是
A.正庚烷在常温、常压下肯定不是气体
B.随分子中碳原子数增加,烷烃的标准燃烧热数值逐渐增大
C.随分子中碳原子数增加,烷烃沸点逐渐升高
D.随分子中碳原子数增加,烷烃沸点和标准燃烧热数值都成比例增加
√
由于正庚烷的相对分子质量大于戊烷,所以正庚烷在常温、常压下不是气体;随分子中碳原子数增加,烷烃沸点和标准燃烧热数值都增加,但是并不是成比例增加。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
12.燃烧0.1 mol两种气态烃的混合物,生成3.58 L CO2(标准状况)和3.60 g H2O,则混合气体中
A.一定有甲烷 B.一定有乙烷
C.一定无甲烷 D.一定有丙烷
√
生成n(CO2)= ≈0.16 mol,生成n(H2O)= =
0.2 mol,因此两种气态烃的平均组成为C1.6H4,根据混合物的平均组成可知,碳原子数小于1.6的烃只有甲烷,而另一种烃中氢原子数必为4,且碳原子数大于或等于2。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
13.(2021·天津耀华中学高二下期中)某烷是优良的有机溶剂,其球棍模型
为 ,X是它的一种同分异构体,且X分子的主链上含有4个碳原子,下列有关说法中正确的是
A.X分子中可能含有三个甲基
B.X的一氯代物可能有三种
C.将标准状况下2.24 L的X完全燃烧,使所生成的气体通过装有足量无水
CaCl2的干燥管,干燥管会增重12.6 g
D.X能使溴的四氯化碳溶液褪色
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
X的结构简式可能为(CH3)2CHCH(CH3)2或(CH3)3CCH2CH3,分子中都含有4个甲基,A项错误;
(CH3)2CHCH(CH3)2中有2种氢原子,一氯代物只有2种,(CH3)3CCH2CH3中有3种氢原子,一氯代物有3种,B项正确;
标准状况下X为液态,无法用气体摩尔体积进行计算,C项错误;
(CH3)2CHCH(CH3)2或(CH3)3CCH2CH3都属于烷烃,与溴的四氯化碳溶液互溶,不能使溴的四氯化碳溶液褪色,D项错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
14.烃A分子的空间结构为 (其中碳、氢原子已略去),因其分子中碳原子排列类似金刚石故名“金刚烷”,下列说法错误的是
A.金刚烷分子式是C10H16
B.金刚烷分子的二氯代物有4种
C.金刚烷分子由4个六元环组成
D.金刚烷分子的一氯代物有2种
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
A项,由结构可知,含4个 ,6个—CH2—,则分子式为C10H16,正确;
B项,金刚烷中氢有两种: 、—CH2—,故二氯取代时可以固定一个氯原子,移动另一个氯原子,①固定 ,故另一个氯原子可位于六元环的邻、间、对三种,②固定—CH2—,另一个氯原子可位于同环的1号、3号碳原子和异环的—CH2—位,有三种,所以二氯代物共6种,错误;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
C项,由金刚烷的键线式可知,分子内由碳原子构成的最小的环上有6个碳原子,这种环有4个,正确;
D项,含4个 ,6个—CH2—,含2种位置的氢原子,则一氯代物有
2种,正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
15.(1)写出下列各链烷烃的分子式。
①烷烃B的分子中含有200个氢原子:________。
链烷烃的通式为CnH2n+2,烷烃B的分子中含有200个氢原子,则2n+2=200,解得n=99,故B的分子式为C99H200。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
C99H200
②1 L烷烃D的蒸气完全燃烧时,生成同温同压下15 L水蒸气:_______。
②1 L烷烃D的蒸气完全燃烧时,生成同温同压下15 L水蒸气,根据氢原子守恒,分子中氢原子数目为 =30,链烷烃的通式为
CnH2n+2,则2n+2=30,解得n=14,故D的分子式为C14H30。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
C14H30
③0.01 mol烷烃E完全燃烧时,消耗标准状况下的氧气2.464 L:_______。
链烷烃燃烧的通式为CnH2n+2 nCO2+(n+1)H2O,
0.01 mol烷烃E完全燃烧时,消耗标准状况下的氧气2.464 L,
则0.01 mol× ×22.4 L·mol-1=2.464 L,解得n=7,故E的
分子式为C7H16。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
C7H16
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
(2)有两种气态烷烃的混合物,在标准状况下密度为1.16 g·L-1,则此混合物组成中一定含有的烃的化学式是______。该烃和氯气在光照下反应生成的有机物共有____种,其中______(填写化学式)在常温下呈气态。
CH3Cl
CH4
4
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
有两种气态烷烃的混合物,在标准状况下密度为1.16 g·L-1,该混合烃的平均摩尔质量为1.16 g·L-1 ×22.4 L·mol-1≈26 g·mol-1,即平均相对分子质量为26,相对分子质量小于26的烷烃是甲烷,其相对分子质量为16,其他烷烃相对分子质量都大于26,所以此混合物中一定有甲烷,化学式为CH4;该烃和氯气在光照下反应生成的有机物有一氯甲烷、二氯甲烷、三氯甲烷以及四氯化碳共4种,其中CH3Cl为气体。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
(3)燃烧法是测定有机化合物分子式的一种重要方法。完全燃烧0.1 mol某烃后,将生成的气体先通过足量的浓硫酸,浓硫酸增重9.0 g,再将剩余气体通过澄清石灰水,生成沉淀40 g。写出该烃可能的结构简式:_____________________________。
CH3CH2CH2CH3、CH3CH(CH3)2
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
将生成的气体先通过足量的浓硫酸,浓硫酸增重9.0 g,9.0 g为水的质量,则n(H2O)= =0.5 mol,n(H)=1 mol,再将剩余气体通过澄清石灰水,生成沉淀40 g,生成的沉淀为碳酸钙,可知n(CO2)=n(CaCO3)= =0.4 mol,可知1 mol烃含有4 mol C、10 mol H,则该烃分子式为C4H10,为丁烷,可能的结构简式为CH3CH2CH2CH3、CH3CH(CH3)2。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
16.利用甲烷与氯气发生卤代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组拟在实验室中模拟上述过程,其设计的模拟装置如下:
(1)B装置有三种功能:
①______________;
②______________;
③______________。
控制气流速度
均匀混合气体
干燥混合气体
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
根据题给信息及装置图可知B装置的作用为除去CH4及Cl2中的水分,同时使Cl2与CH4混合均匀,并通过观察气泡控制气流速度及比例。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
(2)设 =x,若理论上欲获得最多的氯化氢,则x值的取值范围为
______。
若理论上欲获取最多的HCl,应将CH4中的氢原子全部取代,故
应大于等于4。
x≥4
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
(3)D装置的石棉中均匀混有KI粉末,其作用是________________。
D中KI粉末可与未反应的Cl2反应,从而将其吸收。
吸收过量的氯气
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
(4)E装置的作用是_____(填字母)。
A.收集气体
B.吸收氯气
C.防止倒吸
D.吸收氯化氢
E为吸收HCl的装置,因HCl极易溶于水,故用球形干燥管防止倒吸。
CD
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
(5)在C装置中,经过一段时间的
强光照射,发现硬质玻璃管内壁
有黑色小颗粒产生,置换出黑色
小颗粒的化学方程式为________
_________________,可见有机反
应有很多副反应。
CH4+
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
因通入C装置的气体为CH4和Cl2,根据元素守恒可知,硬质玻璃管内壁的黑色小颗粒只能为碳,反应为CH4+2Cl2
C+4HCl。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
(6)E装置除生成盐酸外,还含有
机物,从E中分离出盐酸的最佳
方法为______(填字母,下同)。
A.萃取法 B.蒸馏法
C.过滤法 D.分液法
该装置还有缺陷,原因是没有进行尾气处理,其尾气的主要成分是______和______。
A.CH4 B.CH3Cl C.CH2Cl2 D.CHCl3 E.CCl4
A B
D
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
CH4与Cl2发生取代反应除生成HCl外,同时生成CH3Cl、CH2Cl2、CHCl3、CCl4的混合物,除CH3Cl为气体外,其余均为难溶于水的油状液体,可用分液法将其与盐酸分离。
返回
本课结束
专题3
第1课时
DIYIKESHI
烃的类别及脂肪烃的物理性质 / 烷烃的化学性质 / 课时对点练
脂肪烃的类别 烷烃的性质
专题3
核心素养
发展目标
1.能从化学键的饱和性等微观角度认识脂肪烃的结构及分类,能写出典型代表物的结构简式。
2.能通过CH4的性质,理解烷烃的化学性质,能书写相关反应的化学方程式。
内容索引
一、烃的类别及脂肪烃的物理性质
二、烷烃的化学性质
课时对点练
烃的类别及脂肪烃的物理性质
一
1.烃的组成、结构及其分类
(1)烃:仅由 两种元素组成的有机物。
(2)烃的分类
①根据分子中是否含有苯环,烃分为 和 。
②根据烃的结构,脂肪烃分为 脂肪烃(如烯烃、炔烃)和 脂
肪烃(如烷烃)。
碳、氢
脂肪烃
芳香烃
不饱和
饱和
2.脂肪烃的物理性质
(1)烷烃的物理性质
物理性质 变化规律
状态 随碳原子数的增加,常温下存在的状态由 态逐渐过渡
到 态、 态。当碳原子数小于或等于 时,烷烃在常温下呈气态
溶解性 都难溶于 ,易溶于________
气
液
固
4
水
有机溶剂
熔、沸点 随碳原子数的增加,熔、沸点逐渐 ,同种烷烃的
中,支链越多,熔、沸点越___
密度 随碳原子数的增加,密度逐渐 ,但比水的___
升高
不同异构体
低
增大
小
(2)烯烃、炔烃的物理性质
烯烃、炔烃的物理性质和烷烃相似。
(1)烷烃、烯烃、炔烃和苯的同系物都属于脂肪烃( )
(2)分子中含有苯环的烃一定属于芳香烃( )
(3)碳原子数小于4的烃常温下一定是气体( )
(4)碳原子数相同的烷烃、烯烃、炔烃,沸点相同( )
(5)丙烷分子中的三个碳原子一定不在同一直线上( )
(6)1-戊烯比2-甲基-1-戊烯的沸点高( )
×
正误判断
√
√
×
√
×
1.烷烃分子中所有的碳原子都在同一条直线上吗?
深度思考
提示 烷烃分子中碳原子之间结合成链状,链状不是呈“直线状”,而是呈锯齿状,链上还可分出支链,如图所示:
2.分子式符合通式CnH2n+2的两种有机物一定互为同系物吗?
提示 不一定。分子式符合通式CnH2n+2的有机物都属于烷烃,若碳原子数不同,结构相似,互为同系物;若碳原子数相同,碳架结构不同,则互为同分异构体。
深度思考
应用体验
1.下列有关脂肪烃的分类及物理性质,描述错误的是______(填字母)。
A.随着碳原子数的增加,烷烃中碳的质量分数逐渐增大,无限接近
B.随着碳原子数的增加,烯烃和炔烃中碳的质量分数逐渐减小,无限接近
C.脂肪烃及其同系物随着分子的相对分子质量的增大,熔、沸点逐渐增大
D.烷烃、烯烃、炔烃分类的根本依据是脂肪烃分子内的碳链长短
E.含有碳碳双键的不饱和烃一定属于不饱和脂肪烃
F.芳香烃一定含有苯环,含苯环的有机物一定属于芳香族化合物
G.烷烃、烯烃和炔烃都是随着碳原子数的增加,相对密度逐渐增大
BDE
脂肪烃的密度、熔、沸点都是随着碳原子数的增加而逐渐增大,故C、G正确;烷烃、烯烃和炔烃的分类依据为分子内碳原子的成键方式,故D错误;
含碳碳双键的不饱和烃,如 ,就不属于不饱和脂肪烃,而属于芳香烃,故E错误;
芳香烃一定含有苯环,含苯环的有机物属于芳香族化合物,故F正确。
2.有下列几种烷烃,其沸点由高到低的顺序为_______________________
________。
①丁烷 ②2-甲基丙烷 ③戊烷 ④2-甲基丁烷 ⑤2,2-二甲基丙烷
⑥2,2-二甲基丁烷 ⑦正己烷
对于烷烃而言,碳原子数越多、相对分子质量越大,分子间作用力越大,沸点越高,即沸点:⑥⑦>③④⑤>①②;对于含有相同碳原子数的烷烃,支链越多,沸点越低,即⑦>⑥、③>④>⑤、①>②,故有⑦>⑥>③>④>⑤>①>②。
⑦>⑥>③>④>⑤>
①>②
返回
烷烃的化学性质
二
1.烷烃及其结构
(1)烷烃:烷烃是一种 烃。
(2)结构特点
分子中碳原子之间以 结合,碳原子剩余的价键被 原子饱和。
(3)链烷烃的通式: 。
饱和
单键
氢
CnH2n+2(n≥1)
2.烷烃的化学性质
(1)稳定性:常温下烷烃很不活泼,与 、 、 等都不发生反应。
(2)特征反应——卤代反应
烷烃可与卤素单质在光照下发生取代反应生成卤代烃和卤化氢。
如丙烷和氯气的卤代反应:CH3CH2CH3+Cl2
_____________+HCl
CH3CH2CH2Cl
__________+HCl。
强酸
强碱
强氧化剂
(3)氧化反应——可燃性
烷烃可在空气或氧气中完全燃烧生成CO2和H2O,链烷烃燃烧的通式为
_____________________________________。
写出丙烷完全燃烧的化学方程式:___________________________。
(1)丙烷在光照条件下与氯气反应,只生成两种氯代物( )
(2)甲烷、乙烷和丙烷具有相似的化学性质( )
(3)在光照条件下,丙烷不但和氯气发生取代反应,也可以和氯水发生反应
( )
(4)烷烃的稳定性是相对的,有些含碳原子数多的烷烃可以使酸性KMnO4溶液褪色( )
(5)要制备纯净的CH3CH2Cl,可用CH3CH3和Cl2按物质的量之比1∶1反应
( )
(6)正丁烷和Cl2反应可生成2种一氯代物,两者互为同分异构体( )
×
正误判断
√
×
×
×
√
1.在光照条件下,等物质的量的乙烷和Cl2混合发生取代反应生成的有机产物只有一氯乙烷吗?
深度思考
提示 不是。乙烷与Cl2的取代反应是连续发生的,有机产物是一氯乙烷至六氯乙烷的混合物。
2.烷烃发生取代反应需要什么条件吗?产物有什么特点?
提示 (1)烷烃与卤素单质在室温下的黑暗环境中不发生反应,而在光照条件下能发生反应。
(2)烷烃发生取代反应时,分子中的氢原子能逐个被取代,得到不同卤代物的混合物。
(3)取代反应是“链式”反应。如乙烷与Cl2反应,生成的一氯乙烷可以继续与氯气在光照条件下发生取代反应,生成二氯乙烷……直至生成六氯乙烷。各步反应同时发生,每步只取代一个氢原子,难以得到纯净的有机物。
深度思考
应用体验
1.已知烷烃A的密度是相同条件下H2密度的36倍。
(1)烷烃A的分子式为_______。
(2)写出A可能存在的结构简式:
________________________________________________。
C5H12
CH3CH2CH2CH2CH3、CH3CH(CH3)CH2CH3、C(CH3)4
应用体验
(3)若A的某种同分异构体B的一氯代物只有一种。
①用系统命名法命名,B的名称为_______________。
②B与Cl2发生反应生成一氯代物的化学方程式为__________________
___________________。
③B燃烧的化学方程式为_______________________________。
2,2-二甲基丙烷
C(CH3)3CH2Cl+HCl
根据A的密度是相同条件下H2密度的36倍,推知其相对分子质量为72,设其分子式为CnH2n+2,求得n=5,则分子式为C5H12。
2.1 mol某烷烃完全燃烧消耗的O2为11 mol,则其主链上含有5个碳原子的同分异构体(不考虑立体异构)有
A.3种 B.6种 C.5种 D.7种
链烷烃的燃烧通式为CnH2n+2 nCO2+(n+1)H2O,1 mol某烷烃完全燃烧消耗的O2为11 mol,则 =11,解得n=7,该烷
烃的分子式为C7H16,主链有5个碳原子时,取代基是2个甲基的同分异构体有4种,取代基是乙基的同分异构体有1种,所以共有5种同分异构体。
√
返回
课时对点练
题组一 烃的分类
1.如图所示的有机物因为酷似奥运五元环而被称为奥运分子,则该有机物属于
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
A.苯的同系物 B.烃的衍生物
C.高分子化合物 D.芳香烃
√
有机物含有多个苯环、侧链也不是烷基,所以不是苯的同系物,故A错误;
有机物是烃类物质,不符合烃的衍生物的概念,故B错误;
该有机物不是高分子化合物,故C错误;
有机物仅有C、H两种元素的化合物,且含有苯环,属于芳香烃,故D正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
2.(2022·青岛高二期中)下列对烃的分类错误的是
A.乙烯、甲苯、环己烷都属于脂肪烃
B. 、 和 同属于环烷烃,也属于饱和烃
C.乙烯、乙炔、1,3-丁二烯同属于不饱和烃
D. 、 和 都属于芳香烃,但不都互为同系物
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
A项,乙烯、环己烷分子中不含有苯环,属于脂肪烃,甲苯分子中含有苯环,属于芳香烃,错误;
D项, 、 和 分子内都含苯环,属于芳香烃,但 分子内含一个不饱和的碳碳双键,且通式和苯的同系
物不同,与 、 不互为同系物,正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
题组二 烷烃的物理性质及变化规律
3.根据以下数据推断丙烷的沸点可能是
烷烃的熔、沸点随分子中碳原子数的增加而升高,丙烷的沸点应介于乙烷和正丁烷之间。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
物质 甲烷 乙烷 正丁烷 正戊烷
沸点 -164 ℃ -89 ℃ -0.5 ℃ 36 ℃
A.约-40 ℃ B.低于-164 ℃
C.低于-89 ℃ D.高于36 ℃
√
4.城市居民所用液化石油气的主要成分是丙烷、丁烷、丙烯和丁烯等,在使用过程中,常有一些液态杂质沉积于钢瓶底部,这些杂质可能是
A.甲烷和乙烷 B.乙烷和乙醇
C.乙烷和丁烷 D.戊烷和己烷
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
5.在1.01×105 Pa下,测得某些烷烃的沸点如表所示。据表分析,下列说法正确的是
A.在标准状况下新戊烷是气体
B.在1.01×105 Pa、20 ℃时,
C5H12都是液体
C.随着碳原子数的增加,烷烃
的沸点逐渐降低
D.随着C5H12支链的增加,沸点
逐渐降低
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
物质名称 沸点/℃
正丁烷CH3(CH2)2CH3 -0.5
正戊烷CH3(CH2)3CH3 36.1
异戊烷CH3CH2CH(CH3)2 27.9
新戊烷C(CH3)4 9.5
正己烷CH3(CH2)4CH3 68.7
由表中数据可知,新戊烷的沸点为9.5 ℃,所以在标准状况下其为液体,在1.01×105 Pa、20 ℃时新戊烷为气体,A、B项错误;
随着碳原子数的增加,烷烃的沸点逐渐升高,C项错误;
由C5H12同分异构体的沸点可知,随着烷烃支链的增加,沸点逐渐降低,D项正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
6.已知链烷烃A和B,A比B多一个碳原子,则下列说法正确的是
A.A的沸点比B高
B.A的相对密度比B小
C.一般情况下,同碳原子数的烷烃的沸点和密度低于烯烃
D.已知A在常温下为液态,则B也一定为液态
√
烷烃分子中碳原子数越多,则分子间作用力越大,沸点越高,密度越大。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
题组三 烷烃的结构与化学性质
7.下列关于烷烃的叙述正确的是
A.燃烧产物一定为二氧化碳和水
B.烷烃分子中碳原子不可能在同一平面上
C.在烷烃分子中,所有的化学键都为单键
D.任何烷烃分子中碳、氢原子个数之比都是相同的
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
烷烃中含有碳、氢元素,完全燃烧的产物为二氧化碳和水,但如果氧气不足,烷烃不完全燃烧,产物有可能为一氧化碳和水;烷烃中乙烷的2个碳原子可以在同一直线上,除此之外,多碳烷烃主链是锯齿形,碳原子可能在同一平面上;烷烃属于饱和烃,不存在不饱和键,分子中所有的化学键都为单键;链烷烃的通式为CnH2n+2,碳、氢原子个数之比为n∶(2n+2),碳原子数不同时碳、氢原子个数之比不同。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
8.实验室中用如图所示的装置进行甲烷与氯气在光照下反应的实验。
光照下反应一段时间后,下列装置示意图中能正确反映实验现象的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
甲烷与氯气在光照条件下发生取代反应,
故黄绿色的氯气减少,因此试管内气体颜
色逐渐变浅;反应生成的HCl极易溶于水,
使试管内气体压强减小,因此试管内液
面上升;生成的CH2Cl2、CHCl3、CCl4均为无色油状液体,附着在试管壁上,因此试管壁上出现无色油状液滴;生成的HCl气体遇到水蒸气溶解生成盐酸小液滴,形成白雾,因此试管中有少量白雾。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
9.在120 ℃、1.01×105 Pa时,将两种气态烃和足量的氧气混合点燃,相同条件下测得反应前后气体体积没有发生变化,这两种气体是
A.CH4、C2H4 B.CH4、C2H6
C.C2H2、C2H4 D.C6H6、C2H6
√
在温度高于或等于100 ℃条件下,当气态烃分子中含有4个氢原子时,该烃完全燃烧前后气体体积不变,结合选项可判断A项符合题意。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
10.在光照条件下,CH4与Cl2能发生取代反应。使1 mol CH4与Cl2反应,待反应完全后测得四种有机取代产物的物质的量之比n(CH3Cl)∶ n(CH2Cl2)∶n(CHCl3)∶n(CCl4)=3∶2∶1∶4,则消耗的Cl2的物质的量为
A.1.0 mol B.1.8 mol
C.2.2 mol D.2.6 mol
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
在光照条件下,1 mol CH4与Cl2能发生取代反应,测得四种有机取代产物的物质的量之比n(CH3Cl)∶n(CH2Cl2)∶n(CHCl3)∶n(CCl4)=3∶2∶1∶4,由碳原子守恒可知:n(CH3Cl)+n(CH2Cl2)+n(CHCl3)+n(CCl4)=1 mol,所以n(CH3Cl)=0.3 mol,n(CH2Cl2)=0.2 mol,n(CHCl3)=0.1 mol,n(CCl4)=0.4 mol,该四种取代产物中取代的n(H)=n(Cl)=0.3 mol×1+0.2 mol×2+0.1 mol×3+0.4 mol×4=2.6 mol,根据取代反应的特点可知,取代1 mol H,消耗1 mol Cl2,则消耗的n(Cl2)=n(H)=2.6 mol,D正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
11.分子中含有2~5个碳原子的直链烷烃沸点和标准燃烧热的数据见下表:
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
烷烃名称 乙烷 丙烷 丁烷 戊烷
沸点/℃ -89 -42 -0.5 36.0
标准燃烧热/ (kJ·mol-1) -1 559.8 -2 217.8 -2 653 -3 245
根据表中数据,下列判断错误的是
A.正庚烷在常温、常压下肯定不是气体
B.随分子中碳原子数增加,烷烃的标准燃烧热数值逐渐增大
C.随分子中碳原子数增加,烷烃沸点逐渐升高
D.随分子中碳原子数增加,烷烃沸点和标准燃烧热数值都成比例增加
√
由于正庚烷的相对分子质量大于戊烷,所以正庚烷在常温、常压下不是气体;随分子中碳原子数增加,烷烃沸点和标准燃烧热数值都增加,但是并不是成比例增加。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
12.燃烧0.1 mol两种气态烃的混合物,生成3.58 L CO2(标准状况)和3.60 g H2O,则混合气体中
A.一定有甲烷 B.一定有乙烷
C.一定无甲烷 D.一定有丙烷
√
生成n(CO2)= ≈0.16 mol,生成n(H2O)= =
0.2 mol,因此两种气态烃的平均组成为C1.6H4,根据混合物的平均组成可知,碳原子数小于1.6的烃只有甲烷,而另一种烃中氢原子数必为4,且碳原子数大于或等于2。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
13.(2021·天津耀华中学高二下期中)某烷是优良的有机溶剂,其球棍模型
为 ,X是它的一种同分异构体,且X分子的主链上含有4个碳原子,下列有关说法中正确的是
A.X分子中可能含有三个甲基
B.X的一氯代物可能有三种
C.将标准状况下2.24 L的X完全燃烧,使所生成的气体通过装有足量无水
CaCl2的干燥管,干燥管会增重12.6 g
D.X能使溴的四氯化碳溶液褪色
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
X的结构简式可能为(CH3)2CHCH(CH3)2或(CH3)3CCH2CH3,分子中都含有4个甲基,A项错误;
(CH3)2CHCH(CH3)2中有2种氢原子,一氯代物只有2种,(CH3)3CCH2CH3中有3种氢原子,一氯代物有3种,B项正确;
标准状况下X为液态,无法用气体摩尔体积进行计算,C项错误;
(CH3)2CHCH(CH3)2或(CH3)3CCH2CH3都属于烷烃,与溴的四氯化碳溶液互溶,不能使溴的四氯化碳溶液褪色,D项错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
14.烃A分子的空间结构为 (其中碳、氢原子已略去),因其分子中碳原子排列类似金刚石故名“金刚烷”,下列说法错误的是
A.金刚烷分子式是C10H16
B.金刚烷分子的二氯代物有4种
C.金刚烷分子由4个六元环组成
D.金刚烷分子的一氯代物有2种
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
A项,由结构可知,含4个 ,6个—CH2—,则分子式为C10H16,正确;
B项,金刚烷中氢有两种: 、—CH2—,故二氯取代时可以固定一个氯原子,移动另一个氯原子,①固定 ,故另一个氯原子可位于六元环的邻、间、对三种,②固定—CH2—,另一个氯原子可位于同环的1号、3号碳原子和异环的—CH2—位,有三种,所以二氯代物共6种,错误;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
C项,由金刚烷的键线式可知,分子内由碳原子构成的最小的环上有6个碳原子,这种环有4个,正确;
D项,含4个 ,6个—CH2—,含2种位置的氢原子,则一氯代物有
2种,正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
15.(1)写出下列各链烷烃的分子式。
①烷烃B的分子中含有200个氢原子:________。
链烷烃的通式为CnH2n+2,烷烃B的分子中含有200个氢原子,则2n+2=200,解得n=99,故B的分子式为C99H200。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
C99H200
②1 L烷烃D的蒸气完全燃烧时,生成同温同压下15 L水蒸气:_______。
②1 L烷烃D的蒸气完全燃烧时,生成同温同压下15 L水蒸气,根据氢原子守恒,分子中氢原子数目为 =30,链烷烃的通式为
CnH2n+2,则2n+2=30,解得n=14,故D的分子式为C14H30。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
C14H30
③0.01 mol烷烃E完全燃烧时,消耗标准状况下的氧气2.464 L:_______。
链烷烃燃烧的通式为CnH2n+2 nCO2+(n+1)H2O,
0.01 mol烷烃E完全燃烧时,消耗标准状况下的氧气2.464 L,
则0.01 mol× ×22.4 L·mol-1=2.464 L,解得n=7,故E的
分子式为C7H16。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
C7H16
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
(2)有两种气态烷烃的混合物,在标准状况下密度为1.16 g·L-1,则此混合物组成中一定含有的烃的化学式是______。该烃和氯气在光照下反应生成的有机物共有____种,其中______(填写化学式)在常温下呈气态。
CH3Cl
CH4
4
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
有两种气态烷烃的混合物,在标准状况下密度为1.16 g·L-1,该混合烃的平均摩尔质量为1.16 g·L-1 ×22.4 L·mol-1≈26 g·mol-1,即平均相对分子质量为26,相对分子质量小于26的烷烃是甲烷,其相对分子质量为16,其他烷烃相对分子质量都大于26,所以此混合物中一定有甲烷,化学式为CH4;该烃和氯气在光照下反应生成的有机物有一氯甲烷、二氯甲烷、三氯甲烷以及四氯化碳共4种,其中CH3Cl为气体。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
(3)燃烧法是测定有机化合物分子式的一种重要方法。完全燃烧0.1 mol某烃后,将生成的气体先通过足量的浓硫酸,浓硫酸增重9.0 g,再将剩余气体通过澄清石灰水,生成沉淀40 g。写出该烃可能的结构简式:_____________________________。
CH3CH2CH2CH3、CH3CH(CH3)2
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
将生成的气体先通过足量的浓硫酸,浓硫酸增重9.0 g,9.0 g为水的质量,则n(H2O)= =0.5 mol,n(H)=1 mol,再将剩余气体通过澄清石灰水,生成沉淀40 g,生成的沉淀为碳酸钙,可知n(CO2)=n(CaCO3)= =0.4 mol,可知1 mol烃含有4 mol C、10 mol H,则该烃分子式为C4H10,为丁烷,可能的结构简式为CH3CH2CH2CH3、CH3CH(CH3)2。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
16.利用甲烷与氯气发生卤代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组拟在实验室中模拟上述过程,其设计的模拟装置如下:
(1)B装置有三种功能:
①______________;
②______________;
③______________。
控制气流速度
均匀混合气体
干燥混合气体
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
根据题给信息及装置图可知B装置的作用为除去CH4及Cl2中的水分,同时使Cl2与CH4混合均匀,并通过观察气泡控制气流速度及比例。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
(2)设 =x,若理论上欲获得最多的氯化氢,则x值的取值范围为
______。
若理论上欲获取最多的HCl,应将CH4中的氢原子全部取代,故
应大于等于4。
x≥4
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
(3)D装置的石棉中均匀混有KI粉末,其作用是________________。
D中KI粉末可与未反应的Cl2反应,从而将其吸收。
吸收过量的氯气
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
(4)E装置的作用是_____(填字母)。
A.收集气体
B.吸收氯气
C.防止倒吸
D.吸收氯化氢
E为吸收HCl的装置,因HCl极易溶于水,故用球形干燥管防止倒吸。
CD
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
(5)在C装置中,经过一段时间的
强光照射,发现硬质玻璃管内壁
有黑色小颗粒产生,置换出黑色
小颗粒的化学方程式为________
_________________,可见有机反
应有很多副反应。
CH4+
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
因通入C装置的气体为CH4和Cl2,根据元素守恒可知,硬质玻璃管内壁的黑色小颗粒只能为碳,反应为CH4+2Cl2
C+4HCl。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
(6)E装置除生成盐酸外,还含有
机物,从E中分离出盐酸的最佳
方法为______(填字母,下同)。
A.萃取法 B.蒸馏法
C.过滤法 D.分液法
该装置还有缺陷,原因是没有进行尾气处理,其尾气的主要成分是______和______。
A.CH4 B.CH3Cl C.CH2Cl2 D.CHCl3 E.CCl4
A B
D
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
CH4与Cl2发生取代反应除生成HCl外,同时生成CH3Cl、CH2Cl2、CHCl3、CCl4的混合物,除CH3Cl为气体外,其余均为难溶于水的油状液体,可用分液法将其与盐酸分离。
返回
本课结束
专题3
