化学人教版(2019)选择性必修1 3.3.2 影响盐类水解的主要因素(共27张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 3.3.2 影响盐类水解的主要因素(共27张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 3.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-20 16:48:52 | ||
图片预览






文档简介
(共27张PPT)
第三章 水溶液中的离子反应与平衡
高二化学
3.2 影响盐类水解的主要因素
【情境导入】
【思考】
1、为何碳酸钠可用于去除油污,而碳酸氢钠很少这样应用?
2、为何碳酸氢钠可以用作胃药,而碳酸钠不可以?
生活中用纯碱溶液清洗油污时,加热还可增强去污力,这是为什么?
3、为何热纯碱溶液的去污效果比冷纯碱溶液的去污效果更好?
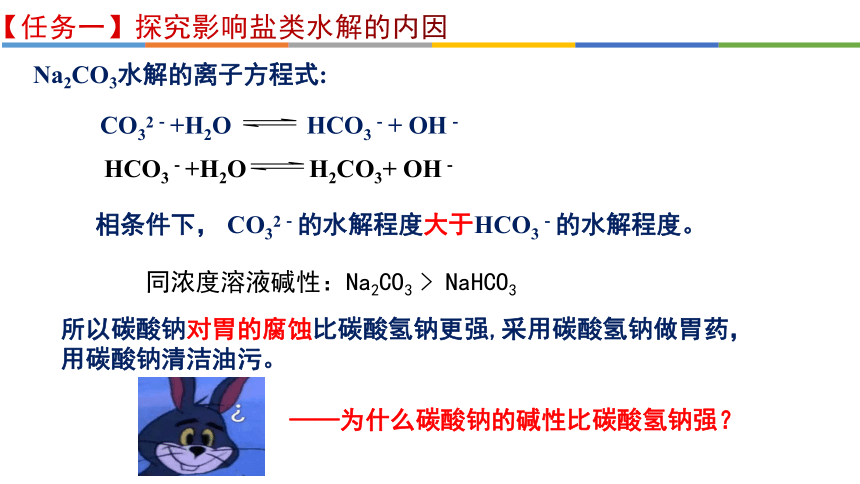
【任务一】探究影响盐类水解的内因
HCO3-+H2O H2CO3+ OH-
CO32-+H2O HCO3-+ OH-
Na2CO3水解的离子方程式:
相条件下, CO32-的水解程度大于HCO3-的水解程度。
同浓度溶液碱性:Na2CO3 > NaHCO3
所以碳酸钠对胃的腐蚀比碳酸氢钠更强,采用碳酸氢钠做胃药,用碳酸钠清洁油污。
——为什么碳酸钠的碱性比碳酸氢钠强?
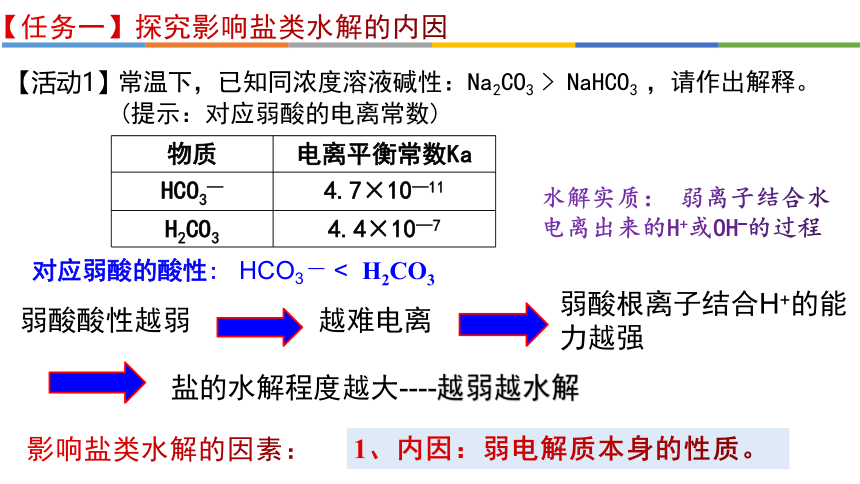
常温下,已知同浓度溶液碱性:Na2CO3 > NaHCO3 ,请作出解释。
物质 电离平衡常数Ka
HCO3— 4.7×10—11
H2CO3 4.4×10—7
对应弱酸的酸性:
HCO3 — < H2CO3
KW
【任务一】探究影响盐类水解的内因
(提示:对应弱酸的电离常数)
【活动1】
越难电离
弱酸根离子结合H+的能力越强
盐的水解程度越大----越弱越水解
弱酸酸性越弱
1、内因:弱电解质本身的性质。
水解实质: 弱离子结合水电离出来的H+或OH-的过程
影响盐类水解的因素:
【学习评价】
①>③>⑤>⑥>②>④>⑦>⑧
【学习评价】
2、物质的量浓度相同的三种盐NaX、NaY和NaZ的溶液,其pH分别为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序是( )
A、HX、HZ、HY B、HX、HY、HZ
C、HZ、HY、HX D、HY、HZ、HX
B
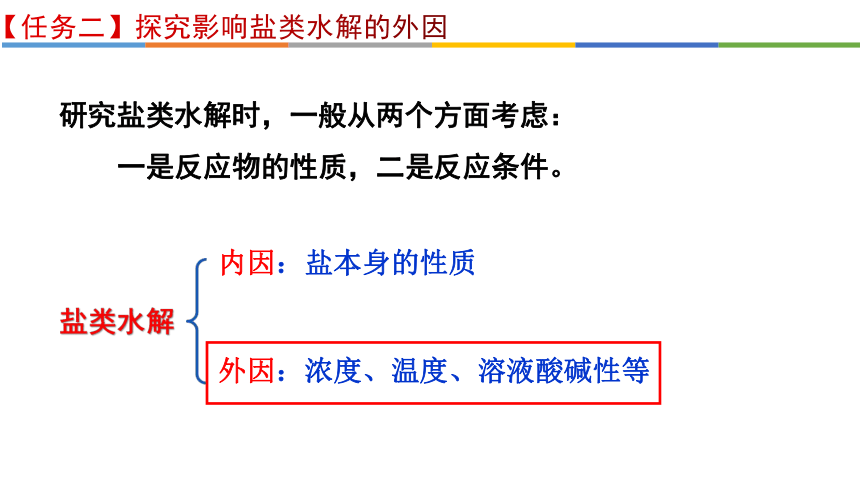
【任务二】探究影响盐类水解的外因
研究盐类水解时,一般从两个方面考虑:
一是反应物的性质,二是反应条件。
盐类水解
内因:盐本身的性质
外因:浓度、温度、溶液酸碱性等
影响盐类水解的因素:
2、外因
P75探究: 反应条件对FeCl3水解平衡的影响
[提出问题]
⑴FeCl3溶液呈酸性还是碱性?写出FeCl3发生水解的离子方程式。
⑵从反应条件考虑,影响FeCl3水解平衡的因素可能有哪些?
呈酸性
Fe3+ + 3H2O Fe(OH)3 + 3H+
温度、浓度(反应物/生成物)
谁强显谁性
【任务二】探究影响盐类水解的外因
实验探究1:温度对FeCl3水解平衡的影响
预测现象:
实验原理:
烧杯、三角架、pH计、酒精灯、火柴、0.01 mol/L FeCl3溶液
实验用品:
Fe3+ + 3H2O Fe(OH)3 + 3H+ ΔH >0
颜色加深,pH值减小
解释原因:
水解反应时吸热,升高温度,平衡向FeCl3水解的方向移动,溶液酸性增强。
FeCl3水解程度 。
增大
加热
常温
加热
常温
[结论]在其它条件不变时,升高温度,平衡向水解的方向移动。
越热越水解
【任务二】探究影响盐类水解的外因——温度
实验探究2:反应物浓度对FeCl3水解平衡的影响
预测现象:
实验原理:
量筒、试管、pH计、药匙、0.01 mol/L FeCl3溶液、FeCl3晶体
实验用品:
Fe3+ + 3H2O Fe(OH)3 + 3H+ ΔH >0
颜色加深,pH值减小
解释原因:
增大反应物浓度,平衡向FeCl3水解的方向移动,溶液酸性增强。
FeCl3水解程度 。
减小
[结论]在其它条件不变时,增大盐的浓度,平衡向水解反应方向移动,但盐的水解程度减小。
【任务二】探究影响盐类水解的外因——浓度
实验探究2:反应物浓度对FeCl3水解平衡的影响
思考与讨论1
【操作】向0.1 mol/L FeCl3溶液中加水稀释10倍,pH?
0.1 mol/L FeCl3溶液
0.01 mol/L FeCl3溶液
【结论】加水稀释,促进盐的水解,水解程度增大
【原理】Fe3+ + 3H2O Fe(OH)3 + 3H+ ΔH >0
越稀越水解
【任务二】探究影响盐类水解的外因——浓度
实验探究3:生成物浓度对FeCl3水解平衡的影响
预测现象:
实验原理:
量筒、试管、蒸馏水、0.01 mol/L FeCl3溶液、浓盐酸
实验用品:
Fe3+ + 3H2O Fe(OH)3 + 3H+ ΔH >0
颜色变浅
解释原因:
增大生成物浓度,FeCl3水解平衡逆向移动。
FeCl3水解程度 。
减小
加盐酸
加蒸馏水
【任务二】探究影响盐类水解的外因——浓度
实验探究3:生成物浓度对FeCl3水解平衡的影响
【实验步骤】向5mL0.1mol/LFeCl3溶液中加入5滴浓NaOH溶液 ?
思考与讨论2
【原理】Fe3+ + 3H2O Fe(OH)3 + 3H+
溶液颜色加深
【结论】
加碱,减小c(H+),FeCl3的水解平衡正向移动,促进Fe3+水解
【任务二】探究影响盐类水解的外因——浓度
实验探究3:生成物浓度对FeCl3水解平衡的影响
【实验步骤】向5mL0.1mol/LFeCl3溶液中加入5滴浓NaOH溶液 ?
思考与讨论2
【原理】Fe3+ + 3H2O Fe(OH)3 + 3H+
溶液颜色加深
【结论】
加碱,减小c(H+),FeCl3的水解平衡正向移动,促进Fe3+水解
【任务二】探究影响盐类水解的外因——浓度
实验探究4:外加盐对FeCl3水解平衡的影响
思考与讨论3
【原理】Fe3+ + 3H2O Fe(OH)3 + 3H+
【实验步骤】向5mL0.1mol/LFeCl3溶液中加入①加入少量AlCl3固体,②加入少量NaCl固体, ③加入少量NaHCO3固体,各有什么现象 ?
显酸性
显酸性,平衡逆移,溶液颜色变浅
平衡不移动,溶液颜色不变
显碱性,平衡正移,溶液颜色加深
① Al3+ + 3H2O Al(OH)3 + 3H+
③ HCO3- + H2O H2CO3+ OH-
②NaCl不水解
同性相抑,异性相促
【任务二】探究影响盐类水解的外因——酸碱性
【情境导入】
【思考】
1、为何碳酸钠可用于去除油污,而碳酸氢钠很少这样应用?
2、为何碳酸氢钠可以用作胃药,而碳酸钠不可以?
生活中用纯碱溶液清洗油污时,加热还可增强去污力,这是为什么?
3、为何热纯碱溶液的去污效果比冷纯碱溶液的去污效果更好?
【任务二】探究影响盐类水解的因素
影响盐类水解平衡的因素
一、内因
二、外因
——符合勒夏特列原理
越弱越水解
1、温度:
越热越水解
2、浓度
加盐(本身):
稀释:
加酸、加碱、加水解盐:
平衡正移,水解程度增大
平衡正移,水解程度增大
越稀越水解
平衡正移,水解程度减小
同性相抑,异性相促
【学习评价】
D
2、向三份0.1 mol/L CH3COONa溶液中分别加入少量NH4NO3、Na2SO3、FeCl3固体(忽略溶液体积变化),则CH3COO-浓度的变化依次为 ( )
A.减小、增大、减小 B.增大、减小、减小
C.减小、增大、增大 D.增大、减小、增大
A
1、在Al3++3H2O Al(OH)3+3H+的平衡体系中,要使平衡向水解方向移动,且使溶液的pH增大,应采取的措施是 ( )
A.加热 B.通入HCl
C.加入少量Na2SO4(s) D.加入NaCl溶液
【学习评价】
改变条件 平衡移动 c(H+) pH 水解程度 现象
加热
加水
少量FeCl3(s)
盐酸
少量NaOH(s)
加NaHCO3
加NH4Cl
加Mg
正向
增大
减小
增大
正向
减小
增大
增大
正向
增大
减小
减小
逆向
增大
减小
减小
正向
减小
增大
增大
正向
减小
增大
增大
颜色变深
颜色变浅
颜色变深
红褐↓无色↑
颜色变浅
红褐↓
练习3、在0.01mol/LFeCl3溶液中,Fe3++3H2O Fe(OH)3+3H+
逆向
减小
增大
减小
颜色变浅
正向
增大
减小
增大
红褐色↓无色↑
【学习评价】
Ⅹ
√
√
Ⅹ
√
课本P78——2题:
2、在实验室配制Na2S溶液时,常加人几滴NaOH溶液,试说明原因: _____________________________________________ 。
在Na2S溶液中存在S2-水解平衡:
S2-+H2O HS-+OH-,
加入几滴NaOH溶液,OH-浓度增大,
水解平衡左移,抑制Na2S水解。
应用勒夏特列原理的答题模板:
(1)写出存在的平衡的离子方程式,
(2) 改变… …条件,
(3)平衡移动方向,
(4)结果
【学习评价】
【拓展延伸】
弱酸根离子与弱碱阳离子的水解相互促进
【拓展延伸】——双水解
会发生完全水解的离子之间不能大量共存。
不完全水解的离子组合:NH4+与CH3COO-、CO32-、HCO3-
1.(2013广东,8)水溶液中能大量共存的一组离子是
A.Na+、Al3+、Cl—、CO32— B.H+、Na+、Fe2+、MnO4—
C.K+、Ca2+、Cl—、NO3— D.K+、NH4+、OH—、SO42—
C
2. Na2SiO3水溶液俗称水玻璃。取少量Na2SiO3溶液于试管中,逐滴
加入饱和NH4Cl溶液,振荡。写出实验现象并给予解释
________________________________________________。
现象:试管中有白色胶状沉淀生成,并且有刺激性气体生成。
解释:Na2SiO3和NH4Cl均能够水解,二者相互促进,
Na2SiO3水解生成H2SiO3,NH4Cl水解产生氨气。
【学习评价】
3. 相同物质的量浓度的①(NH4)2SO4 ②NH4Cl③(NH4)2Fe(SO4)2
④CH3COONH4溶液中, c(NH4+)由大到小的顺序是________________。
③①②④
4、草木灰和铵态氮肥不能混合施用,其原因是
_____________________________________________________________
5、一种常用泡沫灭火器的构造如图所示。内筒a是玻璃瓶,外筒b是钢瓶,筒内盛有液态试剂Al2(SO4)3溶液和饱和NaHCO3溶液,当遇火警时,将灭火器取下倒置,内、外筒液体试剂立即混合产生大量CO2泡沫灭火。从液态试剂在灭火器中长久放置和快速灭火两个角度分析,则a中盛______________,b中盛__________________。写出有关反应的离子方程式:__________________________________。
Al2(SO4)3溶液
饱和NaHCO3溶液
泡沫灭火器
金属铁质
塑料材质
酸性
碱性
有弱才水解,无弱不水解;
谁强显谁性,都强显中性。
越弱越水解,都弱双水解;
越热越水解,越稀越水解。
第三章 水溶液中的离子反应与平衡
高二化学
3.2 影响盐类水解的主要因素
【情境导入】
【思考】
1、为何碳酸钠可用于去除油污,而碳酸氢钠很少这样应用?
2、为何碳酸氢钠可以用作胃药,而碳酸钠不可以?
生活中用纯碱溶液清洗油污时,加热还可增强去污力,这是为什么?
3、为何热纯碱溶液的去污效果比冷纯碱溶液的去污效果更好?
【任务一】探究影响盐类水解的内因
HCO3-+H2O H2CO3+ OH-
CO32-+H2O HCO3-+ OH-
Na2CO3水解的离子方程式:
相条件下, CO32-的水解程度大于HCO3-的水解程度。
同浓度溶液碱性:Na2CO3 > NaHCO3
所以碳酸钠对胃的腐蚀比碳酸氢钠更强,采用碳酸氢钠做胃药,用碳酸钠清洁油污。
——为什么碳酸钠的碱性比碳酸氢钠强?
常温下,已知同浓度溶液碱性:Na2CO3 > NaHCO3 ,请作出解释。
物质 电离平衡常数Ka
HCO3— 4.7×10—11
H2CO3 4.4×10—7
对应弱酸的酸性:
HCO3 — < H2CO3
KW
【任务一】探究影响盐类水解的内因
(提示:对应弱酸的电离常数)
【活动1】
越难电离
弱酸根离子结合H+的能力越强
盐的水解程度越大----越弱越水解
弱酸酸性越弱
1、内因:弱电解质本身的性质。
水解实质: 弱离子结合水电离出来的H+或OH-的过程
影响盐类水解的因素:
【学习评价】
①>③>⑤>⑥>②>④>⑦>⑧
【学习评价】
2、物质的量浓度相同的三种盐NaX、NaY和NaZ的溶液,其pH分别为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序是( )
A、HX、HZ、HY B、HX、HY、HZ
C、HZ、HY、HX D、HY、HZ、HX
B
【任务二】探究影响盐类水解的外因
研究盐类水解时,一般从两个方面考虑:
一是反应物的性质,二是反应条件。
盐类水解
内因:盐本身的性质
外因:浓度、温度、溶液酸碱性等
影响盐类水解的因素:
2、外因
P75探究: 反应条件对FeCl3水解平衡的影响
[提出问题]
⑴FeCl3溶液呈酸性还是碱性?写出FeCl3发生水解的离子方程式。
⑵从反应条件考虑,影响FeCl3水解平衡的因素可能有哪些?
呈酸性
Fe3+ + 3H2O Fe(OH)3 + 3H+
温度、浓度(反应物/生成物)
谁强显谁性
【任务二】探究影响盐类水解的外因
实验探究1:温度对FeCl3水解平衡的影响
预测现象:
实验原理:
烧杯、三角架、pH计、酒精灯、火柴、0.01 mol/L FeCl3溶液
实验用品:
Fe3+ + 3H2O Fe(OH)3 + 3H+ ΔH >0
颜色加深,pH值减小
解释原因:
水解反应时吸热,升高温度,平衡向FeCl3水解的方向移动,溶液酸性增强。
FeCl3水解程度 。
增大
加热
常温
加热
常温
[结论]在其它条件不变时,升高温度,平衡向水解的方向移动。
越热越水解
【任务二】探究影响盐类水解的外因——温度
实验探究2:反应物浓度对FeCl3水解平衡的影响
预测现象:
实验原理:
量筒、试管、pH计、药匙、0.01 mol/L FeCl3溶液、FeCl3晶体
实验用品:
Fe3+ + 3H2O Fe(OH)3 + 3H+ ΔH >0
颜色加深,pH值减小
解释原因:
增大反应物浓度,平衡向FeCl3水解的方向移动,溶液酸性增强。
FeCl3水解程度 。
减小
[结论]在其它条件不变时,增大盐的浓度,平衡向水解反应方向移动,但盐的水解程度减小。
【任务二】探究影响盐类水解的外因——浓度
实验探究2:反应物浓度对FeCl3水解平衡的影响
思考与讨论1
【操作】向0.1 mol/L FeCl3溶液中加水稀释10倍,pH?
0.1 mol/L FeCl3溶液
0.01 mol/L FeCl3溶液
【结论】加水稀释,促进盐的水解,水解程度增大
【原理】Fe3+ + 3H2O Fe(OH)3 + 3H+ ΔH >0
越稀越水解
【任务二】探究影响盐类水解的外因——浓度
实验探究3:生成物浓度对FeCl3水解平衡的影响
预测现象:
实验原理:
量筒、试管、蒸馏水、0.01 mol/L FeCl3溶液、浓盐酸
实验用品:
Fe3+ + 3H2O Fe(OH)3 + 3H+ ΔH >0
颜色变浅
解释原因:
增大生成物浓度,FeCl3水解平衡逆向移动。
FeCl3水解程度 。
减小
加盐酸
加蒸馏水
【任务二】探究影响盐类水解的外因——浓度
实验探究3:生成物浓度对FeCl3水解平衡的影响
【实验步骤】向5mL0.1mol/LFeCl3溶液中加入5滴浓NaOH溶液 ?
思考与讨论2
【原理】Fe3+ + 3H2O Fe(OH)3 + 3H+
溶液颜色加深
【结论】
加碱,减小c(H+),FeCl3的水解平衡正向移动,促进Fe3+水解
【任务二】探究影响盐类水解的外因——浓度
实验探究3:生成物浓度对FeCl3水解平衡的影响
【实验步骤】向5mL0.1mol/LFeCl3溶液中加入5滴浓NaOH溶液 ?
思考与讨论2
【原理】Fe3+ + 3H2O Fe(OH)3 + 3H+
溶液颜色加深
【结论】
加碱,减小c(H+),FeCl3的水解平衡正向移动,促进Fe3+水解
【任务二】探究影响盐类水解的外因——浓度
实验探究4:外加盐对FeCl3水解平衡的影响
思考与讨论3
【原理】Fe3+ + 3H2O Fe(OH)3 + 3H+
【实验步骤】向5mL0.1mol/LFeCl3溶液中加入①加入少量AlCl3固体,②加入少量NaCl固体, ③加入少量NaHCO3固体,各有什么现象 ?
显酸性
显酸性,平衡逆移,溶液颜色变浅
平衡不移动,溶液颜色不变
显碱性,平衡正移,溶液颜色加深
① Al3+ + 3H2O Al(OH)3 + 3H+
③ HCO3- + H2O H2CO3+ OH-
②NaCl不水解
同性相抑,异性相促
【任务二】探究影响盐类水解的外因——酸碱性
【情境导入】
【思考】
1、为何碳酸钠可用于去除油污,而碳酸氢钠很少这样应用?
2、为何碳酸氢钠可以用作胃药,而碳酸钠不可以?
生活中用纯碱溶液清洗油污时,加热还可增强去污力,这是为什么?
3、为何热纯碱溶液的去污效果比冷纯碱溶液的去污效果更好?
【任务二】探究影响盐类水解的因素
影响盐类水解平衡的因素
一、内因
二、外因
——符合勒夏特列原理
越弱越水解
1、温度:
越热越水解
2、浓度
加盐(本身):
稀释:
加酸、加碱、加水解盐:
平衡正移,水解程度增大
平衡正移,水解程度增大
越稀越水解
平衡正移,水解程度减小
同性相抑,异性相促
【学习评价】
D
2、向三份0.1 mol/L CH3COONa溶液中分别加入少量NH4NO3、Na2SO3、FeCl3固体(忽略溶液体积变化),则CH3COO-浓度的变化依次为 ( )
A.减小、增大、减小 B.增大、减小、减小
C.减小、增大、增大 D.增大、减小、增大
A
1、在Al3++3H2O Al(OH)3+3H+的平衡体系中,要使平衡向水解方向移动,且使溶液的pH增大,应采取的措施是 ( )
A.加热 B.通入HCl
C.加入少量Na2SO4(s) D.加入NaCl溶液
【学习评价】
改变条件 平衡移动 c(H+) pH 水解程度 现象
加热
加水
少量FeCl3(s)
盐酸
少量NaOH(s)
加NaHCO3
加NH4Cl
加Mg
正向
增大
减小
增大
正向
减小
增大
增大
正向
增大
减小
减小
逆向
增大
减小
减小
正向
减小
增大
增大
正向
减小
增大
增大
颜色变深
颜色变浅
颜色变深
红褐↓无色↑
颜色变浅
红褐↓
练习3、在0.01mol/LFeCl3溶液中,Fe3++3H2O Fe(OH)3+3H+
逆向
减小
增大
减小
颜色变浅
正向
增大
减小
增大
红褐色↓无色↑
【学习评价】
Ⅹ
√
√
Ⅹ
√
课本P78——2题:
2、在实验室配制Na2S溶液时,常加人几滴NaOH溶液,试说明原因: _____________________________________________ 。
在Na2S溶液中存在S2-水解平衡:
S2-+H2O HS-+OH-,
加入几滴NaOH溶液,OH-浓度增大,
水解平衡左移,抑制Na2S水解。
应用勒夏特列原理的答题模板:
(1)写出存在的平衡的离子方程式,
(2) 改变… …条件,
(3)平衡移动方向,
(4)结果
【学习评价】
【拓展延伸】
弱酸根离子与弱碱阳离子的水解相互促进
【拓展延伸】——双水解
会发生完全水解的离子之间不能大量共存。
不完全水解的离子组合:NH4+与CH3COO-、CO32-、HCO3-
1.(2013广东,8)水溶液中能大量共存的一组离子是
A.Na+、Al3+、Cl—、CO32— B.H+、Na+、Fe2+、MnO4—
C.K+、Ca2+、Cl—、NO3— D.K+、NH4+、OH—、SO42—
C
2. Na2SiO3水溶液俗称水玻璃。取少量Na2SiO3溶液于试管中,逐滴
加入饱和NH4Cl溶液,振荡。写出实验现象并给予解释
________________________________________________。
现象:试管中有白色胶状沉淀生成,并且有刺激性气体生成。
解释:Na2SiO3和NH4Cl均能够水解,二者相互促进,
Na2SiO3水解生成H2SiO3,NH4Cl水解产生氨气。
【学习评价】
3. 相同物质的量浓度的①(NH4)2SO4 ②NH4Cl③(NH4)2Fe(SO4)2
④CH3COONH4溶液中, c(NH4+)由大到小的顺序是________________。
③①②④
4、草木灰和铵态氮肥不能混合施用,其原因是
_____________________________________________________________
5、一种常用泡沫灭火器的构造如图所示。内筒a是玻璃瓶,外筒b是钢瓶,筒内盛有液态试剂Al2(SO4)3溶液和饱和NaHCO3溶液,当遇火警时,将灭火器取下倒置,内、外筒液体试剂立即混合产生大量CO2泡沫灭火。从液态试剂在灭火器中长久放置和快速灭火两个角度分析,则a中盛______________,b中盛__________________。写出有关反应的离子方程式:__________________________________。
Al2(SO4)3溶液
饱和NaHCO3溶液
泡沫灭火器
金属铁质
塑料材质
酸性
碱性
有弱才水解,无弱不水解;
谁强显谁性,都强显中性。
越弱越水解,都弱双水解;
越热越水解,越稀越水解。
