专题4 第二单元 醛 羧酸 第2课时 羧酸的性质及应用(共75张ppt)
文档属性
| 名称 | 专题4 第二单元 醛 羧酸 第2课时 羧酸的性质及应用(共75张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-20 20:15:19 | ||
图片预览











文档简介
(共75张PPT)
第2课时
DIERKESHI
羧酸的结构与分类 / 羧酸的性质 / 酯化反应原理的应用 / 课时对点练
专题4
羧酸的性质及应用
核心素养
发展目标
1.能从羧基的成键方式的角度,了解羧酸的结构特点和分类,理解羧酸、酯的化学性质及官能团与反应类型之间的关系。
2.结合乙酸乙酯水解反应的原理,能推理出羧酸酯化反应、酯类物质水解反应后的产物。
内容索引
一、羧酸的结构与分类
二、羧酸的性质
三、酯化反应原理的应用
课时对点练
羧酸的结构与分类
一
1.羧酸的组成和结构
(1)羧酸:分子中烃基(或氢原子)与 相连的化合物。官能团为
___________。
(2)通式:饱和一元羧酸的通式:CnH2nO2(n≥1,n为整数)或_____________________________。
羧基
CnH2n+1COOH(n≥0,n为整数)
2.羧酸的分类
(1)按分子中烃基的结构分类
羧酸
脂肪酸:如乙酸、C17H35COOH
芳香酸:如
(2)按分子中羧基的个数分类
羧酸
一元酸:如乙酸( )
二元酸:如草酸(HOOC—COOH)
多元酸
CH3COOH
(3)按分子中烃基所含碳原子数分类
羧酸
(1)乙酸可看作乙烷中的一个氢原子被羧基取代后的产物( )
(2)软脂酸(C15H31COOH)属于饱和高级脂肪酸( )
(3)羧基官能团可以简写成—COOH或者HOOC—( )
(4)乙酸、草酸、硬脂酸和石炭酸均属于羧酸类有机物( )
(5)乙酸和乙醇的分子中都含有羟基,所以乙酸与乙醇的性质相似( )
(6)乙酸、硬脂酸、油酸互为同系物( )
×
正误判断
√
√
×
×
×
应用体验
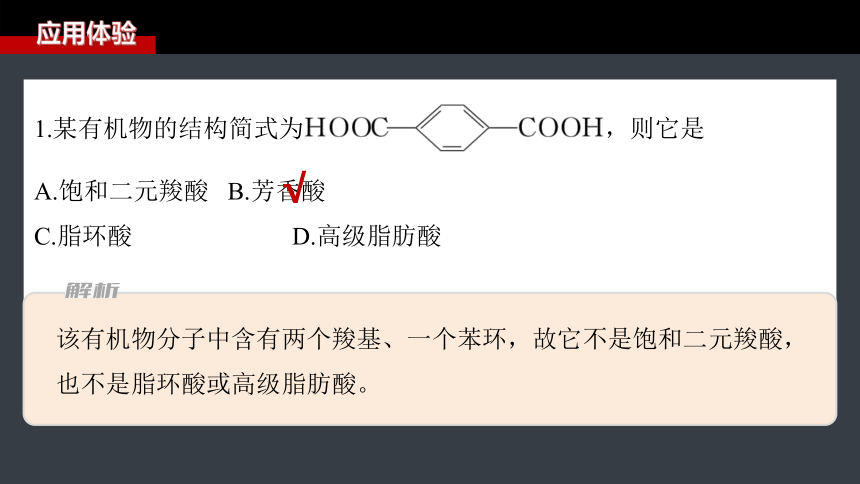
1.某有机物的结构简式为 ,则它是
A.饱和二元羧酸 B.芳香酸
C.脂环酸 D.高级脂肪酸
√
该有机物分子中含有两个羧基、一个苯环,故它不是饱和二元羧酸,也不是脂环酸或高级脂肪酸。
2.分子式为C5H10O2并能与饱和NaHCO3溶液反应放出气体的有机物有(不含立体异构)
A.3种 B.4种 C.5种 D.6种
√
能与NaHCO3反应放出气体说明该有机物为羧酸,将C5H10O2改写为C4H9—COOH;C4H9—有4种结构,故该有机物有4种,即:CH3CH2CH2CH2COOH、 、 、
。
返回
羧酸的性质
二
1.羧酸的通性
羧酸的化学性质与乙酸相似,主要取决于官能团羧基。
(1)由于—COOH能电离出H+,使羧酸具有弱酸性。羧酸具有酸的通性:
RCOOH 。
羧酸可与氢氧化物作用,生成羧酸盐:RCOOH+NaOH―→ 。
羧酸的酸性比碳酸强,可与碳酸钠或碳酸氢钠作用生成羧酸钠:
2RCOOH+Na2CO3―→ 。
RCOOH+NaHCO3―→ 。
酚不溶于碳酸氢钠溶液,可以利用上述反应区分 。羧酸的酸性一般比 弱,当向羧酸盐中加入无机酸后,羧酸又可游离出来。
RCOO-+H+
RCOONa+H2O
2RCOONa+CO2↑+H2O
RCOONa+CO2↑+H2O
羧酸和酚
无机酸
(2)羧酸与醇发生酯化反应时,一般情况下,羧酸脱去 ,醇脱去 。
如:RCOOH+R′—OH 。
RCOOR′+H2O
羟基
氢
2.实验探究乙酸乙酯的制备与性质
(1)制备实验
实验操作
实验现象 饱和碳酸钠溶液的液面上有无色透明的 溶于水的______
_____产生,可闻到_____
有关化学方程式
____________________________________________________
+H—O—C2H5 +H2O
不
油状
液体
香味
(2)性质实验
实验操作
实验现象 A试管较长时间内酯层厚度 ,乙酸乙酯气味很浓;B试管酯层厚度 ,略有乙酸乙酯的气味;C试管酯层_________,无乙酸乙酯的气味
实验结论 乙酸乙酯在中性条件下基本 水解;酸性条件下 水解;碱性条件下 水解
基本不变
减小
基本消失
不
大部分
全部
(3)酯水解反应的化学方程式
①酸性条件下水解
RCOOR′+H2O 。
②碱性条件下水解
RCOOR′+NaOH 。
RCOOH+R′OH
RCOONa+R′OH
3.常见的羧酸
(1)几种常见羧酸比较
甲酸 苯甲酸 乙二酸
俗名 _____ 安息香酸 _____
结构简式 ________ ____________
_______
色、态、味 无色液体、 气味 白色针状晶体、易升华 无色透明晶体
溶解性 溶于水、乙醇 微溶于水、易溶于有机溶剂 能溶于水、乙醇
HCOOH
蚁酸
草酸
刺激性
易
(2)甲酸的结构特点与化学性质
①羧基的性质
试剂 化学方程式
NaOH 与NaOH反应生成HCOONa,化学方程式为________________
__________________
乙醇 与乙醇发生酯化反应,化学方程式为_____________________
_______________________
HCOOH+NaOH
HCOOH+CH3CH2OH
―→HCOONa+H2O
HCOOC2H5+H2O
②醛基的性质
甲酸能发生银镜反应,也能与新制的Cu(OH)2反应:
HCOOH+2Ag(NH3)2OH (NH4)2CO3+2Ag↓+2NH3+H2O
HCOOH+2Cu(OH)2+2NaOH Cu2O↓+4H2O+Na2CO3
注意 甲酸与新制的Cu(OH)2混合,若加热二者发生氧化反应,若不加热二者发生酸碱中和反应。
(1)分子式相同的羧酸和酯类互为同分异构体( )
(2)在碱性条件下的水解反应和酯化反应都是可逆反应( )
(3)1 mol C2H5OH和1 mol CH3COOH在浓硫酸作用下加热可以完全反应生成1 mol CH3COOC2H5( )
(4)乙酸分子中含有碳氧双键,一定条件下乙酸能与氢气发生加成反应( )
(5)乙酸显酸性,电离出H+,因此发生酯化反应时断裂H—O( )
√
正误判断
×
×
×
×
1.在乙酸和乙醇的酯化反应实验中应注意哪些事项?
深度思考
提示 (1)试剂的加入顺序:乙醇―→浓硫酸和冰醋酸,不能先加浓硫酸。
(2)加入碎瓷片,防止暴沸。
(3)要用酒精灯小心加热,防止液体剧烈沸腾、乙酸和乙醇大量挥发。
(4)乙酸乙酯蒸气的导管不能插入饱和Na2CO3溶液中,以防止倒吸。
(5)若将制得的乙酸乙酯分离出来,可用分液漏斗进行分离,得到的上层油状液体即为乙酸乙酯。
(6)饱和碳酸钠溶液的作用:中和挥发出来的乙酸;吸收挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,以便使乙酸乙酯分层析出。
2.由于甲酸( )的特殊结构使其表现特有的性质。
(1)甲酸中加入新制的氢氧化铜,可能的现象:________________________,
反应的化学方程式:_________________________________________。
(2)若在新制的氢氧化铜中滴入少量甲酸并加热,产生红色沉淀,其原因是_____________________________________________________________
_____。
深度思考
蓝色的悬浊液变为蓝色溶液
2HCOOH+Cu(OH)2 (HCOO)2Cu+2H2O
甲酸中含有醛基,具有还原性,将新制的氢氧化铜还原为红色的Cu2O沉淀
应用体验
1.在浓硫酸催化作用下,醋酸与乙醇共热制备乙酸乙酯。
(1)通常乙醇过量,其目的是_________________。
(2)在实际制备时通过反应回流和产物蒸馏提纯两个步骤。第一步反应回流的装置如图,反应回流的目的是_________________________________
_________。
提高乙酸的转化率
减少乙醇、乙酸的挥发,提高乙酸乙
酯的产率
2.已知某有机物的结构简式为 。
请回答下列问题:
(1)当和_____________反应时,可转化为 。
NaHCO3溶液
首先判断出该有机物所含官能团为羧基(—COOH)、酚羟基(—OH)和醇羟基(—OH),然后判断各官能团的活泼性:羧基>酚羟基>醇羟基,最后利用官能团的性质解答。由于酸性:—COOH>H2CO3>
> ,所以题中应加入NaHCO3溶液,只与—COOH反应。
(2)当和____________________反应时,可转化为 。
题中加入NaOH或Na2CO3溶液,与酚羟基和—COOH反应。
NaOH(或Na2CO3)溶液
(3)当和_____反应时,可转化为 。
题中加入Na,与三种官能团都反应。
Na
思维启迪
醇、酚、羧酸分子中羟基氢原子的活泼性比较
名称 乙醇 苯酚 乙酸
结构简式 CH3CH2OH CH3COOH
羟基氢原子的活泼性 不能电离 能电离 能电离
酸性 中性 极弱酸性 弱酸性
思维启迪
由上表可知,常见分子(离子)中羟基氢原子的活泼性顺序为RCOOH>
H2CO3> > >ROH。运用上述实验现象的不同,
可判断有机物分子结构中含有的羟基类型。
返回
与Na反应 反应放出H2 反应放出H2 反应放出H2
与NaOH反应 不反应 反应 反应
与Na2CO3反应 不反应 反应 反应
与NaHCO3反应 不反应 不反应 反应
酯化反应原理的应用
三
1.酯化反应原理
+H—18OR′ __________________。
+H2O
2.生成链状酯
(1)一元羧酸与一元醇的酯化反应
RCOOH+HOR′ 。
(2)一元羧酸与二元醇(或二元羧酸与一元醇)的酯化反应
2CH3COOH+HOCH2CH2OH _____________________________。
HOOC—COOH+2CH3CH2OH ____________________________
_____。
RCOOR′+H2O
CH3COOCH2CH2OOCCH3+2H2O
CH3CH2OOC—COOCH2CH3+
2H2O
3.生成环状酯
(1)二元羧酸与二元醇的酯化反应
(2)羟基酸自身酯化反应
。
。
(3)羟基酸分子内脱水生成酯
HOCH2CH2CH2COOH ______________________。
+H2O
4.生成聚酯
(1)二元羧酸与二元醇的缩聚反应
+nHO—CH2CH2—OH―→____________
_____________________________________。
(2n-1)H2O+
(2)羟基酸的自身缩聚反应
______________________________。
+(n-1)H2O
应用体验
1.(2022·山东菏泽高二期中)山梨酸是一种高效安全的防腐保鲜剂。其合成反应如图,下列说法正确的是
CH3CH==CHCHO(巴豆醛)+CH2(COOH)2(丙二酸) CH3CH==
CHCH==CHCOOH(山梨酸)
A.巴豆醛与丙二酸生成山梨酸属于取代反应
B.一定条件下,丙二酸能与乙二醇发生酯化反应生成六元环状酯类化合物
C.可用酸性高锰酸钾溶液检验山梨酸中是否含有巴豆醛
D.山梨酸与K2CO3溶液反应可生成水溶性更好的山梨酸钾
√
巴豆醛与丙二酸生成山梨酸有新的碳碳双键形成,不属于取代反应,A错误;
一定条件下,丙二酸能与乙二醇发生酯化反应生成七元环状酯类化
合物 ,B错误;
山梨酸含羧基,与K2CO3溶液反应可生成山梨酸钾,山梨酸钾是离子化合物,水溶性更好,D正确。
2.有机物A的结构简式为 ,据此回答下列问题:
(1)A的分子式为__________。
(2)A在NaOH溶液中加热,经酸化得到有机物B和D,D是芳香族化合物,当有1 mol A发生反应时,最多消耗____ mol NaOH。
C12H14O5
2
1 mol A在NaOH溶液中加热,生成 、 ,
最多消耗2 mol NaOH。
(3)B在一定条件下发生酯化反应可生成某五元环酯,该五元环酯的结构
简式为____________。
B为 ,在浓硫酸加热的条件下自身发生酯化反应,
生成的五元环酯为 。
返回
课时对点练
题组一 羧酸的组成和结构
1.下列物质中,属于饱和一元脂肪酸的是
A.乙二酸 B.苯甲酸 C.硬脂酸 D.石炭酸
√
乙二酸为二元脂肪酸,分子中含有两个羧基;苯甲酸中含苯环,不属于饱和一元脂肪酸;硬脂酸(C17H35COOH)分子中含有烷基和一个羧基,属于饱和一元脂肪酸;石炭酸为苯酚,属于酚类,不属于羧酸。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
2.下列有机物中,互为同系物的是
A.甲酸与油酸 B.乙酸和丙烯酸
C.硬脂酸和油酸 D.甲酸与硬脂酸
√
同系物是结构相似,组成上相差一个或若干个“CH2”原子团的有机物。甲酸、硬脂酸和乙酸为饱和一元羧酸,互为同系物。丙烯酸和油酸为一元酸,且均含有一个碳碳双键,互为同系物。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
3.将甲基、羟基、羧基和苯基四种不同的原子团两两结合后形成的化合物的水溶液呈酸性的有机物有
A.2种 B.3种 C.4种 D.5种
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
水溶液呈酸性的有机物可以是羧酸或酚,四种原子团两两结合后形成
的化合物的水溶液呈酸性的有:CH3COOH、 、
和 ,但是 为无机物,故选B。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
题组二 羧酸的性质与应用
4.(2021·重庆高二阶段练习)COVID-19病毒具有非常强的传染性,公共环境消毒是防控新型冠状病毒传播的有效措施之一。75%乙醇、次氯酸钠溶液、过氧乙酸(CH3COOOH)溶液、过氧化氢溶液等均可有效灭活环境中的COVID-19病毒。下列说法错误的是
A.COVID-19病毒疫苗运输过程中应冷藏保存
B.乙醇溶液中乙醇的体积分数越高,消毒杀菌效果就越好
C.次氯酸钠、过氧乙酸和过氧化氢在灭活病毒过程中都利用了它们的氧化性
D.过氧乙酸的摩尔质量为76 g·mol-1
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
疫苗的主要成分是蛋白质,高温会变性,故应冷藏储存,故A正确;
浓度高的乙醇可使细胞外形成一层保护膜,高于75%消毒杀菌效果差,不具有良好的消毒杀菌能力,一般用75%乙醇溶液做医用酒精,故B错误;
次氯酸钠、过氧乙酸和过氧化氢均具有强氧化性,能将蛋白质氧化从而使其变性,达到消毒的目的,故C正确;
摩尔质量的单位为g·mol-1,和该物质的相对分子质量在数值上相等,过氧乙酸(CH3COOOH)的相对分子质量为76,故摩尔质量为76 g·mol-1,故D正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
5.某甲酸溶液中可能存在着甲醛,下列操作能正确说明的是
A.加入新制的Cu(OH)2加热,有红色沉淀生成,证明一定存在甲醛
B.能发生银镜反应,证明含甲醛
C.溶液与足量NaOH溶液混合,其蒸馏产物可发生银镜反应,则有甲醛
D.先将溶液充分进行酯化反应,收集生成物进行银镜反应,有银镜产
生,则含甲醛
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
甲酸( )与甲醛( )含有相同的结构 ,因此二者均可发生银镜反应,或与新制的Cu(OH)2反应产生红色沉淀。若要证明溶液中存在着甲醛,可使溶液与足量NaOH溶液反应,生成沸点高的甲酸钠溶液,这时蒸馏,得到低沸点的甲醛,可用银氨溶液或新制的Cu(OH)2加以鉴定。D项中将溶液进行酯化反应,由于酯化反应是可逆反应,生成物中还是含有甲酸,并且生成的甲酸酯中也含有醛基,因而无法鉴别。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
6.(2022·菏泽高二期末)甲酸、乙酸、碳酸、苯酚的酸性由强到弱的顺序是
A.碳酸、苯酚、甲酸、乙酸 B.甲酸、乙酸、碳酸、苯酚
C.甲酸、碳酸、苯酚、乙酸 D.苯酚、碳酸、乙酸、甲酸
√
饱和一元羧酸随着碳原子个数的增加,酸性依次减弱,则甲酸的酸性强于乙酸;羧酸的酸性强于碳酸,则乙酸的酸性强于碳酸;碳酸的酸性强于苯酚,则酸性由强到弱的顺序是甲酸、乙酸、碳酸、苯酚。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
7.聚乳酸( )可在乳酸菌作用下降解,下列有关聚乳
酸的说法正确的是
A.聚乳酸是一种纯净物
B.聚乳酸是一种酸性高分子材料
C.聚乳酸的单体为
D.聚乳酸是由单体之间通过加聚反应合成的
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
高分子化合物是混合物,A错;
由聚乳酸的结构可知,该物质是由乳酸的羟基和羧基脱水而生成的,属于缩聚反应,C对、D错;
乳酸显酸性,但聚乳酸不显酸性,B错。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
8.如图所示为实验室制取少量乙酸乙酯的装置图,下列关于该实验的叙述错误的是
A.向试管a中先加入浓硫酸,然后边摇动试管边慢慢
加入乙醇,再加入冰醋酸
B.试管b中导气管下端管口不能浸入液面下的目的是
防止实验过程中产生倒吸现象
C.实验时加热试管a的目的之一是及时将乙酸乙酯蒸出,使平衡向生成乙酸乙
酯的方向移动
D.饱和Na2CO3溶液可以降低乙酸乙酯的溶解度,并吸收蒸出的乙酸和乙醇
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
题组三 多官能团有机物性质的考查
9.(2022·台州高二期末)香草醛是一种食品添加剂,可由愈创木酚作原料合成,合成路线如图所示。关于香草醛的合成路线,下列说法不正确的是
A.理论上物质1→2,原子利用率为100%
B.有机物2可发生氧化、还原、取代、加成、消去、
缩聚反应
C.检验制得的香草醛中是否混有有机物3,不可用氯
化铁溶液
D.等物质的量的上述四种有机物分别与足量NaOH反应,消耗NaOH的物质的
量之比为1∶2∶2∶1
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
物质1→2发生的是加成反应,因此,理论上物质1→2的原子利用率为100%,A正确;
有机物2的分子中虽然有羟基,但是与羟基相连的碳原子的邻位碳原子上没有氢原子,故不能发生消去反应,B不正确;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
有机物3和香草醛的分子中均有酚羟基,都能与氯化铁溶液发生显色反应,因此,不能用氯化铁溶液检验制得的香草醛中是否混有有机物3,C正确;
有机物1和4中只有酚羟基可与碱反应,有机物2和3中有酚羟基和羧基可与碱反应,因此,等物质的量的此四种有机物分别与足量NaOH反应,消耗NaOH的物质的量之比为1∶2∶2∶1,D正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
10.苹果酸是一种常见的有机酸,结构简式为 ,
苹果酸可能发生的反应是
①与NaOH溶液反应 ②与紫色石蕊溶液作用变红 ③与金属钠反应放出气体 ④一定条件下与乙酸酯化 ⑤一定条件下与乙醇酯化 ⑥一定条件下自身发生缩聚反应
A.①②③⑥ B.①②③④
C.①②③⑤⑥ D.①②③④⑤⑥
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
11.2016年诺贝尔化学奖由法国、美国及荷兰的三位化学家获得,以表彰他们在“分子马达”研究方面的成就,一种光驱分子马达结构如图所示。下列有关该分子的说法正确的是
A.该分子属于芳香烃
B.两个苯环一定处于同一平面
C.能与NaHCO3、酸性KMnO4溶液反应
D.1 mol该分子最多可与2 mol H2发生加成反应
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
该分子中含有羧基,不属于芳香烃,A项错误;
碳碳单键可旋转,分子中两个苯环有可能处于
同一平面,B项错误;
分子中含有羧基能与NaHCO3反应放出CO2,分子中含有碳碳三键能使酸性KMnO4溶液褪色,C项正确;
苯环和碳碳三键均能与H2发生加成反应,即1 mol该分子最多能与8 mol H2发生加成反应,D项错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
12.阿魏酸化学名称为4-羟基-3-甲氧基肉桂酸,可以作医药、保健品、化
妆品原料和食品添加剂,结构简式为 。
在阿魏酸溶液中加入合适试剂(可以加热),检验其官能团。下列试剂、现象、结论都正确的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选项 试剂 现象 结论
A 氯化铁溶液 溶液变蓝色 含有酚羟基
B 银氨溶液 产生银镜 含有醛基
C 碳酸氢钠溶液 产生气泡 含有羧基
D 溴水 溶液褪色 含有碳碳双键
√
根据阿魏酸的结构简式可知,它含
有酚羟基,与氯化铁溶液反应显紫
色,不是蓝色,A项错误;
它不含醛基,B项错误;
它含羧基,与碳酸氢钠溶液反应产生气泡,C项正确;
酚羟基邻位上的氢原子可与Br2发生取代反应,溴水褪色不能证明一定含有碳碳双键,D项错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
13.有机物Q的结构简式为 ,下列关于Q的
性质叙述正确的是
A.酸性条件下水解能得到两种有机产物
B.不能与NaHCO3溶液反应放出气体
C.与足量溴水反应时,n(Q)∶n(Br2)=1∶3
D.与足量NaOH溶液反应时,n(Q)∶n(NaOH)=1∶8
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
本题的解题关键是正确判断水解产物的结构。1个Q分子中含有5个
—OH、1个—COOH、1个酯基,酸性条件下水解时生成的产物只有
一种: ;Q中含有—COOH,能与NaHCO3反应;
Q分子中羟基共有4个邻、对位氢原子,故充分反应时,n(Q)∶n(Br2)=1∶4;Q与足量NaOH溶液反应时,1 mol Q消耗8 mol NaOH(酯基消耗2 mol)。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
14.乙酰水杨酸(阿司匹林)是一种白色晶体,在临床上被广泛用于发热、肌肉痛、神经痛、头痛、风湿热、急性风湿
性关节炎等的治疗。乙酰水杨酸的合成原理
和装置如图:
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
请回答下列问题:
(1)实验中水浴加热的优点是_____________________________
_____,直导管的作用是________________________________
_____________。
使反应体系受热均匀,容易控制
冷凝、回流,减少水杨酸和乙酸酐挥
发造成的损失
温度
(2)根据阿司匹林的结构分析,其不可能发
生的反应是______(填字母)。
A.加成反应 B.氧化反应
C.酯化反应 D.水解反应
E.银镜反应
含有酯基,能发生水解反应,含有羧基,能发生酯化反应,
含有苯环,能发生加成反应,有机物可以燃烧,但是没有醛基,不能发生银镜反应,故选E。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
E
(3)阿司匹林也可通过水杨酸和乙酸反应制取,写出该反应的化学方程式:
_________________________________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
+CH3COOH H2O+
(4)乙酰水杨酸粗产品中常含有少量水杨酸杂质,该产品提纯方法与苯甲酸类似,采用________法。提纯后,请设计实验方案验证水杨酸是否完全除去:______________________________________________________
_____。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
重结晶
滴加氯化铁溶液鉴别,没有紫色溶液出现,说明水杨酸已完全除去
该产品提纯方法与粗苯甲酸的提纯方法类似是重结晶,然后采用趁热过滤冷却结晶就可以,水杨酸具有酚羟基,可以通过滴加氯化铁溶液鉴别,没有紫色溶液出现,说明水杨酸已完全除去。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
15.PBS是一种可降解的聚酯类高分子材料,
可由马来酸酐等原料经如图所示路线合成。
已知:RC≡CH+
(1)A→B的反应类型是_________;B的结构简式是____________________。
依据烯烃的性质知,A→B的反应是加成反应,故B的结构简式为HOOCCH2CH2COOH。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
加成反应 HOOCCH2CH2COOH
(2)C中含有的官能团名称是_______
_________;D的名称(系统命名)是__________。
利用已知信息和合成路线可知,C的结构简式为HOCH2—C≡C—CH2OH,其中所含官能团的名称为碳碳三键、羟基;D的碳链上1、4号碳原子连有羟基,故D的名称为1,4-丁二醇。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
碳碳三
1,4-丁二醇
键、羟基
(3)半方酸是马来酸酐的同分异构体,分子中含1个环(四元碳环)和1个羟基,但不含—O—O—。半方酸的
结构简式是_____________。
根据马来酸酐的分子式(C4H2O3)和半方酸的结构特点可写出其结构简式。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
(4)由B和D合成PBS的化学方程式是___________________________
_____________________________________________________________________。
根据B、D的结构简式可知合成PBS的反应为缩聚反应。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
nHOOCCH2CH2COOH+
nHOCH2CH2CH2CH2OH―→ +(2n-1)H2O
(5)下列关于A的说法正确的是_____(填字母)。
a.能使酸性KMnO4溶液或溴的CCl4溶液
褪色
b.能与Na2CO3反应,但不与HBr反应
c.能与新制的Cu(OH)2反应
d.1 mol A完全燃烧消耗5 mol O2
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
ac
物质A中含有碳碳双键,能使酸性KMnO4溶液褪色,能与溴的CCl4溶液发生加成反应使其褪色,a项正确;
物质A可与HBr发生加成反应,b项错误;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
物质A含有羧基,可与新制的Cu(OH)2发生中和反应,c项正确;
1 mol A完全燃烧消耗3 mol O2,d项错误。
返回
本课结束
专题4
第2课时
DIERKESHI
羧酸的结构与分类 / 羧酸的性质 / 酯化反应原理的应用 / 课时对点练
专题4
羧酸的性质及应用
核心素养
发展目标
1.能从羧基的成键方式的角度,了解羧酸的结构特点和分类,理解羧酸、酯的化学性质及官能团与反应类型之间的关系。
2.结合乙酸乙酯水解反应的原理,能推理出羧酸酯化反应、酯类物质水解反应后的产物。
内容索引
一、羧酸的结构与分类
二、羧酸的性质
三、酯化反应原理的应用
课时对点练
羧酸的结构与分类
一
1.羧酸的组成和结构
(1)羧酸:分子中烃基(或氢原子)与 相连的化合物。官能团为
___________。
(2)通式:饱和一元羧酸的通式:CnH2nO2(n≥1,n为整数)或_____________________________。
羧基
CnH2n+1COOH(n≥0,n为整数)
2.羧酸的分类
(1)按分子中烃基的结构分类
羧酸
脂肪酸:如乙酸、C17H35COOH
芳香酸:如
(2)按分子中羧基的个数分类
羧酸
一元酸:如乙酸( )
二元酸:如草酸(HOOC—COOH)
多元酸
CH3COOH
(3)按分子中烃基所含碳原子数分类
羧酸
(1)乙酸可看作乙烷中的一个氢原子被羧基取代后的产物( )
(2)软脂酸(C15H31COOH)属于饱和高级脂肪酸( )
(3)羧基官能团可以简写成—COOH或者HOOC—( )
(4)乙酸、草酸、硬脂酸和石炭酸均属于羧酸类有机物( )
(5)乙酸和乙醇的分子中都含有羟基,所以乙酸与乙醇的性质相似( )
(6)乙酸、硬脂酸、油酸互为同系物( )
×
正误判断
√
√
×
×
×
应用体验
1.某有机物的结构简式为 ,则它是
A.饱和二元羧酸 B.芳香酸
C.脂环酸 D.高级脂肪酸
√
该有机物分子中含有两个羧基、一个苯环,故它不是饱和二元羧酸,也不是脂环酸或高级脂肪酸。
2.分子式为C5H10O2并能与饱和NaHCO3溶液反应放出气体的有机物有(不含立体异构)
A.3种 B.4种 C.5种 D.6种
√
能与NaHCO3反应放出气体说明该有机物为羧酸,将C5H10O2改写为C4H9—COOH;C4H9—有4种结构,故该有机物有4种,即:CH3CH2CH2CH2COOH、 、 、
。
返回
羧酸的性质
二
1.羧酸的通性
羧酸的化学性质与乙酸相似,主要取决于官能团羧基。
(1)由于—COOH能电离出H+,使羧酸具有弱酸性。羧酸具有酸的通性:
RCOOH 。
羧酸可与氢氧化物作用,生成羧酸盐:RCOOH+NaOH―→ 。
羧酸的酸性比碳酸强,可与碳酸钠或碳酸氢钠作用生成羧酸钠:
2RCOOH+Na2CO3―→ 。
RCOOH+NaHCO3―→ 。
酚不溶于碳酸氢钠溶液,可以利用上述反应区分 。羧酸的酸性一般比 弱,当向羧酸盐中加入无机酸后,羧酸又可游离出来。
RCOO-+H+
RCOONa+H2O
2RCOONa+CO2↑+H2O
RCOONa+CO2↑+H2O
羧酸和酚
无机酸
(2)羧酸与醇发生酯化反应时,一般情况下,羧酸脱去 ,醇脱去 。
如:RCOOH+R′—OH 。
RCOOR′+H2O
羟基
氢
2.实验探究乙酸乙酯的制备与性质
(1)制备实验
实验操作
实验现象 饱和碳酸钠溶液的液面上有无色透明的 溶于水的______
_____产生,可闻到_____
有关化学方程式
____________________________________________________
+H—O—C2H5 +H2O
不
油状
液体
香味
(2)性质实验
实验操作
实验现象 A试管较长时间内酯层厚度 ,乙酸乙酯气味很浓;B试管酯层厚度 ,略有乙酸乙酯的气味;C试管酯层_________,无乙酸乙酯的气味
实验结论 乙酸乙酯在中性条件下基本 水解;酸性条件下 水解;碱性条件下 水解
基本不变
减小
基本消失
不
大部分
全部
(3)酯水解反应的化学方程式
①酸性条件下水解
RCOOR′+H2O 。
②碱性条件下水解
RCOOR′+NaOH 。
RCOOH+R′OH
RCOONa+R′OH
3.常见的羧酸
(1)几种常见羧酸比较
甲酸 苯甲酸 乙二酸
俗名 _____ 安息香酸 _____
结构简式 ________ ____________
_______
色、态、味 无色液体、 气味 白色针状晶体、易升华 无色透明晶体
溶解性 溶于水、乙醇 微溶于水、易溶于有机溶剂 能溶于水、乙醇
HCOOH
蚁酸
草酸
刺激性
易
(2)甲酸的结构特点与化学性质
①羧基的性质
试剂 化学方程式
NaOH 与NaOH反应生成HCOONa,化学方程式为________________
__________________
乙醇 与乙醇发生酯化反应,化学方程式为_____________________
_______________________
HCOOH+NaOH
HCOOH+CH3CH2OH
―→HCOONa+H2O
HCOOC2H5+H2O
②醛基的性质
甲酸能发生银镜反应,也能与新制的Cu(OH)2反应:
HCOOH+2Ag(NH3)2OH (NH4)2CO3+2Ag↓+2NH3+H2O
HCOOH+2Cu(OH)2+2NaOH Cu2O↓+4H2O+Na2CO3
注意 甲酸与新制的Cu(OH)2混合,若加热二者发生氧化反应,若不加热二者发生酸碱中和反应。
(1)分子式相同的羧酸和酯类互为同分异构体( )
(2)在碱性条件下的水解反应和酯化反应都是可逆反应( )
(3)1 mol C2H5OH和1 mol CH3COOH在浓硫酸作用下加热可以完全反应生成1 mol CH3COOC2H5( )
(4)乙酸分子中含有碳氧双键,一定条件下乙酸能与氢气发生加成反应( )
(5)乙酸显酸性,电离出H+,因此发生酯化反应时断裂H—O( )
√
正误判断
×
×
×
×
1.在乙酸和乙醇的酯化反应实验中应注意哪些事项?
深度思考
提示 (1)试剂的加入顺序:乙醇―→浓硫酸和冰醋酸,不能先加浓硫酸。
(2)加入碎瓷片,防止暴沸。
(3)要用酒精灯小心加热,防止液体剧烈沸腾、乙酸和乙醇大量挥发。
(4)乙酸乙酯蒸气的导管不能插入饱和Na2CO3溶液中,以防止倒吸。
(5)若将制得的乙酸乙酯分离出来,可用分液漏斗进行分离,得到的上层油状液体即为乙酸乙酯。
(6)饱和碳酸钠溶液的作用:中和挥发出来的乙酸;吸收挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,以便使乙酸乙酯分层析出。
2.由于甲酸( )的特殊结构使其表现特有的性质。
(1)甲酸中加入新制的氢氧化铜,可能的现象:________________________,
反应的化学方程式:_________________________________________。
(2)若在新制的氢氧化铜中滴入少量甲酸并加热,产生红色沉淀,其原因是_____________________________________________________________
_____。
深度思考
蓝色的悬浊液变为蓝色溶液
2HCOOH+Cu(OH)2 (HCOO)2Cu+2H2O
甲酸中含有醛基,具有还原性,将新制的氢氧化铜还原为红色的Cu2O沉淀
应用体验
1.在浓硫酸催化作用下,醋酸与乙醇共热制备乙酸乙酯。
(1)通常乙醇过量,其目的是_________________。
(2)在实际制备时通过反应回流和产物蒸馏提纯两个步骤。第一步反应回流的装置如图,反应回流的目的是_________________________________
_________。
提高乙酸的转化率
减少乙醇、乙酸的挥发,提高乙酸乙
酯的产率
2.已知某有机物的结构简式为 。
请回答下列问题:
(1)当和_____________反应时,可转化为 。
NaHCO3溶液
首先判断出该有机物所含官能团为羧基(—COOH)、酚羟基(—OH)和醇羟基(—OH),然后判断各官能团的活泼性:羧基>酚羟基>醇羟基,最后利用官能团的性质解答。由于酸性:—COOH>H2CO3>
> ,所以题中应加入NaHCO3溶液,只与—COOH反应。
(2)当和____________________反应时,可转化为 。
题中加入NaOH或Na2CO3溶液,与酚羟基和—COOH反应。
NaOH(或Na2CO3)溶液
(3)当和_____反应时,可转化为 。
题中加入Na,与三种官能团都反应。
Na
思维启迪
醇、酚、羧酸分子中羟基氢原子的活泼性比较
名称 乙醇 苯酚 乙酸
结构简式 CH3CH2OH CH3COOH
羟基氢原子的活泼性 不能电离 能电离 能电离
酸性 中性 极弱酸性 弱酸性
思维启迪
由上表可知,常见分子(离子)中羟基氢原子的活泼性顺序为RCOOH>
H2CO3> > >ROH。运用上述实验现象的不同,
可判断有机物分子结构中含有的羟基类型。
返回
与Na反应 反应放出H2 反应放出H2 反应放出H2
与NaOH反应 不反应 反应 反应
与Na2CO3反应 不反应 反应 反应
与NaHCO3反应 不反应 不反应 反应
酯化反应原理的应用
三
1.酯化反应原理
+H—18OR′ __________________。
+H2O
2.生成链状酯
(1)一元羧酸与一元醇的酯化反应
RCOOH+HOR′ 。
(2)一元羧酸与二元醇(或二元羧酸与一元醇)的酯化反应
2CH3COOH+HOCH2CH2OH _____________________________。
HOOC—COOH+2CH3CH2OH ____________________________
_____。
RCOOR′+H2O
CH3COOCH2CH2OOCCH3+2H2O
CH3CH2OOC—COOCH2CH3+
2H2O
3.生成环状酯
(1)二元羧酸与二元醇的酯化反应
(2)羟基酸自身酯化反应
。
。
(3)羟基酸分子内脱水生成酯
HOCH2CH2CH2COOH ______________________。
+H2O
4.生成聚酯
(1)二元羧酸与二元醇的缩聚反应
+nHO—CH2CH2—OH―→____________
_____________________________________。
(2n-1)H2O+
(2)羟基酸的自身缩聚反应
______________________________。
+(n-1)H2O
应用体验
1.(2022·山东菏泽高二期中)山梨酸是一种高效安全的防腐保鲜剂。其合成反应如图,下列说法正确的是
CH3CH==CHCHO(巴豆醛)+CH2(COOH)2(丙二酸) CH3CH==
CHCH==CHCOOH(山梨酸)
A.巴豆醛与丙二酸生成山梨酸属于取代反应
B.一定条件下,丙二酸能与乙二醇发生酯化反应生成六元环状酯类化合物
C.可用酸性高锰酸钾溶液检验山梨酸中是否含有巴豆醛
D.山梨酸与K2CO3溶液反应可生成水溶性更好的山梨酸钾
√
巴豆醛与丙二酸生成山梨酸有新的碳碳双键形成,不属于取代反应,A错误;
一定条件下,丙二酸能与乙二醇发生酯化反应生成七元环状酯类化
合物 ,B错误;
山梨酸含羧基,与K2CO3溶液反应可生成山梨酸钾,山梨酸钾是离子化合物,水溶性更好,D正确。
2.有机物A的结构简式为 ,据此回答下列问题:
(1)A的分子式为__________。
(2)A在NaOH溶液中加热,经酸化得到有机物B和D,D是芳香族化合物,当有1 mol A发生反应时,最多消耗____ mol NaOH。
C12H14O5
2
1 mol A在NaOH溶液中加热,生成 、 ,
最多消耗2 mol NaOH。
(3)B在一定条件下发生酯化反应可生成某五元环酯,该五元环酯的结构
简式为____________。
B为 ,在浓硫酸加热的条件下自身发生酯化反应,
生成的五元环酯为 。
返回
课时对点练
题组一 羧酸的组成和结构
1.下列物质中,属于饱和一元脂肪酸的是
A.乙二酸 B.苯甲酸 C.硬脂酸 D.石炭酸
√
乙二酸为二元脂肪酸,分子中含有两个羧基;苯甲酸中含苯环,不属于饱和一元脂肪酸;硬脂酸(C17H35COOH)分子中含有烷基和一个羧基,属于饱和一元脂肪酸;石炭酸为苯酚,属于酚类,不属于羧酸。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
2.下列有机物中,互为同系物的是
A.甲酸与油酸 B.乙酸和丙烯酸
C.硬脂酸和油酸 D.甲酸与硬脂酸
√
同系物是结构相似,组成上相差一个或若干个“CH2”原子团的有机物。甲酸、硬脂酸和乙酸为饱和一元羧酸,互为同系物。丙烯酸和油酸为一元酸,且均含有一个碳碳双键,互为同系物。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
3.将甲基、羟基、羧基和苯基四种不同的原子团两两结合后形成的化合物的水溶液呈酸性的有机物有
A.2种 B.3种 C.4种 D.5种
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
水溶液呈酸性的有机物可以是羧酸或酚,四种原子团两两结合后形成
的化合物的水溶液呈酸性的有:CH3COOH、 、
和 ,但是 为无机物,故选B。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
题组二 羧酸的性质与应用
4.(2021·重庆高二阶段练习)COVID-19病毒具有非常强的传染性,公共环境消毒是防控新型冠状病毒传播的有效措施之一。75%乙醇、次氯酸钠溶液、过氧乙酸(CH3COOOH)溶液、过氧化氢溶液等均可有效灭活环境中的COVID-19病毒。下列说法错误的是
A.COVID-19病毒疫苗运输过程中应冷藏保存
B.乙醇溶液中乙醇的体积分数越高,消毒杀菌效果就越好
C.次氯酸钠、过氧乙酸和过氧化氢在灭活病毒过程中都利用了它们的氧化性
D.过氧乙酸的摩尔质量为76 g·mol-1
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
疫苗的主要成分是蛋白质,高温会变性,故应冷藏储存,故A正确;
浓度高的乙醇可使细胞外形成一层保护膜,高于75%消毒杀菌效果差,不具有良好的消毒杀菌能力,一般用75%乙醇溶液做医用酒精,故B错误;
次氯酸钠、过氧乙酸和过氧化氢均具有强氧化性,能将蛋白质氧化从而使其变性,达到消毒的目的,故C正确;
摩尔质量的单位为g·mol-1,和该物质的相对分子质量在数值上相等,过氧乙酸(CH3COOOH)的相对分子质量为76,故摩尔质量为76 g·mol-1,故D正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
5.某甲酸溶液中可能存在着甲醛,下列操作能正确说明的是
A.加入新制的Cu(OH)2加热,有红色沉淀生成,证明一定存在甲醛
B.能发生银镜反应,证明含甲醛
C.溶液与足量NaOH溶液混合,其蒸馏产物可发生银镜反应,则有甲醛
D.先将溶液充分进行酯化反应,收集生成物进行银镜反应,有银镜产
生,则含甲醛
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
甲酸( )与甲醛( )含有相同的结构 ,因此二者均可发生银镜反应,或与新制的Cu(OH)2反应产生红色沉淀。若要证明溶液中存在着甲醛,可使溶液与足量NaOH溶液反应,生成沸点高的甲酸钠溶液,这时蒸馏,得到低沸点的甲醛,可用银氨溶液或新制的Cu(OH)2加以鉴定。D项中将溶液进行酯化反应,由于酯化反应是可逆反应,生成物中还是含有甲酸,并且生成的甲酸酯中也含有醛基,因而无法鉴别。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
6.(2022·菏泽高二期末)甲酸、乙酸、碳酸、苯酚的酸性由强到弱的顺序是
A.碳酸、苯酚、甲酸、乙酸 B.甲酸、乙酸、碳酸、苯酚
C.甲酸、碳酸、苯酚、乙酸 D.苯酚、碳酸、乙酸、甲酸
√
饱和一元羧酸随着碳原子个数的增加,酸性依次减弱,则甲酸的酸性强于乙酸;羧酸的酸性强于碳酸,则乙酸的酸性强于碳酸;碳酸的酸性强于苯酚,则酸性由强到弱的顺序是甲酸、乙酸、碳酸、苯酚。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
7.聚乳酸( )可在乳酸菌作用下降解,下列有关聚乳
酸的说法正确的是
A.聚乳酸是一种纯净物
B.聚乳酸是一种酸性高分子材料
C.聚乳酸的单体为
D.聚乳酸是由单体之间通过加聚反应合成的
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
高分子化合物是混合物,A错;
由聚乳酸的结构可知,该物质是由乳酸的羟基和羧基脱水而生成的,属于缩聚反应,C对、D错;
乳酸显酸性,但聚乳酸不显酸性,B错。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
8.如图所示为实验室制取少量乙酸乙酯的装置图,下列关于该实验的叙述错误的是
A.向试管a中先加入浓硫酸,然后边摇动试管边慢慢
加入乙醇,再加入冰醋酸
B.试管b中导气管下端管口不能浸入液面下的目的是
防止实验过程中产生倒吸现象
C.实验时加热试管a的目的之一是及时将乙酸乙酯蒸出,使平衡向生成乙酸乙
酯的方向移动
D.饱和Na2CO3溶液可以降低乙酸乙酯的溶解度,并吸收蒸出的乙酸和乙醇
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
题组三 多官能团有机物性质的考查
9.(2022·台州高二期末)香草醛是一种食品添加剂,可由愈创木酚作原料合成,合成路线如图所示。关于香草醛的合成路线,下列说法不正确的是
A.理论上物质1→2,原子利用率为100%
B.有机物2可发生氧化、还原、取代、加成、消去、
缩聚反应
C.检验制得的香草醛中是否混有有机物3,不可用氯
化铁溶液
D.等物质的量的上述四种有机物分别与足量NaOH反应,消耗NaOH的物质的
量之比为1∶2∶2∶1
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
物质1→2发生的是加成反应,因此,理论上物质1→2的原子利用率为100%,A正确;
有机物2的分子中虽然有羟基,但是与羟基相连的碳原子的邻位碳原子上没有氢原子,故不能发生消去反应,B不正确;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
有机物3和香草醛的分子中均有酚羟基,都能与氯化铁溶液发生显色反应,因此,不能用氯化铁溶液检验制得的香草醛中是否混有有机物3,C正确;
有机物1和4中只有酚羟基可与碱反应,有机物2和3中有酚羟基和羧基可与碱反应,因此,等物质的量的此四种有机物分别与足量NaOH反应,消耗NaOH的物质的量之比为1∶2∶2∶1,D正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
10.苹果酸是一种常见的有机酸,结构简式为 ,
苹果酸可能发生的反应是
①与NaOH溶液反应 ②与紫色石蕊溶液作用变红 ③与金属钠反应放出气体 ④一定条件下与乙酸酯化 ⑤一定条件下与乙醇酯化 ⑥一定条件下自身发生缩聚反应
A.①②③⑥ B.①②③④
C.①②③⑤⑥ D.①②③④⑤⑥
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
11.2016年诺贝尔化学奖由法国、美国及荷兰的三位化学家获得,以表彰他们在“分子马达”研究方面的成就,一种光驱分子马达结构如图所示。下列有关该分子的说法正确的是
A.该分子属于芳香烃
B.两个苯环一定处于同一平面
C.能与NaHCO3、酸性KMnO4溶液反应
D.1 mol该分子最多可与2 mol H2发生加成反应
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
该分子中含有羧基,不属于芳香烃,A项错误;
碳碳单键可旋转,分子中两个苯环有可能处于
同一平面,B项错误;
分子中含有羧基能与NaHCO3反应放出CO2,分子中含有碳碳三键能使酸性KMnO4溶液褪色,C项正确;
苯环和碳碳三键均能与H2发生加成反应,即1 mol该分子最多能与8 mol H2发生加成反应,D项错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
12.阿魏酸化学名称为4-羟基-3-甲氧基肉桂酸,可以作医药、保健品、化
妆品原料和食品添加剂,结构简式为 。
在阿魏酸溶液中加入合适试剂(可以加热),检验其官能团。下列试剂、现象、结论都正确的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选项 试剂 现象 结论
A 氯化铁溶液 溶液变蓝色 含有酚羟基
B 银氨溶液 产生银镜 含有醛基
C 碳酸氢钠溶液 产生气泡 含有羧基
D 溴水 溶液褪色 含有碳碳双键
√
根据阿魏酸的结构简式可知,它含
有酚羟基,与氯化铁溶液反应显紫
色,不是蓝色,A项错误;
它不含醛基,B项错误;
它含羧基,与碳酸氢钠溶液反应产生气泡,C项正确;
酚羟基邻位上的氢原子可与Br2发生取代反应,溴水褪色不能证明一定含有碳碳双键,D项错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
13.有机物Q的结构简式为 ,下列关于Q的
性质叙述正确的是
A.酸性条件下水解能得到两种有机产物
B.不能与NaHCO3溶液反应放出气体
C.与足量溴水反应时,n(Q)∶n(Br2)=1∶3
D.与足量NaOH溶液反应时,n(Q)∶n(NaOH)=1∶8
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
本题的解题关键是正确判断水解产物的结构。1个Q分子中含有5个
—OH、1个—COOH、1个酯基,酸性条件下水解时生成的产物只有
一种: ;Q中含有—COOH,能与NaHCO3反应;
Q分子中羟基共有4个邻、对位氢原子,故充分反应时,n(Q)∶n(Br2)=1∶4;Q与足量NaOH溶液反应时,1 mol Q消耗8 mol NaOH(酯基消耗2 mol)。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
14.乙酰水杨酸(阿司匹林)是一种白色晶体,在临床上被广泛用于发热、肌肉痛、神经痛、头痛、风湿热、急性风湿
性关节炎等的治疗。乙酰水杨酸的合成原理
和装置如图:
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
请回答下列问题:
(1)实验中水浴加热的优点是_____________________________
_____,直导管的作用是________________________________
_____________。
使反应体系受热均匀,容易控制
冷凝、回流,减少水杨酸和乙酸酐挥
发造成的损失
温度
(2)根据阿司匹林的结构分析,其不可能发
生的反应是______(填字母)。
A.加成反应 B.氧化反应
C.酯化反应 D.水解反应
E.银镜反应
含有酯基,能发生水解反应,含有羧基,能发生酯化反应,
含有苯环,能发生加成反应,有机物可以燃烧,但是没有醛基,不能发生银镜反应,故选E。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
E
(3)阿司匹林也可通过水杨酸和乙酸反应制取,写出该反应的化学方程式:
_________________________________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
+CH3COOH H2O+
(4)乙酰水杨酸粗产品中常含有少量水杨酸杂质,该产品提纯方法与苯甲酸类似,采用________法。提纯后,请设计实验方案验证水杨酸是否完全除去:______________________________________________________
_____。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
重结晶
滴加氯化铁溶液鉴别,没有紫色溶液出现,说明水杨酸已完全除去
该产品提纯方法与粗苯甲酸的提纯方法类似是重结晶,然后采用趁热过滤冷却结晶就可以,水杨酸具有酚羟基,可以通过滴加氯化铁溶液鉴别,没有紫色溶液出现,说明水杨酸已完全除去。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
15.PBS是一种可降解的聚酯类高分子材料,
可由马来酸酐等原料经如图所示路线合成。
已知:RC≡CH+
(1)A→B的反应类型是_________;B的结构简式是____________________。
依据烯烃的性质知,A→B的反应是加成反应,故B的结构简式为HOOCCH2CH2COOH。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
加成反应 HOOCCH2CH2COOH
(2)C中含有的官能团名称是_______
_________;D的名称(系统命名)是__________。
利用已知信息和合成路线可知,C的结构简式为HOCH2—C≡C—CH2OH,其中所含官能团的名称为碳碳三键、羟基;D的碳链上1、4号碳原子连有羟基,故D的名称为1,4-丁二醇。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
碳碳三
1,4-丁二醇
键、羟基
(3)半方酸是马来酸酐的同分异构体,分子中含1个环(四元碳环)和1个羟基,但不含—O—O—。半方酸的
结构简式是_____________。
根据马来酸酐的分子式(C4H2O3)和半方酸的结构特点可写出其结构简式。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
(4)由B和D合成PBS的化学方程式是___________________________
_____________________________________________________________________。
根据B、D的结构简式可知合成PBS的反应为缩聚反应。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
nHOOCCH2CH2COOH+
nHOCH2CH2CH2CH2OH―→ +(2n-1)H2O
(5)下列关于A的说法正确的是_____(填字母)。
a.能使酸性KMnO4溶液或溴的CCl4溶液
褪色
b.能与Na2CO3反应,但不与HBr反应
c.能与新制的Cu(OH)2反应
d.1 mol A完全燃烧消耗5 mol O2
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
ac
物质A中含有碳碳双键,能使酸性KMnO4溶液褪色,能与溴的CCl4溶液发生加成反应使其褪色,a项正确;
物质A可与HBr发生加成反应,b项错误;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
物质A含有羧基,可与新制的Cu(OH)2发生中和反应,c项正确;
1 mol A完全燃烧消耗3 mol O2,d项错误。
返回
本课结束
专题4
