2.2 氯及其化合物 氯气的实验室制法 课件2022-2023学年高一上学期化学人教版(2019)必修第一册(16张ppt)
文档属性
| 名称 | 2.2 氯及其化合物 氯气的实验室制法 课件2022-2023学年高一上学期化学人教版(2019)必修第一册(16张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 311.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-21 08:56:11 | ||
图片预览




文档简介
(共16张PPT)
氯气的实验室制法
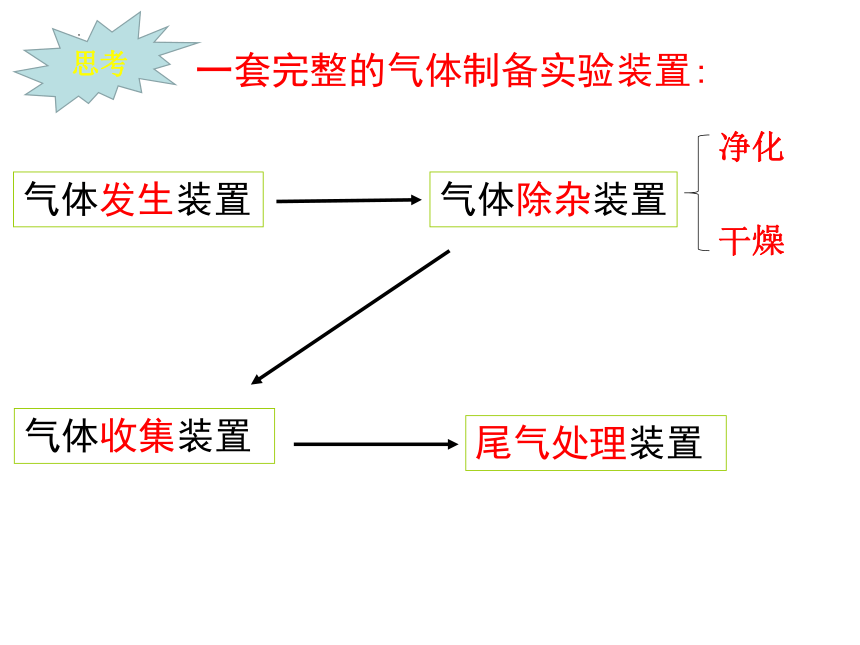
一套完整的气体制备实验装置:
气体发生装置
气体除杂装置
气体收集装置
尾气处理装置
思考
净化
干燥
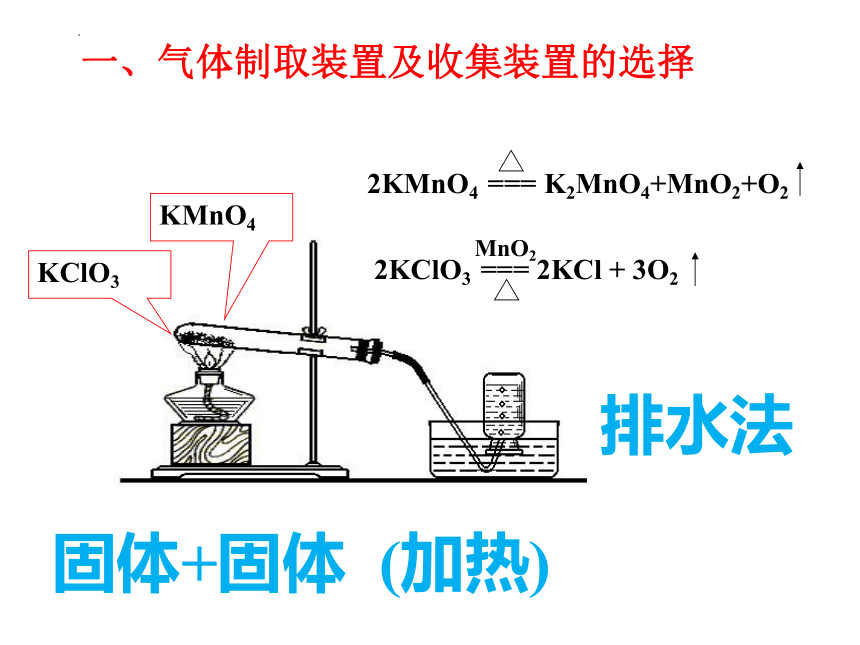
固体+固体 (加热)
KMnO4
2KMnO4 === K2MnO4+MnO2+O2
KClO3
2KClO3 === 2KCl + 3O2
MnO2
一、气体制取装置及收集装置的选择
排水法
固体、液体 (不加热)
MnO2
2H2O2 ===== 2H2O + O2
MnO2
H2O2
稀盐酸
(稀硫酸)
锌粒
Zn+2HCl=ZnCl2+H2
向上排空气法
向下排空气法
密度大于空气,且不与空气中的成分反应
密度小于空气,且不与空气中的成分反应
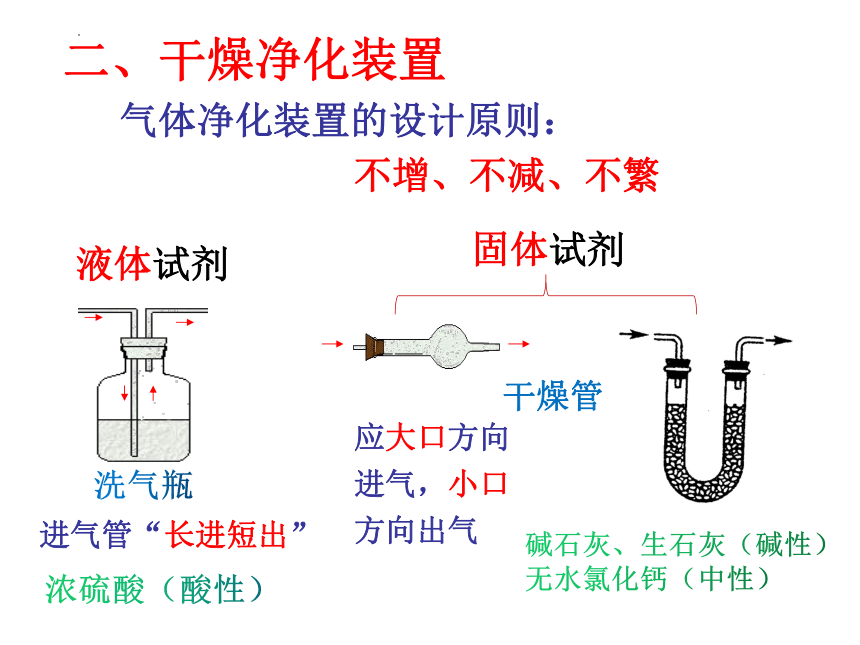
进气管“长进短出”
应大口方向
进气,小口
方向出气
液体试剂
固体试剂
洗气瓶
干燥管
二、干燥净化装置
气体净化装置的设计原则:
不增、不减、不繁
浓硫酸(酸性)
碱石灰、生石灰(碱性)
无水氯化钙(中性)
氯气的实验室制法
反应原理
发生装置
净化装置
气体收集
尾气吸收
MnO2+ 4HCl(浓) == MnCl2+2H2O+Cl2↑
1、反应原理
1.二氧化锰为难溶于水的黑色粉末。
2.稀盐酸与二氧化锰不反应。
3.此反应必须加热。
注意
(1)改写为离子方程式
MnO2+4H++ 2Cl-=Mn2++Cl2↑+2H2O
(2)HCl在反应中表现为什么性?
酸性和还原性
控制用量和反应速率
固 + 液(加热)型
有关仪器的名称:铁架台(带铁圈、铁夹)、酒精灯、石棉网、(圆底)烧瓶、双孔塞、
分液漏斗、玻璃导管。
组装时必须由下到上,从左到右。
2、发生装置
HCl气体
水蒸气(H2O)
饱和食盐水
浓硫酸
浓 H2SO4
饱和食盐水
3、净化装置
思考:
先除杂还是先干燥?
HCl气体
水蒸气(H2O)
饱和食盐水
浓硫酸
浓 H2SO4
饱和食盐水
3、净化装置
饱和食盐水
浓 H2SO4
A
B
×
先除杂后干燥
a. 向上排空气法
b. 排饱和食盐水法
4、收集装置
4、尾气吸收处理
氯气有毒,会污染空气,故用饱和氢氧化钠溶液吸收。
饱和NaOH溶液
Cl2 + 2NaOH == NaCl + NaClO + H2O
一套完整制取氯气的装置
组装原则:由下至上,由左至右
注意:
通过观察颜色变化停止加热
实验结束应先撤导管后撤酒精灯
(集气瓶中充满黄绿色气体)
三、氯离子(Cl-)的检验
【实验2-9】
①在3支试管中分别加入2-3mL稀盐酸、NaCl溶液、Na2CO3溶液;
②分别滴入几滴AgNO3溶液,观察现象;
③再分别滴入少量稀硝酸,观察现象。
实验现象
解释或离子方程式
加入AgNO3溶液后 加入 稀硝酸后 稀盐酸
NaCl溶液
Na2CO3溶液
白色沉淀
白色沉淀
沉淀消失,有气泡生成
沉淀不消失
沉淀不消失
Cl- + Ag+ =AgCl↓
CO32- +2Ag+ =Ag2CO3↓
Cl- + Ag+ =AgCl↓
Ag2CO3+2H+=2Ag++CO2↑ + H2O
白色沉淀
三、氯离子的检验
离子方程式为:
Ag+ + Cl-=AgCl ↓
现象:产生不溶于硝酸的白色沉淀。
试剂:硝酸酸化的硝酸银溶液。
讨论1:检验Cl-时,为什么先滴加稀硝酸再加AgNO3溶液呢?
原因:排除CO32-的干扰
讨论2:检验Cl-时,为什么采用稀硝酸酸化,为什么不用稀盐酸或稀硫酸呢?
氯气的实验室制法
一套完整的气体制备实验装置:
气体发生装置
气体除杂装置
气体收集装置
尾气处理装置
思考
净化
干燥
固体+固体 (加热)
KMnO4
2KMnO4 === K2MnO4+MnO2+O2
KClO3
2KClO3 === 2KCl + 3O2
MnO2
一、气体制取装置及收集装置的选择
排水法
固体、液体 (不加热)
MnO2
2H2O2 ===== 2H2O + O2
MnO2
H2O2
稀盐酸
(稀硫酸)
锌粒
Zn+2HCl=ZnCl2+H2
向上排空气法
向下排空气法
密度大于空气,且不与空气中的成分反应
密度小于空气,且不与空气中的成分反应
进气管“长进短出”
应大口方向
进气,小口
方向出气
液体试剂
固体试剂
洗气瓶
干燥管
二、干燥净化装置
气体净化装置的设计原则:
不增、不减、不繁
浓硫酸(酸性)
碱石灰、生石灰(碱性)
无水氯化钙(中性)
氯气的实验室制法
反应原理
发生装置
净化装置
气体收集
尾气吸收
MnO2+ 4HCl(浓) == MnCl2+2H2O+Cl2↑
1、反应原理
1.二氧化锰为难溶于水的黑色粉末。
2.稀盐酸与二氧化锰不反应。
3.此反应必须加热。
注意
(1)改写为离子方程式
MnO2+4H++ 2Cl-=Mn2++Cl2↑+2H2O
(2)HCl在反应中表现为什么性?
酸性和还原性
控制用量和反应速率
固 + 液(加热)型
有关仪器的名称:铁架台(带铁圈、铁夹)、酒精灯、石棉网、(圆底)烧瓶、双孔塞、
分液漏斗、玻璃导管。
组装时必须由下到上,从左到右。
2、发生装置
HCl气体
水蒸气(H2O)
饱和食盐水
浓硫酸
浓 H2SO4
饱和食盐水
3、净化装置
思考:
先除杂还是先干燥?
HCl气体
水蒸气(H2O)
饱和食盐水
浓硫酸
浓 H2SO4
饱和食盐水
3、净化装置
饱和食盐水
浓 H2SO4
A
B
×
先除杂后干燥
a. 向上排空气法
b. 排饱和食盐水法
4、收集装置
4、尾气吸收处理
氯气有毒,会污染空气,故用饱和氢氧化钠溶液吸收。
饱和NaOH溶液
Cl2 + 2NaOH == NaCl + NaClO + H2O
一套完整制取氯气的装置
组装原则:由下至上,由左至右
注意:
通过观察颜色变化停止加热
实验结束应先撤导管后撤酒精灯
(集气瓶中充满黄绿色气体)
三、氯离子(Cl-)的检验
【实验2-9】
①在3支试管中分别加入2-3mL稀盐酸、NaCl溶液、Na2CO3溶液;
②分别滴入几滴AgNO3溶液,观察现象;
③再分别滴入少量稀硝酸,观察现象。
实验现象
解释或离子方程式
加入AgNO3溶液后 加入 稀硝酸后 稀盐酸
NaCl溶液
Na2CO3溶液
白色沉淀
白色沉淀
沉淀消失,有气泡生成
沉淀不消失
沉淀不消失
Cl- + Ag+ =AgCl↓
CO32- +2Ag+ =Ag2CO3↓
Cl- + Ag+ =AgCl↓
Ag2CO3+2H+=2Ag++CO2↑ + H2O
白色沉淀
三、氯离子的检验
离子方程式为:
Ag+ + Cl-=AgCl ↓
现象:产生不溶于硝酸的白色沉淀。
试剂:硝酸酸化的硝酸银溶液。
讨论1:检验Cl-时,为什么先滴加稀硝酸再加AgNO3溶液呢?
原因:排除CO32-的干扰
讨论2:检验Cl-时,为什么采用稀硝酸酸化,为什么不用稀盐酸或稀硫酸呢?
