高一化学人教版(2019)必修第一册 第三节 氧化还原反应 第1课时课件(19张)
文档属性
| 名称 | 高一化学人教版(2019)必修第一册 第三节 氧化还原反应 第1课时课件(19张) |  | |
| 格式 | pptx | ||
| 文件大小 | 38.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-21 09:07:31 | ||
图片预览





文档简介
(共19张PPT)
为什么刚切开的苹果一段时间后会变色呢?
钢铁生锈
天然气燃烧
生活中发生氧化反应的现象
食物腐烂
第三节 氧化还原反应
第一课时
学习目标
1、通过对化合价的分析,认识氧化还原反应的规律,并对常见的化学反应进行分类。
2、基于化合价变化与电子转移的相关性,从微观上认识氧化还原反应的本质,形成认识化学反应的微观视角,建构氧化还原反应的认识模型。
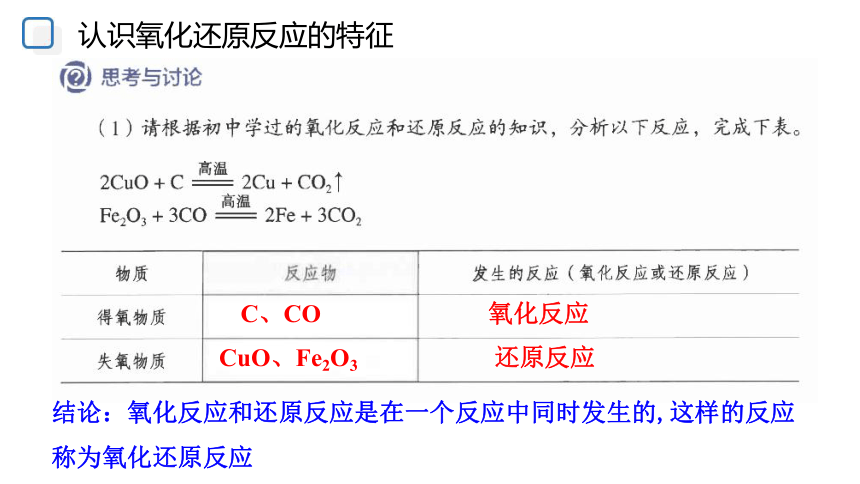
认识氧化还原反应的特征
CuO、Fe2O3
C、CO
还原反应
氧化反应
结论:氧化反应和还原反应是在一个反应中同时发生的,这样的反应称为氧化还原反应
2CuO + C
高温
2Cu + CO2
Fe2O 3 + 3CO
高温
2Fe + 3CO2
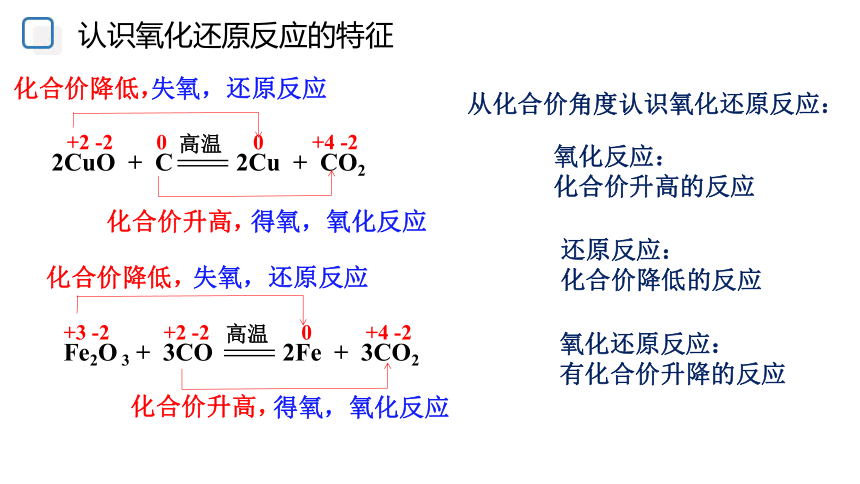
认识氧化还原反应的特征
(2)请标出以上反应中各物质所含元素的化合价,比较反应前后价态有无变化。
(3)讨论:在以上反应中,物质发生氧化反应或还原反应,与物质所含元素化合价的升高或降低有什么关系?
2CuO + C
高温
2Cu + CO2
Fe2O 3 + 3CO
高温
2Fe + 3CO2
+2 -2 0 0 +4 -2
+3 -2 +2 -2 0 +4 -2
化合价降低,
化合价降低,
化合价升高,
化合价升高,
失氧,还原反应
得氧,氧化反应
失氧,还原反应
得氧,氧化反应
认识氧化还原反应的特征
还原反应:
化合价降低的反应
氧化反应:
化合价升高的反应
从化合价角度认识氧化还原反应:
氧化还原反应:
有化合价升降的反应
认识氧化还原反应的特征
0
化合价升高,发生氧化反应
+1
-1
0
化合价降低,发生还原反应
1、并不是所有的氧化还原反应发生氧的得失,但一定会有元素化合价变化
2、元素化合价升降是氧化还原反应的重要特征,也是判断反应是否氧化还原反应的依据。
新认识:
探究氧化还原反应的本质
是什么原因导致了元素化合价发生变化?
Question
Na+ Cl-
+17
Na
Cl
+11
+17
+11
Cl-
Na+
失去e-
得到e-
化合价升降的原因之一:电子得失
0
+1
0
-1
探究氧化还原反应的本质
H
Cl
均不容易失去e-
+17
+1
形成共用电子对,双方都达到稳定结构——共赢
H Cl
+1
+17
H2 + Cl2 2HCl
点燃
是什么原因导致了元素化合价发生变化?
Question
0
+1
0
-1
化合价的升降的原因之二:共用电子对的偏移(偏离或偏向)
电子对偏离
电子对偏向
小结
氧化还原反应的特征
氧化还原反应的本质
元素化合价的变化
电子的转移(电子的得失或共用电子对的偏移)
根本原因
电子转移、化合价升降、反应类型的关系:
得电子→化合价降低→还原反应(得降还)
失电子→化合价升高→氧化反应(失升氧)
氧化还原反应与四大基本反应类型的关系
【思考与讨论】判断下列反应属于四种基本反应类型中的哪一种类型?哪些属于氧化还原反应?
化合反应
分解反应
置换反应
复分解反应
氧化还原反应
非氧化还原反应
2Na + Cl2 2NaCl
△
H2O + CaO Ca(OH)2
CaCO3 CaO + CO2↑
高温
2H2O2 2H2O + O2↑
MnO2
Fe + H2SO4 FeSO4 + H2↑
HCl + NaOH NaCl + H2O
氧化还原反应
非氧化还原反应
置换反应
复分解反应
化合反应
(1)置换反应一定属于氧化还原反应。
(2)复分解反应一定不属于氧化还原反应。
(3)有单质参与的化合反应和分解反应均属于氧化还原反应。
氧化还原反应与四大基本反应类型的关系
分解反应
阅读教材P25科学史话—氧化还原反应概念的发展,人们对氧化还原反应的认识经过了几个发展阶段?
氧化还原反应概念的发展:
电子转移(电子得失或共用电子对偏移)
得氧、失氧
元素化合价升降
元素(宏观视角)
电子(微观视角)
局限性
特征
本质
归纳总结
01
达标检测
下列反应不属于四大基本反应类型,但属于氧化还原反应的是
( )
Fe + CuSO4 FeSO4 + Cu
AgNO3 + NaCl AgCl ↓ + NaNO3
Fe2O3 + 3CO 2Fe + 3CO2
MgCl2(熔融) Mg + Cl2
高温
电解
C
02
达标检测
下列变化过程中,属于还原反应的是( )
HCl → Cl2 B. Na → Na+
C. CO → CO2 D. Fe3+ → Fe
D
03
达标检测
东晋炼丹价葛洪的《抱朴子》里记载“丹砂(HgS)烧之成水银,积变又还成丹砂”,这句话里没有涉及的反应类型有( )
A、分解反应
B、化合反应
C、置换反应
D、氧化还原反应
C
氧化还原反应在工农业生产、科学技术和日常生活中的作用意义,例如:氧化还原反应在金属冶炼工业、化工产品(合成氨,工业制硝酸等)的生产、农业生产,化学电源的制造等方面的应用。请同学们查找有关资料加深对氧化还原反应的认识。
课后活动
敬 请 指 导 !
为什么刚切开的苹果一段时间后会变色呢?
钢铁生锈
天然气燃烧
生活中发生氧化反应的现象
食物腐烂
第三节 氧化还原反应
第一课时
学习目标
1、通过对化合价的分析,认识氧化还原反应的规律,并对常见的化学反应进行分类。
2、基于化合价变化与电子转移的相关性,从微观上认识氧化还原反应的本质,形成认识化学反应的微观视角,建构氧化还原反应的认识模型。
认识氧化还原反应的特征
CuO、Fe2O3
C、CO
还原反应
氧化反应
结论:氧化反应和还原反应是在一个反应中同时发生的,这样的反应称为氧化还原反应
2CuO + C
高温
2Cu + CO2
Fe2O 3 + 3CO
高温
2Fe + 3CO2
认识氧化还原反应的特征
(2)请标出以上反应中各物质所含元素的化合价,比较反应前后价态有无变化。
(3)讨论:在以上反应中,物质发生氧化反应或还原反应,与物质所含元素化合价的升高或降低有什么关系?
2CuO + C
高温
2Cu + CO2
Fe2O 3 + 3CO
高温
2Fe + 3CO2
+2 -2 0 0 +4 -2
+3 -2 +2 -2 0 +4 -2
化合价降低,
化合价降低,
化合价升高,
化合价升高,
失氧,还原反应
得氧,氧化反应
失氧,还原反应
得氧,氧化反应
认识氧化还原反应的特征
还原反应:
化合价降低的反应
氧化反应:
化合价升高的反应
从化合价角度认识氧化还原反应:
氧化还原反应:
有化合价升降的反应
认识氧化还原反应的特征
0
化合价升高,发生氧化反应
+1
-1
0
化合价降低,发生还原反应
1、并不是所有的氧化还原反应发生氧的得失,但一定会有元素化合价变化
2、元素化合价升降是氧化还原反应的重要特征,也是判断反应是否氧化还原反应的依据。
新认识:
探究氧化还原反应的本质
是什么原因导致了元素化合价发生变化?
Question
Na+ Cl-
+17
Na
Cl
+11
+17
+11
Cl-
Na+
失去e-
得到e-
化合价升降的原因之一:电子得失
0
+1
0
-1
探究氧化还原反应的本质
H
Cl
均不容易失去e-
+17
+1
形成共用电子对,双方都达到稳定结构——共赢
H Cl
+1
+17
H2 + Cl2 2HCl
点燃
是什么原因导致了元素化合价发生变化?
Question
0
+1
0
-1
化合价的升降的原因之二:共用电子对的偏移(偏离或偏向)
电子对偏离
电子对偏向
小结
氧化还原反应的特征
氧化还原反应的本质
元素化合价的变化
电子的转移(电子的得失或共用电子对的偏移)
根本原因
电子转移、化合价升降、反应类型的关系:
得电子→化合价降低→还原反应(得降还)
失电子→化合价升高→氧化反应(失升氧)
氧化还原反应与四大基本反应类型的关系
【思考与讨论】判断下列反应属于四种基本反应类型中的哪一种类型?哪些属于氧化还原反应?
化合反应
分解反应
置换反应
复分解反应
氧化还原反应
非氧化还原反应
2Na + Cl2 2NaCl
△
H2O + CaO Ca(OH)2
CaCO3 CaO + CO2↑
高温
2H2O2 2H2O + O2↑
MnO2
Fe + H2SO4 FeSO4 + H2↑
HCl + NaOH NaCl + H2O
氧化还原反应
非氧化还原反应
置换反应
复分解反应
化合反应
(1)置换反应一定属于氧化还原反应。
(2)复分解反应一定不属于氧化还原反应。
(3)有单质参与的化合反应和分解反应均属于氧化还原反应。
氧化还原反应与四大基本反应类型的关系
分解反应
阅读教材P25科学史话—氧化还原反应概念的发展,人们对氧化还原反应的认识经过了几个发展阶段?
氧化还原反应概念的发展:
电子转移(电子得失或共用电子对偏移)
得氧、失氧
元素化合价升降
元素(宏观视角)
电子(微观视角)
局限性
特征
本质
归纳总结
01
达标检测
下列反应不属于四大基本反应类型,但属于氧化还原反应的是
( )
Fe + CuSO4 FeSO4 + Cu
AgNO3 + NaCl AgCl ↓ + NaNO3
Fe2O3 + 3CO 2Fe + 3CO2
MgCl2(熔融) Mg + Cl2
高温
电解
C
02
达标检测
下列变化过程中,属于还原反应的是( )
HCl → Cl2 B. Na → Na+
C. CO → CO2 D. Fe3+ → Fe
D
03
达标检测
东晋炼丹价葛洪的《抱朴子》里记载“丹砂(HgS)烧之成水银,积变又还成丹砂”,这句话里没有涉及的反应类型有( )
A、分解反应
B、化合反应
C、置换反应
D、氧化还原反应
C
氧化还原反应在工农业生产、科学技术和日常生活中的作用意义,例如:氧化还原反应在金属冶炼工业、化工产品(合成氨,工业制硝酸等)的生产、农业生产,化学电源的制造等方面的应用。请同学们查找有关资料加深对氧化还原反应的认识。
课后活动
敬 请 指 导 !
