浙教版2022-2023学年上学期九年级科学期末专题复习九:盐的性质【word,含答案】
文档属性
| 名称 | 浙教版2022-2023学年上学期九年级科学期末专题复习九:盐的性质【word,含答案】 |  | |
| 格式 | doc | ||
| 文件大小 | 324.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2022-11-21 16:40:28 | ||
图片预览


文档简介
考点 概述一些常见的盐(如食盐、纯碱、碳酸钙等)的主要性质及用途
1.几种重要的盐
概述 化学性质 用途
碳酸钠 白色粉末,水溶液显碱性,因而俗名纯碱,俗称苏打,碳酸钠晶体的化学式为Na2CO3·10H2O Na2CO3+2HCl===2NaCl+CO2↑+H2O 玻璃、造纸、纺织品、洗涤剂等工业原料
碳酸钙 难溶于水的白色固体,是石灰石和大理石的主要成分 CaCO3CaO+CO2↑CaCO3+CO2+H2O===Ca(HCO3)2 制石灰、水泥,作建筑材料和白色涂料等
氯化钠 无色透明的晶体,俗称食盐,不潮解,溶解度受温度的影响不大 NaCl+AgNO3===NaNO3+AgCl↓ 供食用和腌制食品,制取盐酸、氯气、烧碱等的原料
2.盐的溶解性
一般来说,钾盐、钠盐、铵盐、硝酸盐都易溶;而大多数碳酸盐都不溶于水;盐酸盐除AgCl不溶,硫酸盐除BaSO4不溶,其余均可溶(注:Ag2SO4、CaSO4为微溶物)。
3.盐的性质
(1)金属和盐溶液反应生成另一种金属和另一种盐。例:Fe+CuSO4===Cu+FeSO4
反应条件:参加反应的金属比盐中金属活泼(除钾、钙、钠外)。
(2)酸和盐反应生成另一种酸和另一种盐。例:Na2CO3+H2SO4===Na2SO4+H2O+CO2↑
(3)盐和盐反应生成另外两种新盐。例:Na2SO4+BaCl2===BaSO4↓+2NaCl
(4)碱和盐反应生成另一种碱和另一种盐。例:2NaOH+CuSO4===Na2SO4+Cu(OH)2↓
4.几种常见离子的检验
(1)Cl-的检验:加入AgNO3溶液,有白色沉淀生成,再加稀HNO3沉淀不溶解,证明样品中含Cl-。例:AgNO3+HCl===AgCl↓+HNO3
(2)SO的检验:加入Ba(NO3)2溶液,有白色沉淀生成,再加稀HNO3沉淀不溶解,说明样品中含SO。例:H2SO4+Ba(NO3)2===BaSO4↓+2HNO3
(3)CO的检验:向试样中滴加稀盐酸,有气体产生,将气体通入澄清的石灰水中变浑浊,说明样品中含有CO。例:Na2CO3+2HCl===2NaCl+H2O+CO2↑
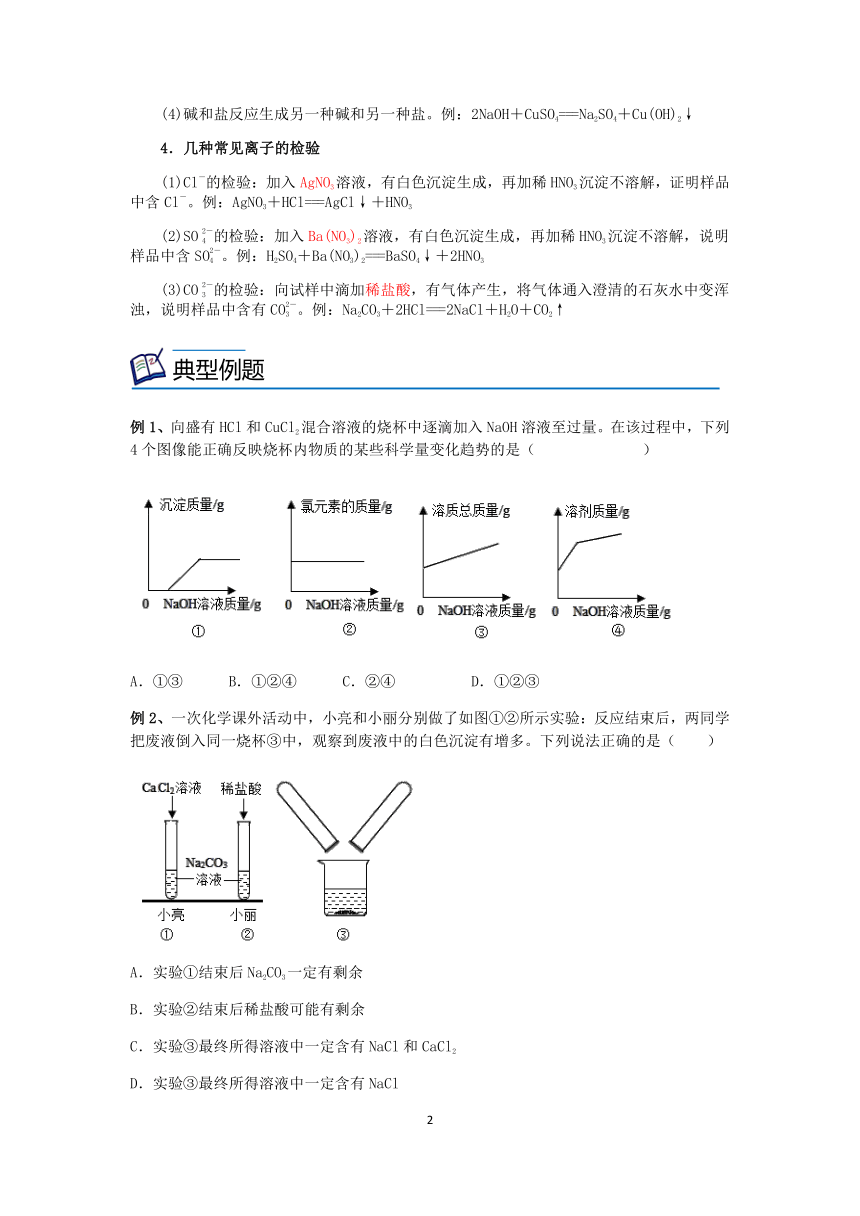
例1、向盛有HCl和CuCl2混合溶液的烧杯中逐滴加入NaOH溶液至过量。在该过程中,下列4个图像能正确反映烧杯内物质的某些科学量变化趋势的是( )
A.①③ B.①②④ C.②④ D.①②③
例2、一次化学课外活动中,小亮和小丽分别做了如图①②所示实验:反应结束后,两同学把废液倒入同一烧杯③中,观察到废液中的白色沉淀有增多。下列说法正确的是( )
A.实验①结束后Na2CO3一定有剩余
B.实验②结束后稀盐酸可能有剩余
C.实验③最终所得溶液中一定含有NaCl和CaCl2
D.实验③最终所得溶液中一定含有NaCl
例3、向一定的盐酸和氯化钙溶液的混合物中逐滴滴入碳酸钠溶液,且参加反应的碳酸钠溶液的质量与生成沉淀的质量之间的关系如图所示.则得下列说法正确的是( )
A. 反应过程中没有气泡
B. a点所处状态的溶液中溶质只有一种
C. b点比c点所处状态的溶液中氯化钠的质量分数小
D. ab线段上任意一点对应溶液的pH=7
例4、取石灰石样品4克,把20克稀盐酸分4次加入样品中(样品中除碳酸钙外,其余成分既不与盐酸反应,也不溶与水),充分反应后经过过滤、干燥,最后称量,得如下数据:
实验次数 第1次 第2次 第3次 第5次
稀盐酸用量/克 5 5 5 5
剩余固体质量/克 3 2 1 1
(1)求该石灰石样品中碳酸钙的质量分数_______;
(2)计算稀盐酸的溶质质量分数_______。
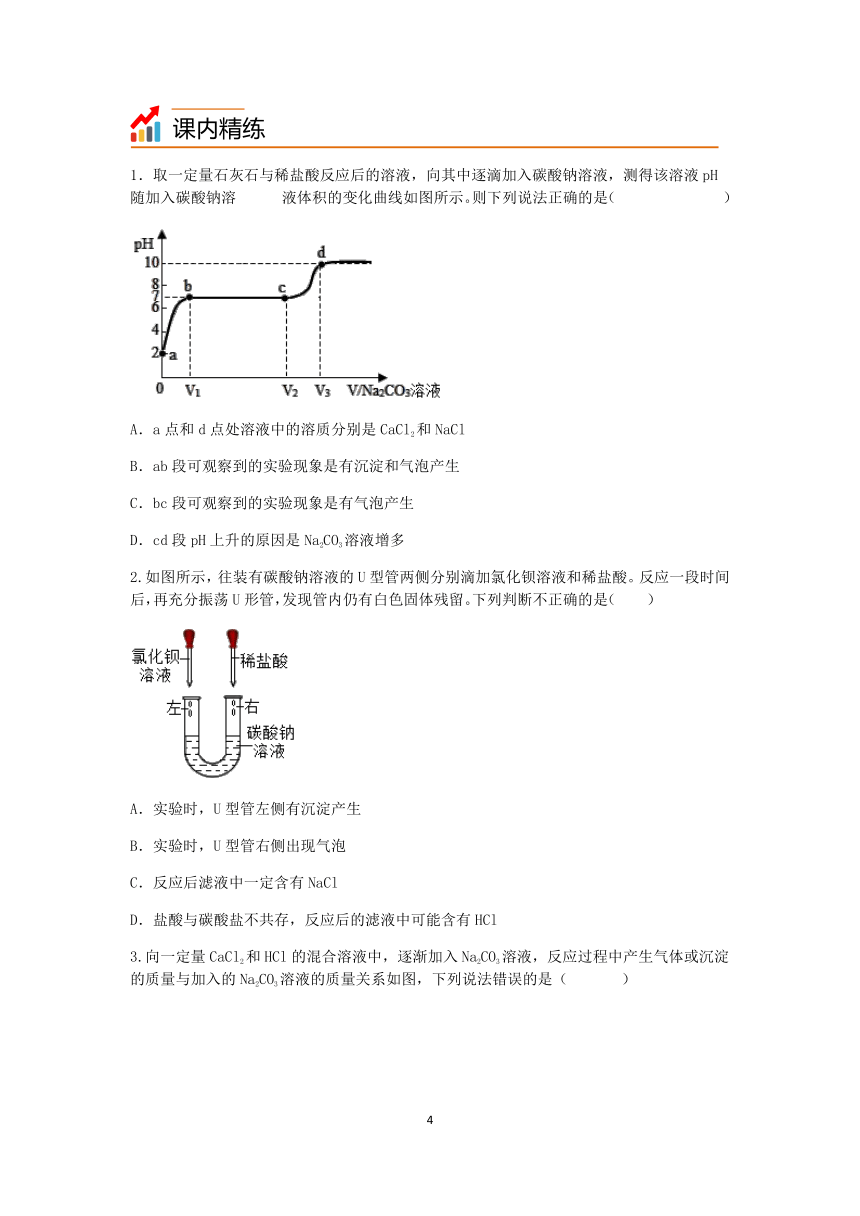
1.取一定量石灰石与稀盐酸反应后的溶液,向其中逐滴加入碳酸钠溶液,测得该溶液pH随加入碳酸钠溶 液体积的变化曲线如图所示。则下列说法正确的是( )
A.a点和d点处溶液中的溶质分别是CaCl2和NaCl
B.ab段可观察到的实验现象是有沉淀和气泡产生
C.bc段可观察到的实验现象是有气泡产生
D.cd段pH上升的原因是Na2CO3溶液增多
2.如图所示,往装有碳酸钠溶液的U型管两侧分别滴加氯化钡溶液和稀盐酸。反应一段时间后,再充分振荡U形管,发现管内仍有白色固体残留。下列判断不正确的是( )
A.实验时,U型管左侧有沉淀产生
B.实验时,U型管右侧出现气泡
C.反应后滤液中一定含有NaCl
D.盐酸与碳酸盐不共存,反应后的滤液中可能含有HCl
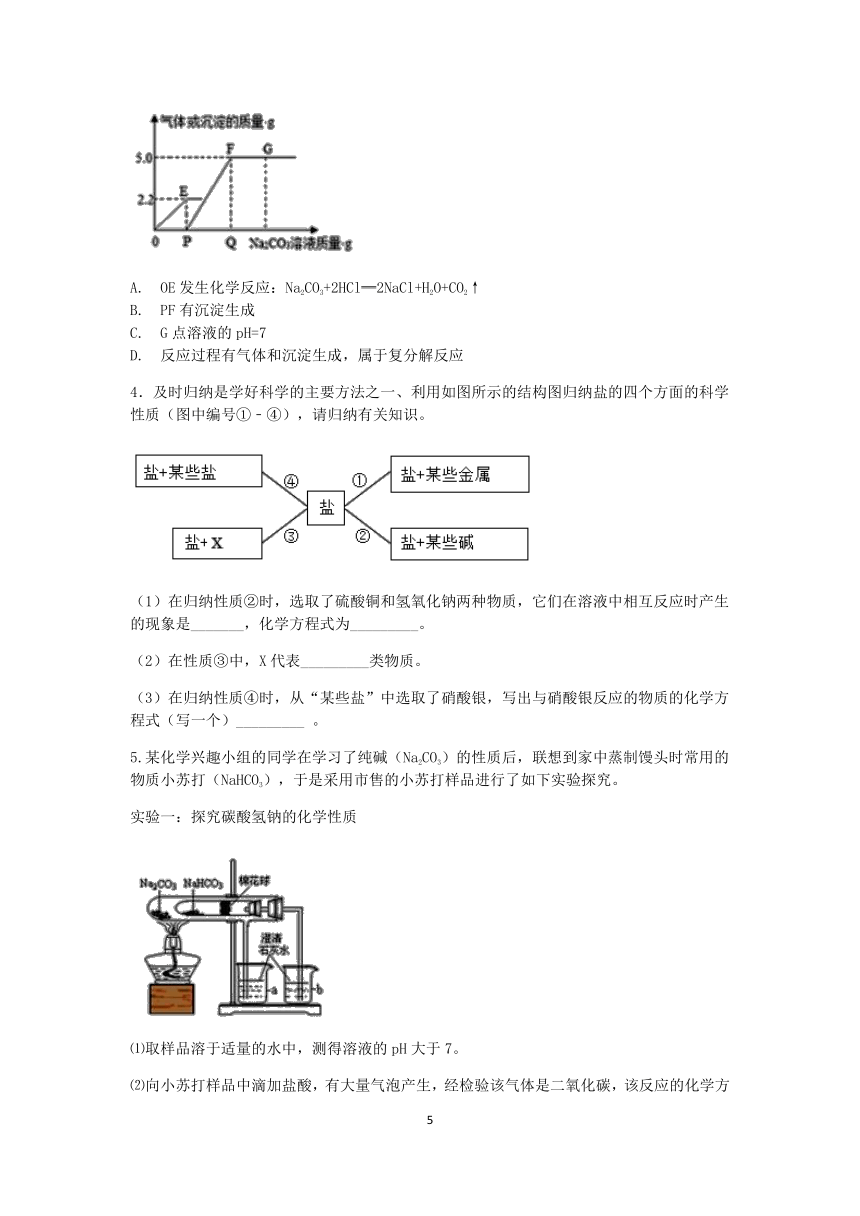
3.向一定量CaCl2和HCl的混合溶液中,逐渐加入Na2CO3溶液,反应过程中产生气体或沉淀的质量与加入的Na2CO3溶液的质量关系如图,下列说法错误的是( )
A. OE发生化学反应:Na2CO3+2HCl═2NaCl+H2O+CO2↑
B. PF有沉淀生成
C. G点溶液的pH=7
D. 反应过程有气体和沉淀生成,属于复分解反应
4.及时归纳是学好科学的主要方法之一、利用如图所示的结构图归纳盐的四个方面的科学性质(图中编号①﹣④),请归纳有关知识。
(1)在归纳性质②时,选取了硫酸铜和氢氧化钠两种物质,它们在溶液中相互反应时产生的现象是_______,化学方程式为_________。
(2)在性质③中,X代表_________类物质。
(3)在归纳性质④时,从“某些盐”中选取了硝酸银,写出与硝酸银反应的物质的化学方程式(写一个)_________ 。
5.某化学兴趣小组的同学在学习了纯碱(Na2CO3)的性质后,联想到家中蒸制馒头时常用的物质小苏打(NaHCO3),于是采用市售的小苏打样品进行了如下实验探究。
实验一:探究碳酸氢钠的化学性质
⑴取样品溶于适量的水中,测得溶液的pH大于7。
⑵向小苏打样品中滴加盐酸,有大量气泡产生,经检验该气体是二氧化碳,该反应的化学方程式为 。
⑶向小苏打的溶液中加入澄清石灰水,生成了白色沉淀。
⑷同学们通过查阅资料,在老师的指导下采用了如上图所示装置对小苏打和纯碱做了对比实验.实验中小试管内沾有无水硫酸铜粉末的棉花球变成蓝色,a烧杯中石灰水无明显现象,b烧杯中石灰水了现白色浑浊.试回答:
①在实验结束时,操作上要注意的问题是: 。
②由实验(4)可以得出的结论是 。
③请归纳出小苏打的化学性质(至少三点) 、 、 。
6.某同学为了研究生石灰露置于空气中变质情况,设计如下实验:
请通过计算分析:
(1)产生气体B的质量为___________;
(2)粉末A中碳酸钙的质量为___________ ,这些碳酸钙是由___________g氧化钙转化而来的;
(3)粉末A中氧化钙的质量分数是多少?(请写出计算过程)
1.向氯化钠溶液中滴加硝酸银溶液至恰好完全反应,反应前后溶液中存在的离子种类如图所示(其中“○”“☉”“●”“●”表示不同离子)则下列说法正确的是( )
A.表示钠离子
B.该化学反应前后原子数目发生了改变
C.该化学反应的本质是○●这两种微粒间的作用
D.该化学反应完全反应后溶液中只有两种粒子存在
2.小李在探究氢氧化钙的性质,进行图甲所示的实验。实验后,他向反应后的溶液中逐滴滴加碳酸钠溶液,溶液pH的变化如图所示,下列分析正确的是的( )
A.图甲中实验仪器操作无误
B.图乙中d-m段反应过程中有沉淀产生
C.图乙中m-n段反应过程中有气泡产生
D.图乙中n点之后溶液中的溶质有和
3.向一定量的硫酸铜和稀硫酸的混合溶液中滴加氢氧化钠溶液,反应过程中产生的沉淀质量与加入的氢氧化钠溶液质量关系如图所示。下列说法错误的是( )
A.a点溶液中的溶质有2种
B.滴加过程中,溶液中钠离子数量不断增加
C.整个变化过程中硫酸根离子数目没有改变
D.d点溶液的pH>7
4.图中的几种物质是常见的盐,请回答下列问题。
(1)在碳酸钠溶液中滴入氯化钙溶液,现象是___________。
(2)硫酸铜溶液与氢氧化钠溶液能发生反应,该反应的化学方程式为_________;硫酸铜溶液与氯化钠溶液不能反应,其理由是___________。
5.在一烧杯中盛有CaCl2和HCl的混合溶液100g,向其中逐渐滴加溶质质量分数为10%Na2CO3溶液,混合溶液的质量与所滴入的Na2CO3溶液的质量关系图象如图所示。
(1)在实验过程中,其中出现冒气泡的是 (填“PA”或“AB”)段。
(2)逐渐滴入碳酸钠溶液的过程中,杯中溶液的pH如何变化?
(3)原溶液中HCl的质量是多少克?
(4)当滴入Na2CO3溶液至图中B点时,通过计算求烧杯中(不饱和溶液)溶质的质量分数为多少?(计算结果精确到0.1%)
答案及解析
例1、B
【解析】
①由以上分析可知,开始滴加氢氧化钠溶液时,没有沉淀产生,当盐酸充分反应后,氢氧化钠再与氯化铜反应生成氢氧化铜蓝色沉淀,当氯化铜完全反应后,沉淀的质量不再改变,故①正确;
②由质量守恒定律可知,化学反应前后,元素的种类及其质量保持不变,所以反应过程中,氯元素的质量保持不变,故②正确;
③氢氧化钠先与盐酸反应生成氯化钠和水,根据HCl+NaOH=NaCl+H2O可知,每36.5份质量的氯化氢能生成58.5份质量的氯化钠,此时溶液中溶质的质量增大;氢氧化钠与氯化铜反应生成氢氧化铜蓝色沉淀和氯化钠,根据CuCl2+2NaOH= Cu(OH)2↓+2 NaCl可知,每135份质量的氯化铜能生成117份质量的氯化钠,此时溶液中溶质的质量减小,故③错误;
④氢氧化钠先与盐酸反应生成氯化钠和水,此时溶液中溶剂的质量增大,增大的是生成的水和氢氧化钠溶液中的水;氢氧化钠溶液与氯化铜反应生成氢氧化铜蓝色沉淀和氯化钠的过程中,由于加入的氢氧化钠溶液中存在水,溶剂的质量增大,但是幅度减小,故④正确。4个图像能正确反应烧杯内的某些物理量变化趋势的①②④。
例2、D
【解析】
A、反应结束后,两同学把废液倒入同一烧杯③中,观察到废液中的白色沉淀有增多,说明实验①结束后CaCl2一定有剩余,故选项说法错误;
B、反应结束后,两同学把废液倒入同一烧杯中,最后观察到废液中仍有白色沉淀存在,该白色沉淀是碳酸钙,说明一定没有盐酸剩余,故选项说法错误;
C、氯化钙与碳酸钠反应生成碳酸钙白色沉淀和氯化钠,所以实验③最终所得溶液中一定含有NaCl,可能含有CaCl2或碳酸钠,故选项说法错误;
D、氯化钙与碳酸钠反应生成碳酸钙白色沉淀和氯化钠,碳酸钠与盐酸反应生成氯化钠、水和二氧化碳,所以实验③最终所得溶液中一定含有NaCl,故选项说法正确。
例3、 D
【解析】碳酸钠先和稀盐酸反应,生成氯化钠、水和二氧化碳气体,再和氯化钙反应,生成碳酸钙沉淀和氯化钠,据此分析判断。
【解答】A.碳酸钠先和稀盐酸反应,生成氯化钠、水和二氧化碳气体,肯定有气泡产生,故A错误;
B.a点时稀盐酸恰好完全反应,而氯化钙还没有开始反应,此时的溶质为反应产物氯化钠和未反应的氯化钙,故B错误;
C.b点时,沉淀质量不再增大,即所有的反应已经结束,c点时碳酸钠溶液过量。二者氯化钠的质量相等,但是溶液质量增大了,根据“溶质质量分数=”可知,氯化钠的溶质质量分数b点大于c点,故C错误;
D.ab段的反应为碳酸钠和氯化钙的反应,氯化钙溶液呈中性,反应产物氯化钠也呈中性,因此ab段任意一点的溶液pH=7,故D正确。
故选D。
例4、 75%; 14.6%;
解:根据第1次和第2次加入稀盐酸的实验数据可知,5g的稀盐酸可反应掉1g的碳酸钙。设5g稀盐酸中溶质的质量为x。
,x=0.73g
稀盐酸的溶质质量分数为:=14.6%
【解析】
(1)石灰石样品中的碳酸钙能与稀盐酸反应生成二氧化碳气体,固体减少的质量是参加反应的碳酸钙的质量。第5次加入稀盐酸后固体质量仍剩余1g,说明该1g固体是杂质,所以石灰石样品中碳酸钙的质量分数为:=75%;
1.D
【解析】
A、a点是加入碳酸钠溶液前,此处溶液中的溶质是反应生成的氯化钙和过量的氯化氢,该选项说法不正确。
B、ab段是碳酸钠和稀盐酸反应,能够生成二氧化碳气体,因此可观察到的实验现象是有气泡产生,该选项说法不正确。
C、bc段发生反应是碳酸钠和氯化钙反应生成碳酸钙和氯化钠,有沉淀生成,该选项说法不正确。
D、碳酸钠溶液显碱性,cd段pH上升的原因是Na2CO3过量,该选项说法正确。
2.D
【解析】
A、实验时,左侧的碳酸钠和氯化钡反应生成碳酸钡白色沉淀和氯化钠,故A正确;
B、实验时,右侧的碳酸钠和稀盐酸反应生成氯化钠、水和二氧化碳气体,故B正确;
C、碳酸钠和氯化钡反应生成氯化钠,碳酸钠和稀盐酸反应生成氯化钠,氯化钠不和其它物质反应,反应后一定存在氯化钠,故C正确;
D、盐酸和碳酸盐不能共存,完全反应后试管中仍然存在白色固体碳酸钡,则反应后的滤液中不含HCl,故D不正确。故选D。
3.C
【解析】碳酸钠先和稀盐酸反应,生成氯化钠、水和二氧化碳气体,然后再和氯化钙反应,生成碳酸钙沉淀和氯化钠,据此分析判断。
【解答】A.OE段为碳酸钠和稀盐酸的反应,生成氯化钠、水和二氧化碳气体,方程式为: Na2CO3+2HCl═2NaCl+H2O+CO2↑ ,故A正确不合题意;
B.PF段为碳酸钠和氯化钙反应,生成氯化钠和碳酸钙沉淀,故B正确不合题意;
C.G点时加入的碳酸钠过量,此时溶液成碱性,pH>7,故C错误符合题意;
D. 反应过程有气体和沉淀生成,属于复分解反应,故D正确不合题意。
故选C。
4.产生蓝色絮状沉淀 CuSO4+2NaOH=Cu(OH)2↓+Na2SO4 酸 NaCl+AgNO3═NaNO3+AgCl↓
【解析】
(1)硫酸铜和氢氧化钠反应会生成氢氧化铜和硫酸钠,氢氧化铜是蓝色沉淀,故实验现象是由蓝色沉淀生成,化学方程式为。
(2)盐除了能和某些金属、某些碱、某些盐反应,还可以和某些酸反应,故在性质③中,X代表酸类物质。
(3)在归纳性质④时,从“某些盐”中选取了硝酸银,根据复分解反应的条件,可知化学方程式可以为:NaCl+AgNO3═NaNO3+AgCl↓。
5.NaHCO3+HCl=NaCl+H2O+CO2↑;为防止倒吸引起试管炸裂,应先将导管从烧杯中取出,再熄灭酒精灯;碳酸氢钠受热会分解,碳酸钠受热不分解;水溶液呈碱性;可与酸发生反应;受热能分解
【解析】(2)确定反应物、反应条件和生成物,据此写出反应的化学方程式;
(4)①反应结束后,如果熄灭酒精灯后拿出导管,那么由于试管内气压减小,会会被吸入试管而炸裂;
②a烧杯与装有碳酸钠的大试管相连,受热后,a中石灰水没有明显现象,说明没有二氧化碳产生,即碳酸钠受热不分解。b烧杯与装有碳酸氢钠的小试管相连,受热后,b中石灰水变浑浊,说明产生了二氧化碳;棉花变成蓝色,说明有水生成,即碳酸氢钠受热分解了,据此分析解答。
③可从水溶液的酸碱性、是否与酸反应以及热稳定性等角度分析解答。
【解答】(2)碳酸氢钠与稀盐酸反应,生成氯化钠、水和二氧化碳,反应的方程式为: NaHCO3+HCl=NaCl+H2O+CO2↑ 。
(4)①在实验结束时,操作上要注意的问题是:为防止倒吸引起试管炸裂,应先将导管从烧杯中取出,再熄灭酒精灯。
②由实验(4)可以得出的结论是:碳酸氢钠受热会分解,碳酸钠受热不分解。
③小苏打的化学性质:水溶液呈碱性、可与酸发生反应和受热能分解。
6.(1)1.1g(2)2.5g;1.4
(3)解:由(2)可知,粉末A中含2.5g碳酸钙,则氧化钙和氢氧化钙的总质量为12g-2.5g=9.5g。
原氧化钙质量为10g,则现未变质的氧化钙和变质为氢氧化钙的氧化钙质量总和为10g-1.4g=8.6g。
设未变质的氧化钙质量为x
x=5.8g
CaO% = ×100% = 48.3%
答:粉末A中氧化钙的质量分数是48.3%。
【解析】
【详解】
(1)气体B是二氧化碳,沉淀质量2.5g是二氧化碳和氢氧化钙反应生成碳酸钙的质量,设生成二氧化碳的质量为x;
解得:x=1.1g
(2)由,可知,粉末A中CaCO3的质量即为二氧化碳和氢氧化钙反应生成碳酸钙的质量,也是2.5g;
设这些CaCO3是由质量为y的CaO转化而来;
由,可知,CaO~CaCO3,
解得:y=1.4g
(3)解:由(2)可知,粉末A中含2.5g碳酸钙,则氧化钙和氢氧化钙的总质量为12g-2.5g=9.5g;
原氧化钙质量为10g,则现未变质的氧化钙和变质为氢氧化钙的氧化钙质量总和为10g-1.4g=8.6g;
再利用化学方程式计算得到氧化钙的质量,过程见答案。
1.A
【解析】
A、 表示钠离子,说法正确;
B、该化学反应前后原子数目没有发生了改变,说法错误;
C、该化学反应的本质是银离子和氯离子这两种微粒间生成氯化银沉淀,说法错误;
D、该化学反应完全反应后有水分子、钠离子、硝酸根离子三种粒子存在,说法错误。
2.D
【解析】
A、使用胶头滴管滴加少量液体的操作,注意胶头滴管不能伸入到试管内或接触试管内壁,应垂直悬空在试管口上方滴加液体,防止污染胶头滴管,故A不正确;
B、由溶液pH的变化图,d m段pH增大,发生的是碳酸钠与稀盐酸反应生成氯化钠、水和二氧化碳,d m断反应过程中有气泡产生,故B不正确;
C、由溶液pH的变化图,m n段pH不变,碳酸钠能与氯化钙反应生成碳酸钙沉淀和氯化钠,反应过程中没有气泡产生,故C不正确;
D、图乙中n点之后溶液中是氯化钠和碳酸钠的混合溶液,溶质有Na2CO3和NaCl,故D正确。故选D。
3.A
【解析】
A. 0—b段是氢氧化钠溶液与稀硫酸反应,所以a点溶液中的溶质有硫酸、硫酸钠、硫酸铜3种,此选项错误;
B. 因为反应过程中,钠离子不与其它离子结合为沉淀,所以滴加过程中,溶液中钠离子数量不断增加,此选项正确;
C. 因为反应过程中,硫酸根离子不与其它离子结合为沉淀,所以整个变化过程中硫酸根离子数目没有改变,此选项正确;
D. d点是氢氧化钠过量,氢氧化钠溶液显碱性,所以溶液的pH>7,此选项正确。
4.产生白色沉淀 CuSO4+2NaOH=Na2SO4+Cu(OH)2↓ 硫酸铜溶液与氯化钠溶液交换成分没有沉淀、气体或水生成
【解析】
(1)碳酸钠与氯化钙反应生成碳酸钙白色沉淀和氯化钠,因此现象是产生白色沉淀。
(2)硫酸铜溶液与氢氧化钠溶液反应生成氢氧化铜蓝色沉淀和硫酸钠,化学方程式为:CuSO4+2NaOH=Na2SO4+Cu(OH)2↓。硫酸铜溶液与氯化钠溶液不能反应的理由是:硫酸铜溶液与氯化钠溶液交换成分没有沉淀、气体或水生成。
5.(1)PA
(2)先变大,再不变,再变大
(3)设原溶液中HCl的质量是x。
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 73
10.6g x
x=7.3g
原溶液中HCl的质量是7.3g
(4)设碳酸钠与氯化钙反应生成的碳酸钙的质量为a,生成的氯化钠的质量为b
据质量守恒定律化学反应前后元素的质量不变,故溶质氯化钠的质量=×100%=23.4g。与氯化钙反应的碳酸钠的质量=106g×10%=10.6g,设生成的碳酸钙的质量为x,
Na2CO3+CaCl2=CaCO3↓+2NaCl
106 100
10.6g x
X=10g
设生成的二氧化碳的质量为y;
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
10.6g y
Y=4.4g
c点时溶液的总质量=100g+212g-10g-4.4g=297.6g
溶质的质量分数=×100%=7.9%,
【解析】PA段表示碳酸钠溶液与盐酸反应,AB段表示氯化钙和碳酸钠溶液反应。
【解答】(1)在实验过程中,由于混合溶液中含有盐酸和氯化钙,所以加入碳酸钠溶液时,先生成气体后生成沉淀,所以出现冒气泡的是PA段,而AB段是生成沉淀的。
(2)由于混合溶液中含有盐酸和氯化钙,盐酸先被反应掉,所以逐渐滴入碳酸钠溶液的过程中,杯中溶液的pH由小于7,慢慢变大,后来等于7,最有由于碳酸钠过量,而碳酸钠溶液显碱性,所以pH大于7. 先变大,再不变,再变大 .
浙教版2022-2023学年上学期九年级科学期末专题复习(九)
盐的性质
考点过关
典型例题
课内精练
课后提分
典型例题
课内精练
课后提分
1.几种重要的盐
概述 化学性质 用途
碳酸钠 白色粉末,水溶液显碱性,因而俗名纯碱,俗称苏打,碳酸钠晶体的化学式为Na2CO3·10H2O Na2CO3+2HCl===2NaCl+CO2↑+H2O 玻璃、造纸、纺织品、洗涤剂等工业原料
碳酸钙 难溶于水的白色固体,是石灰石和大理石的主要成分 CaCO3CaO+CO2↑CaCO3+CO2+H2O===Ca(HCO3)2 制石灰、水泥,作建筑材料和白色涂料等
氯化钠 无色透明的晶体,俗称食盐,不潮解,溶解度受温度的影响不大 NaCl+AgNO3===NaNO3+AgCl↓ 供食用和腌制食品,制取盐酸、氯气、烧碱等的原料
2.盐的溶解性
一般来说,钾盐、钠盐、铵盐、硝酸盐都易溶;而大多数碳酸盐都不溶于水;盐酸盐除AgCl不溶,硫酸盐除BaSO4不溶,其余均可溶(注:Ag2SO4、CaSO4为微溶物)。
3.盐的性质
(1)金属和盐溶液反应生成另一种金属和另一种盐。例:Fe+CuSO4===Cu+FeSO4
反应条件:参加反应的金属比盐中金属活泼(除钾、钙、钠外)。
(2)酸和盐反应生成另一种酸和另一种盐。例:Na2CO3+H2SO4===Na2SO4+H2O+CO2↑
(3)盐和盐反应生成另外两种新盐。例:Na2SO4+BaCl2===BaSO4↓+2NaCl
(4)碱和盐反应生成另一种碱和另一种盐。例:2NaOH+CuSO4===Na2SO4+Cu(OH)2↓
4.几种常见离子的检验
(1)Cl-的检验:加入AgNO3溶液,有白色沉淀生成,再加稀HNO3沉淀不溶解,证明样品中含Cl-。例:AgNO3+HCl===AgCl↓+HNO3
(2)SO的检验:加入Ba(NO3)2溶液,有白色沉淀生成,再加稀HNO3沉淀不溶解,说明样品中含SO。例:H2SO4+Ba(NO3)2===BaSO4↓+2HNO3
(3)CO的检验:向试样中滴加稀盐酸,有气体产生,将气体通入澄清的石灰水中变浑浊,说明样品中含有CO。例:Na2CO3+2HCl===2NaCl+H2O+CO2↑
例1、向盛有HCl和CuCl2混合溶液的烧杯中逐滴加入NaOH溶液至过量。在该过程中,下列4个图像能正确反映烧杯内物质的某些科学量变化趋势的是( )
A.①③ B.①②④ C.②④ D.①②③
例2、一次化学课外活动中,小亮和小丽分别做了如图①②所示实验:反应结束后,两同学把废液倒入同一烧杯③中,观察到废液中的白色沉淀有增多。下列说法正确的是( )
A.实验①结束后Na2CO3一定有剩余
B.实验②结束后稀盐酸可能有剩余
C.实验③最终所得溶液中一定含有NaCl和CaCl2
D.实验③最终所得溶液中一定含有NaCl
例3、向一定的盐酸和氯化钙溶液的混合物中逐滴滴入碳酸钠溶液,且参加反应的碳酸钠溶液的质量与生成沉淀的质量之间的关系如图所示.则得下列说法正确的是( )
A. 反应过程中没有气泡
B. a点所处状态的溶液中溶质只有一种
C. b点比c点所处状态的溶液中氯化钠的质量分数小
D. ab线段上任意一点对应溶液的pH=7
例4、取石灰石样品4克,把20克稀盐酸分4次加入样品中(样品中除碳酸钙外,其余成分既不与盐酸反应,也不溶与水),充分反应后经过过滤、干燥,最后称量,得如下数据:
实验次数 第1次 第2次 第3次 第5次
稀盐酸用量/克 5 5 5 5
剩余固体质量/克 3 2 1 1
(1)求该石灰石样品中碳酸钙的质量分数_______;
(2)计算稀盐酸的溶质质量分数_______。
1.取一定量石灰石与稀盐酸反应后的溶液,向其中逐滴加入碳酸钠溶液,测得该溶液pH随加入碳酸钠溶 液体积的变化曲线如图所示。则下列说法正确的是( )
A.a点和d点处溶液中的溶质分别是CaCl2和NaCl
B.ab段可观察到的实验现象是有沉淀和气泡产生
C.bc段可观察到的实验现象是有气泡产生
D.cd段pH上升的原因是Na2CO3溶液增多
2.如图所示,往装有碳酸钠溶液的U型管两侧分别滴加氯化钡溶液和稀盐酸。反应一段时间后,再充分振荡U形管,发现管内仍有白色固体残留。下列判断不正确的是( )
A.实验时,U型管左侧有沉淀产生
B.实验时,U型管右侧出现气泡
C.反应后滤液中一定含有NaCl
D.盐酸与碳酸盐不共存,反应后的滤液中可能含有HCl
3.向一定量CaCl2和HCl的混合溶液中,逐渐加入Na2CO3溶液,反应过程中产生气体或沉淀的质量与加入的Na2CO3溶液的质量关系如图,下列说法错误的是( )
A. OE发生化学反应:Na2CO3+2HCl═2NaCl+H2O+CO2↑
B. PF有沉淀生成
C. G点溶液的pH=7
D. 反应过程有气体和沉淀生成,属于复分解反应
4.及时归纳是学好科学的主要方法之一、利用如图所示的结构图归纳盐的四个方面的科学性质(图中编号①﹣④),请归纳有关知识。
(1)在归纳性质②时,选取了硫酸铜和氢氧化钠两种物质,它们在溶液中相互反应时产生的现象是_______,化学方程式为_________。
(2)在性质③中,X代表_________类物质。
(3)在归纳性质④时,从“某些盐”中选取了硝酸银,写出与硝酸银反应的物质的化学方程式(写一个)_________ 。
5.某化学兴趣小组的同学在学习了纯碱(Na2CO3)的性质后,联想到家中蒸制馒头时常用的物质小苏打(NaHCO3),于是采用市售的小苏打样品进行了如下实验探究。
实验一:探究碳酸氢钠的化学性质
⑴取样品溶于适量的水中,测得溶液的pH大于7。
⑵向小苏打样品中滴加盐酸,有大量气泡产生,经检验该气体是二氧化碳,该反应的化学方程式为 。
⑶向小苏打的溶液中加入澄清石灰水,生成了白色沉淀。
⑷同学们通过查阅资料,在老师的指导下采用了如上图所示装置对小苏打和纯碱做了对比实验.实验中小试管内沾有无水硫酸铜粉末的棉花球变成蓝色,a烧杯中石灰水无明显现象,b烧杯中石灰水了现白色浑浊.试回答:
①在实验结束时,操作上要注意的问题是: 。
②由实验(4)可以得出的结论是 。
③请归纳出小苏打的化学性质(至少三点) 、 、 。
6.某同学为了研究生石灰露置于空气中变质情况,设计如下实验:
请通过计算分析:
(1)产生气体B的质量为___________;
(2)粉末A中碳酸钙的质量为___________ ,这些碳酸钙是由___________g氧化钙转化而来的;
(3)粉末A中氧化钙的质量分数是多少?(请写出计算过程)
1.向氯化钠溶液中滴加硝酸银溶液至恰好完全反应,反应前后溶液中存在的离子种类如图所示(其中“○”“☉”“●”“●”表示不同离子)则下列说法正确的是( )
A.表示钠离子
B.该化学反应前后原子数目发生了改变
C.该化学反应的本质是○●这两种微粒间的作用
D.该化学反应完全反应后溶液中只有两种粒子存在
2.小李在探究氢氧化钙的性质,进行图甲所示的实验。实验后,他向反应后的溶液中逐滴滴加碳酸钠溶液,溶液pH的变化如图所示,下列分析正确的是的( )
A.图甲中实验仪器操作无误
B.图乙中d-m段反应过程中有沉淀产生
C.图乙中m-n段反应过程中有气泡产生
D.图乙中n点之后溶液中的溶质有和
3.向一定量的硫酸铜和稀硫酸的混合溶液中滴加氢氧化钠溶液,反应过程中产生的沉淀质量与加入的氢氧化钠溶液质量关系如图所示。下列说法错误的是( )
A.a点溶液中的溶质有2种
B.滴加过程中,溶液中钠离子数量不断增加
C.整个变化过程中硫酸根离子数目没有改变
D.d点溶液的pH>7
4.图中的几种物质是常见的盐,请回答下列问题。
(1)在碳酸钠溶液中滴入氯化钙溶液,现象是___________。
(2)硫酸铜溶液与氢氧化钠溶液能发生反应,该反应的化学方程式为_________;硫酸铜溶液与氯化钠溶液不能反应,其理由是___________。
5.在一烧杯中盛有CaCl2和HCl的混合溶液100g,向其中逐渐滴加溶质质量分数为10%Na2CO3溶液,混合溶液的质量与所滴入的Na2CO3溶液的质量关系图象如图所示。
(1)在实验过程中,其中出现冒气泡的是 (填“PA”或“AB”)段。
(2)逐渐滴入碳酸钠溶液的过程中,杯中溶液的pH如何变化?
(3)原溶液中HCl的质量是多少克?
(4)当滴入Na2CO3溶液至图中B点时,通过计算求烧杯中(不饱和溶液)溶质的质量分数为多少?(计算结果精确到0.1%)
答案及解析
例1、B
【解析】
①由以上分析可知,开始滴加氢氧化钠溶液时,没有沉淀产生,当盐酸充分反应后,氢氧化钠再与氯化铜反应生成氢氧化铜蓝色沉淀,当氯化铜完全反应后,沉淀的质量不再改变,故①正确;
②由质量守恒定律可知,化学反应前后,元素的种类及其质量保持不变,所以反应过程中,氯元素的质量保持不变,故②正确;
③氢氧化钠先与盐酸反应生成氯化钠和水,根据HCl+NaOH=NaCl+H2O可知,每36.5份质量的氯化氢能生成58.5份质量的氯化钠,此时溶液中溶质的质量增大;氢氧化钠与氯化铜反应生成氢氧化铜蓝色沉淀和氯化钠,根据CuCl2+2NaOH= Cu(OH)2↓+2 NaCl可知,每135份质量的氯化铜能生成117份质量的氯化钠,此时溶液中溶质的质量减小,故③错误;
④氢氧化钠先与盐酸反应生成氯化钠和水,此时溶液中溶剂的质量增大,增大的是生成的水和氢氧化钠溶液中的水;氢氧化钠溶液与氯化铜反应生成氢氧化铜蓝色沉淀和氯化钠的过程中,由于加入的氢氧化钠溶液中存在水,溶剂的质量增大,但是幅度减小,故④正确。4个图像能正确反应烧杯内的某些物理量变化趋势的①②④。
例2、D
【解析】
A、反应结束后,两同学把废液倒入同一烧杯③中,观察到废液中的白色沉淀有增多,说明实验①结束后CaCl2一定有剩余,故选项说法错误;
B、反应结束后,两同学把废液倒入同一烧杯中,最后观察到废液中仍有白色沉淀存在,该白色沉淀是碳酸钙,说明一定没有盐酸剩余,故选项说法错误;
C、氯化钙与碳酸钠反应生成碳酸钙白色沉淀和氯化钠,所以实验③最终所得溶液中一定含有NaCl,可能含有CaCl2或碳酸钠,故选项说法错误;
D、氯化钙与碳酸钠反应生成碳酸钙白色沉淀和氯化钠,碳酸钠与盐酸反应生成氯化钠、水和二氧化碳,所以实验③最终所得溶液中一定含有NaCl,故选项说法正确。
例3、 D
【解析】碳酸钠先和稀盐酸反应,生成氯化钠、水和二氧化碳气体,再和氯化钙反应,生成碳酸钙沉淀和氯化钠,据此分析判断。
【解答】A.碳酸钠先和稀盐酸反应,生成氯化钠、水和二氧化碳气体,肯定有气泡产生,故A错误;
B.a点时稀盐酸恰好完全反应,而氯化钙还没有开始反应,此时的溶质为反应产物氯化钠和未反应的氯化钙,故B错误;
C.b点时,沉淀质量不再增大,即所有的反应已经结束,c点时碳酸钠溶液过量。二者氯化钠的质量相等,但是溶液质量增大了,根据“溶质质量分数=”可知,氯化钠的溶质质量分数b点大于c点,故C错误;
D.ab段的反应为碳酸钠和氯化钙的反应,氯化钙溶液呈中性,反应产物氯化钠也呈中性,因此ab段任意一点的溶液pH=7,故D正确。
故选D。
例4、 75%; 14.6%;
解:根据第1次和第2次加入稀盐酸的实验数据可知,5g的稀盐酸可反应掉1g的碳酸钙。设5g稀盐酸中溶质的质量为x。
,x=0.73g
稀盐酸的溶质质量分数为:=14.6%
【解析】
(1)石灰石样品中的碳酸钙能与稀盐酸反应生成二氧化碳气体,固体减少的质量是参加反应的碳酸钙的质量。第5次加入稀盐酸后固体质量仍剩余1g,说明该1g固体是杂质,所以石灰石样品中碳酸钙的质量分数为:=75%;
1.D
【解析】
A、a点是加入碳酸钠溶液前,此处溶液中的溶质是反应生成的氯化钙和过量的氯化氢,该选项说法不正确。
B、ab段是碳酸钠和稀盐酸反应,能够生成二氧化碳气体,因此可观察到的实验现象是有气泡产生,该选项说法不正确。
C、bc段发生反应是碳酸钠和氯化钙反应生成碳酸钙和氯化钠,有沉淀生成,该选项说法不正确。
D、碳酸钠溶液显碱性,cd段pH上升的原因是Na2CO3过量,该选项说法正确。
2.D
【解析】
A、实验时,左侧的碳酸钠和氯化钡反应生成碳酸钡白色沉淀和氯化钠,故A正确;
B、实验时,右侧的碳酸钠和稀盐酸反应生成氯化钠、水和二氧化碳气体,故B正确;
C、碳酸钠和氯化钡反应生成氯化钠,碳酸钠和稀盐酸反应生成氯化钠,氯化钠不和其它物质反应,反应后一定存在氯化钠,故C正确;
D、盐酸和碳酸盐不能共存,完全反应后试管中仍然存在白色固体碳酸钡,则反应后的滤液中不含HCl,故D不正确。故选D。
3.C
【解析】碳酸钠先和稀盐酸反应,生成氯化钠、水和二氧化碳气体,然后再和氯化钙反应,生成碳酸钙沉淀和氯化钠,据此分析判断。
【解答】A.OE段为碳酸钠和稀盐酸的反应,生成氯化钠、水和二氧化碳气体,方程式为: Na2CO3+2HCl═2NaCl+H2O+CO2↑ ,故A正确不合题意;
B.PF段为碳酸钠和氯化钙反应,生成氯化钠和碳酸钙沉淀,故B正确不合题意;
C.G点时加入的碳酸钠过量,此时溶液成碱性,pH>7,故C错误符合题意;
D. 反应过程有气体和沉淀生成,属于复分解反应,故D正确不合题意。
故选C。
4.产生蓝色絮状沉淀 CuSO4+2NaOH=Cu(OH)2↓+Na2SO4 酸 NaCl+AgNO3═NaNO3+AgCl↓
【解析】
(1)硫酸铜和氢氧化钠反应会生成氢氧化铜和硫酸钠,氢氧化铜是蓝色沉淀,故实验现象是由蓝色沉淀生成,化学方程式为。
(2)盐除了能和某些金属、某些碱、某些盐反应,还可以和某些酸反应,故在性质③中,X代表酸类物质。
(3)在归纳性质④时,从“某些盐”中选取了硝酸银,根据复分解反应的条件,可知化学方程式可以为:NaCl+AgNO3═NaNO3+AgCl↓。
5.NaHCO3+HCl=NaCl+H2O+CO2↑;为防止倒吸引起试管炸裂,应先将导管从烧杯中取出,再熄灭酒精灯;碳酸氢钠受热会分解,碳酸钠受热不分解;水溶液呈碱性;可与酸发生反应;受热能分解
【解析】(2)确定反应物、反应条件和生成物,据此写出反应的化学方程式;
(4)①反应结束后,如果熄灭酒精灯后拿出导管,那么由于试管内气压减小,会会被吸入试管而炸裂;
②a烧杯与装有碳酸钠的大试管相连,受热后,a中石灰水没有明显现象,说明没有二氧化碳产生,即碳酸钠受热不分解。b烧杯与装有碳酸氢钠的小试管相连,受热后,b中石灰水变浑浊,说明产生了二氧化碳;棉花变成蓝色,说明有水生成,即碳酸氢钠受热分解了,据此分析解答。
③可从水溶液的酸碱性、是否与酸反应以及热稳定性等角度分析解答。
【解答】(2)碳酸氢钠与稀盐酸反应,生成氯化钠、水和二氧化碳,反应的方程式为: NaHCO3+HCl=NaCl+H2O+CO2↑ 。
(4)①在实验结束时,操作上要注意的问题是:为防止倒吸引起试管炸裂,应先将导管从烧杯中取出,再熄灭酒精灯。
②由实验(4)可以得出的结论是:碳酸氢钠受热会分解,碳酸钠受热不分解。
③小苏打的化学性质:水溶液呈碱性、可与酸发生反应和受热能分解。
6.(1)1.1g(2)2.5g;1.4
(3)解:由(2)可知,粉末A中含2.5g碳酸钙,则氧化钙和氢氧化钙的总质量为12g-2.5g=9.5g。
原氧化钙质量为10g,则现未变质的氧化钙和变质为氢氧化钙的氧化钙质量总和为10g-1.4g=8.6g。
设未变质的氧化钙质量为x
x=5.8g
CaO% = ×100% = 48.3%
答:粉末A中氧化钙的质量分数是48.3%。
【解析】
【详解】
(1)气体B是二氧化碳,沉淀质量2.5g是二氧化碳和氢氧化钙反应生成碳酸钙的质量,设生成二氧化碳的质量为x;
解得:x=1.1g
(2)由,可知,粉末A中CaCO3的质量即为二氧化碳和氢氧化钙反应生成碳酸钙的质量,也是2.5g;
设这些CaCO3是由质量为y的CaO转化而来;
由,可知,CaO~CaCO3,
解得:y=1.4g
(3)解:由(2)可知,粉末A中含2.5g碳酸钙,则氧化钙和氢氧化钙的总质量为12g-2.5g=9.5g;
原氧化钙质量为10g,则现未变质的氧化钙和变质为氢氧化钙的氧化钙质量总和为10g-1.4g=8.6g;
再利用化学方程式计算得到氧化钙的质量,过程见答案。
1.A
【解析】
A、 表示钠离子,说法正确;
B、该化学反应前后原子数目没有发生了改变,说法错误;
C、该化学反应的本质是银离子和氯离子这两种微粒间生成氯化银沉淀,说法错误;
D、该化学反应完全反应后有水分子、钠离子、硝酸根离子三种粒子存在,说法错误。
2.D
【解析】
A、使用胶头滴管滴加少量液体的操作,注意胶头滴管不能伸入到试管内或接触试管内壁,应垂直悬空在试管口上方滴加液体,防止污染胶头滴管,故A不正确;
B、由溶液pH的变化图,d m段pH增大,发生的是碳酸钠与稀盐酸反应生成氯化钠、水和二氧化碳,d m断反应过程中有气泡产生,故B不正确;
C、由溶液pH的变化图,m n段pH不变,碳酸钠能与氯化钙反应生成碳酸钙沉淀和氯化钠,反应过程中没有气泡产生,故C不正确;
D、图乙中n点之后溶液中是氯化钠和碳酸钠的混合溶液,溶质有Na2CO3和NaCl,故D正确。故选D。
3.A
【解析】
A. 0—b段是氢氧化钠溶液与稀硫酸反应,所以a点溶液中的溶质有硫酸、硫酸钠、硫酸铜3种,此选项错误;
B. 因为反应过程中,钠离子不与其它离子结合为沉淀,所以滴加过程中,溶液中钠离子数量不断增加,此选项正确;
C. 因为反应过程中,硫酸根离子不与其它离子结合为沉淀,所以整个变化过程中硫酸根离子数目没有改变,此选项正确;
D. d点是氢氧化钠过量,氢氧化钠溶液显碱性,所以溶液的pH>7,此选项正确。
4.产生白色沉淀 CuSO4+2NaOH=Na2SO4+Cu(OH)2↓ 硫酸铜溶液与氯化钠溶液交换成分没有沉淀、气体或水生成
【解析】
(1)碳酸钠与氯化钙反应生成碳酸钙白色沉淀和氯化钠,因此现象是产生白色沉淀。
(2)硫酸铜溶液与氢氧化钠溶液反应生成氢氧化铜蓝色沉淀和硫酸钠,化学方程式为:CuSO4+2NaOH=Na2SO4+Cu(OH)2↓。硫酸铜溶液与氯化钠溶液不能反应的理由是:硫酸铜溶液与氯化钠溶液交换成分没有沉淀、气体或水生成。
5.(1)PA
(2)先变大,再不变,再变大
(3)设原溶液中HCl的质量是x。
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 73
10.6g x
x=7.3g
原溶液中HCl的质量是7.3g
(4)设碳酸钠与氯化钙反应生成的碳酸钙的质量为a,生成的氯化钠的质量为b
据质量守恒定律化学反应前后元素的质量不变,故溶质氯化钠的质量=×100%=23.4g。与氯化钙反应的碳酸钠的质量=106g×10%=10.6g,设生成的碳酸钙的质量为x,
Na2CO3+CaCl2=CaCO3↓+2NaCl
106 100
10.6g x
X=10g
设生成的二氧化碳的质量为y;
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
10.6g y
Y=4.4g
c点时溶液的总质量=100g+212g-10g-4.4g=297.6g
溶质的质量分数=×100%=7.9%,
【解析】PA段表示碳酸钠溶液与盐酸反应,AB段表示氯化钙和碳酸钠溶液反应。
【解答】(1)在实验过程中,由于混合溶液中含有盐酸和氯化钙,所以加入碳酸钠溶液时,先生成气体后生成沉淀,所以出现冒气泡的是PA段,而AB段是生成沉淀的。
(2)由于混合溶液中含有盐酸和氯化钙,盐酸先被反应掉,所以逐渐滴入碳酸钠溶液的过程中,杯中溶液的pH由小于7,慢慢变大,后来等于7,最有由于碳酸钠过量,而碳酸钠溶液显碱性,所以pH大于7. 先变大,再不变,再变大 .
浙教版2022-2023学年上学期九年级科学期末专题复习(九)
盐的性质
考点过关
典型例题
课内精练
课后提分
典型例题
课内精练
课后提分
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
