专题2《化学反应速率与化学平衡》单元检测题2022--2023学年上学期高二苏教版(2020)高中化学选择性必修1
文档属性
| 名称 | 专题2《化学反应速率与化学平衡》单元检测题2022--2023学年上学期高二苏教版(2020)高中化学选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-21 14:20:20 | ||
图片预览



文档简介
专题2《化学反应速率与化学平衡》单元检测题
一、单选题
1.下列关于化学反应速率的说法正确的是
A.化学反应速率是指在一段时间内反应物物质的量的减少或生成物物质的量的增加量
B.化学反应速率为0.2mol·L-1·min-1,是指反应经过1min后,某物质的浓度是0.2mol·L-1
C.对于任何化学反应来说,反应速率越快,反应现象越明显
D.化学反应速率可以衡量化学反应进行的快慢
2.已知反应A(g)+B(g) C(g)+D(g)的平衡常数K值与温度的关系如表所示。830℃时,向一个2L的密闭容器中充入0.20molA和0.20molB,10s末达平衡。下列说法不正确的是
A.达到平衡后,B的转化率为50%
B.该反应为吸热反应,升高温度,平衡正向移动
C.反应初始至平衡,A的平均反应速率v(A)=0.005mol·L-1·s-1
D.容器体积减小为原来的一半,平衡不移动,正、逆反应速率均增大
3.开发催化加氢合成甲醇技术是有效利用资源,实现“碳达峰、碳中和”目标的重要途径。某温度下,在恒容密闭容器中发生反应: 。下列有关说法正确的是
A.加入合适的催化剂,能提高单位时间内的产量
B.升高反应温度有利于提高的平衡转化率
C.平衡后再通入适量,平衡常数K增大
D.增大体系的压强,平衡不发生移动
4.乙烯与HCl气体催化加成反应的能量与反应历程的关系如图所示,下列说法正确的是
A.第一步反应比第二步的快
B.第一步的逆反应活化能比第二步的小
C.两步反应的均小于0
D.增大压强可以使该反应的增大
5.合成氨反应为 。下列有关该反应的说法正确的是
A.催化剂增大了正、逆反应的活化能
B.升高温度,该反应的平衡常数增大
C.正反应的活化能小于逆反应的活化能
D.反应在高温、高压和催化剂条件下进行可提高的平衡转化率
6.碳酸铵[(NH4) 2CO3]在室温下就能自发地分解产生氨气,下列说法正确的是
A.碳酸盐都不稳定,都能自发分解
B.碳酸铵分解是因为进行了加热的操作
C.碳酸铵分解是吸热反应,此反应不应该自发进行,必须借助外力才能进行
D.碳酸铵分解是因为生成了易挥发的气体,使体系的熵增大
7.少量铁粉与100mL0.01mol·L-1的稀盐酸反应,反应速率太慢,为了加快此反应速率而不改变H2的量,可以使用如下方法中的
①由铁粉换铁块②加NaNO3固体③将0.01mol·L-1的稀盐酸换成98%的硫酸溶液④加CH3COONa固体⑤加NaCl溶液⑥滴入几滴硫酸铜溶液⑦升高温度(不考虑盐酸挥发)⑧改用100mL0.1mol·L-1盐酸
A.③⑤ B.①③ C.⑥⑦ D.⑦⑧
8.反应4NH3(g)+5O2(g)4NO(g)+6H2O(g) △H=-905.9 kJ·mol-1,在5 L密闭容器中投入1 mol NH3和1 mol的O2,2分钟后NO的物质的量增加了0.4 mol,下列说法错误的是
A.0~2 min v(O2)=0.05 mol·L-1·min-1 B.2分钟内O2的转化率是50%
C.2分钟末c(H2O)=0.6 mol/L D.2分钟反应放出的热量值等于90.59 kJ
9.在温度T1时,向一体积固定为2L的密闭容器中通入1molCO2和3molH2发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H<0,5min后反应达到平衡,CO2的转化率为20%。下列说法正确的是
A.前5min,平均反应速率v(H2)=0.06mol(L·min)
B.该温度下反应平衡常数的值为
C.当v正(CO2)=3v逆(H2)时,说明反应已达到平衡状态
D.若平衡后升温,正反应速率减小,逆反应速率增大,平衡左移
10.室温下,某溶液初始时仅溶有M和N且浓度相等,同时发生以下两个反应:①;②。反应①的速率可表示为,反应②的速率可表示为(、为速率常数)。反应体系中组分M、Z的浓度随时间变化情况如图。下列说法错误的是
A.0~30min时间段内,Y的平均反应速率为
B.反应开始后,体系中Y和Z的浓度之比保持不变
C.如果反应能进行到底,反应结束时62.5%的M转化为Z
D.反应①的活化能比反应②的活化能大
11.实验室中模拟合成氨反应:在恒容密闭容器中,初始投入量相等的条件下,得到三组实验数据如表所示:
实验序号 温度() 浓度()
1 300 2.00 1.70 1.50 1.36 1.25 1.20 1.20
2 300 2.00 1.50 1.28 1.20 1.20 1.20 1.20
3 200 2.00 1.60 1.39 1.29 1.27 1.27 1.27
下列有关说法不正确的是A.当容器内的压强不再改变时,说明该可逆反应已达到化学平衡状态
B.实验2中,前内以的浓度变化表示的化学反应速率为
C.比较实验1和2,说明实验2使用了更高效的催化剂
D.实验3中,时向容器中充入一定量,则正反应速率不变
12.一定温度下,将2molA和2molB两种气体混合放入体积为2L的密闭刚性容器中,发生反应3A(g)+B(g)xC(g)+2D(g),2min末反应达到平衡,生成0.8molD,并测得C的物质的量浓度为0.4mol·L-1,下列说法正确的是( )
A.此温度下该反应的平衡常数K等于0.5
B.A的平衡转化率为40%
C.x的值为1
D.A和B的平衡转化率相等
二、填空题
13.环戊二烯()是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
(1)已知:(g) (g)+H2(g) ΔH1=100.3 kJ·mol 1①H2(g)+ I2(g) 2HI(g) ΔH2= 11.0 kJ·mol 1②,对于反应:(g)+ I2(g) (g)+2HI(g) ③ ΔH3=___________kJ·mol 1。
(2)某温度下,等物质的量的碘和环戊烯()在刚性容器内发生反应③,起始总压为105Pa,平衡时总压增加了20%,环戊烯的转化率为_________,该反应的平衡常数Kp=_________Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有__________(填标号)。
A.通入惰性气体 B.提高温度 C.增加环戊烯浓度 D.增加碘浓度
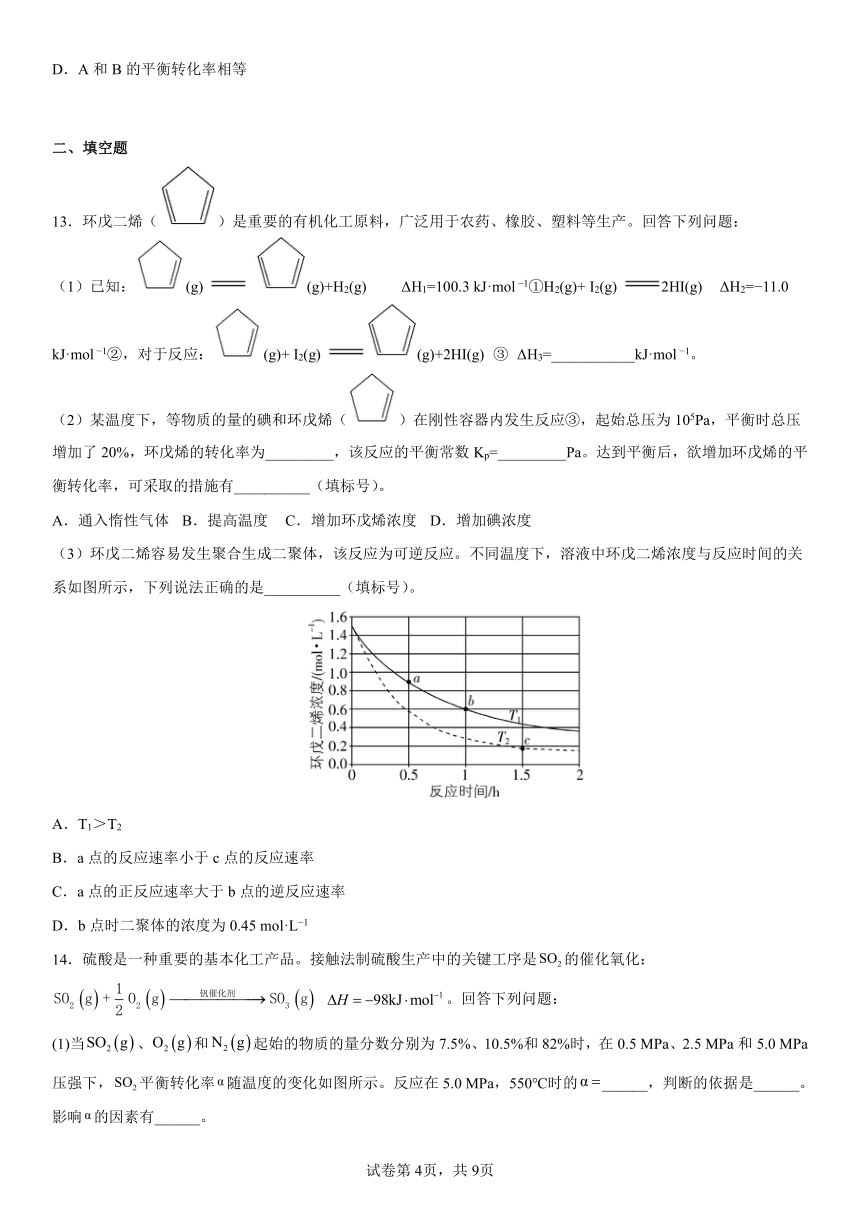
(3)环戊二烯容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是__________(填标号)。
A.T1>T2
B.a点的反应速率小于c点的反应速率
C.a点的正反应速率大于b点的逆反应速率
D.b点时二聚体的浓度为0.45 mol·L 1
14.硫酸是一种重要的基本化工产品。接触法制硫酸生产中的关键工序是的催化氧化: 。回答下列问题:
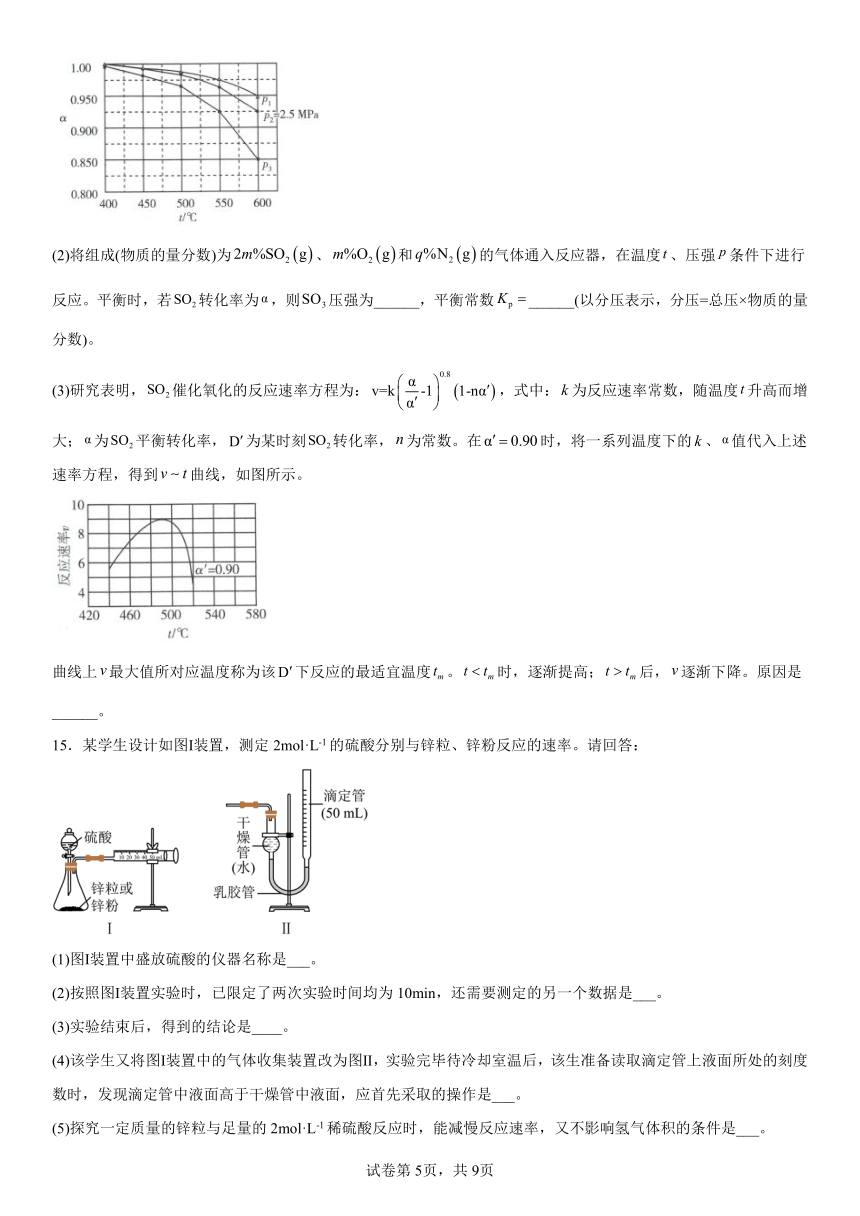
(1)当、和起始的物质的量分数分别为7.5%、10.5%和82%时,在0.5 MPa、2.5 MPa和5.0 MPa压强下,平衡转化率随温度的变化如图所示。反应在5.0 MPa,550℃时的______,判断的依据是______。影响的因素有______。
(2)将组成(物质的量分数)为、和的气体通入反应器,在温度、压强条件下进行反应。平衡时,若转化率为,则压强为______,平衡常数______(以分压表示,分压=总压×物质的量分数)。
(3)研究表明,催化氧化的反应速率方程为:,式中:为反应速率常数,随温度升高而增大;为平衡转化率,为某时刻转化率,为常数。在时,将一系列温度下的、值代入上述速率方程,得到曲线,如图所示。
曲线上最大值所对应温度称为该下反应的最适宜温度。时,逐渐提高;后,逐渐下降。原因是______。
15.某学生设计如图Ⅰ装置,测定2mol·L-1的硫酸分别与锌粒、锌粉反应的速率。请回答:
(1)图Ⅰ装置中盛放硫酸的仪器名称是___。
(2)按照图Ⅰ装置实验时,已限定了两次实验时间均为10min,还需要测定的另一个数据是___。
(3)实验结束后,得到的结论是____。
(4)该学生又将图Ⅰ装置中的气体收集装置改为图Ⅱ,实验完毕待冷却室温后,该生准备读取滴定管上液面所处的刻度数时,发现滴定管中液面高于干燥管中液面,应首先采取的操作是___。
(5)探究一定质量的锌粒与足量的2mol·L-1稀硫酸反应时,能减慢反应速率,又不影响氢气体积的条件是___。
A.加入一定量的醋酸钠固体 B.加入一定量的硫酸铜
C.加入一定KNO3溶液 D.加入一定体积的Na2SO4溶液
16.氧化剂在反应时不产生污染物,被称为绿色氧化剂,因而受到人们越来越多的关注。某实验小组以分解为例,探究浓度、催化剂、温度对反应速率的影响。在常温下按照下表所示的方案完成实验。
实验编号 温度(℃) 反应物 催化剂
① 20 253%溶液 无
② 20 255%溶液 无
③ 20 255%溶液 0.1g
④ 20 255%溶液 1~2滴1溶液
⑤ 30 255%溶液 0.1g
(1)实验①和②的目的是___________。同学甲在进行实验①和②时并没有观察到明显现象。资料显示,通常条件下过氧化氢稳定,不易分解。为了达到实验目的,可采取的改进方法是___________(写出一种即可)。
(2)实验③、④、⑤中,测得生成氧气的体积随时间变化如甲图所示。分析该图能得出的结论是___________,___________;
(3)同学乙设计了乙图所示的实验装置对过氧化氢的分解速率进行定量分析,以生成20气体为准,其他影响实验的因素均已忽略。实验中需要测量的数据是___________。
(4)向某体积固定的密闭容器中加入0.6A、0.2C和一定量(未知)的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图所示。已知在反应过程中混合气体的平均相对分子质量没有变化。请回答:
①写出反应的化学方程式:___________;
②若,则内反应速率___________,A的转化率为___________;
③B的起始的物质的量是___________;平衡时体系内的压强为初始状态的___________倍。
三、计算题
17.将固体置于密闭容器中,在一定温度下发生下列反应:①;②,达到平衡时,,,则此温度下反应①的平衡常数为
A. B. C. D.
18.加0.10 mol MnO2粉末于50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示。
(1)写出H2O2在MnO2作用下发生反应的化学方程式_______。
(2)实验时放出气体的总体积是_______ mL。
(3)反应进行4、3、2、1分钟分别对应曲线上A、B、C、D四点,各点反应速率快慢的顺序为_______。用有效碰撞理论解释该反应速率变化的原因_______。
(4)计算H2O2的初始物质的量浓度_______。(请保留两位有效数字)
四、工业流程题
19.活性炭载钯催化剂被广泛应用于医药和化工行业。废钯催化剂的杂质主要含炭、有机物及少量、、等元素。从废钯催化剂中回收钯,并制备二氯二氨合钯的一种工艺流程如下:
回答下列问题:
(1)“焙烧”的目的是_______。
(2)“烧渣”的主要成分是,利用水合肼在弱碱性环境下还原,产生的气体可以参与大气循环。该还原反应的化学方程式为_______。
(3)“粗钯”中含、等杂质,可采用电解精炼的方法得到纯钯,精炼时粗钯应与电源的_______极相连,与均为第Ⅷ族元素,性质相似,则阴极的电极反应为_______。
(4)王水是按体积比3∶1将浓盐酸和浓硝酸混合而得到的强氧化性溶液,加热条件下钯在王水中发生反应生成和一种有毒的无色气体A,该气体遇空气变红棕色,请写出该红棕色气体在集气瓶里颜色变浅的化学方程式:_______。
(5)“沉钯”中氯化铵与“混合液”中的氯钯酸反应生成氨钯酸铵沉淀,其沉淀率随温度的变化曲线如图所示,下列有关推断错误的是_______(填标号)。
A.升高温度有利于氯化氢挥发,促使平衡正向移动
B.沉钯的最佳温度为100℃
C.该反应
(6)海绵状金属钯密度为,具有优良的吸氢功能,标准状况下,其吸附的氢气是其体积的840倍,则此条件下海绵钯的吸附容量_______。
20.某研究性学习小组利用氯型阴离子交换树脂(RCl)从海带中提取,并测定反应的平衡常数。
Ⅰ.离子交换法提取的流程如下:
已知:①交换吸附发生反应:,;
②吸附和达饱和的树脂分别呈淡黄色和黑红色。
(1)“氧化”时转化为,反应的离子方程式为___________。
(2)“一次洗脱”已经完成的现象是___________。
(3)洗脱液1中,碘元素以___________(填离子符号)存在,向其中加入,可析出碘晶体。
(4)将分离出碘晶体的洗脱液合并,置于___________(填仪器名称)中,加入乙醚,振荡,静置,分液。后经___________(填操作名称)回收乙醚。
Ⅱ.测定反应的平衡常数K
常温下,取2个碘量瓶分别加入下表中的药品,振荡半小时。取一定体积的上层清液用溶液进行滴定,测定和的总浓度。
编号 250mL碘量瓶① 250mL碘量瓶②
药品 0.5g研细的碘 0.5g研细的碘
和的总浓度
(5)不能用普通锥形瓶代替碘量瓶的原因___________。
(6)0.5g的碘的不需要精确称取的理由是___________。
(7)碘量瓶①平衡体系中与②中接近。___________(保留3位有效数字)。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
【解析】A.化学反应速率用单位时间内反应物浓度的减少或生成物浓度的增加来表示,故A错误;
B.化学反应速率为0.2mol·L-1·min-1,是指反应经过1min后,某物质的浓度减少或增加0.2mol·L-1,故B错误;
C.有些反应无明显的现象,如酸碱中和反应,故C错误;
D.化学反应速率可以衡量化学反应进行的快慢,故D正确;
故选D。
2.B
【解析】A.830℃时, ,向一个2L的密闭容器中充入0.20molA和0.20molB,10s末达平衡,设A反应的物质的量浓度为x,则有 , ,解得x=0.05,故达到平衡后,B的转化率为 ,A正确;
B.由表中数据可知,温度越高、K越小,可知升高温度平衡逆向移动,则正反应为放热反应,B错误;
C.反应初始至平衡,A的平均反应速率 ,C正确;
D.反应前后气体的总物质的量不变,则容器体积减小为原来的一半,平衡不移动,正、逆反应速率增大程度相等,D正确;
故选B。
3.A
【解析】A.加入合适的催化剂,能降低反应的活化能,加快反应速率,提高单位时间内甲醇的产量,故A正确;
B.该反应是放热反应,升高温度,平衡向逆反应方向移动,氢气的转化率减小,故B错误;
C.平衡常数是温度函数,温度不变,平衡常数不变,所以平衡后再通入适量氢气,平衡常数K不变,故C错误;
D.该反应是气体体积减小的反应,增大体系的压强,平衡向正反应方向移动,故D错误;
故选A。
4.B
【解析】A.由图可知,第一部反应的活化能高于第二步,活化能越高反应速率越慢,所以第一步比第二步慢,A错误;
B.由图可知,第一步逆反应的活化能比第二步的小,B正确;
C.第一步反应为吸热反应,大于0,C错误;
D.对于确定的反应而言,反应热与压强无关,D错误;
答案为:B。
5.C
【解析】A.催化剂降低反应的活化能,增大反应速率,A错误;
B.该反应为放热反应,升温平衡逆向移动,平衡常数减小,B错误;
C.该反应为放热反应,反应物的总能量大于生成物的总能量,故正反应的活化能小于逆反应的活化能,C正确;
D.合成氨反应为放热反应,在高温下,反应会逆向移动,H2的平衡转化率会减小;工业上采用高温的原因是加快生成NH3的速率,同时考虑催化剂的活性在较高温度下较好,另外催化剂不会影响平衡转化率,D错误;
故选C。
6.D
【解析】A.有的碳酸盐稳定,不能自发分解,如Na2CO3受热不分解,故A错误;
B.碳酸铵在室温下就能自发地分解,不需要外界给予了能量,故B错误;
C.有些吸热反应也可自发,而焓变不是自发反应的唯一因素,应根据△H T△S进行判断反应是否自发进行,故C错误;
D.碳铵自发分解,是因为体系由于氨气和二氧化碳气体的生成而使熵增大,故D正确;
故选:D。
7.D
【解析】①由铁粉换铁块,反应速率减慢,故错误;②加NaNO3固体与酸形成硝酸,不产生氢气,故错误;③将0.01mol·L-1的稀盐酸换成98%的硫酸溶液,发生钝化现象,故错误;④加CH3COONa固体,生成醋酸,氢离子浓度减小,反应速率减慢,故错误;⑤加NaCl溶液,氢离子浓度减小,反应速率减慢,故错误;⑥滴入几滴硫酸铜溶液,铁置换出铜,构成原电池,反应速率加快,但Fe少量,导致生成的氢气减少,故错误;⑦升高温度(不考虑盐酸挥发),反应速率加快,故正确;⑧改用100mL0.1mol·L-1盐酸,氢离子浓度增大,反应速率加快,故正确;故选D。
8.C
【解析】A.2分钟后NO的物质的量增加了0.4 mol,则根据物质反应转化关系可知:反应消耗O2的物质的量为△n(O2)=,故0~2 min v(O2)==0.05 mol·L-1·min-1,A正确;
B.根据A计算可知2分钟内反应消耗O2的物质的量为△n(O2)=0.5 mol,反应开始时O2的物质的量为1 mol,故O2转化率是=50%,B正确;
C.从反应开始至2分钟后NO的物质的量增加了0.4 mol,则根据物质反应转化关系可知反应产生H2O的物质的量为△n(H2O)=,反应容器的容积是5 L,故2分钟末c(H2O)==0.12 mol/L,C错误;
D.根据热化学方程式可知:每反应产生4 mol NO气体时,反应放出热量是905.9 kJ,现在是发生该反应产生了0.4 mol NO 气体,因此2分钟反应放出的热量值Q==90.59 kJ,D正确;
故合理选项是C。
9.A
【解析】A.由题意知,前5min,CO2的变化量为0.2mol,则H2的变化量为0.6mol,v(H2)=0.06mol(L·min),A正确;
B.向体积为2L的密闭容器中通入1molCO2和3molH2发生上述反应,5min后反应达到平衡,CO2的转化率为20%,可列出三段式(单位为mol/L):,则该温度下反应平衡常数为,B错误;
C.当3v正(CO2)= v逆(H2)时,说明反应已达到平衡状态,C错误;
D.平衡后升温,正反应速率增大,逆反应速率增大,因反应放热反应,平衡左移,D错误;
故答案为A。
10.A
【解析】A.由图象可知0~30min时间段内,M的浓度变化为,Z的浓度变化为0.125,即反应②中M的浓度变化为0.125,故反应①中M的浓度变化为(,即Y的浓度变化为0.075,所以0~30min时间段内,Y的平均反应速率,故A错误;
B.由可得:,且,,则Y、Z的浓度变化之比,所以反应开始后,Y、Z的浓度变化保持不变,故B正确;
C.根据A项计算,参加反应②的M所占的比例为,故如果反应能进行到底,反应结束时62.5%的M转化为Z,故C正确;
D.反应②的速率较大,所以反应①的活化能比反应②的活化能大,故D正确;
答案选A。
11.B
【解析】A.根据反应方程式可知,该反应前后气体的分子数不同,在反应过程中体系的压强随着分子数的变化而变化,故当容器内的压强不再改变时,说明该可逆反应已达到化学平衡状态,A正确;
B.实验2中,前20min内以H2的浓度变化表示的化学反应速率为=0.036mol L-1 min-1,NH3的浓度变化表示的化学反应速率为0.024mol L-1 min-1,B错误;
C.催化剂只能加快反应速率,不能影响平衡移动。比较实验1和2,实验2更快达到了与实验1相同的化学平衡状态,说明实验2使用了更高效的催化剂C正确;
D.恒容容器中通入氦气,反应混合物中各组分的深度保持不变,故反应速率不变,D正确;
故选B。
12.A
【解析】列三段式:
C.根据题意0.2x mol/L = 0.4mol/L,解得x = 2,C错;
A.,A正确;
B.A平衡转化率= ,B错;
D.B的平衡转化率=,D错;
故答案选A。
13. 89.3 40% 3.56×104 BD CD
【解析】(1)利用盖斯定律解题;
(2)利用差量法计算转化率;三行式法计算平衡常数;根据平衡移动原理解释;
(3)通过外界因素对速率的影响和平衡状态的形成分析A、B、C选项,D选项观察图象计算;
【解析】(1)已知:(g)=(g)+H2(g)△H1=+100.3kJ mol-1 ①,H2(g)+I2(g)=2HI(g)△H2=-11.0kJ mol-1 ②,根据盖斯定律,①+②得③(g)+I2(g)=(g)+2HI(g)△H3=(+100.3kJ mol-1)+(-11.0kJ mol-1)=+89.3kJ mol-1;
(2)设碘和环戊烯()的初始物质的量都为nmol,转化的物质的量为xmol,
(g)+I2(g)=(g)+2HI(g)
初始(mol) n n 0 0
转化(mol)x x x 2x
平衡(mol)n-x n-x x 2x
刚性容器内气体的压强与物质的量成正比,则:=1+20%,解得:x=0.4n,
平衡时环戊烯的转化率为:×100%=40%;
平衡时混合气体的压强为:105Pa×(1+20%)=1.2×105Pa,混合气体总物质的量为:(n-0.4n+n-0.4n+0.4n+0.4n×2)mol=2.4nmol,
平衡时各组分所占压强分别为p()=p(I2)=×1.2×105Pa=3×104Pa,p()=×1.2×105Pa=2×104Pa,p(HI)=×1.2×105Pa=4×104Pa,该反应的平衡常数Kp=≈3.56×104Pa;
A.通入惰性气体,各组分浓度不变,平衡不移动,则环戊烯的转化率不变,故A错误;
B.该反应为吸热反应,提高温度平衡向着正向移动,环戊烯的转化率增大,故B正确;
C.增加环戊烯浓度,环戊烯的转化率减小,故C错误;
D.增加碘浓度,反应物浓度增大,平衡向着正向移动,环戊烯的转化率增大,故D正确;
故答案为BD;
(3)A.温度越高反应速率越快,根据图示可知,在温度T2(虚线)的反应速率较大,则T1<T2,故A错误;
B.根据图象可知,a点切线斜率的绝对值大于c点切线的绝对值,则a点速率大于c点,故B错误;
C.a到b的过程为正反应速率逐渐减小,且b点v(正)>v(逆),则a点的正反应速率大于b点的逆反应速率,故C正确;
D.b点时环戊二烯的浓度变化为:1.5mol/L-0.6mol/L=0.9mol/L,环戊二烯的二聚体的浓度为环戊二烯浓度变化的,则b点时二聚体的浓度为0.9mol/L×=0.45mol L-1,故D正确;
故答案为CD。
【点睛】考查盖斯定律的应用,有关盖斯定律的习题,首先要根据所求的反应分析,分析以下几点:①所求反应中的反应物在哪个反应了?是反应物还是生成物?②所给反应中哪些物质是所求反应中没有的?③如何才能去掉无用的?然后,通过相互加减,去掉无关物质;将所对应的△H代入上述化学方程式的加减中就可以了。
14. 0.975 该反应气体分子数减少,增大压强,提高 ,所以 温度、压强和反应物的起始浓度(组成) 升高温度,增大使逐渐提高,但降低使逐渐下降。时,增大对的提高大于引起的降低;后,增大对的提高小于引起的降低。
【解析】(1)由题给反应式知,该反应为气体分子数减少的反应,其他条件一定时,增大压强,平衡转化率增大,故,结合题图(b)知5.0 MPa、550℃时对应的平衡转化率为0.975。影响平衡转化率的因素有:温度、压强、反应物的起始浓度等。
(2)设通入的、和共100 mol,利用三段式法进行计算:
平衡时气体的总物质的量为,则,,,因,,代入计算得。
(3)升高温度,反应速率常数增大,反应速率,提高但降低使反应速率逐渐下降。时,增大对的提高大于引起的降低后,增大对的提高小于引起的降低。
15.(1)分液漏斗
(2)收集到气体的体积
(3)其他条件相同时,锌粉与硫酸的反应速率比锌粒与硫酸的反应速率快
(4)调节滴定管的高度使得两侧液面相平
(5)AD
【解析】(1)
根据装置的特点可知,图Ⅰ装置中盛放硫酸的仪器名称是分液漏斗。
(2)
若测定反应速率,则还需要测定的另一个数据是收集到气体的体积。
(3)
由于增大反应物的接触面积可以加快反应速率,所以该实验中得出的结论是:其他条件相同时,锌粉与硫酸的反应速率比锌粒与硫酸的反应速率快。
(4)
由于气体的体积受压强的影响大,所以在读数之前还需要采取的措施是调节滴定管的高度,使得两侧液面相平。
(5)
A.加入一定量的醋酸钠固体,生成弱酸醋酸,氢离子浓度减小,速率减小,但不影响氢气的总量,符合题意;B.加入一定量的硫酸铜和锌生成铜,组成原电池,加快反应速率,不符合题意;C.加入一定KNO3溶液,生成硝酸和锌不生成氢气,不符合题意;D.加入一定体积的Na2SO4溶液,稀释了溶液,浓度减小,速率减慢,不影响氢气的总量,符合题意;故选AD。
16. 探究浓度对反应速率的影响 向反应物中加入等量同种催化剂(或升高相同温度) 升高温度,反应速率加快 对过氧化氢分解的催化效果更好 产生20气体所需的时间 0.006 60% 0.08 1
【解析】(1)实验①和②的浓度不同,则该实验的目的为探究浓度对化学反应速率的影响;同学甲在进行实验时并没有观察到明显现象。资料显示,通常条件下过氧化氢稳定,不易分解。为了便于比较,需要加快反应速率,可以向反应物中加入等量同种催化剂(或将盛有反应物的试管放在同一热水浴中,升高相同温度),故答案为:探究浓度对反应速率的影响;向反应物中加入等量同种催化剂(或将盛有反应物的试管放在同一热水浴中,升高相同温度);
(2)由图可知,③、⑤中⑤的反应速率大,说明升高温度,反应速率加快;③、④中④的反应速率小,说明MnO2对过氧化氢分解的催化效果更好,故答案为:升高温度,反应速率加快;MnO2对过氧化氢分解的催化效果更好;
(3)反应是通过反应速率分析的,根据,所以实验中需要测量的数据是时间(或收集一定体积的气体所需要的时间),故答案为:产生20mL气体所需的时间;
(4)①由图可知,A、B的物质的量减小,C的物质的量增加,且t1时物质的量不变,说明该反应为可逆反应,A、C的物质的量的变化量之比为(0.15-0.06)∶(0.11-0.05)=3∶2,反应过程中混合气体的平均相对分子质量不变,则反应为3A B+2C,故答案为:3A B+2C;
②若t1=10时,则内以C物质浓度变化表示的反应速率;t1时,A的转化率为,故答案为:0.006;60%;
③由A和C的变化量之比为(0.15-0.06)∶(0.11-0.05)=3∶2,可以推出B的变化量为0.03mol/L,容器的体积为4L,所以B起始的物质的量是(0.05-0.03)×4mol=0.08mol;根据阿伏加德罗定律可知,在同温同体积条件下,气体的压强之比等于其物质的量之比,也等于其分子数之比。由于反应前后气体的分子数保持不变,所以平衡时体系内的压强保持不变,为初始状态的1倍,故答案为:0.08mol;1。
17.C
【解析】反应①的平衡常数K=c(NH3) c(HI),NH4I分解生成的HI为平衡时HI与分解的HI之和,由反应②可知分解的c(HI)为平衡时c(H2)的2倍,进而求出NH4I分解生成NH3的浓度,代入反应①的平衡常数K=c(NH3) c(HI)计算。
【解析】平衡时c(HI)=4mol L 1,HI分解生成的H2的浓度为0.5mol L 1,NH4I分解生成的HI的浓度为4mol L 1+2×0.5mol L 1=5mol L 1,所以NH4I分解生成的NH3的浓度为5mol L 1,所以反应①的平衡常数K=c(NH3) c(HI)=5mol L 1×4mol L 1=20mol2 L 2,故C正确;
故答案选C。
【点睛】本题主要考查化学平衡常数的计算,掌握化学平衡常数的计算表达式是解题的关键。
18.(1)
(2)60
(3) D>C>B>A 随着反应的进行,反应物浓度减小,单位体积内活化分子总数减小,有效碰撞几率减小,反应速率减小
(4)0.11mol/L
【解析】(1)由题意知,反应物为H2O2,生成物为水和氧气,反应条件为二氧化锰作催化剂,则反应的方程式为;
(2)由图象可知,反应至4min时,H2O2完全反应,生成气体的总体积是60mL,故答案为60;
(3)反应进行4、3、2、1分钟分别对应曲线上A、B、C、D四点,随着反应的进行,反应物浓度减小,反应速率减慢,各点反应速率快慢的顺序为D>C>B>A,故答案为:D>C>B>A;随着反应的进行,反应物浓度减小,单位体积内活化分子总数减小,有效碰撞几率减小,反应速率减小;
(4)根据方程式计算:,n==0.0054mol,c==0.11mol/L,故答案为0.11mol/L。
19.(1)将炭和有机物燃烧除掉,同时将钯元素转化为
(2)
(3) 正
(4)
(5)BC
(6)70.0
【解析】废钯催化剂的杂质主要含炭、有机物及少量、、等元素,高温焙烧可以将炭和有机物燃烧除掉,钯元素转化为 ;“烧渣”的主要成分是,水合肼在弱碱性环境下可以还原,得粗钯,“粗钯”中含、等杂质,可采用电解精炼的方法得到纯钯;粗钯用王水溶解生成生成和NO,溶液中加氯化铵生成沉淀,用氨水溶解生成,和盐酸反应生成和氯化铵。
【解析】(1)废钯中含有的主要杂质为炭和有机物,高温焙烧可以将炭和有机物燃烧除掉,同时将钯元素转化为。
(2)水合肼在弱碱性环境下可以还原,产生的气体可以参与大气循环,可知该气体应为,所以该反应中,,根据得失电子守恒可知两种物质的系数比为,再结合元素守恒可得化学反应方程式为;
(3)根据电解法精炼铜,电解精炼时,需要被提纯的金属作为阳极,所以粗钯与电源的正极相连;与均为第Ⅷ族元素,性质相似,则作为阳极时被氧化成,在阴极,被还原为单质,所以阴极电极反应为。
(4)在加热条件下与王水发生氧化还原反应产生和有毒的无色气体,该气体遇空气变为红棕色,说明产生的气体是,与反应生成红色的,在集气瓶中会转化为无色的N2O4,发生反应方程式为,所以颜色变浅。
(5)A.与“混合液”中的氯钯酸反应的方程式为,升高温度有利于挥发,促使平衡正向移动,故A正确;
B.虽然100℃时氯钯酸的沉淀率最高,但温度过高会促进的水解产生大量,造成的浪费,所以温度不能太高,故B错误;
C.该反应过程中有沉淀生成,溶质物质的量减少,所以为,故C错误;
选BC。
(6)海绵状金属钯密度为,具有优良的吸氢功能,标准状况下,其吸附的氢气是其体积的840倍,设有1cm3海绵状金属钯,则海绵状金属钯的质量为12g、吸收氢气的体积为840mL,此条件下海绵钯的吸附容量。
20.(1)
(2)树脂的颜色由黑红色变成淡黄色
(3)、
(4) 分液漏斗 蒸馏
(5)使用锥形瓶易被空气中氧气氧化(或I2易升华)
(6)在水或KI溶液中已经饱和,浓度不随碘固体的质量增大而增大
(7)511
【解析】本题是一道利从海带中提取碘单质的工业流程题,首先用过氧化氢氧化过氧化氢中的碘离子,生成碘单质,利用交换树脂吸附,之后用氢氧化钠洗脱使转化为,生成,以此解题。
(1)
氧化时,过氧化氢将碘离子氧化为碘单质,离子方程式为:;
(2)
洗脱是为了将交换吸附产生的转化为,根据信息②可知完成的现象是树脂的颜色由黑红色变成淡黄色;
(3)
氢氧化钠洗脱将RI3转化为RI,NaIO3,NaI,H2SO4,酸化发生归中反应生成I2,I元素以、形式存在;
(4)
I2萃取分液的方法提取,所以应置于分液漏斗中,加入乙醚振荡,静置分液后,经蒸馏回收乙醚;
(5)
I-具有较强的还原性,易被空气氧化,且生成的碘单质易挥发,所以用碘量瓶,可以防止I-被氧气氧化,故答案为:使用锥形瓶易被空气中氧气氧化(或I2易升华);
(6)
当溶液中达到饱和后,其浓度不再改变,故答案为:在水或KI溶液中已经饱和,浓度不随碘固体的质量增大而增大;
(7)
由②中可知①中c(I2)=0.0012mol/L,①中c(I)=0.005mol/L-0.0012mol/L=0.0038 mol/L,根据I2(aq)+I (aq) I (aq),可知c(I-)=0.01-0.0038=0.0062mol/L, 。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.下列关于化学反应速率的说法正确的是
A.化学反应速率是指在一段时间内反应物物质的量的减少或生成物物质的量的增加量
B.化学反应速率为0.2mol·L-1·min-1,是指反应经过1min后,某物质的浓度是0.2mol·L-1
C.对于任何化学反应来说,反应速率越快,反应现象越明显
D.化学反应速率可以衡量化学反应进行的快慢
2.已知反应A(g)+B(g) C(g)+D(g)的平衡常数K值与温度的关系如表所示。830℃时,向一个2L的密闭容器中充入0.20molA和0.20molB,10s末达平衡。下列说法不正确的是
A.达到平衡后,B的转化率为50%
B.该反应为吸热反应,升高温度,平衡正向移动
C.反应初始至平衡,A的平均反应速率v(A)=0.005mol·L-1·s-1
D.容器体积减小为原来的一半,平衡不移动,正、逆反应速率均增大
3.开发催化加氢合成甲醇技术是有效利用资源,实现“碳达峰、碳中和”目标的重要途径。某温度下,在恒容密闭容器中发生反应: 。下列有关说法正确的是
A.加入合适的催化剂,能提高单位时间内的产量
B.升高反应温度有利于提高的平衡转化率
C.平衡后再通入适量,平衡常数K增大
D.增大体系的压强,平衡不发生移动
4.乙烯与HCl气体催化加成反应的能量与反应历程的关系如图所示,下列说法正确的是
A.第一步反应比第二步的快
B.第一步的逆反应活化能比第二步的小
C.两步反应的均小于0
D.增大压强可以使该反应的增大
5.合成氨反应为 。下列有关该反应的说法正确的是
A.催化剂增大了正、逆反应的活化能
B.升高温度,该反应的平衡常数增大
C.正反应的活化能小于逆反应的活化能
D.反应在高温、高压和催化剂条件下进行可提高的平衡转化率
6.碳酸铵[(NH4) 2CO3]在室温下就能自发地分解产生氨气,下列说法正确的是
A.碳酸盐都不稳定,都能自发分解
B.碳酸铵分解是因为进行了加热的操作
C.碳酸铵分解是吸热反应,此反应不应该自发进行,必须借助外力才能进行
D.碳酸铵分解是因为生成了易挥发的气体,使体系的熵增大
7.少量铁粉与100mL0.01mol·L-1的稀盐酸反应,反应速率太慢,为了加快此反应速率而不改变H2的量,可以使用如下方法中的
①由铁粉换铁块②加NaNO3固体③将0.01mol·L-1的稀盐酸换成98%的硫酸溶液④加CH3COONa固体⑤加NaCl溶液⑥滴入几滴硫酸铜溶液⑦升高温度(不考虑盐酸挥发)⑧改用100mL0.1mol·L-1盐酸
A.③⑤ B.①③ C.⑥⑦ D.⑦⑧
8.反应4NH3(g)+5O2(g)4NO(g)+6H2O(g) △H=-905.9 kJ·mol-1,在5 L密闭容器中投入1 mol NH3和1 mol的O2,2分钟后NO的物质的量增加了0.4 mol,下列说法错误的是
A.0~2 min v(O2)=0.05 mol·L-1·min-1 B.2分钟内O2的转化率是50%
C.2分钟末c(H2O)=0.6 mol/L D.2分钟反应放出的热量值等于90.59 kJ
9.在温度T1时,向一体积固定为2L的密闭容器中通入1molCO2和3molH2发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H<0,5min后反应达到平衡,CO2的转化率为20%。下列说法正确的是
A.前5min,平均反应速率v(H2)=0.06mol(L·min)
B.该温度下反应平衡常数的值为
C.当v正(CO2)=3v逆(H2)时,说明反应已达到平衡状态
D.若平衡后升温,正反应速率减小,逆反应速率增大,平衡左移
10.室温下,某溶液初始时仅溶有M和N且浓度相等,同时发生以下两个反应:①;②。反应①的速率可表示为,反应②的速率可表示为(、为速率常数)。反应体系中组分M、Z的浓度随时间变化情况如图。下列说法错误的是
A.0~30min时间段内,Y的平均反应速率为
B.反应开始后,体系中Y和Z的浓度之比保持不变
C.如果反应能进行到底,反应结束时62.5%的M转化为Z
D.反应①的活化能比反应②的活化能大
11.实验室中模拟合成氨反应:在恒容密闭容器中,初始投入量相等的条件下,得到三组实验数据如表所示:
实验序号 温度() 浓度()
1 300 2.00 1.70 1.50 1.36 1.25 1.20 1.20
2 300 2.00 1.50 1.28 1.20 1.20 1.20 1.20
3 200 2.00 1.60 1.39 1.29 1.27 1.27 1.27
下列有关说法不正确的是A.当容器内的压强不再改变时,说明该可逆反应已达到化学平衡状态
B.实验2中,前内以的浓度变化表示的化学反应速率为
C.比较实验1和2,说明实验2使用了更高效的催化剂
D.实验3中,时向容器中充入一定量,则正反应速率不变
12.一定温度下,将2molA和2molB两种气体混合放入体积为2L的密闭刚性容器中,发生反应3A(g)+B(g)xC(g)+2D(g),2min末反应达到平衡,生成0.8molD,并测得C的物质的量浓度为0.4mol·L-1,下列说法正确的是( )
A.此温度下该反应的平衡常数K等于0.5
B.A的平衡转化率为40%
C.x的值为1
D.A和B的平衡转化率相等
二、填空题
13.环戊二烯()是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
(1)已知:(g) (g)+H2(g) ΔH1=100.3 kJ·mol 1①H2(g)+ I2(g) 2HI(g) ΔH2= 11.0 kJ·mol 1②,对于反应:(g)+ I2(g) (g)+2HI(g) ③ ΔH3=___________kJ·mol 1。
(2)某温度下,等物质的量的碘和环戊烯()在刚性容器内发生反应③,起始总压为105Pa,平衡时总压增加了20%,环戊烯的转化率为_________,该反应的平衡常数Kp=_________Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有__________(填标号)。
A.通入惰性气体 B.提高温度 C.增加环戊烯浓度 D.增加碘浓度
(3)环戊二烯容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是__________(填标号)。
A.T1>T2
B.a点的反应速率小于c点的反应速率
C.a点的正反应速率大于b点的逆反应速率
D.b点时二聚体的浓度为0.45 mol·L 1
14.硫酸是一种重要的基本化工产品。接触法制硫酸生产中的关键工序是的催化氧化: 。回答下列问题:
(1)当、和起始的物质的量分数分别为7.5%、10.5%和82%时,在0.5 MPa、2.5 MPa和5.0 MPa压强下,平衡转化率随温度的变化如图所示。反应在5.0 MPa,550℃时的______,判断的依据是______。影响的因素有______。
(2)将组成(物质的量分数)为、和的气体通入反应器,在温度、压强条件下进行反应。平衡时,若转化率为,则压强为______,平衡常数______(以分压表示,分压=总压×物质的量分数)。
(3)研究表明,催化氧化的反应速率方程为:,式中:为反应速率常数,随温度升高而增大;为平衡转化率,为某时刻转化率,为常数。在时,将一系列温度下的、值代入上述速率方程,得到曲线,如图所示。
曲线上最大值所对应温度称为该下反应的最适宜温度。时,逐渐提高;后,逐渐下降。原因是______。
15.某学生设计如图Ⅰ装置,测定2mol·L-1的硫酸分别与锌粒、锌粉反应的速率。请回答:
(1)图Ⅰ装置中盛放硫酸的仪器名称是___。
(2)按照图Ⅰ装置实验时,已限定了两次实验时间均为10min,还需要测定的另一个数据是___。
(3)实验结束后,得到的结论是____。
(4)该学生又将图Ⅰ装置中的气体收集装置改为图Ⅱ,实验完毕待冷却室温后,该生准备读取滴定管上液面所处的刻度数时,发现滴定管中液面高于干燥管中液面,应首先采取的操作是___。
(5)探究一定质量的锌粒与足量的2mol·L-1稀硫酸反应时,能减慢反应速率,又不影响氢气体积的条件是___。
A.加入一定量的醋酸钠固体 B.加入一定量的硫酸铜
C.加入一定KNO3溶液 D.加入一定体积的Na2SO4溶液
16.氧化剂在反应时不产生污染物,被称为绿色氧化剂,因而受到人们越来越多的关注。某实验小组以分解为例,探究浓度、催化剂、温度对反应速率的影响。在常温下按照下表所示的方案完成实验。
实验编号 温度(℃) 反应物 催化剂
① 20 253%溶液 无
② 20 255%溶液 无
③ 20 255%溶液 0.1g
④ 20 255%溶液 1~2滴1溶液
⑤ 30 255%溶液 0.1g
(1)实验①和②的目的是___________。同学甲在进行实验①和②时并没有观察到明显现象。资料显示,通常条件下过氧化氢稳定,不易分解。为了达到实验目的,可采取的改进方法是___________(写出一种即可)。
(2)实验③、④、⑤中,测得生成氧气的体积随时间变化如甲图所示。分析该图能得出的结论是___________,___________;
(3)同学乙设计了乙图所示的实验装置对过氧化氢的分解速率进行定量分析,以生成20气体为准,其他影响实验的因素均已忽略。实验中需要测量的数据是___________。
(4)向某体积固定的密闭容器中加入0.6A、0.2C和一定量(未知)的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图所示。已知在反应过程中混合气体的平均相对分子质量没有变化。请回答:
①写出反应的化学方程式:___________;
②若,则内反应速率___________,A的转化率为___________;
③B的起始的物质的量是___________;平衡时体系内的压强为初始状态的___________倍。
三、计算题
17.将固体置于密闭容器中,在一定温度下发生下列反应:①;②,达到平衡时,,,则此温度下反应①的平衡常数为
A. B. C. D.
18.加0.10 mol MnO2粉末于50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示。
(1)写出H2O2在MnO2作用下发生反应的化学方程式_______。
(2)实验时放出气体的总体积是_______ mL。
(3)反应进行4、3、2、1分钟分别对应曲线上A、B、C、D四点,各点反应速率快慢的顺序为_______。用有效碰撞理论解释该反应速率变化的原因_______。
(4)计算H2O2的初始物质的量浓度_______。(请保留两位有效数字)
四、工业流程题
19.活性炭载钯催化剂被广泛应用于医药和化工行业。废钯催化剂的杂质主要含炭、有机物及少量、、等元素。从废钯催化剂中回收钯,并制备二氯二氨合钯的一种工艺流程如下:
回答下列问题:
(1)“焙烧”的目的是_______。
(2)“烧渣”的主要成分是,利用水合肼在弱碱性环境下还原,产生的气体可以参与大气循环。该还原反应的化学方程式为_______。
(3)“粗钯”中含、等杂质,可采用电解精炼的方法得到纯钯,精炼时粗钯应与电源的_______极相连,与均为第Ⅷ族元素,性质相似,则阴极的电极反应为_______。
(4)王水是按体积比3∶1将浓盐酸和浓硝酸混合而得到的强氧化性溶液,加热条件下钯在王水中发生反应生成和一种有毒的无色气体A,该气体遇空气变红棕色,请写出该红棕色气体在集气瓶里颜色变浅的化学方程式:_______。
(5)“沉钯”中氯化铵与“混合液”中的氯钯酸反应生成氨钯酸铵沉淀,其沉淀率随温度的变化曲线如图所示,下列有关推断错误的是_______(填标号)。
A.升高温度有利于氯化氢挥发,促使平衡正向移动
B.沉钯的最佳温度为100℃
C.该反应
(6)海绵状金属钯密度为,具有优良的吸氢功能,标准状况下,其吸附的氢气是其体积的840倍,则此条件下海绵钯的吸附容量_______。
20.某研究性学习小组利用氯型阴离子交换树脂(RCl)从海带中提取,并测定反应的平衡常数。
Ⅰ.离子交换法提取的流程如下:
已知:①交换吸附发生反应:,;
②吸附和达饱和的树脂分别呈淡黄色和黑红色。
(1)“氧化”时转化为,反应的离子方程式为___________。
(2)“一次洗脱”已经完成的现象是___________。
(3)洗脱液1中,碘元素以___________(填离子符号)存在,向其中加入,可析出碘晶体。
(4)将分离出碘晶体的洗脱液合并,置于___________(填仪器名称)中,加入乙醚,振荡,静置,分液。后经___________(填操作名称)回收乙醚。
Ⅱ.测定反应的平衡常数K
常温下,取2个碘量瓶分别加入下表中的药品,振荡半小时。取一定体积的上层清液用溶液进行滴定,测定和的总浓度。
编号 250mL碘量瓶① 250mL碘量瓶②
药品 0.5g研细的碘 0.5g研细的碘
和的总浓度
(5)不能用普通锥形瓶代替碘量瓶的原因___________。
(6)0.5g的碘的不需要精确称取的理由是___________。
(7)碘量瓶①平衡体系中与②中接近。___________(保留3位有效数字)。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
【解析】A.化学反应速率用单位时间内反应物浓度的减少或生成物浓度的增加来表示,故A错误;
B.化学反应速率为0.2mol·L-1·min-1,是指反应经过1min后,某物质的浓度减少或增加0.2mol·L-1,故B错误;
C.有些反应无明显的现象,如酸碱中和反应,故C错误;
D.化学反应速率可以衡量化学反应进行的快慢,故D正确;
故选D。
2.B
【解析】A.830℃时, ,向一个2L的密闭容器中充入0.20molA和0.20molB,10s末达平衡,设A反应的物质的量浓度为x,则有 , ,解得x=0.05,故达到平衡后,B的转化率为 ,A正确;
B.由表中数据可知,温度越高、K越小,可知升高温度平衡逆向移动,则正反应为放热反应,B错误;
C.反应初始至平衡,A的平均反应速率 ,C正确;
D.反应前后气体的总物质的量不变,则容器体积减小为原来的一半,平衡不移动,正、逆反应速率增大程度相等,D正确;
故选B。
3.A
【解析】A.加入合适的催化剂,能降低反应的活化能,加快反应速率,提高单位时间内甲醇的产量,故A正确;
B.该反应是放热反应,升高温度,平衡向逆反应方向移动,氢气的转化率减小,故B错误;
C.平衡常数是温度函数,温度不变,平衡常数不变,所以平衡后再通入适量氢气,平衡常数K不变,故C错误;
D.该反应是气体体积减小的反应,增大体系的压强,平衡向正反应方向移动,故D错误;
故选A。
4.B
【解析】A.由图可知,第一部反应的活化能高于第二步,活化能越高反应速率越慢,所以第一步比第二步慢,A错误;
B.由图可知,第一步逆反应的活化能比第二步的小,B正确;
C.第一步反应为吸热反应,大于0,C错误;
D.对于确定的反应而言,反应热与压强无关,D错误;
答案为:B。
5.C
【解析】A.催化剂降低反应的活化能,增大反应速率,A错误;
B.该反应为放热反应,升温平衡逆向移动,平衡常数减小,B错误;
C.该反应为放热反应,反应物的总能量大于生成物的总能量,故正反应的活化能小于逆反应的活化能,C正确;
D.合成氨反应为放热反应,在高温下,反应会逆向移动,H2的平衡转化率会减小;工业上采用高温的原因是加快生成NH3的速率,同时考虑催化剂的活性在较高温度下较好,另外催化剂不会影响平衡转化率,D错误;
故选C。
6.D
【解析】A.有的碳酸盐稳定,不能自发分解,如Na2CO3受热不分解,故A错误;
B.碳酸铵在室温下就能自发地分解,不需要外界给予了能量,故B错误;
C.有些吸热反应也可自发,而焓变不是自发反应的唯一因素,应根据△H T△S进行判断反应是否自发进行,故C错误;
D.碳铵自发分解,是因为体系由于氨气和二氧化碳气体的生成而使熵增大,故D正确;
故选:D。
7.D
【解析】①由铁粉换铁块,反应速率减慢,故错误;②加NaNO3固体与酸形成硝酸,不产生氢气,故错误;③将0.01mol·L-1的稀盐酸换成98%的硫酸溶液,发生钝化现象,故错误;④加CH3COONa固体,生成醋酸,氢离子浓度减小,反应速率减慢,故错误;⑤加NaCl溶液,氢离子浓度减小,反应速率减慢,故错误;⑥滴入几滴硫酸铜溶液,铁置换出铜,构成原电池,反应速率加快,但Fe少量,导致生成的氢气减少,故错误;⑦升高温度(不考虑盐酸挥发),反应速率加快,故正确;⑧改用100mL0.1mol·L-1盐酸,氢离子浓度增大,反应速率加快,故正确;故选D。
8.C
【解析】A.2分钟后NO的物质的量增加了0.4 mol,则根据物质反应转化关系可知:反应消耗O2的物质的量为△n(O2)=,故0~2 min v(O2)==0.05 mol·L-1·min-1,A正确;
B.根据A计算可知2分钟内反应消耗O2的物质的量为△n(O2)=0.5 mol,反应开始时O2的物质的量为1 mol,故O2转化率是=50%,B正确;
C.从反应开始至2分钟后NO的物质的量增加了0.4 mol,则根据物质反应转化关系可知反应产生H2O的物质的量为△n(H2O)=,反应容器的容积是5 L,故2分钟末c(H2O)==0.12 mol/L,C错误;
D.根据热化学方程式可知:每反应产生4 mol NO气体时,反应放出热量是905.9 kJ,现在是发生该反应产生了0.4 mol NO 气体,因此2分钟反应放出的热量值Q==90.59 kJ,D正确;
故合理选项是C。
9.A
【解析】A.由题意知,前5min,CO2的变化量为0.2mol,则H2的变化量为0.6mol,v(H2)=0.06mol(L·min),A正确;
B.向体积为2L的密闭容器中通入1molCO2和3molH2发生上述反应,5min后反应达到平衡,CO2的转化率为20%,可列出三段式(单位为mol/L):,则该温度下反应平衡常数为,B错误;
C.当3v正(CO2)= v逆(H2)时,说明反应已达到平衡状态,C错误;
D.平衡后升温,正反应速率增大,逆反应速率增大,因反应放热反应,平衡左移,D错误;
故答案为A。
10.A
【解析】A.由图象可知0~30min时间段内,M的浓度变化为,Z的浓度变化为0.125,即反应②中M的浓度变化为0.125,故反应①中M的浓度变化为(,即Y的浓度变化为0.075,所以0~30min时间段内,Y的平均反应速率,故A错误;
B.由可得:,且,,则Y、Z的浓度变化之比,所以反应开始后,Y、Z的浓度变化保持不变,故B正确;
C.根据A项计算,参加反应②的M所占的比例为,故如果反应能进行到底,反应结束时62.5%的M转化为Z,故C正确;
D.反应②的速率较大,所以反应①的活化能比反应②的活化能大,故D正确;
答案选A。
11.B
【解析】A.根据反应方程式可知,该反应前后气体的分子数不同,在反应过程中体系的压强随着分子数的变化而变化,故当容器内的压强不再改变时,说明该可逆反应已达到化学平衡状态,A正确;
B.实验2中,前20min内以H2的浓度变化表示的化学反应速率为=0.036mol L-1 min-1,NH3的浓度变化表示的化学反应速率为0.024mol L-1 min-1,B错误;
C.催化剂只能加快反应速率,不能影响平衡移动。比较实验1和2,实验2更快达到了与实验1相同的化学平衡状态,说明实验2使用了更高效的催化剂C正确;
D.恒容容器中通入氦气,反应混合物中各组分的深度保持不变,故反应速率不变,D正确;
故选B。
12.A
【解析】列三段式:
C.根据题意0.2x mol/L = 0.4mol/L,解得x = 2,C错;
A.,A正确;
B.A平衡转化率= ,B错;
D.B的平衡转化率=,D错;
故答案选A。
13. 89.3 40% 3.56×104 BD CD
【解析】(1)利用盖斯定律解题;
(2)利用差量法计算转化率;三行式法计算平衡常数;根据平衡移动原理解释;
(3)通过外界因素对速率的影响和平衡状态的形成分析A、B、C选项,D选项观察图象计算;
【解析】(1)已知:(g)=(g)+H2(g)△H1=+100.3kJ mol-1 ①,H2(g)+I2(g)=2HI(g)△H2=-11.0kJ mol-1 ②,根据盖斯定律,①+②得③(g)+I2(g)=(g)+2HI(g)△H3=(+100.3kJ mol-1)+(-11.0kJ mol-1)=+89.3kJ mol-1;
(2)设碘和环戊烯()的初始物质的量都为nmol,转化的物质的量为xmol,
(g)+I2(g)=(g)+2HI(g)
初始(mol) n n 0 0
转化(mol)x x x 2x
平衡(mol)n-x n-x x 2x
刚性容器内气体的压强与物质的量成正比,则:=1+20%,解得:x=0.4n,
平衡时环戊烯的转化率为:×100%=40%;
平衡时混合气体的压强为:105Pa×(1+20%)=1.2×105Pa,混合气体总物质的量为:(n-0.4n+n-0.4n+0.4n+0.4n×2)mol=2.4nmol,
平衡时各组分所占压强分别为p()=p(I2)=×1.2×105Pa=3×104Pa,p()=×1.2×105Pa=2×104Pa,p(HI)=×1.2×105Pa=4×104Pa,该反应的平衡常数Kp=≈3.56×104Pa;
A.通入惰性气体,各组分浓度不变,平衡不移动,则环戊烯的转化率不变,故A错误;
B.该反应为吸热反应,提高温度平衡向着正向移动,环戊烯的转化率增大,故B正确;
C.增加环戊烯浓度,环戊烯的转化率减小,故C错误;
D.增加碘浓度,反应物浓度增大,平衡向着正向移动,环戊烯的转化率增大,故D正确;
故答案为BD;
(3)A.温度越高反应速率越快,根据图示可知,在温度T2(虚线)的反应速率较大,则T1<T2,故A错误;
B.根据图象可知,a点切线斜率的绝对值大于c点切线的绝对值,则a点速率大于c点,故B错误;
C.a到b的过程为正反应速率逐渐减小,且b点v(正)>v(逆),则a点的正反应速率大于b点的逆反应速率,故C正确;
D.b点时环戊二烯的浓度变化为:1.5mol/L-0.6mol/L=0.9mol/L,环戊二烯的二聚体的浓度为环戊二烯浓度变化的,则b点时二聚体的浓度为0.9mol/L×=0.45mol L-1,故D正确;
故答案为CD。
【点睛】考查盖斯定律的应用,有关盖斯定律的习题,首先要根据所求的反应分析,分析以下几点:①所求反应中的反应物在哪个反应了?是反应物还是生成物?②所给反应中哪些物质是所求反应中没有的?③如何才能去掉无用的?然后,通过相互加减,去掉无关物质;将所对应的△H代入上述化学方程式的加减中就可以了。
14. 0.975 该反应气体分子数减少,增大压强,提高 ,所以 温度、压强和反应物的起始浓度(组成) 升高温度,增大使逐渐提高,但降低使逐渐下降。时,增大对的提高大于引起的降低;后,增大对的提高小于引起的降低。
【解析】(1)由题给反应式知,该反应为气体分子数减少的反应,其他条件一定时,增大压强,平衡转化率增大,故,结合题图(b)知5.0 MPa、550℃时对应的平衡转化率为0.975。影响平衡转化率的因素有:温度、压强、反应物的起始浓度等。
(2)设通入的、和共100 mol,利用三段式法进行计算:
平衡时气体的总物质的量为,则,,,因,,代入计算得。
(3)升高温度,反应速率常数增大,反应速率,提高但降低使反应速率逐渐下降。时,增大对的提高大于引起的降低后,增大对的提高小于引起的降低。
15.(1)分液漏斗
(2)收集到气体的体积
(3)其他条件相同时,锌粉与硫酸的反应速率比锌粒与硫酸的反应速率快
(4)调节滴定管的高度使得两侧液面相平
(5)AD
【解析】(1)
根据装置的特点可知,图Ⅰ装置中盛放硫酸的仪器名称是分液漏斗。
(2)
若测定反应速率,则还需要测定的另一个数据是收集到气体的体积。
(3)
由于增大反应物的接触面积可以加快反应速率,所以该实验中得出的结论是:其他条件相同时,锌粉与硫酸的反应速率比锌粒与硫酸的反应速率快。
(4)
由于气体的体积受压强的影响大,所以在读数之前还需要采取的措施是调节滴定管的高度,使得两侧液面相平。
(5)
A.加入一定量的醋酸钠固体,生成弱酸醋酸,氢离子浓度减小,速率减小,但不影响氢气的总量,符合题意;B.加入一定量的硫酸铜和锌生成铜,组成原电池,加快反应速率,不符合题意;C.加入一定KNO3溶液,生成硝酸和锌不生成氢气,不符合题意;D.加入一定体积的Na2SO4溶液,稀释了溶液,浓度减小,速率减慢,不影响氢气的总量,符合题意;故选AD。
16. 探究浓度对反应速率的影响 向反应物中加入等量同种催化剂(或升高相同温度) 升高温度,反应速率加快 对过氧化氢分解的催化效果更好 产生20气体所需的时间 0.006 60% 0.08 1
【解析】(1)实验①和②的浓度不同,则该实验的目的为探究浓度对化学反应速率的影响;同学甲在进行实验时并没有观察到明显现象。资料显示,通常条件下过氧化氢稳定,不易分解。为了便于比较,需要加快反应速率,可以向反应物中加入等量同种催化剂(或将盛有反应物的试管放在同一热水浴中,升高相同温度),故答案为:探究浓度对反应速率的影响;向反应物中加入等量同种催化剂(或将盛有反应物的试管放在同一热水浴中,升高相同温度);
(2)由图可知,③、⑤中⑤的反应速率大,说明升高温度,反应速率加快;③、④中④的反应速率小,说明MnO2对过氧化氢分解的催化效果更好,故答案为:升高温度,反应速率加快;MnO2对过氧化氢分解的催化效果更好;
(3)反应是通过反应速率分析的,根据,所以实验中需要测量的数据是时间(或收集一定体积的气体所需要的时间),故答案为:产生20mL气体所需的时间;
(4)①由图可知,A、B的物质的量减小,C的物质的量增加,且t1时物质的量不变,说明该反应为可逆反应,A、C的物质的量的变化量之比为(0.15-0.06)∶(0.11-0.05)=3∶2,反应过程中混合气体的平均相对分子质量不变,则反应为3A B+2C,故答案为:3A B+2C;
②若t1=10时,则内以C物质浓度变化表示的反应速率;t1时,A的转化率为,故答案为:0.006;60%;
③由A和C的变化量之比为(0.15-0.06)∶(0.11-0.05)=3∶2,可以推出B的变化量为0.03mol/L,容器的体积为4L,所以B起始的物质的量是(0.05-0.03)×4mol=0.08mol;根据阿伏加德罗定律可知,在同温同体积条件下,气体的压强之比等于其物质的量之比,也等于其分子数之比。由于反应前后气体的分子数保持不变,所以平衡时体系内的压强保持不变,为初始状态的1倍,故答案为:0.08mol;1。
17.C
【解析】反应①的平衡常数K=c(NH3) c(HI),NH4I分解生成的HI为平衡时HI与分解的HI之和,由反应②可知分解的c(HI)为平衡时c(H2)的2倍,进而求出NH4I分解生成NH3的浓度,代入反应①的平衡常数K=c(NH3) c(HI)计算。
【解析】平衡时c(HI)=4mol L 1,HI分解生成的H2的浓度为0.5mol L 1,NH4I分解生成的HI的浓度为4mol L 1+2×0.5mol L 1=5mol L 1,所以NH4I分解生成的NH3的浓度为5mol L 1,所以反应①的平衡常数K=c(NH3) c(HI)=5mol L 1×4mol L 1=20mol2 L 2,故C正确;
故答案选C。
【点睛】本题主要考查化学平衡常数的计算,掌握化学平衡常数的计算表达式是解题的关键。
18.(1)
(2)60
(3) D>C>B>A 随着反应的进行,反应物浓度减小,单位体积内活化分子总数减小,有效碰撞几率减小,反应速率减小
(4)0.11mol/L
【解析】(1)由题意知,反应物为H2O2,生成物为水和氧气,反应条件为二氧化锰作催化剂,则反应的方程式为;
(2)由图象可知,反应至4min时,H2O2完全反应,生成气体的总体积是60mL,故答案为60;
(3)反应进行4、3、2、1分钟分别对应曲线上A、B、C、D四点,随着反应的进行,反应物浓度减小,反应速率减慢,各点反应速率快慢的顺序为D>C>B>A,故答案为:D>C>B>A;随着反应的进行,反应物浓度减小,单位体积内活化分子总数减小,有效碰撞几率减小,反应速率减小;
(4)根据方程式计算:,n==0.0054mol,c==0.11mol/L,故答案为0.11mol/L。
19.(1)将炭和有机物燃烧除掉,同时将钯元素转化为
(2)
(3) 正
(4)
(5)BC
(6)70.0
【解析】废钯催化剂的杂质主要含炭、有机物及少量、、等元素,高温焙烧可以将炭和有机物燃烧除掉,钯元素转化为 ;“烧渣”的主要成分是,水合肼在弱碱性环境下可以还原,得粗钯,“粗钯”中含、等杂质,可采用电解精炼的方法得到纯钯;粗钯用王水溶解生成生成和NO,溶液中加氯化铵生成沉淀,用氨水溶解生成,和盐酸反应生成和氯化铵。
【解析】(1)废钯中含有的主要杂质为炭和有机物,高温焙烧可以将炭和有机物燃烧除掉,同时将钯元素转化为。
(2)水合肼在弱碱性环境下可以还原,产生的气体可以参与大气循环,可知该气体应为,所以该反应中,,根据得失电子守恒可知两种物质的系数比为,再结合元素守恒可得化学反应方程式为;
(3)根据电解法精炼铜,电解精炼时,需要被提纯的金属作为阳极,所以粗钯与电源的正极相连;与均为第Ⅷ族元素,性质相似,则作为阳极时被氧化成,在阴极,被还原为单质,所以阴极电极反应为。
(4)在加热条件下与王水发生氧化还原反应产生和有毒的无色气体,该气体遇空气变为红棕色,说明产生的气体是,与反应生成红色的,在集气瓶中会转化为无色的N2O4,发生反应方程式为,所以颜色变浅。
(5)A.与“混合液”中的氯钯酸反应的方程式为,升高温度有利于挥发,促使平衡正向移动,故A正确;
B.虽然100℃时氯钯酸的沉淀率最高,但温度过高会促进的水解产生大量,造成的浪费,所以温度不能太高,故B错误;
C.该反应过程中有沉淀生成,溶质物质的量减少,所以为,故C错误;
选BC。
(6)海绵状金属钯密度为,具有优良的吸氢功能,标准状况下,其吸附的氢气是其体积的840倍,设有1cm3海绵状金属钯,则海绵状金属钯的质量为12g、吸收氢气的体积为840mL,此条件下海绵钯的吸附容量。
20.(1)
(2)树脂的颜色由黑红色变成淡黄色
(3)、
(4) 分液漏斗 蒸馏
(5)使用锥形瓶易被空气中氧气氧化(或I2易升华)
(6)在水或KI溶液中已经饱和,浓度不随碘固体的质量增大而增大
(7)511
【解析】本题是一道利从海带中提取碘单质的工业流程题,首先用过氧化氢氧化过氧化氢中的碘离子,生成碘单质,利用交换树脂吸附,之后用氢氧化钠洗脱使转化为,生成,以此解题。
(1)
氧化时,过氧化氢将碘离子氧化为碘单质,离子方程式为:;
(2)
洗脱是为了将交换吸附产生的转化为,根据信息②可知完成的现象是树脂的颜色由黑红色变成淡黄色;
(3)
氢氧化钠洗脱将RI3转化为RI,NaIO3,NaI,H2SO4,酸化发生归中反应生成I2,I元素以、形式存在;
(4)
I2萃取分液的方法提取,所以应置于分液漏斗中,加入乙醚振荡,静置分液后,经蒸馏回收乙醚;
(5)
I-具有较强的还原性,易被空气氧化,且生成的碘单质易挥发,所以用碘量瓶,可以防止I-被氧气氧化,故答案为:使用锥形瓶易被空气中氧气氧化(或I2易升华);
(6)
当溶液中达到饱和后,其浓度不再改变,故答案为:在水或KI溶液中已经饱和,浓度不随碘固体的质量增大而增大;
(7)
由②中可知①中c(I2)=0.0012mol/L,①中c(I)=0.005mol/L-0.0012mol/L=0.0038 mol/L,根据I2(aq)+I (aq) I (aq),可知c(I-)=0.01-0.0038=0.0062mol/L, 。
答案第1页,共2页
答案第1页,共2页
