6.2 元素(第二课时)
图片预览











文档简介
课件44张PPT。知识回顾一、元素1、定义:元素是具有相同核电荷数(质子数)的一类原子的总称。同种元素可能存在多种原子,它们的 数
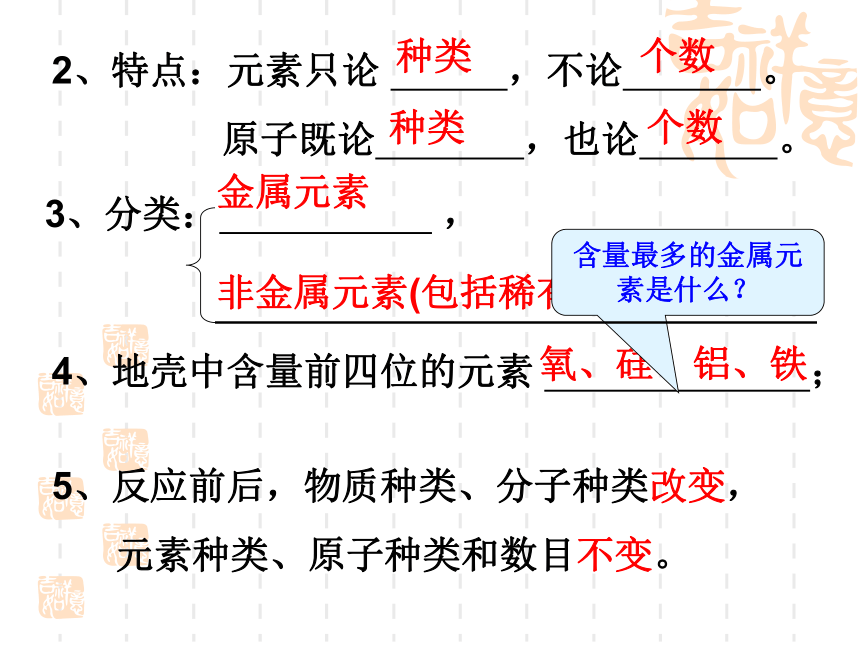
相同, 数不同。质子中子区分不同元素,主要是根据其 数不同。质子同种元素的不同原子质量相同吗?2、特点:元素只论 ,不论 。
原子既论 ,也论 。种类种类个数个数3、分类: , 金属元素非金属元素(包括稀有气体元素)4、地壳中含量前四位的元素 ;
氧、硅、铝、铁5、反应前后,物质种类、分子种类改变,
元素种类、原子种类和数目不变。含量最多的金属元素是什么?二、元素符号 1、书写①、只有一个字母:大写
②、两个字母:一大二小 2、元素符号的意义所有元素符号都有两层含意
①表示一种元素;
②表示此元素的一个原子;
部分符号有第3层含意
③表示某种物质;
④注意:符号前加系数,只能表示N个原子如H表示氢元素
如H表示一个氢原子
①金属元素
②9种固态非金属(除了 ; 不能表示碘
这种物质, 才能表示碘这种物质)
③稀有气体元素He、Ne、Ar、Kr、Xe、Rn
I2 II 一 个 碳 原 子 的 质 量:
1.993×10-2 6 kg 原 子 的 实 际 质 量0.000000000000000
00 000000001993 kg
不同原子的质量各不相同,可以用现代科学仪器精确地测量出来。如:
一个氢原子的质量是:1.67×10-27㎏,
一个氧原子的质量是:2.657×10-26㎏,
一个铁原子的质量是:9.288×10-26㎏。 这样小的数字,书写、记忆和使用起来都很不方便,就像用吨做单位来表示一粒稻谷或小麦的质量一样,能不能用一种好写、好记、好用的方法来表示原子的质量呢?相 对 原 子 质 量 原子的质量非常小,使用起来很繁琐,不方便,一般不采用。为方便使用确定了原子的相对质量──相对原子质量 (Ar) 定 义: 国 际 上 一 致 同 意 以 一 种 碳 原 子 质 量 的1/12作 为 标 准, 其 他 原 子 的 质 量 跟 它 比 值, 就 是 这 种 原 子 的 相 对 原 子 质 量。 碳-12:是含有6个质子和6个中子的碳原子。1个碳-12原子的质量:1.993×10-26千克,其1/12是1.993×10-26×1/12千克≈1.66×10-27千克,即 原子的相对原子质量= 练习: 已知1个碳原子的质量是1.993×10-26Kg,一个氧原子的质量是2.657×10-26Kg,求氧原子的相对原子质量?标准=1.993×10-26Kg×1/12=1.66×10-27Kg氧原子的相对原子质量=1.66×10-27Kg2.657×10-26Kg=16答:氧原子的相对原子质量是16。解:练习题一个氢原子的质量是1.67×10-27㎏,一个铁原子的质量是9.288×10-26㎏。请你计算出二者的相对原子质量? 氢原子的相对原子质量
= 1.6726×10- 27 kg÷ 1.66×10- 27 kg ≈ 1
铁原子的相对原子质量
= 9.288×10- 26 kg÷ 1.66×10- 27 kg ≈ 1
相对原子质量与原子实际质量的关系 (1) 相对原子质量________原子的实际质量
(2) 原子实际质量越大,它的相对原子质量数值:
(3)相对原子质量的单位是:
原子实际质量的单位是:
不等于(是个比值)越大“1”(没有单位)千克相 对 原 子 质 量 与质 子 数 和 中 子 数 的 关 系:(为什么会有这种关系?)原子中各粒子的质量:②相对原子质量是原子的真实质量吗?
与原子的实际质量的区别与联系? ③相对原子质量的与组成原子的粒子的关系? 问题:①原子的质量集中在哪儿?②相对原子质量不是原子的真实质量,
而是相对质量;相对原子质量是一个比值,与实际质量的
关系是:乘以碳原子的质量的1/12,它可以
用来比较原子质量的大小。③相对原子质量=质子数+中子数结论:①原子的质量主要集中在原子核上填写下列表格: 尝试查阅一下如下几种元素的相对原子质量:磷、铝、氮、钠、硫、镁
看谁查得又快又准! 磷——31 铝——27
氮——14 钠——23
硫——32 镁——24 张青莲教授是我国科学院院士,于1983年当选为国际原子量委员会委员,主持测定了铟、铱、锌等元素的相对原子质量,为相对原子质量的测定作出了卓越贡献。这是国际上第一次采用中国测定的相对原子质量数据。这不仅说明中国人的科学水平有国际竞争能力,更重要的是为中国人民长了志气。1908年7月- 2006年12月 (一)元素周期表的历史1.第一张元素周期表(1)时间:
(2)绘制者:
(3)排序依据:
(4)结构特点:
(5)意义:俄国化学家——门捷列夫1869年将元素按照相对原子质量由小到大依次排列揭示了化学元素的内在联系——里程碑2.现行元素周期表(1)排序依据:
(2)原子序数:
(3)结构特点:
原子的核电荷数按照元素在周期表中的顺序给元素编号将化学性质相似的元素放在一个纵行? 物质结构 元素周期表一、元素: 二、原子的构成: 具有相同核电荷数(即核内质子数)的一类原子的总称。原子核核外电子{质子中子原子序数=核电荷数=质子数=核外电子数 元素种类原子(核素)种类元素的化学性质相对原子质量=质子数+中子数 三、核外电子的排布规律及表示方法 1、核外电子总是尽先排布在能量最低的电子层里,然后由里往外,依次排布在能量较高的电子层里(这就是能量最低原理)。 2、各电子层最多能容纳的电子数为 2n2 3、最外层电子数不能超过 8(当K层为最外层时不能超过 2 )。 4、次外层电子数不能超过 18 ,倒数第三层电子数不能超过 32 。注意:以上四条规律是相互联系的 1、元素周期表的结构:元素名称元素符号相对原子质量原子序数=质子数=核电荷数=核外电子数13Al铝26.98三、元素周期表问:1. 在元素周期表中横行和纵行又称为什么? 2. 元素周期表中有多少横行,多少周期? 多少纵行,多少族?看书并思考1-18号元素原子结构示意图问:原子序数与原子结构有什么关系?原子序数=核电荷数=质子数=原子的核外电子数
1.每一横行原子电子层数相同
2.每一纵行原子最外层电子数相同横行:周期数=电子层数ⅠA0纵行:族序数=最外层电子数注意红框里是过渡元素红线是金属和非金属元素分界线 1B Al SiGeAs Sb Te 2 3 4 5 6 7ⅠAⅡAⅢAⅣAⅤAⅥAⅦA 0 Po At非金属性逐渐增强 金属性逐渐增强金属性逐渐增强 非金属性逐渐增强非金属区 金属区零
族
元
素 1、元素周期表的结构(1)7个周期三个短周期第1周期 2种元素第2周期 8种元素第3周期 8种元素第6周期 32种元素第5周期 18种元素第4周期 18种元素三个长周期四、元素周期表和元素周期律 一个不完全周期:第七周期,应有32种元素,
现有31种元素。 周期序数=电子层数(2)16个族七个主族:由长周期和短周期元素组成,IA~VIIA 位于第1、2、13、14、15、16、17纵行 一个第Ⅷ族:位于第8、9、10三个纵行七个副族:仅由长周期元素组成,IB~VIIB
位于第11、12、3、4、5、6、7纵行 一个0族:稀有气体元素族,位于第18纵行主族序数=最外层电子数=最高正价数罗马数字 4=5-1,9=10-1ⅠⅡⅢⅣⅤⅥⅦⅧⅨⅩ12345678910族16=7+7+1+1A代表主族,B代表副族
ⅠA~ⅦA 7个主族 (第1、2、13、14、15、16、17列)
ⅠB~ⅦB 7个副族 (第11、12、3、4、5、6、7列)
Ⅷ 1个第八族 (第8、9、10列)
0 族 1零族16个族主族AⅠAⅡAⅢAⅣAⅤAⅥAⅦA第七主族第一主族第二主族第六主族第五主族第四主族第三主族副族BⅠBⅡBⅢBⅣBⅤBⅥBⅦB第七副族第六副族第五副族第四副族第三副族第二副族第一副族4、考察每周期开头的是什么类型的元素?靠近尾部的是什么类型的元素?结尾的是什么类型的元素?这说明元素之间存在着什么规律性的联系?它与元素周期表这个名称有没有联系? 除第一周期外开头的是非金属元素,靠近结尾的是非金属元素,结尾的是稀有气体元素。说明自然界各元素间存在着元素种类、元素性质等周期性变化。
5、元素周期表的意义是学习和研究化学知识的重要工具;为寻找新元素提供了理论依据;在元素周期表中,位置越靠近的元素,性质越相似(具有规律性),可以启发人们在元素周期表的一定区域寻找新物质(如农药、催化剂、半导体材料)。1、 据报道,上海某医院正研究用放射性碘治疗肿瘤,这种碘原子的核电荷数为53,相对原子质量是125,下列关于这种原子的说法错误的是( )
A.质子数53 B.核外电子数是53
C.中子数53 D.质子数与中子数之和是125
2、贫铀弹的主要成分是低放射性的铀,铀原子的相对原子质量是238,核电荷数为92,中子数应为( )
A、146 B、92 C、136 D、238
C我能行A3.一个碳原子的质量是1.993×10千克, 碳的相对原子质量为 ( ) (A)12克(B)14 (C)12 (D)16 4.已知原子的核电荷数,可以确定它的( ) (A)相对原子质量 (B)质子数 (C)中子数 (D)电子层数 5.原子中决定相对原子质量大小的主要微粒是( ) A.质子数和电子数 B.质子数和中子数 C.中子数和电子数 D.核电荷数 7、在同一原子里,其数目相同的是( ) A、中子数和质子数 B、电子数和质子数 C、中子数和电子数 D、质子数和原子质量 CBBB
相同, 数不同。质子中子区分不同元素,主要是根据其 数不同。质子同种元素的不同原子质量相同吗?2、特点:元素只论 ,不论 。
原子既论 ,也论 。种类种类个数个数3、分类: , 金属元素非金属元素(包括稀有气体元素)4、地壳中含量前四位的元素 ;
氧、硅、铝、铁5、反应前后,物质种类、分子种类改变,
元素种类、原子种类和数目不变。含量最多的金属元素是什么?二、元素符号 1、书写①、只有一个字母:大写
②、两个字母:一大二小 2、元素符号的意义所有元素符号都有两层含意
①表示一种元素;
②表示此元素的一个原子;
部分符号有第3层含意
③表示某种物质;
④注意:符号前加系数,只能表示N个原子如H表示氢元素
如H表示一个氢原子
①金属元素
②9种固态非金属(除了 ; 不能表示碘
这种物质, 才能表示碘这种物质)
③稀有气体元素He、Ne、Ar、Kr、Xe、Rn
I2 II 一 个 碳 原 子 的 质 量:
1.993×10-2 6 kg 原 子 的 实 际 质 量0.000000000000000
00 000000001993 kg
不同原子的质量各不相同,可以用现代科学仪器精确地测量出来。如:
一个氢原子的质量是:1.67×10-27㎏,
一个氧原子的质量是:2.657×10-26㎏,
一个铁原子的质量是:9.288×10-26㎏。 这样小的数字,书写、记忆和使用起来都很不方便,就像用吨做单位来表示一粒稻谷或小麦的质量一样,能不能用一种好写、好记、好用的方法来表示原子的质量呢?相 对 原 子 质 量 原子的质量非常小,使用起来很繁琐,不方便,一般不采用。为方便使用确定了原子的相对质量──相对原子质量 (Ar) 定 义: 国 际 上 一 致 同 意 以 一 种 碳 原 子 质 量 的1/12作 为 标 准, 其 他 原 子 的 质 量 跟 它 比 值, 就 是 这 种 原 子 的 相 对 原 子 质 量。 碳-12:是含有6个质子和6个中子的碳原子。1个碳-12原子的质量:1.993×10-26千克,其1/12是1.993×10-26×1/12千克≈1.66×10-27千克,即 原子的相对原子质量= 练习: 已知1个碳原子的质量是1.993×10-26Kg,一个氧原子的质量是2.657×10-26Kg,求氧原子的相对原子质量?标准=1.993×10-26Kg×1/12=1.66×10-27Kg氧原子的相对原子质量=1.66×10-27Kg2.657×10-26Kg=16答:氧原子的相对原子质量是16。解:练习题一个氢原子的质量是1.67×10-27㎏,一个铁原子的质量是9.288×10-26㎏。请你计算出二者的相对原子质量? 氢原子的相对原子质量
= 1.6726×10- 27 kg÷ 1.66×10- 27 kg ≈ 1
铁原子的相对原子质量
= 9.288×10- 26 kg÷ 1.66×10- 27 kg ≈ 1
相对原子质量与原子实际质量的关系 (1) 相对原子质量________原子的实际质量
(2) 原子实际质量越大,它的相对原子质量数值:
(3)相对原子质量的单位是:
原子实际质量的单位是:
不等于(是个比值)越大“1”(没有单位)千克相 对 原 子 质 量 与质 子 数 和 中 子 数 的 关 系:(为什么会有这种关系?)原子中各粒子的质量:②相对原子质量是原子的真实质量吗?
与原子的实际质量的区别与联系? ③相对原子质量的与组成原子的粒子的关系? 问题:①原子的质量集中在哪儿?②相对原子质量不是原子的真实质量,
而是相对质量;相对原子质量是一个比值,与实际质量的
关系是:乘以碳原子的质量的1/12,它可以
用来比较原子质量的大小。③相对原子质量=质子数+中子数结论:①原子的质量主要集中在原子核上填写下列表格: 尝试查阅一下如下几种元素的相对原子质量:磷、铝、氮、钠、硫、镁
看谁查得又快又准! 磷——31 铝——27
氮——14 钠——23
硫——32 镁——24 张青莲教授是我国科学院院士,于1983年当选为国际原子量委员会委员,主持测定了铟、铱、锌等元素的相对原子质量,为相对原子质量的测定作出了卓越贡献。这是国际上第一次采用中国测定的相对原子质量数据。这不仅说明中国人的科学水平有国际竞争能力,更重要的是为中国人民长了志气。1908年7月- 2006年12月 (一)元素周期表的历史1.第一张元素周期表(1)时间:
(2)绘制者:
(3)排序依据:
(4)结构特点:
(5)意义:俄国化学家——门捷列夫1869年将元素按照相对原子质量由小到大依次排列揭示了化学元素的内在联系——里程碑2.现行元素周期表(1)排序依据:
(2)原子序数:
(3)结构特点:
原子的核电荷数按照元素在周期表中的顺序给元素编号将化学性质相似的元素放在一个纵行? 物质结构 元素周期表一、元素: 二、原子的构成: 具有相同核电荷数(即核内质子数)的一类原子的总称。原子核核外电子{质子中子原子序数=核电荷数=质子数=核外电子数 元素种类原子(核素)种类元素的化学性质相对原子质量=质子数+中子数 三、核外电子的排布规律及表示方法 1、核外电子总是尽先排布在能量最低的电子层里,然后由里往外,依次排布在能量较高的电子层里(这就是能量最低原理)。 2、各电子层最多能容纳的电子数为 2n2 3、最外层电子数不能超过 8(当K层为最外层时不能超过 2 )。 4、次外层电子数不能超过 18 ,倒数第三层电子数不能超过 32 。注意:以上四条规律是相互联系的 1、元素周期表的结构:元素名称元素符号相对原子质量原子序数=质子数=核电荷数=核外电子数13Al铝26.98三、元素周期表问:1. 在元素周期表中横行和纵行又称为什么? 2. 元素周期表中有多少横行,多少周期? 多少纵行,多少族?看书并思考1-18号元素原子结构示意图问:原子序数与原子结构有什么关系?原子序数=核电荷数=质子数=原子的核外电子数
1.每一横行原子电子层数相同
2.每一纵行原子最外层电子数相同横行:周期数=电子层数ⅠA0纵行:族序数=最外层电子数注意红框里是过渡元素红线是金属和非金属元素分界线 1B Al SiGeAs Sb Te 2 3 4 5 6 7ⅠAⅡAⅢAⅣAⅤAⅥAⅦA 0 Po At非金属性逐渐增强 金属性逐渐增强金属性逐渐增强 非金属性逐渐增强非金属区 金属区零
族
元
素 1、元素周期表的结构(1)7个周期三个短周期第1周期 2种元素第2周期 8种元素第3周期 8种元素第6周期 32种元素第5周期 18种元素第4周期 18种元素三个长周期四、元素周期表和元素周期律 一个不完全周期:第七周期,应有32种元素,
现有31种元素。 周期序数=电子层数(2)16个族七个主族:由长周期和短周期元素组成,IA~VIIA 位于第1、2、13、14、15、16、17纵行 一个第Ⅷ族:位于第8、9、10三个纵行七个副族:仅由长周期元素组成,IB~VIIB
位于第11、12、3、4、5、6、7纵行 一个0族:稀有气体元素族,位于第18纵行主族序数=最外层电子数=最高正价数罗马数字 4=5-1,9=10-1ⅠⅡⅢⅣⅤⅥⅦⅧⅨⅩ12345678910族16=7+7+1+1A代表主族,B代表副族
ⅠA~ⅦA 7个主族 (第1、2、13、14、15、16、17列)
ⅠB~ⅦB 7个副族 (第11、12、3、4、5、6、7列)
Ⅷ 1个第八族 (第8、9、10列)
0 族 1零族16个族主族AⅠAⅡAⅢAⅣAⅤAⅥAⅦA第七主族第一主族第二主族第六主族第五主族第四主族第三主族副族BⅠBⅡBⅢBⅣBⅤBⅥBⅦB第七副族第六副族第五副族第四副族第三副族第二副族第一副族4、考察每周期开头的是什么类型的元素?靠近尾部的是什么类型的元素?结尾的是什么类型的元素?这说明元素之间存在着什么规律性的联系?它与元素周期表这个名称有没有联系? 除第一周期外开头的是非金属元素,靠近结尾的是非金属元素,结尾的是稀有气体元素。说明自然界各元素间存在着元素种类、元素性质等周期性变化。
5、元素周期表的意义是学习和研究化学知识的重要工具;为寻找新元素提供了理论依据;在元素周期表中,位置越靠近的元素,性质越相似(具有规律性),可以启发人们在元素周期表的一定区域寻找新物质(如农药、催化剂、半导体材料)。1、 据报道,上海某医院正研究用放射性碘治疗肿瘤,这种碘原子的核电荷数为53,相对原子质量是125,下列关于这种原子的说法错误的是( )
A.质子数53 B.核外电子数是53
C.中子数53 D.质子数与中子数之和是125
2、贫铀弹的主要成分是低放射性的铀,铀原子的相对原子质量是238,核电荷数为92,中子数应为( )
A、146 B、92 C、136 D、238
C我能行A3.一个碳原子的质量是1.993×10千克, 碳的相对原子质量为 ( ) (A)12克(B)14 (C)12 (D)16 4.已知原子的核电荷数,可以确定它的( ) (A)相对原子质量 (B)质子数 (C)中子数 (D)电子层数 5.原子中决定相对原子质量大小的主要微粒是( ) A.质子数和电子数 B.质子数和中子数 C.中子数和电子数 D.核电荷数 7、在同一原子里,其数目相同的是( ) A、中子数和质子数 B、电子数和质子数 C、中子数和电子数 D、质子数和原子质量 CBBB
同课章节目录
- 第1章 运动和力
- 1 机械运动
- 2 力
- 3 几种常见的力
- 4 运动和力
- 5 二力平衡的条件
- 第2章 压力 压强
- 1 压强
- 2 液体内部的压强
- 3 大气压强
- 4 流体的压强与流速的关系
- 第3章 浮力
- 1 密度
- 2 浮力
- 3 阿基米德原理
- 4 物体浮沉条件及其应用
- 第4章 植物的物质和能量的转化
- 1 绿色开花植物的营养器官
- 2 水在植物体中的代谢
- 3 无机盐在植物体内的代谢
- 4 植物的光合作用和呼吸作用
- 第5章 人体的物质和能量的转化
- 1 食物的消化和吸收
- 2 人体的呼吸
- 3 人体内的物质运输
- 4 人体的排泄
- 5 人体生命活动过程中物质和能量的转化
- 第6章 物质的构成
- 1 构成物质的微粒
- 2 元素
- 3 物质的分类
- 4 化学式
- 5 固态物质
