第八单元 金属和金属材料复习(课件37页)
文档属性
| 名称 | 第八单元 金属和金属材料复习(课件37页) |  | |
| 格式 | zip | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-21 21:13:15 | ||
图片预览











文档简介
(共37张PPT)
第八单元 金属和金属材料
复习课
1.了解金属的物理、化学性质、用途及保护方法。
2.探究铁生锈的原因及防止金属锈蚀的简单方法。
3.知道炼铁的原理,能进行有关含杂质化学反应的计算。
学习目标
金
属
和
金
属
材
料
金
属
合
金
颜色、状态、导电导热性、延展性(金属之最)
物理性质:共性、特性
化学
性质
1.大多数金属可与O2的反应
金属 + 酸 → 化合物 + H2↑
金属1 + 化合物1 → 金属2 + 化合物2
金属 + O2 → 金属氧化物
2.大多数金属可与酸的反应
3. 金属与金属化合溶液的反应
4.金属活动性顺序
常见金属活动性顺序
运用:
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
判断金属活动性强弱
判断金属能否与酸反应
判断金属能否与金属化合物溶液反应
保护各
利用:
铁的
冶炼
锈蚀原因:
实验室:
工业上:
装置、原理、注意事项
原料、设备、原理、原料的作用
铁与氧气、水接触
防护方法:
破坏铁生锈的条件
保护措施:
防生锈
回收利用
合理开采
寻找代用品
锈蚀
防护
改变内部结构和涂保护膜
概念:
优点:
混合物
(1)、熔点低、硬度大
(2)、抗腐蚀性能好
(3)、可塑性好、易于加工、机械性能好
常见合金:
铁合金:生铁和钢
钛和钛合金
基本概念:
置换反应
金属的物理性质
大多数金属常温下是固体(汞是液体),有金属光泽,呈银白色(铜呈紫红色,金呈黄色),密度、硬度较大,熔沸点较高,有优良的导电导热性和延展性。
一、金属与合金
常见的合金制品
合金:是由一种金属跟其他金属或非金属加热熔合形成的有金属特性的物质。 (合金属于混合物)
生铁和钢属于铁合金。生铁和钢主要成分都是铁,但含碳量不同(生铁含碳量高于钢),因此机械性能不同。
合金与组成它们的金属的性质差异:
合金的硬度大于组成它们的金属
合金的熔点低于组成它们的金属
合金的抗腐蚀能力强于组成它们的金属
合金的机械性能优于组成它们的金属
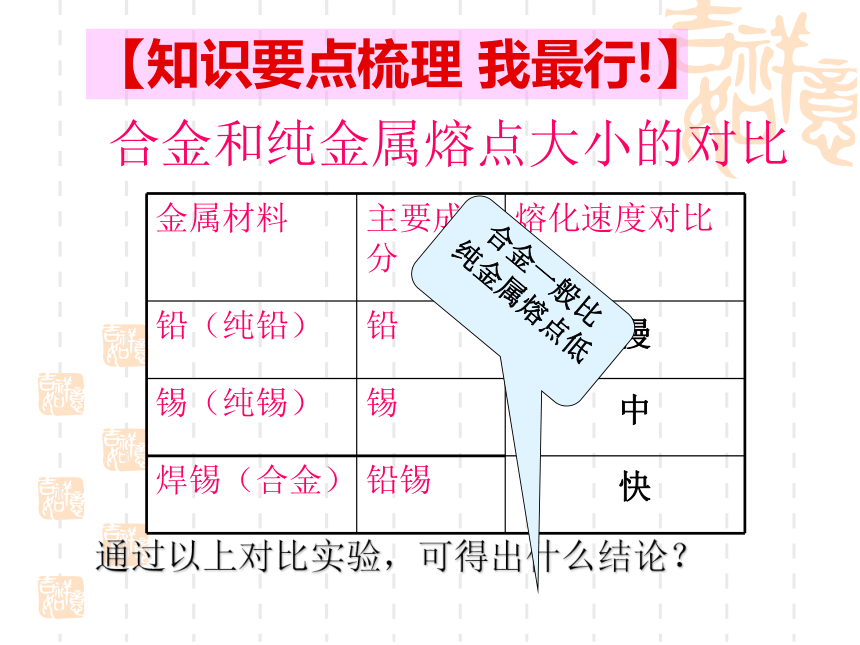
合金和纯金属熔点大小的对比
金属材料 主要成分 熔化速度对比
铅(纯铅) 铅
锡(纯锡) 锡
焊锡(合金) 铅锡
通过以上对比实验,可得出什么结论?
慢
中
快
【知识要点梳理 我最行!】
合金一般比
纯金属熔点低
2 合金和纯金属性质的对比
金属材料 主要成分 光泽和颜色 硬度大小对比
黄铜片(合金) 铜锌
铜片(纯铜) 铜 焊锡(合金) 铅锡
锡(纯锡) 锡 通过以上对比实验,可得出什么结论?
(从颜色,硬度方面)?
黄色 (紫)红色 银白色 银白色
黄铜片>铜片
锡 > 焊锡
【知识要点梳理 我最行!】
返回
合金一般比纯
金属硬度大
(反馈练习)
下列做法符合科学常识的是( )
A、电路中的保险丝熔断后,换用了更粗的保险丝
B、向燃着的酒精灯中添加酒精
C、用燃着的木条检验石油液化气是否泄漏
D、油罐车的尾部装有一条拖在地面上的铁链
D
铁丝在氧气中燃烧
镁带在空气中燃烧
二、金属的化学性质
1、大多数金属能跟氧气反应
金属与氧气反应的难易和剧烈程度不同,取决于金属的化学活动性。
金在高温时也不与氧气反应。
金属单质+氧气 金属氧化物
(1)铝在常温下能与氧气反应,那么我们用的铝制餐具是怎么回事呢?
金属在常温下发生缓慢氧化:4Al+3O2=2Al2O3; 2Mg+O2=2MgO
形成一层致密的氧化物薄膜,从而阻止铝的进一步氧化,因而铝具有较好的抗腐蚀性。
(2)为何不宜用钢刷来擦洗铝制餐具呢?
若用钢刷擦洗铝制品,容易把氧化薄膜除掉,从而起不到保护作用。
思考:
我会实践
铁是一种应用广泛的金属,下列有关铁的说法中,正确的是( )
A、铁丝在氧气中燃烧生成氧化铁
B、铁在干燥的空气中易生锈
C、铁是地壳中含量最多的金属
D、用铁锅炒菜可使食物增加微量铁元素
铁丝在纯氧中剧烈燃烧,生成Fe3O4
在常温下,铁在干燥的空气中很难跟氧气发生化学反应,生成铁锈。铁生锈,实际上是铁、氧气、和水相互作用的结果。
地壳中含量最多的金属是铝;其次是铁。
D
练一练
【我会梳理】 , 我会运用!】
返回
2、某些金属能跟酸(稀盐酸与稀硫酸)反应
金属能否与酸反应,以及反应的剧烈程度取决于金属的化学活动性。
强调:铁与盐酸、稀硫酸发生置换反应生成亚铁盐。
金属单质+酸 金属化合物+氢气
金属 稀盐酸 现象 反应的化学方程式
镁
锌
铁
铜
放出气泡最迅速,反应最剧烈。
放出气泡速度次之,反应
较为剧烈。
放出气泡速度最慢,反应较为缓和。
不反应
Mg + 2HCl = MgCl2 + H2↑
Zn + 2HCl = ZnCl2 + H2↑
Fe + 2HCl = FeCl2 + H2↑
金属活动性由强到弱
Mg、Zn、Fe Cu
﹖
H
(H)
上图是甲、乙、丙、丁四种常见金属与稀盐酸反应的比较示意图。
(1)上述四种金属可以归为两类,
其中哪几种金属可以归为一类?
(2)若乙是金属锌,则丙可能是什
么金属?请你说明理由。
气泡
读图分析
在金属活动性顺序里,位于氢前的金属能置换出盐酸、稀硫酸中的氢;
【知识要点梳理 我最行!】
探究题:
取甲、乙两支完全相同的试管,装有足量的质量和质量分数相同的盐酸;在试管上方各罩
一完全相同的气球,两气球中分别装
有相同质量的金属A、B,现同时提起 A B
两只气球,使其中的金属迅速与稀盐 甲 乙
酸接触反应。实验发现:开始时,甲气球迅速鼓起,
而乙气球鼓起较慢。反应结束时,甲气球鼓起的体积比乙气球大。根据以上事实,可得出以下结论
(1)
(2)
金属A的活泼性强于金属B
消耗等质量的金属A和B,A产生的氢气比B多
在金属活动性顺序,表中,金属的位置越靠前,它的活动性就越强,反应的就越剧烈
【知识要点梳理 我最行!】
返回
铝与硫酸铜溶液的反应
铜与硝酸银溶的反应
3、金属能跟某些盐溶液反应
Fe+CuSO4=Cu+FeSO4(湿法冶铜)
2Al+3CuSO4=3Cu+Al2(SO4)3
Cu+2AgNO3=2Ag+Cu(NO3)2
强调:铁与盐溶液发生置换反应,生成亚铁盐。
A金属单质+B金属化合物 B金属单质+A金属化合物 (金属活动性)A>B
(反馈练习)
化学的研究目的就是帮助人们认识、改造和应用物质,把金属矿物冶炼成金属就是人们利用化学方法实现物质改造的典型范例。下表中不同的金属被开发和利用的年代不同,从化学反应的角度看,决定这一年代先后顺序的关键因素是( )
A、金属的活动性 B、金属的导电性
C、金属的延展性 D、地壳中金属元素的含量
K 、Ca、 Na、 Mg 、Al 、Zn 、Fe、 Sn、 Pb、(H) 、Cu 、Hg 、Ag 、Pt 、Au
约200年前
约6000年前
约6000年前
A
约2500年前
三、置换反应:
由一种单质与一种化合物反应,生成另一种单质和另一种化合物的反应叫做置换反应
A +BC == AC + B
置换反应的类型
1、活泼金属与盐酸、硫酸反应
2、活动性强的金属与活动性弱的金属的化合物反应
3、C、H2还原金属氧化物的反应
Fe+H2SO4===FeSO4+H2↑
Fe+CuCl2===Cu+FeCl2
C+2CuO === 2Cu+CO2 ↑
高温
归纳已学的化学基本反应类型:
A + B == AB
AB == A+B
A +BC == AC + B
分解反应
置换反应
化合反应
主要应用:
一 、判断金属跟酸能否发生置换反应及其反应的快慢。
二 、判断金属跟盐溶液能否发生置换反应。
三 、判断金属跟混合盐溶液反应的次序。
K
Ca
Na
Mg
Al
Zn
Fe
Sn
Pb
(H)
Cu
Hg
Ag
Pt
Au
金属活动性顺序由强逐渐减弱
四、金属活动性顺序
2
(反馈练习)
X、Y、Z三种金属中,只有Z能和稀硫酸反应;将Y放人X的盐溶液中,Y表面有X析出。则X、Y、Z三种金属的活动性顺序为( )
A、X > Z > Y
B、Y > X > Z
C、Y > Z > X
D、Z > Y > X
D
(反馈练习)
向含有AgNO3、Cu(NO3)2的混合溶液中加入一定量的铁粉,充分反应后过滤,向滤出的固体中滴加稀硫酸,有气体生成,则滤出的固体一定为( )
A、Ag、Cu两种单质的混合物
B、Cu、Fe两种单质的混合物
C、Ag、Fe两种单质的混合物
D、Ag、Cu、 Fe三种单质的混合物
D
请你设计一个简单的实验探究Mg、Fe、Cu三种金属的活动性顺序。
提示:要有实验操作、实验现象及实验结论。
中间的金属单质,两边的金属化合物,
两边的金属单质,中间的金属化合物.
活动与探究:
五、金属的冶炼
自然界中以单质形式存在的金
自然界中以单质形式存在的银
自然界中金属除金、银等以单质形式存在外,其余都以化合物形式存在。同时主要存在于矿石中。
赤铁矿
(Fe2O3)
黄铁矿
(FeS2)
菱铁矿
(FeCO3)
铝土矿
(Al2O3)
黄铜矿
(CuFeS2)
辉铜矿
(Cu2S)
五、金属的冶炼
几种常见的矿石
现象:红色粉末变成黑色,澄清的石灰水变浑浊。
一氧化碳还原氧化铁
石灰水的作用:检验是否有二氧化碳生成。
酒精灯的作用:点燃尾气,防止尾气污染空气。
1、实验室炼铁
1、反应原理:
Fe2O3 + 3CO ==== 2Fe + 3CO2
高温
2、实验现象:
红色粉末中出现黑色固体,澄清石灰水变浑浊
3、注意事项:
重温一下
a 、先通入气体,再点燃酒精灯
b 、结束时,先熄灭酒精灯,冷却后再停止通气
c 、尾气处理
炼铁主要设备:高炉
炼铁反应原理是:在高温下,用还原剂一氧化碳把铁从铁矿石里还原出来 。
Fe2O3 + 3CO ===== 2Fe + 3CO2
高温
炼铁的主要原料:铁矿石、焦炭、石灰石、空气
2、工业炼铁
铁的冶炼
六、有关炼铁(含杂质物质)的计算
由于炼铁所用原料和产品都是混合物,因此牵涉到混合物和纯净物之间的质量换算。
×纯度
M混合物
M纯净物
÷纯度
有关炼铁的计算可以根据化学方程式计算,也可以根据化学式计算。根据化学式计算利用的是元素质量守衡的原则。
某钢铁厂每天消耗2000t含氧化铁80%的赤铁矿,理论上
可以炼出含铁98%的生铁多少吨?
(反馈练习)
解:mFe2O3==2000t×80%==1600t
设可以炼出铁的质量为X。
3CO+Fe2O3===2Fe+3CO2
160 112
1600t X
160/1600t=112/X
X=1120t
m生铁==1120t÷98%==1142.9t
答:可以炼出含铁98%的生铁是1142.9t。
高温
解法一:
分析:
m铁矿石
mFe2O3
mFe
m生铁
÷铁的纯度
×Fe2O3中Fe的质量分数
× Fe2O3的纯度
解:2000t×80%×(112/160×100%)÷98%==1142.9t
答:可以炼出含铁98%的生铁是1142.9t。
解法二:
铁轨的锈蚀
铁钉的生锈
各种铁制品的锈蚀
世界上每年因腐蚀而报废的金属相当于年产量的20%--40%,金属锈蚀给人类带来了巨大的损失。
七、金属的锈蚀、防锈与保护
铁生锈的探究
铁生锈的条件:与氧气和水同时接触时容易生锈。
防锈的方法:保持铁制品表面的洁净和干燥;涂一层保护膜,如刷油漆、涂油、镀其他的金属、烤蓝等,还可以制成合金。
金属资源的保护
防止金属的腐蚀
金属的回收利用
有计划、合理地开采矿物
寻找金属的代用品
(反馈练习)
人们的日常生活离不开金属,高科技新材料的开发和应用也需要金属。请回答:
(1)地壳中含量最多的金属元素是 。
(2)根据下图的应用实例,试说出金属具有的两点物理性质
(3)早在春秋战国时期,我国古代人民已经开始炼铁。
①写出磁铁矿(Fe3O4)与CO反应的化学方式
。
②钢铁防腐十分重要!请写出一种防止钢铁生锈的方法 。
Al
4CO+Fe3O4===3Fe+4CO2
高温
刷油漆
多谢莅临指导!
第八单元 金属和金属材料
复习课
1.了解金属的物理、化学性质、用途及保护方法。
2.探究铁生锈的原因及防止金属锈蚀的简单方法。
3.知道炼铁的原理,能进行有关含杂质化学反应的计算。
学习目标
金
属
和
金
属
材
料
金
属
合
金
颜色、状态、导电导热性、延展性(金属之最)
物理性质:共性、特性
化学
性质
1.大多数金属可与O2的反应
金属 + 酸 → 化合物 + H2↑
金属1 + 化合物1 → 金属2 + 化合物2
金属 + O2 → 金属氧化物
2.大多数金属可与酸的反应
3. 金属与金属化合溶液的反应
4.金属活动性顺序
常见金属活动性顺序
运用:
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
判断金属活动性强弱
判断金属能否与酸反应
判断金属能否与金属化合物溶液反应
保护各
利用:
铁的
冶炼
锈蚀原因:
实验室:
工业上:
装置、原理、注意事项
原料、设备、原理、原料的作用
铁与氧气、水接触
防护方法:
破坏铁生锈的条件
保护措施:
防生锈
回收利用
合理开采
寻找代用品
锈蚀
防护
改变内部结构和涂保护膜
概念:
优点:
混合物
(1)、熔点低、硬度大
(2)、抗腐蚀性能好
(3)、可塑性好、易于加工、机械性能好
常见合金:
铁合金:生铁和钢
钛和钛合金
基本概念:
置换反应
金属的物理性质
大多数金属常温下是固体(汞是液体),有金属光泽,呈银白色(铜呈紫红色,金呈黄色),密度、硬度较大,熔沸点较高,有优良的导电导热性和延展性。
一、金属与合金
常见的合金制品
合金:是由一种金属跟其他金属或非金属加热熔合形成的有金属特性的物质。 (合金属于混合物)
生铁和钢属于铁合金。生铁和钢主要成分都是铁,但含碳量不同(生铁含碳量高于钢),因此机械性能不同。
合金与组成它们的金属的性质差异:
合金的硬度大于组成它们的金属
合金的熔点低于组成它们的金属
合金的抗腐蚀能力强于组成它们的金属
合金的机械性能优于组成它们的金属
合金和纯金属熔点大小的对比
金属材料 主要成分 熔化速度对比
铅(纯铅) 铅
锡(纯锡) 锡
焊锡(合金) 铅锡
通过以上对比实验,可得出什么结论?
慢
中
快
【知识要点梳理 我最行!】
合金一般比
纯金属熔点低
2 合金和纯金属性质的对比
金属材料 主要成分 光泽和颜色 硬度大小对比
黄铜片(合金) 铜锌
铜片(纯铜) 铜 焊锡(合金) 铅锡
锡(纯锡) 锡 通过以上对比实验,可得出什么结论?
(从颜色,硬度方面)?
黄色 (紫)红色 银白色 银白色
黄铜片>铜片
锡 > 焊锡
【知识要点梳理 我最行!】
返回
合金一般比纯
金属硬度大
(反馈练习)
下列做法符合科学常识的是( )
A、电路中的保险丝熔断后,换用了更粗的保险丝
B、向燃着的酒精灯中添加酒精
C、用燃着的木条检验石油液化气是否泄漏
D、油罐车的尾部装有一条拖在地面上的铁链
D
铁丝在氧气中燃烧
镁带在空气中燃烧
二、金属的化学性质
1、大多数金属能跟氧气反应
金属与氧气反应的难易和剧烈程度不同,取决于金属的化学活动性。
金在高温时也不与氧气反应。
金属单质+氧气 金属氧化物
(1)铝在常温下能与氧气反应,那么我们用的铝制餐具是怎么回事呢?
金属在常温下发生缓慢氧化:4Al+3O2=2Al2O3; 2Mg+O2=2MgO
形成一层致密的氧化物薄膜,从而阻止铝的进一步氧化,因而铝具有较好的抗腐蚀性。
(2)为何不宜用钢刷来擦洗铝制餐具呢?
若用钢刷擦洗铝制品,容易把氧化薄膜除掉,从而起不到保护作用。
思考:
我会实践
铁是一种应用广泛的金属,下列有关铁的说法中,正确的是( )
A、铁丝在氧气中燃烧生成氧化铁
B、铁在干燥的空气中易生锈
C、铁是地壳中含量最多的金属
D、用铁锅炒菜可使食物增加微量铁元素
铁丝在纯氧中剧烈燃烧,生成Fe3O4
在常温下,铁在干燥的空气中很难跟氧气发生化学反应,生成铁锈。铁生锈,实际上是铁、氧气、和水相互作用的结果。
地壳中含量最多的金属是铝;其次是铁。
D
练一练
【我会梳理】 , 我会运用!】
返回
2、某些金属能跟酸(稀盐酸与稀硫酸)反应
金属能否与酸反应,以及反应的剧烈程度取决于金属的化学活动性。
强调:铁与盐酸、稀硫酸发生置换反应生成亚铁盐。
金属单质+酸 金属化合物+氢气
金属 稀盐酸 现象 反应的化学方程式
镁
锌
铁
铜
放出气泡最迅速,反应最剧烈。
放出气泡速度次之,反应
较为剧烈。
放出气泡速度最慢,反应较为缓和。
不反应
Mg + 2HCl = MgCl2 + H2↑
Zn + 2HCl = ZnCl2 + H2↑
Fe + 2HCl = FeCl2 + H2↑
金属活动性由强到弱
Mg、Zn、Fe Cu
﹖
H
(H)
上图是甲、乙、丙、丁四种常见金属与稀盐酸反应的比较示意图。
(1)上述四种金属可以归为两类,
其中哪几种金属可以归为一类?
(2)若乙是金属锌,则丙可能是什
么金属?请你说明理由。
气泡
读图分析
在金属活动性顺序里,位于氢前的金属能置换出盐酸、稀硫酸中的氢;
【知识要点梳理 我最行!】
探究题:
取甲、乙两支完全相同的试管,装有足量的质量和质量分数相同的盐酸;在试管上方各罩
一完全相同的气球,两气球中分别装
有相同质量的金属A、B,现同时提起 A B
两只气球,使其中的金属迅速与稀盐 甲 乙
酸接触反应。实验发现:开始时,甲气球迅速鼓起,
而乙气球鼓起较慢。反应结束时,甲气球鼓起的体积比乙气球大。根据以上事实,可得出以下结论
(1)
(2)
金属A的活泼性强于金属B
消耗等质量的金属A和B,A产生的氢气比B多
在金属活动性顺序,表中,金属的位置越靠前,它的活动性就越强,反应的就越剧烈
【知识要点梳理 我最行!】
返回
铝与硫酸铜溶液的反应
铜与硝酸银溶的反应
3、金属能跟某些盐溶液反应
Fe+CuSO4=Cu+FeSO4(湿法冶铜)
2Al+3CuSO4=3Cu+Al2(SO4)3
Cu+2AgNO3=2Ag+Cu(NO3)2
强调:铁与盐溶液发生置换反应,生成亚铁盐。
A金属单质+B金属化合物 B金属单质+A金属化合物 (金属活动性)A>B
(反馈练习)
化学的研究目的就是帮助人们认识、改造和应用物质,把金属矿物冶炼成金属就是人们利用化学方法实现物质改造的典型范例。下表中不同的金属被开发和利用的年代不同,从化学反应的角度看,决定这一年代先后顺序的关键因素是( )
A、金属的活动性 B、金属的导电性
C、金属的延展性 D、地壳中金属元素的含量
K 、Ca、 Na、 Mg 、Al 、Zn 、Fe、 Sn、 Pb、(H) 、Cu 、Hg 、Ag 、Pt 、Au
约200年前
约6000年前
约6000年前
A
约2500年前
三、置换反应:
由一种单质与一种化合物反应,生成另一种单质和另一种化合物的反应叫做置换反应
A +BC == AC + B
置换反应的类型
1、活泼金属与盐酸、硫酸反应
2、活动性强的金属与活动性弱的金属的化合物反应
3、C、H2还原金属氧化物的反应
Fe+H2SO4===FeSO4+H2↑
Fe+CuCl2===Cu+FeCl2
C+2CuO === 2Cu+CO2 ↑
高温
归纳已学的化学基本反应类型:
A + B == AB
AB == A+B
A +BC == AC + B
分解反应
置换反应
化合反应
主要应用:
一 、判断金属跟酸能否发生置换反应及其反应的快慢。
二 、判断金属跟盐溶液能否发生置换反应。
三 、判断金属跟混合盐溶液反应的次序。
K
Ca
Na
Mg
Al
Zn
Fe
Sn
Pb
(H)
Cu
Hg
Ag
Pt
Au
金属活动性顺序由强逐渐减弱
四、金属活动性顺序
2
(反馈练习)
X、Y、Z三种金属中,只有Z能和稀硫酸反应;将Y放人X的盐溶液中,Y表面有X析出。则X、Y、Z三种金属的活动性顺序为( )
A、X > Z > Y
B、Y > X > Z
C、Y > Z > X
D、Z > Y > X
D
(反馈练习)
向含有AgNO3、Cu(NO3)2的混合溶液中加入一定量的铁粉,充分反应后过滤,向滤出的固体中滴加稀硫酸,有气体生成,则滤出的固体一定为( )
A、Ag、Cu两种单质的混合物
B、Cu、Fe两种单质的混合物
C、Ag、Fe两种单质的混合物
D、Ag、Cu、 Fe三种单质的混合物
D
请你设计一个简单的实验探究Mg、Fe、Cu三种金属的活动性顺序。
提示:要有实验操作、实验现象及实验结论。
中间的金属单质,两边的金属化合物,
两边的金属单质,中间的金属化合物.
活动与探究:
五、金属的冶炼
自然界中以单质形式存在的金
自然界中以单质形式存在的银
自然界中金属除金、银等以单质形式存在外,其余都以化合物形式存在。同时主要存在于矿石中。
赤铁矿
(Fe2O3)
黄铁矿
(FeS2)
菱铁矿
(FeCO3)
铝土矿
(Al2O3)
黄铜矿
(CuFeS2)
辉铜矿
(Cu2S)
五、金属的冶炼
几种常见的矿石
现象:红色粉末变成黑色,澄清的石灰水变浑浊。
一氧化碳还原氧化铁
石灰水的作用:检验是否有二氧化碳生成。
酒精灯的作用:点燃尾气,防止尾气污染空气。
1、实验室炼铁
1、反应原理:
Fe2O3 + 3CO ==== 2Fe + 3CO2
高温
2、实验现象:
红色粉末中出现黑色固体,澄清石灰水变浑浊
3、注意事项:
重温一下
a 、先通入气体,再点燃酒精灯
b 、结束时,先熄灭酒精灯,冷却后再停止通气
c 、尾气处理
炼铁主要设备:高炉
炼铁反应原理是:在高温下,用还原剂一氧化碳把铁从铁矿石里还原出来 。
Fe2O3 + 3CO ===== 2Fe + 3CO2
高温
炼铁的主要原料:铁矿石、焦炭、石灰石、空气
2、工业炼铁
铁的冶炼
六、有关炼铁(含杂质物质)的计算
由于炼铁所用原料和产品都是混合物,因此牵涉到混合物和纯净物之间的质量换算。
×纯度
M混合物
M纯净物
÷纯度
有关炼铁的计算可以根据化学方程式计算,也可以根据化学式计算。根据化学式计算利用的是元素质量守衡的原则。
某钢铁厂每天消耗2000t含氧化铁80%的赤铁矿,理论上
可以炼出含铁98%的生铁多少吨?
(反馈练习)
解:mFe2O3==2000t×80%==1600t
设可以炼出铁的质量为X。
3CO+Fe2O3===2Fe+3CO2
160 112
1600t X
160/1600t=112/X
X=1120t
m生铁==1120t÷98%==1142.9t
答:可以炼出含铁98%的生铁是1142.9t。
高温
解法一:
分析:
m铁矿石
mFe2O3
mFe
m生铁
÷铁的纯度
×Fe2O3中Fe的质量分数
× Fe2O3的纯度
解:2000t×80%×(112/160×100%)÷98%==1142.9t
答:可以炼出含铁98%的生铁是1142.9t。
解法二:
铁轨的锈蚀
铁钉的生锈
各种铁制品的锈蚀
世界上每年因腐蚀而报废的金属相当于年产量的20%--40%,金属锈蚀给人类带来了巨大的损失。
七、金属的锈蚀、防锈与保护
铁生锈的探究
铁生锈的条件:与氧气和水同时接触时容易生锈。
防锈的方法:保持铁制品表面的洁净和干燥;涂一层保护膜,如刷油漆、涂油、镀其他的金属、烤蓝等,还可以制成合金。
金属资源的保护
防止金属的腐蚀
金属的回收利用
有计划、合理地开采矿物
寻找金属的代用品
(反馈练习)
人们的日常生活离不开金属,高科技新材料的开发和应用也需要金属。请回答:
(1)地壳中含量最多的金属元素是 。
(2)根据下图的应用实例,试说出金属具有的两点物理性质
(3)早在春秋战国时期,我国古代人民已经开始炼铁。
①写出磁铁矿(Fe3O4)与CO反应的化学方式
。
②钢铁防腐十分重要!请写出一种防止钢铁生锈的方法 。
Al
4CO+Fe3O4===3Fe+4CO2
高温
刷油漆
多谢莅临指导!
同课章节目录
