课题 2 二氧化碳制取的研究(课件30页)
文档属性
| 名称 | 课题 2 二氧化碳制取的研究(课件30页) |  | |
| 格式 | zip | ||
| 文件大小 | 22.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-21 21:32:19 | ||
图片预览






文档简介
(共30张PPT)
第六单元 碳和碳的氧化物
课题2 二氧化碳制取的研究
学习目标
1.了解二氧化碳的实验室制取。
学习定位
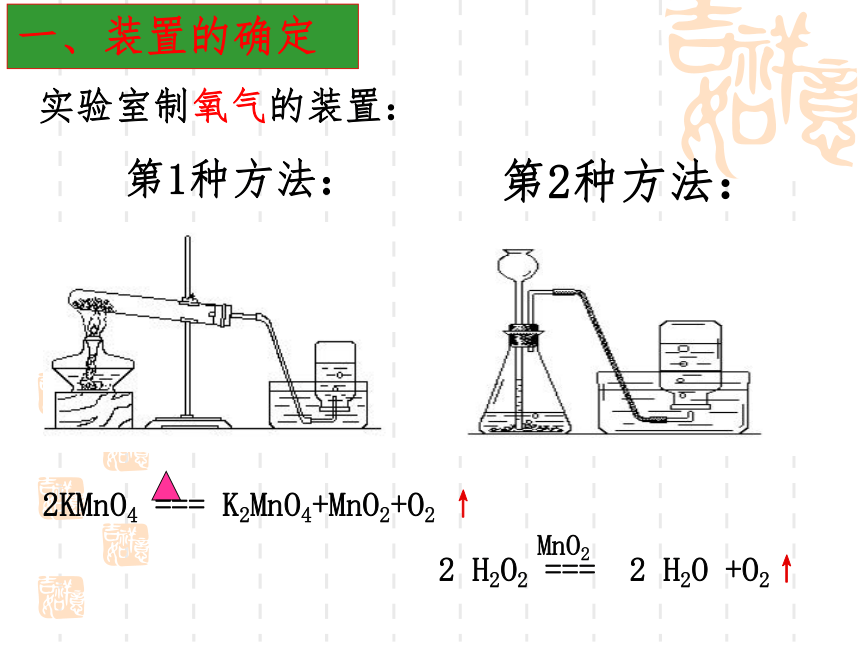
实验室制氧气的装置:
2KMnO4 === K2MnO4+MnO2+O2 ↑
2 H2O2 === 2 H2O +O2↑
MnO2
第1种方法:
第2种方法:
一、装置的确定
发生装置
收集装置
1、实验室制取气体的装置由哪几部分组成?
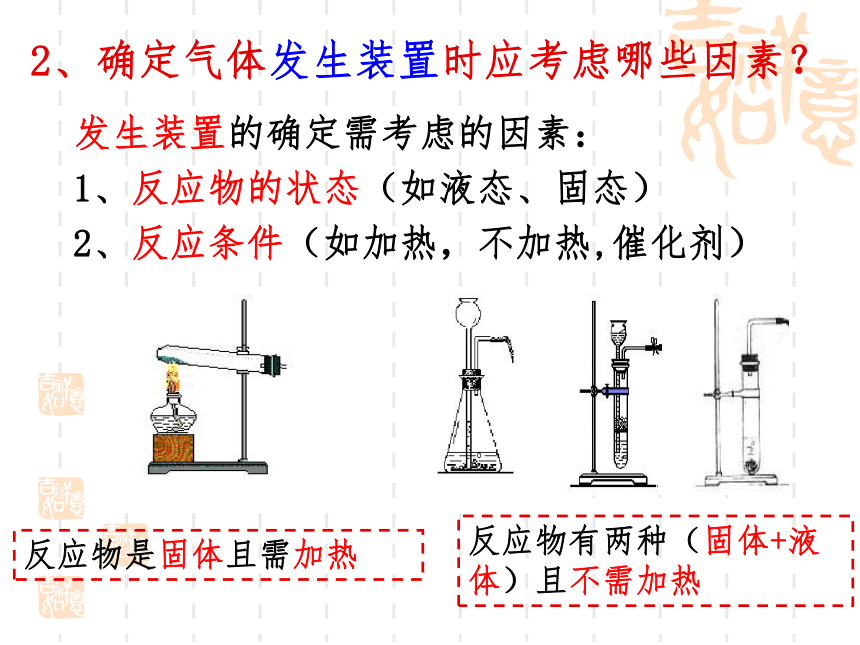
2、确定气体发生装置时应考虑哪些因素?
发生装置的确定需考虑的因素:
1、反应物的状态(如液态、固态)
2、反应条件(如加热,不加热,催化剂)
反应物是固体且需加热
反应物有两种(固体+液体)且不需加热
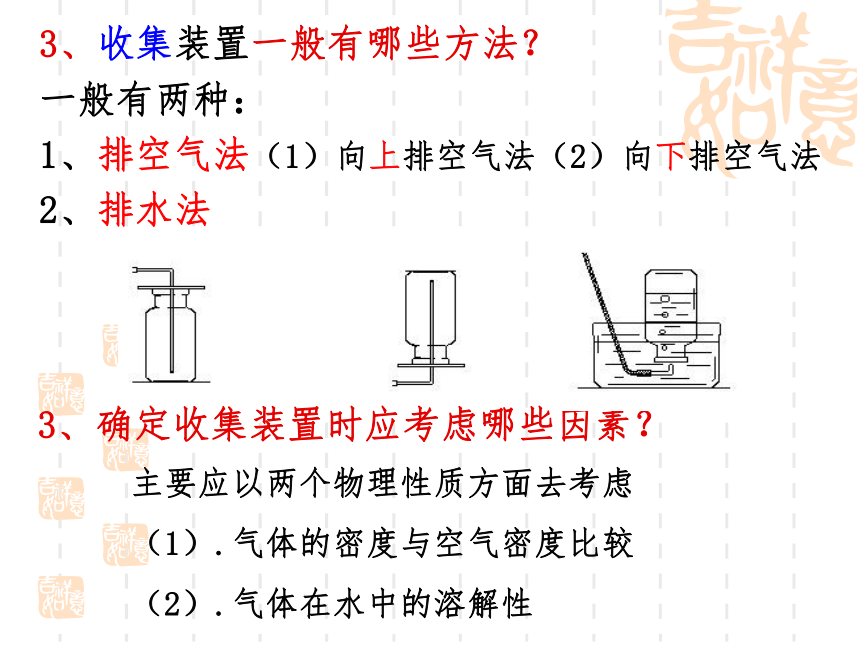
3、收集装置一般有哪些方法?
一般有两种:
1、排空气法(1)向上排空气法(2)向下排空气法
2、排水法
3、确定收集装置时应考虑哪些因素?
主要应以两个物理性质方面去考虑
(1).气体的密度与空气密度比较
(2).气体在水中的溶解性
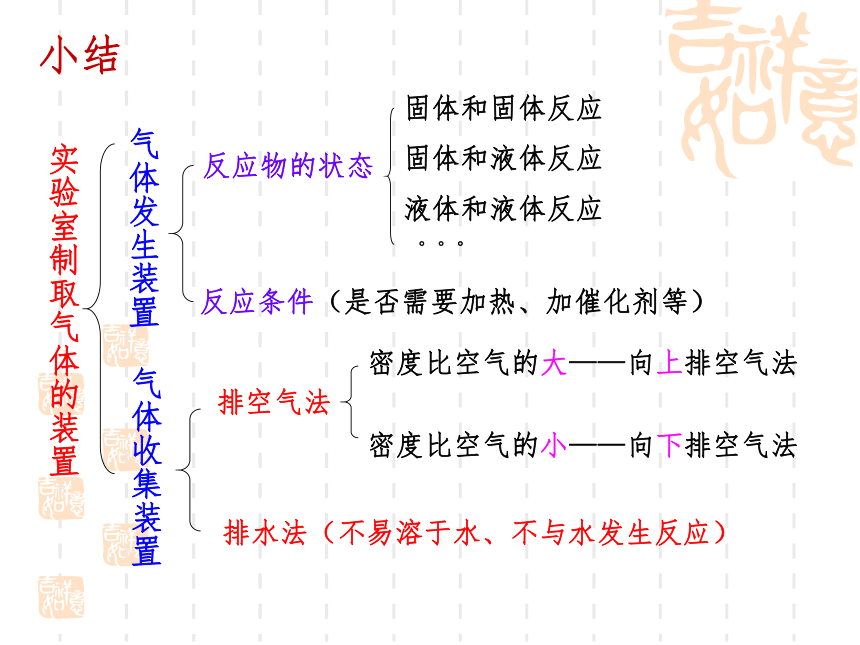
实验室制取气体的装置
气体发生装置
气体收集装置
反应物的状态
固体和固体反应
固体和液体反应
液体和液体反应
反应条件(是否需要加热、加催化剂等)
。。。
小结
排空气法
密度比空气的大——向上排空气法
密度比空气的小——向下排空气法
排水法(不易溶于水、不与水发生反应)
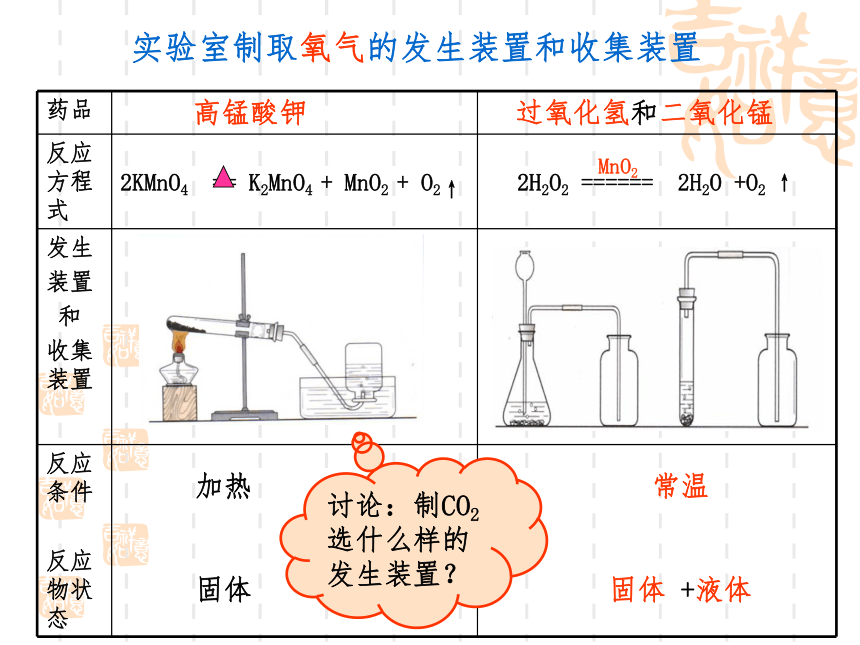
实验室制取氧气的发生装置和收集装置
药品 高锰酸钾 过氧化氢和二氧化锰
反应方程式
发生 装置 和 收集装置
反应条件 反应物状态
2KMnO4 == K2MnO4 + MnO2 + O2↑
2H2O2 ====== 2H2O +O2 ↑
MnO2
讨论:制CO2选什么样的发生装置?
加热
固体
常温
固体 +液体
实验1 :碳酸钠粉未与稀盐酸反应
现象
分析
结论
反应非常剧烈,短时间产生大量气泡
碳酸钠粉未的表面积很大,与盐酸接触面积大,
反应速度很快,不易控制
反应速率太快,不易收集 ,实验室不能用碳酸钠
粉未或大理石粉未等粉未状物质制取CO2
该反应的化学方程式为:
Na2CO3 + 2HCl = 2NaCl + H2O + CO2
我们通过下面三个对比实验进行探究
注意观察反应现象,并分析原因,然后填写下表
二、实验室制取CO2的药品和反应原理:
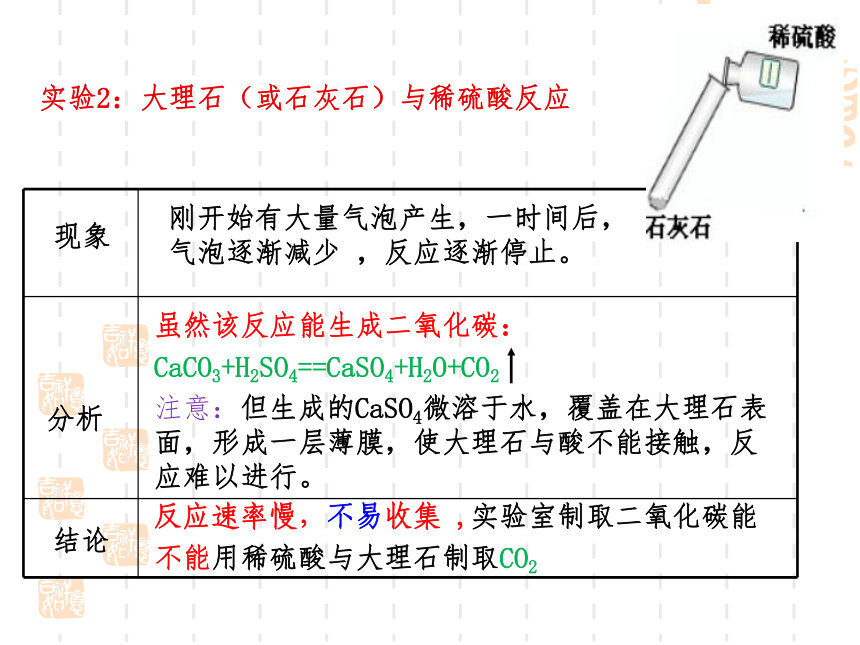
实验2:大理石(或石灰石)与稀硫酸反应
刚开始有大量气泡产生,一时间后,气泡逐渐减少 ,反应逐渐停止。
现象
分析
结论
反应速率慢,不易收集 ,实验室制取二氧化碳能
不能用稀硫酸与大理石制取CO2
虽然该反应能生成二氧化碳:
CaCO3+H2SO4==CaSO4+H2O+CO2
注意:但生成的CaSO4微溶于水,覆盖在大理石表面,形成一层薄膜,使大理石与酸不能接触,反应难以进行。
现象
分析
结论
实验3:大理石(或石灰石)与稀盐酸反应
有大量气泡产生,大理石逐渐溶解
该反应在常温下进行,反应速度适中,便于控制。
大理石与稀盐酸反应生成了碳酸和氯化钙:
CaCO3 + 2HCl = CaCl2 + H2CO3
碳酸很不稳定,分解成水和二氧化碳:
H2CO3 = H2O + CO2
主要成分:
碳酸钙CaCO3
产生气泡速率比较适中 ,适合实验室制取CO2
反应方程式:
总反应方程式为:
CaCO3+2HCl=CaCl2+H2CO3
+)
H2CO3=H2O+CO2↑
CaCO3+2HCl=CaCl2+ H2O + CO2↑
1、实验室制取二氧化碳药品
主要成分:
碳酸钙CaCO3
总体思路是:装置简单操作易行。
其具体思路是:
2、实验室制取二氧化碳的装置
.确定发生装置:
反应物:
大理石(或石灰石)
稀盐酸
固态
液态
反应条件:
常温下进行
发生装置
二氧化碳的多种发生装置
分
液
漏
斗
长颈漏斗
随时添加液体
控制反应速率
关闭弹簧夹,试管内
气压增大,液面下降,
长颈漏斗中液面上升,
固液分离,反应停止。
适用于块状固体与
液体间的反应
控制反应的
发生和停止
节约药品
我们能创新
破底试管
不足
加一加
随开随停,控制反应的开始和结束
.确定收集装置
生成物:
CaCl2
CO2
H2O
气体
在标准状况下,CO2的密度比空气的密度大,二氧化碳能溶于水,在通常状况下,1体积水中能溶解1体积的二氧化碳。
CO2的性质:
收集装置
植物油
水
制取二氧化碳的总装置
长颈漏斗下端应插到液面以下
导管只需突出胶塞少许
导管口应插到集气瓶底
课堂练习1
下图为实验室制取二氧化碳的装置图,有哪些错误?为什么?请改正?
长颈漏斗没有
插入液面下
出气导管太长,
伸入了液面下
没有用向上排
空气法收集
3、实验步骤:
.连接仪器
.检查气密性
导管一端放入水中,用手紧握试管,导管口有气泡冒出,松开手后,导管口形成一段稳定的水柱,说明装置不漏气。
夹紧弹簧夹,向长颈漏斗中加水至漏斗颈中形成一段水柱,如果一段时间后,水柱高度不变,说明装置的气密性良好。
加大理石
加稀盐酸
.加药品
收集气体并验满
正放
检验气体:
澄清石灰水
变浑浊
检验
验满
将燃着的 木条放在集气瓶口,火焰熄灭 ,证明二氧化碳已收集满。
①长颈漏斗的下端管口应 以
下形成 ,
防止 。
②反应器内的导管 即可,不宜 ,
否则 。
③实验室制取二氧化碳 加热;
④集气瓶内的导管应伸入到 ,
目的是 。
伸入液面
液封
气体从长颈漏斗口逸出
稍露出橡皮塞
过长
不利于气体的排出和收集
不需要
接近集气瓶底
排尽集气瓶中的空气
实验室制取二氧化碳装置如图所示:
【交流讨论】
三、工业制法
高温煅烧石灰石(主要成分:碳酸钙)
制得生石灰,同时产生副产品二氧化碳。
CaCO3 CaO + CO2
高温
千锤万凿出深山,
烈火焚烧若等闲。
粉骨碎身浑不怕,
要留清白在人间。
《石灰吟·于谦》
本课题小结:
二氧化碳实验室制法
1、反应的药品
2、反应的原理
3、装置图
4、验满方法
5、检验方法
大理石(或石灰石)和稀盐酸
CaCO3+2HCl=CaCl2+H2O+CO2↑
将燃着的木条伸到集气瓶口,木条熄灭,则说明集满。
将气体通入澄清的石灰水,石灰水
变浑浊,证明生成的气体是CO2。
比较氧气、二氧化碳的实验室制取
氧气
二氧化碳
CaCO3+2HCl CaCl2+H2O+CO2↑
检验氧气:
(用带火星的木条)
使带火星的木条复燃
检验二氧化碳:
(用澄清石灰水)
使澄清的石灰水变浑浊
2H2O2 2H2O+O2
MnO2
2KMnO4 K2MnO4+MnO2+O2
1、实验室制取二氧化碳部分操作如图所示,其中错误的是( )
A.检查气密性 B.仪器连接 C.加入药品 D.收集气体
C
习题
2、下列有关实验室制取二氧化碳气体的操作图示正确的是( )
A.导管连接 B.胶塞塞紧 C.气体验满 D.气体收集
A
3. 硫化氢是没有颜色,有臭鸡蛋气味的有剧毒气体。它的密度比空气略大,能溶于水,1体积水能溶解2.6体积的硫化氢,溶于水形成氢硫酸。
硫化氢是一种可燃性气体,
2H2S+3O2===2H2O+2SO2
实验室里常用块状固体硫化亚铁(FeS)与稀硫酸反应来制取。
(1)实验室制取硫化氢的发生装置可用
(2)收集应用
(3)为了防止多余的气体逸出污染环境,
可将其通入 中。
点燃
二氧化碳
向上排空气法
水
4、下图是实验室制备CO2的装置图。该装置的特点是:打开弹簧夹,大理石和盐酸接触,发生反应。关闭弹簧夹后,盐酸被反应产生的CO2气体压回长颈漏斗,与大理石分离,停止反应。
优点:随开随用、随关随停
使用该装置的要求:块状固体和液体的反应
下面装置中,哪些可以产生与上述装置相同的效果 (填写编号)
第六单元 碳和碳的氧化物
课题2 二氧化碳制取的研究
学习目标
1.了解二氧化碳的实验室制取。
学习定位
实验室制氧气的装置:
2KMnO4 === K2MnO4+MnO2+O2 ↑
2 H2O2 === 2 H2O +O2↑
MnO2
第1种方法:
第2种方法:
一、装置的确定
发生装置
收集装置
1、实验室制取气体的装置由哪几部分组成?
2、确定气体发生装置时应考虑哪些因素?
发生装置的确定需考虑的因素:
1、反应物的状态(如液态、固态)
2、反应条件(如加热,不加热,催化剂)
反应物是固体且需加热
反应物有两种(固体+液体)且不需加热
3、收集装置一般有哪些方法?
一般有两种:
1、排空气法(1)向上排空气法(2)向下排空气法
2、排水法
3、确定收集装置时应考虑哪些因素?
主要应以两个物理性质方面去考虑
(1).气体的密度与空气密度比较
(2).气体在水中的溶解性
实验室制取气体的装置
气体发生装置
气体收集装置
反应物的状态
固体和固体反应
固体和液体反应
液体和液体反应
反应条件(是否需要加热、加催化剂等)
。。。
小结
排空气法
密度比空气的大——向上排空气法
密度比空气的小——向下排空气法
排水法(不易溶于水、不与水发生反应)
实验室制取氧气的发生装置和收集装置
药品 高锰酸钾 过氧化氢和二氧化锰
反应方程式
发生 装置 和 收集装置
反应条件 反应物状态
2KMnO4 == K2MnO4 + MnO2 + O2↑
2H2O2 ====== 2H2O +O2 ↑
MnO2
讨论:制CO2选什么样的发生装置?
加热
固体
常温
固体 +液体
实验1 :碳酸钠粉未与稀盐酸反应
现象
分析
结论
反应非常剧烈,短时间产生大量气泡
碳酸钠粉未的表面积很大,与盐酸接触面积大,
反应速度很快,不易控制
反应速率太快,不易收集 ,实验室不能用碳酸钠
粉未或大理石粉未等粉未状物质制取CO2
该反应的化学方程式为:
Na2CO3 + 2HCl = 2NaCl + H2O + CO2
我们通过下面三个对比实验进行探究
注意观察反应现象,并分析原因,然后填写下表
二、实验室制取CO2的药品和反应原理:
实验2:大理石(或石灰石)与稀硫酸反应
刚开始有大量气泡产生,一时间后,气泡逐渐减少 ,反应逐渐停止。
现象
分析
结论
反应速率慢,不易收集 ,实验室制取二氧化碳能
不能用稀硫酸与大理石制取CO2
虽然该反应能生成二氧化碳:
CaCO3+H2SO4==CaSO4+H2O+CO2
注意:但生成的CaSO4微溶于水,覆盖在大理石表面,形成一层薄膜,使大理石与酸不能接触,反应难以进行。
现象
分析
结论
实验3:大理石(或石灰石)与稀盐酸反应
有大量气泡产生,大理石逐渐溶解
该反应在常温下进行,反应速度适中,便于控制。
大理石与稀盐酸反应生成了碳酸和氯化钙:
CaCO3 + 2HCl = CaCl2 + H2CO3
碳酸很不稳定,分解成水和二氧化碳:
H2CO3 = H2O + CO2
主要成分:
碳酸钙CaCO3
产生气泡速率比较适中 ,适合实验室制取CO2
反应方程式:
总反应方程式为:
CaCO3+2HCl=CaCl2+H2CO3
+)
H2CO3=H2O+CO2↑
CaCO3+2HCl=CaCl2+ H2O + CO2↑
1、实验室制取二氧化碳药品
主要成分:
碳酸钙CaCO3
总体思路是:装置简单操作易行。
其具体思路是:
2、实验室制取二氧化碳的装置
.确定发生装置:
反应物:
大理石(或石灰石)
稀盐酸
固态
液态
反应条件:
常温下进行
发生装置
二氧化碳的多种发生装置
分
液
漏
斗
长颈漏斗
随时添加液体
控制反应速率
关闭弹簧夹,试管内
气压增大,液面下降,
长颈漏斗中液面上升,
固液分离,反应停止。
适用于块状固体与
液体间的反应
控制反应的
发生和停止
节约药品
我们能创新
破底试管
不足
加一加
随开随停,控制反应的开始和结束
.确定收集装置
生成物:
CaCl2
CO2
H2O
气体
在标准状况下,CO2的密度比空气的密度大,二氧化碳能溶于水,在通常状况下,1体积水中能溶解1体积的二氧化碳。
CO2的性质:
收集装置
植物油
水
制取二氧化碳的总装置
长颈漏斗下端应插到液面以下
导管只需突出胶塞少许
导管口应插到集气瓶底
课堂练习1
下图为实验室制取二氧化碳的装置图,有哪些错误?为什么?请改正?
长颈漏斗没有
插入液面下
出气导管太长,
伸入了液面下
没有用向上排
空气法收集
3、实验步骤:
.连接仪器
.检查气密性
导管一端放入水中,用手紧握试管,导管口有气泡冒出,松开手后,导管口形成一段稳定的水柱,说明装置不漏气。
夹紧弹簧夹,向长颈漏斗中加水至漏斗颈中形成一段水柱,如果一段时间后,水柱高度不变,说明装置的气密性良好。
加大理石
加稀盐酸
.加药品
收集气体并验满
正放
检验气体:
澄清石灰水
变浑浊
检验
验满
将燃着的 木条放在集气瓶口,火焰熄灭 ,证明二氧化碳已收集满。
①长颈漏斗的下端管口应 以
下形成 ,
防止 。
②反应器内的导管 即可,不宜 ,
否则 。
③实验室制取二氧化碳 加热;
④集气瓶内的导管应伸入到 ,
目的是 。
伸入液面
液封
气体从长颈漏斗口逸出
稍露出橡皮塞
过长
不利于气体的排出和收集
不需要
接近集气瓶底
排尽集气瓶中的空气
实验室制取二氧化碳装置如图所示:
【交流讨论】
三、工业制法
高温煅烧石灰石(主要成分:碳酸钙)
制得生石灰,同时产生副产品二氧化碳。
CaCO3 CaO + CO2
高温
千锤万凿出深山,
烈火焚烧若等闲。
粉骨碎身浑不怕,
要留清白在人间。
《石灰吟·于谦》
本课题小结:
二氧化碳实验室制法
1、反应的药品
2、反应的原理
3、装置图
4、验满方法
5、检验方法
大理石(或石灰石)和稀盐酸
CaCO3+2HCl=CaCl2+H2O+CO2↑
将燃着的木条伸到集气瓶口,木条熄灭,则说明集满。
将气体通入澄清的石灰水,石灰水
变浑浊,证明生成的气体是CO2。
比较氧气、二氧化碳的实验室制取
氧气
二氧化碳
CaCO3+2HCl CaCl2+H2O+CO2↑
检验氧气:
(用带火星的木条)
使带火星的木条复燃
检验二氧化碳:
(用澄清石灰水)
使澄清的石灰水变浑浊
2H2O2 2H2O+O2
MnO2
2KMnO4 K2MnO4+MnO2+O2
1、实验室制取二氧化碳部分操作如图所示,其中错误的是( )
A.检查气密性 B.仪器连接 C.加入药品 D.收集气体
C
习题
2、下列有关实验室制取二氧化碳气体的操作图示正确的是( )
A.导管连接 B.胶塞塞紧 C.气体验满 D.气体收集
A
3. 硫化氢是没有颜色,有臭鸡蛋气味的有剧毒气体。它的密度比空气略大,能溶于水,1体积水能溶解2.6体积的硫化氢,溶于水形成氢硫酸。
硫化氢是一种可燃性气体,
2H2S+3O2===2H2O+2SO2
实验室里常用块状固体硫化亚铁(FeS)与稀硫酸反应来制取。
(1)实验室制取硫化氢的发生装置可用
(2)收集应用
(3)为了防止多余的气体逸出污染环境,
可将其通入 中。
点燃
二氧化碳
向上排空气法
水
4、下图是实验室制备CO2的装置图。该装置的特点是:打开弹簧夹,大理石和盐酸接触,发生反应。关闭弹簧夹后,盐酸被反应产生的CO2气体压回长颈漏斗,与大理石分离,停止反应。
优点:随开随用、随关随停
使用该装置的要求:块状固体和液体的反应
下面装置中,哪些可以产生与上述装置相同的效果 (填写编号)
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
