课题3 金属资源的利用和保护(课件48页)
文档属性
| 名称 | 课题3 金属资源的利用和保护(课件48页) |  | |
| 格式 | pptx | ||
| 文件大小 | 10.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-21 21:45:27 | ||
图片预览










文档简介
(共48张PPT)
第八单元 金属和金属材料
课题3 金属资源的利用和保护
学习定位
学习目标
人类生活离不开金属
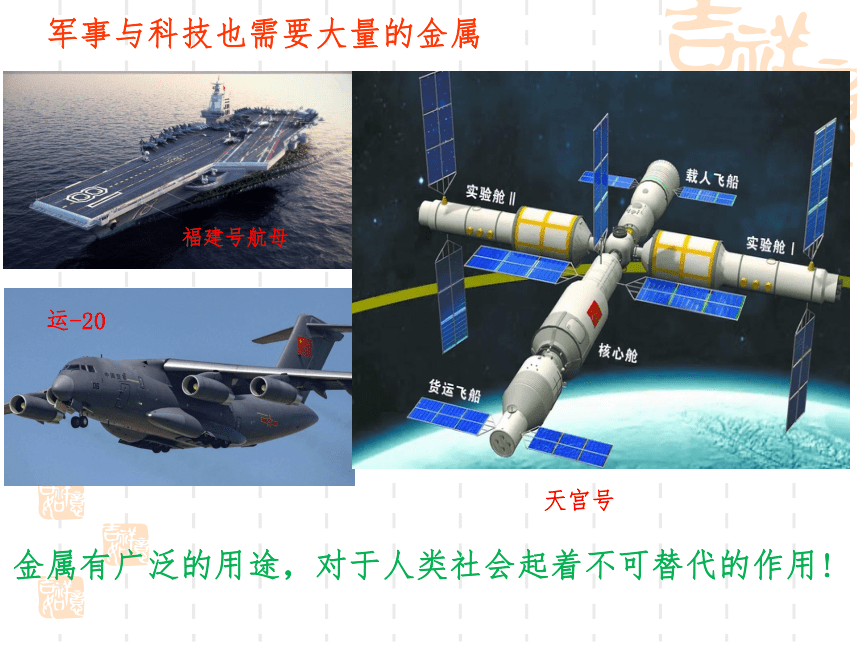
金属有广泛的用途,对于人类社会起着不可替代的作用!
军事与科技也需要大量的金属
福建号航母
运-20
天宫号
一.金属元素在自然界中的存在
自然界单质金 Au
自然界单质银Ag
沙里淘金 Au
自然界单质铂 Pt
金属元素在自然界中分布很广,广泛存在于地壳、海洋,极少数不活泼的金属(如金、银等)有单质形式存在;
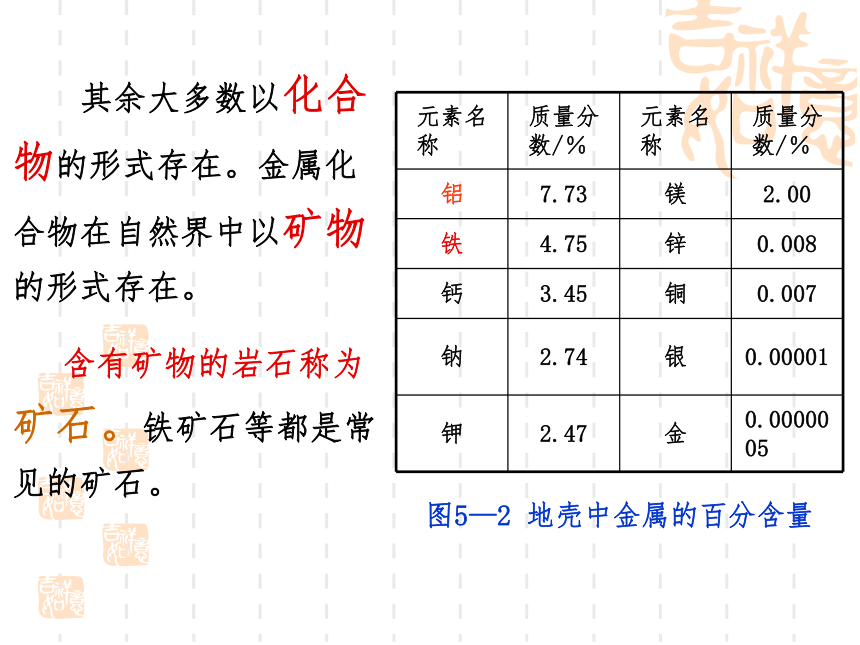
图5—2 地壳中金属的百分含量
含有矿物的岩石称为矿石。铁矿石等都是常见的矿石。
其余大多数以化合物的形式存在。金属化合物在自然界中以矿物的形式存在。
元素名称 质量分数/% 元素名称 质量分数/%
铝 7.73 镁 2.00
铁 4.75 锌 0.008
钙 3.45 铜 0.007
钠 2.74 银 0.00001
钾 2.47 金 0.0000005
赤铁矿 Fe2O3
黄铁矿FeS2
菱铁矿FeCO3
磁铁矿(主要成分Fe3O4)
常见的铁矿石
孔雀石 Cu2(OH)2CO3
赤铜矿 Cu2O
常
见
的
铜
矿
石
黄铜矿(CuFeS2 )
辉铜矿(Cu2S)
罕见的铜矿石
毛赤铜矿(Cu2O )
其它矿石
金红石(TiO2)
闪锌矿( ZnS )
铝土矿(Al2O3)
明矾石KAl(SO4)·12H2O
我国是世界上已知矿物种类比较齐全的少数国家这一,矿物储量也很丰富,其中钨、钼、钛、锡、锑等储量居世界前列,铜、铝、锰等储量在世界观上也占有重要地位。
大自然向人类提供了丰富的金属矿物资源,人类每年要提炼数以亿吨计的金属用于工农业生产和其它领域。其中,提取量最大的是铁.。
拓展延伸
1.金属材料被开发利用的早晚与________________有关。
2.金属的存在形式与其________________有关。
金属活动性顺序
金属活动性顺序
K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au
金属活动性顺序
为纪念1996年中国钢产产量突破1亿吨而发行的邮票
上海宝山钢铁公司炼铁高炉
图8-19 我国古代炼铁图
二、铁的冶炼(实验室与工业)
含铁量70%
赤铁矿
主要成分
Fe2O3
含铁量72.4%
磁铁矿
主要成分
Fe3O4
含铁量48.3%
菱铁矿
主要成分
FeCO3
含铁量46.7%
黄铁矿
主要成分
FeS2
以下哪种矿物不适宜用来炼铁?
含铁量
产物是否环保
铁的几种矿物:
选择依据:
H2
Fe2O3
Fe3O4
化合物
单质
Fe
发生氧化反应
失去氧元素
(氧化剂)
发生还原反应
C
CO
夺取氧元素
(还原剂)
1、实验室用CO还原Fe2O3
实验步骤:
2、把少量研细的氧化铁粉末装进硬质玻璃管中。
5、通入CO:
1、按下图组装仪器,并检查其气密性,并对CO验纯。
3、点燃后面的酒精灯:
点燃未参加反应的CO,防止其污染空气
排除装置内的空气,防止CO与空气混合受热爆炸。
现象:红色粉末变成黑色,澄清的石灰水变浑浊,。点燃尾气有蓝色火焰
相关的化学方程式:
CO2 + Ca(OH)2 CaCO3↓+ H2O
Fe2O3 + 3CO 2Fe + 3CO2
高温
2CO + O2 2CO2
点燃
5、点燃酒精喷灯,并观察装置中所发生的现象
6、当红棕色粉末已转变成黑色后,
熄灭酒精喷灯,再通入一会儿CO,直至玻璃管冷却,最后熄灭后面的酒精灯。
用燃着酒精灯点燃尾气的作用是:
防止CO污染空气
7.合作交流:
怎样知道反应后生成了铁?
生成的铁可用磁铁来检验。
防止Fe被氧化,同时还可防止石灰水倒吸。
古代炼铁
现代炼铁高炉
2、工业炼铁
设备
炼铁高炉
原料
铁矿石、焦炭、石灰石、空气
C+O2 CO2
高温
CO2+C 2CO
高温
3CO+Fe2O3 2Fe+3CO2
高温
CaCO3+SiO2====CaSiO3 +CO2↑
高温
原理
石灰石作用
将矿石中的SiO2转变为炉渣
交流讨论
1.焦炭的作用是什么?
燃烧提供热量;生成还原剂CO
3.为什么出渣口在出铁口的上方?
滤渣的密度小于铁水
4.高炉炼铁得到的是纯铁吗?
是含杂质较多的生铁,属于铁合金
2.焦炭也具有还原性,为什么不直接用焦炭做还原剂?
焦炭是固体,与铁矿石接触不充分;
CO优点是气体还原剂具有流动性,能与矿石充分接触,
使反应更彻底。
在实际生产时,所用的原料或产物一般都含有杂质,在计算用料时和产量时,应考虑到杂质问题。
不纯物质、纯物质、纯度之间的关系:
列比例时,一定要用纯量。
3、含杂质计算:
m(纯) = m(不纯 )×纯度
纯度= ×100%
纯净物的质量
不纯物质的总质量
例题:用1000t含氧化铁(Fe2O3) 80%的赤铁矿石,理论上可炼含铁96%的生铁多少吨?
Fe2O3+3CO===2Fe + 3CO2
高温
解:1000t赤铁矿石中含氧化铁的质量为1000t×80%=800t。
设800t氧化铁理论上可以炼出铁的质量为X。
160 112
800t X
160
112
=
800t
X
X=560t
折合含铁96%的生铁的质量为560t÷ 96%=583t(纯化杂)
答:1000t含氧化铁(Fe2O3) 80%的赤铁矿石,理论上可炼出含铁96%的生铁为583t。
或设800t氧化铁理论上可以炼含铁96%的生铁质量为X。
Fe2O3+3CO===2Fe + 3CO2
高温
160 112
800t 96%X
160 :112=800t :96%X X=583t
(杂化纯)
⑵设需含Fe2O3质量分数为85%的赤铁矿石的质量为x。
解:⑴生铁中含纯铁:3000t×(1-5%)=2850t.
Fe2O3 + 3CO === 2Fe + 3CO2
160 112
85%X 2850t
高温
160
112
=
85%X
2850t
X≈4790t
答:⑴该3000 t生铁中含纯铁2850t。
⑵该炼钢厂每天需含Fe2O3质量分数为85%的赤铁矿石为4790t。
1.某炼钢厂日产含杂质5%的生铁3000t,试计算:
⑴该3000 t生铁中含纯铁多少吨?
⑵该炼钢厂每天需含Fe2O3质量分数为85%的赤铁矿石多
少吨?(计算结果保留整数)
2.下图是课堂中模拟炼铁的实验装置。
(1)写出图中标有序号的仪器名称① ,② 。
(2)实验过程中,先要进行的是__________ 。(填Ⅰ或Ⅱ)
Ⅰ.加热 Ⅱ.通一氧化碳
(3)A中反应的化学方程式是_____________________________
B中反应的化学方程式是________________________________
B中观察到的现象是_______________ 。
(4)该装置的不足之处是________________________________
铁架台
试管
Ⅱ
Fe2O3+3CO === 2Fe+3CO2
高温
没有尾气处理装置
Ca(OH)2+CO2===CaCO3↓+H2O
澄清的石灰水变浑浊
①
②
课堂小结
1.金属资源的概况
2. 铁的冶炼
①炼铁的原理:
②工业炼铁设备:炼铁高炉
③工业炼铁原料:铁矿石、焦炭、石灰石
3.有关含杂质物质的计算
3CO+Fe2O3 2Fe+3CO2
高温
每年大量开采(数以亿吨计),据有关资料报道,世界上每年因腐蚀而报废的金属设备和材料相当于年产量的 20%~40%。
金属锈蚀给人类带来了巨大的损失,为了减少损失,需要探究金属锈蚀的原因、防护的方法和废金属的回收利用?
铜生锈
三、金属资源保护
探究:铁制品生锈的条件
植物油
铁钉只与
水接触
铁钉与空气
和水接触
棉花和干燥剂
铁钉只与空气接触
现有洁净无锈的铁钉、试管、经煮沸迅速冷却的蒸馏水、植物油、食盐业、棉花和干燥剂氯化钙。试设计实验以证明铁制品锈蚀的条件。
1、金属的腐蚀和防护
铁钉与空气
和食盐水接触
食盐水
①
②
③
④
① ② ③ ④
立即观察
1周后观察
结论 无现象
无现象
无现象
无现象
无现象
无现象
整个铁钉已
严重锈蚀
部分铁钉变成一堆红棕色的铁锈粉末,沉在试管底
①
②
③
铁钉与氧气和水同时接触易生锈,铁锈属于混合物,主要成分是Fe2O3·xH2O)很疏松。
铁钉与食盐等盐类物质接触时,铁生锈速度会加快
思考与交流
(3)为什么铁制品易生锈且可以全部锈蚀,而铝制品不易生锈?
(1)蒸馏水为何要经煮沸并迅速冷却?
铝与氧气反应生成的致密的氧化铝薄膜,能覆盖在铝表面,从而保护里层的铝不再与氧气反应,使铝“自我保护”;而铁与氧气、水等反应生成的铁锈(主要成分是Fe2O3·xH2O)很疏松,不能阻碍里层的铁继续与氧气、水等反应,因此铁制品可以被全部锈蚀。
除去蒸馏水里溶解的氧气,并防止氧气再溶于水。
(2)实验②在水面上加一层植物油的目的是什么?
隔绝氧气
(4)其它影响因素:温度、盐等
交流讨论
如何除去铁制品表面的铁锈呢?
物理方法
化学方法
砂纸打磨
高压水冲
酸洗法
铁锈能与稀盐酸或稀硫酸发生反应生成可溶性的物质,所以可用稀盐酸或稀硫酸除去铁锈
1.为什么铁粉既能做食品脱氧剂,又能做食品干燥剂?
铁能与空气中的水和氧气反应,
从而起到了脱氧和干燥的作用。
拓展延伸
2.铜锈(铜绿)的成分是碱式碳酸铜[Cu2(OH)2CO3],可推断铜生锈的过程是铜与空气中的O2、H2O和_____发生反应。发生反应的化学方程式为___________________________________。
CO2
2Cu + H2O + CO2 + O2= Cu2(OH)2CO3
Cu2(OH)2CO3 = 2CuO + H2O + CO2↑
铜锈不稳定,受热易分解
弊
利用铁粉缓慢氧化放热如制成暖宝宝
利用铁生锈吸收O2和H2O制成铁粉双吸剂
铁生锈造成钢铁浪费
2.防止金属腐蚀的措施(原理:隔绝_________。)
(1)保持铁制品表面干燥
(2)覆盖保护层(喷漆、涂油、电镀)
(3)改变金属结构(制成不锈钢)
氧气和水
刷漆
保持干燥
涂油
不锈钢
电镀
烤蓝
⑴三角架:
⑵钢线(辐条):
⑷链条:
刷漆
镀一层耐腐蚀的金属
涂油等
平时要保持自行车的洁净与干燥(或涂油)!
自行车防锈措施有哪些?
讨论:
⑶钢圈:
图8-25 据估计一些矿物可供开采的年限
①、为什么要保护金属资源?
矿物的储量是有限的,而且不能再生。
2.金属资源保护
②、怎样保护金属资源呢
⑴、防止金属的腐蚀。
⑵、金属的回收与利用。
据估算,回收一个铝制饮料罐比制造一个新饮料罐要便宜20%,而且还可节约金属资源和95%的能源。
废旧电池中含有铅、镍、镉、汞等,若随意丢弃,危害很大。
回收利用,不仅可以节约金属资源,而且可以减少对环境的污染
⑶、有计划,合理地开采矿物,严禁不顾国家利益的乱采矿。
⑷、寻找金属代用品;如以塑代钢。
3CO+ Fe2O3 2Fe + 3CO2 ;
====
高温
1.把铁矿石冶炼成铁是一个复杂的过程,其主要反应原理是在高温条件下CO作还原剂,夺取铁矿石里的氧,将铁还原出来。
2.在实际生产时,所用的原料或产物一般都含有杂质,在计算用料时和产量时,应考虑到杂质问题。
3.铁生锈的条件是铁与空气中的氧气、水(或水蒸气)直接接触,如果隔绝了空气和水,就能在一定程度上防止钢铁生锈。在铁表面涂油、刷漆、镀上耐磨和 耐腐蚀的铬及制造耐腐蚀的合金,如不锈钢等,就能防止钢铁生锈。
4. 保护金属资源的有效途径是防止金属的腐蚀、回收与利用废旧金属、合理有效地地开采矿物,以及寻找金属代用品等。
列比例时,一定要用纯量。
m(纯) = m(不纯 )×纯度
4Fe+3O2+2XH2O=2Fe2O3 · XH2O
小结
反馈练习
1.在下列情况下,埋在地下的铸铁管道腐蚀最快的是 ( )
A.在潮湿、致密的土壤中
B.在干燥、致密的土壤中
C.在潮湿、疏松的土壤中
D.在干燥、疏松的土壤中
2.某运输用铁船,在水中行驶,最易生锈的部位是( )
C
B
A.水面上的船头部分
B.水面附近的船体部分
C.水面下的船底部分
D.各部分都一样速度生锈
3.日常生活中的一些铁制品经常会被锈蚀。下列做法中不能起防锈作用的是( )
①在铁制品表面镀锌
②在铁制品表面涂油脂
③保留铁件表面的铁锈作保护层
④在铁器表面刷油漆
⑤自行车脏了用清水冲洗
⑥用废酸液冲洗铁制污水管道
⑦切完咸菜后,尽快将菜刀洗净擦干
A.②⑤ B.③⑤⑥
C.①③⑦ D.②⑥⑦
B
4.如图所示,在盛水的试管中加入一根洁净的铁钉用带U型管的胶塞塞紧,U型管内水面处于同一高度一周后观察铁钉和U型管内水面变化( )
A.铁钉未锈蚀,水面一样高
B.铁钉锈蚀,水面左低右高
C.铁钉锈蚀,水面左高右低
D.铁钉锈蚀,U型管内水从右边全部逸出
C
5.控制变量法是实验探究的重要方法。下列设计
方案探究目的不能实现的是( )
C
A
B
C
D
甲可探究可燃物的燃烧是否需要与氧气接触
甲可探究可燃物的燃烧是否需要达到一定温度
乙中①③对比可探究铁的锈蚀条件与氧气是否有关
乙中①②③对比可探究铁的锈蚀条件与氧气和水等物质是否有关
6.某同学根据铜锈的成分Cu2(OH)2CO3作出猜想:引起金属铜锈蚀的因素除有氧气和水外,还应该有二氧化碳。为证明“必须有二氧化碳”,需要进行下列实验中的( )
A.甲和乙 B.甲和丁 C.乙和丁 D.丙和丁
B
7.工业炼铁的部分反应如下所示,则( )
A.X可以是木炭
B.X与CO都具有氧化性
C.③反应后的尾气可直接排放
D.Y中铁元素以游离态存在
A
8.随着社会的不断发展,汽车已进入寻常百姓家,给我们日常出行带来了极大的方便。请按要求回答下列问题:
(1)如图所示的汽车各部件中,用到的金属材料有___________(只填一种,下同),用到的有机高分子材料有___________。
(2)汽车轮毂材料用铝合金而不用纯铝,其主要原因是___________;
(3)车身喷漆除保持汽车美观外,其主要作用是___________;
塑料保险杠
或橡胶轮胎
铝合金的强度和硬度比纯铝高
防止车身锈蚀
铝合金轮毂
第八单元 金属和金属材料
课题3 金属资源的利用和保护
学习定位
学习目标
人类生活离不开金属
金属有广泛的用途,对于人类社会起着不可替代的作用!
军事与科技也需要大量的金属
福建号航母
运-20
天宫号
一.金属元素在自然界中的存在
自然界单质金 Au
自然界单质银Ag
沙里淘金 Au
自然界单质铂 Pt
金属元素在自然界中分布很广,广泛存在于地壳、海洋,极少数不活泼的金属(如金、银等)有单质形式存在;
图5—2 地壳中金属的百分含量
含有矿物的岩石称为矿石。铁矿石等都是常见的矿石。
其余大多数以化合物的形式存在。金属化合物在自然界中以矿物的形式存在。
元素名称 质量分数/% 元素名称 质量分数/%
铝 7.73 镁 2.00
铁 4.75 锌 0.008
钙 3.45 铜 0.007
钠 2.74 银 0.00001
钾 2.47 金 0.0000005
赤铁矿 Fe2O3
黄铁矿FeS2
菱铁矿FeCO3
磁铁矿(主要成分Fe3O4)
常见的铁矿石
孔雀石 Cu2(OH)2CO3
赤铜矿 Cu2O
常
见
的
铜
矿
石
黄铜矿(CuFeS2 )
辉铜矿(Cu2S)
罕见的铜矿石
毛赤铜矿(Cu2O )
其它矿石
金红石(TiO2)
闪锌矿( ZnS )
铝土矿(Al2O3)
明矾石KAl(SO4)·12H2O
我国是世界上已知矿物种类比较齐全的少数国家这一,矿物储量也很丰富,其中钨、钼、钛、锡、锑等储量居世界前列,铜、铝、锰等储量在世界观上也占有重要地位。
大自然向人类提供了丰富的金属矿物资源,人类每年要提炼数以亿吨计的金属用于工农业生产和其它领域。其中,提取量最大的是铁.。
拓展延伸
1.金属材料被开发利用的早晚与________________有关。
2.金属的存在形式与其________________有关。
金属活动性顺序
金属活动性顺序
K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au
金属活动性顺序
为纪念1996年中国钢产产量突破1亿吨而发行的邮票
上海宝山钢铁公司炼铁高炉
图8-19 我国古代炼铁图
二、铁的冶炼(实验室与工业)
含铁量70%
赤铁矿
主要成分
Fe2O3
含铁量72.4%
磁铁矿
主要成分
Fe3O4
含铁量48.3%
菱铁矿
主要成分
FeCO3
含铁量46.7%
黄铁矿
主要成分
FeS2
以下哪种矿物不适宜用来炼铁?
含铁量
产物是否环保
铁的几种矿物:
选择依据:
H2
Fe2O3
Fe3O4
化合物
单质
Fe
发生氧化反应
失去氧元素
(氧化剂)
发生还原反应
C
CO
夺取氧元素
(还原剂)
1、实验室用CO还原Fe2O3
实验步骤:
2、把少量研细的氧化铁粉末装进硬质玻璃管中。
5、通入CO:
1、按下图组装仪器,并检查其气密性,并对CO验纯。
3、点燃后面的酒精灯:
点燃未参加反应的CO,防止其污染空气
排除装置内的空气,防止CO与空气混合受热爆炸。
现象:红色粉末变成黑色,澄清的石灰水变浑浊,。点燃尾气有蓝色火焰
相关的化学方程式:
CO2 + Ca(OH)2 CaCO3↓+ H2O
Fe2O3 + 3CO 2Fe + 3CO2
高温
2CO + O2 2CO2
点燃
5、点燃酒精喷灯,并观察装置中所发生的现象
6、当红棕色粉末已转变成黑色后,
熄灭酒精喷灯,再通入一会儿CO,直至玻璃管冷却,最后熄灭后面的酒精灯。
用燃着酒精灯点燃尾气的作用是:
防止CO污染空气
7.合作交流:
怎样知道反应后生成了铁?
生成的铁可用磁铁来检验。
防止Fe被氧化,同时还可防止石灰水倒吸。
古代炼铁
现代炼铁高炉
2、工业炼铁
设备
炼铁高炉
原料
铁矿石、焦炭、石灰石、空气
C+O2 CO2
高温
CO2+C 2CO
高温
3CO+Fe2O3 2Fe+3CO2
高温
CaCO3+SiO2====CaSiO3 +CO2↑
高温
原理
石灰石作用
将矿石中的SiO2转变为炉渣
交流讨论
1.焦炭的作用是什么?
燃烧提供热量;生成还原剂CO
3.为什么出渣口在出铁口的上方?
滤渣的密度小于铁水
4.高炉炼铁得到的是纯铁吗?
是含杂质较多的生铁,属于铁合金
2.焦炭也具有还原性,为什么不直接用焦炭做还原剂?
焦炭是固体,与铁矿石接触不充分;
CO优点是气体还原剂具有流动性,能与矿石充分接触,
使反应更彻底。
在实际生产时,所用的原料或产物一般都含有杂质,在计算用料时和产量时,应考虑到杂质问题。
不纯物质、纯物质、纯度之间的关系:
列比例时,一定要用纯量。
3、含杂质计算:
m(纯) = m(不纯 )×纯度
纯度= ×100%
纯净物的质量
不纯物质的总质量
例题:用1000t含氧化铁(Fe2O3) 80%的赤铁矿石,理论上可炼含铁96%的生铁多少吨?
Fe2O3+3CO===2Fe + 3CO2
高温
解:1000t赤铁矿石中含氧化铁的质量为1000t×80%=800t。
设800t氧化铁理论上可以炼出铁的质量为X。
160 112
800t X
160
112
=
800t
X
X=560t
折合含铁96%的生铁的质量为560t÷ 96%=583t(纯化杂)
答:1000t含氧化铁(Fe2O3) 80%的赤铁矿石,理论上可炼出含铁96%的生铁为583t。
或设800t氧化铁理论上可以炼含铁96%的生铁质量为X。
Fe2O3+3CO===2Fe + 3CO2
高温
160 112
800t 96%X
160 :112=800t :96%X X=583t
(杂化纯)
⑵设需含Fe2O3质量分数为85%的赤铁矿石的质量为x。
解:⑴生铁中含纯铁:3000t×(1-5%)=2850t.
Fe2O3 + 3CO === 2Fe + 3CO2
160 112
85%X 2850t
高温
160
112
=
85%X
2850t
X≈4790t
答:⑴该3000 t生铁中含纯铁2850t。
⑵该炼钢厂每天需含Fe2O3质量分数为85%的赤铁矿石为4790t。
1.某炼钢厂日产含杂质5%的生铁3000t,试计算:
⑴该3000 t生铁中含纯铁多少吨?
⑵该炼钢厂每天需含Fe2O3质量分数为85%的赤铁矿石多
少吨?(计算结果保留整数)
2.下图是课堂中模拟炼铁的实验装置。
(1)写出图中标有序号的仪器名称① ,② 。
(2)实验过程中,先要进行的是__________ 。(填Ⅰ或Ⅱ)
Ⅰ.加热 Ⅱ.通一氧化碳
(3)A中反应的化学方程式是_____________________________
B中反应的化学方程式是________________________________
B中观察到的现象是_______________ 。
(4)该装置的不足之处是________________________________
铁架台
试管
Ⅱ
Fe2O3+3CO === 2Fe+3CO2
高温
没有尾气处理装置
Ca(OH)2+CO2===CaCO3↓+H2O
澄清的石灰水变浑浊
①
②
课堂小结
1.金属资源的概况
2. 铁的冶炼
①炼铁的原理:
②工业炼铁设备:炼铁高炉
③工业炼铁原料:铁矿石、焦炭、石灰石
3.有关含杂质物质的计算
3CO+Fe2O3 2Fe+3CO2
高温
每年大量开采(数以亿吨计),据有关资料报道,世界上每年因腐蚀而报废的金属设备和材料相当于年产量的 20%~40%。
金属锈蚀给人类带来了巨大的损失,为了减少损失,需要探究金属锈蚀的原因、防护的方法和废金属的回收利用?
铜生锈
三、金属资源保护
探究:铁制品生锈的条件
植物油
铁钉只与
水接触
铁钉与空气
和水接触
棉花和干燥剂
铁钉只与空气接触
现有洁净无锈的铁钉、试管、经煮沸迅速冷却的蒸馏水、植物油、食盐业、棉花和干燥剂氯化钙。试设计实验以证明铁制品锈蚀的条件。
1、金属的腐蚀和防护
铁钉与空气
和食盐水接触
食盐水
①
②
③
④
① ② ③ ④
立即观察
1周后观察
结论 无现象
无现象
无现象
无现象
无现象
无现象
整个铁钉已
严重锈蚀
部分铁钉变成一堆红棕色的铁锈粉末,沉在试管底
①
②
③
铁钉与氧气和水同时接触易生锈,铁锈属于混合物,主要成分是Fe2O3·xH2O)很疏松。
铁钉与食盐等盐类物质接触时,铁生锈速度会加快
思考与交流
(3)为什么铁制品易生锈且可以全部锈蚀,而铝制品不易生锈?
(1)蒸馏水为何要经煮沸并迅速冷却?
铝与氧气反应生成的致密的氧化铝薄膜,能覆盖在铝表面,从而保护里层的铝不再与氧气反应,使铝“自我保护”;而铁与氧气、水等反应生成的铁锈(主要成分是Fe2O3·xH2O)很疏松,不能阻碍里层的铁继续与氧气、水等反应,因此铁制品可以被全部锈蚀。
除去蒸馏水里溶解的氧气,并防止氧气再溶于水。
(2)实验②在水面上加一层植物油的目的是什么?
隔绝氧气
(4)其它影响因素:温度、盐等
交流讨论
如何除去铁制品表面的铁锈呢?
物理方法
化学方法
砂纸打磨
高压水冲
酸洗法
铁锈能与稀盐酸或稀硫酸发生反应生成可溶性的物质,所以可用稀盐酸或稀硫酸除去铁锈
1.为什么铁粉既能做食品脱氧剂,又能做食品干燥剂?
铁能与空气中的水和氧气反应,
从而起到了脱氧和干燥的作用。
拓展延伸
2.铜锈(铜绿)的成分是碱式碳酸铜[Cu2(OH)2CO3],可推断铜生锈的过程是铜与空气中的O2、H2O和_____发生反应。发生反应的化学方程式为___________________________________。
CO2
2Cu + H2O + CO2 + O2= Cu2(OH)2CO3
Cu2(OH)2CO3 = 2CuO + H2O + CO2↑
铜锈不稳定,受热易分解
弊
利用铁粉缓慢氧化放热如制成暖宝宝
利用铁生锈吸收O2和H2O制成铁粉双吸剂
铁生锈造成钢铁浪费
2.防止金属腐蚀的措施(原理:隔绝_________。)
(1)保持铁制品表面干燥
(2)覆盖保护层(喷漆、涂油、电镀)
(3)改变金属结构(制成不锈钢)
氧气和水
刷漆
保持干燥
涂油
不锈钢
电镀
烤蓝
⑴三角架:
⑵钢线(辐条):
⑷链条:
刷漆
镀一层耐腐蚀的金属
涂油等
平时要保持自行车的洁净与干燥(或涂油)!
自行车防锈措施有哪些?
讨论:
⑶钢圈:
图8-25 据估计一些矿物可供开采的年限
①、为什么要保护金属资源?
矿物的储量是有限的,而且不能再生。
2.金属资源保护
②、怎样保护金属资源呢
⑴、防止金属的腐蚀。
⑵、金属的回收与利用。
据估算,回收一个铝制饮料罐比制造一个新饮料罐要便宜20%,而且还可节约金属资源和95%的能源。
废旧电池中含有铅、镍、镉、汞等,若随意丢弃,危害很大。
回收利用,不仅可以节约金属资源,而且可以减少对环境的污染
⑶、有计划,合理地开采矿物,严禁不顾国家利益的乱采矿。
⑷、寻找金属代用品;如以塑代钢。
3CO+ Fe2O3 2Fe + 3CO2 ;
====
高温
1.把铁矿石冶炼成铁是一个复杂的过程,其主要反应原理是在高温条件下CO作还原剂,夺取铁矿石里的氧,将铁还原出来。
2.在实际生产时,所用的原料或产物一般都含有杂质,在计算用料时和产量时,应考虑到杂质问题。
3.铁生锈的条件是铁与空气中的氧气、水(或水蒸气)直接接触,如果隔绝了空气和水,就能在一定程度上防止钢铁生锈。在铁表面涂油、刷漆、镀上耐磨和 耐腐蚀的铬及制造耐腐蚀的合金,如不锈钢等,就能防止钢铁生锈。
4. 保护金属资源的有效途径是防止金属的腐蚀、回收与利用废旧金属、合理有效地地开采矿物,以及寻找金属代用品等。
列比例时,一定要用纯量。
m(纯) = m(不纯 )×纯度
4Fe+3O2+2XH2O=2Fe2O3 · XH2O
小结
反馈练习
1.在下列情况下,埋在地下的铸铁管道腐蚀最快的是 ( )
A.在潮湿、致密的土壤中
B.在干燥、致密的土壤中
C.在潮湿、疏松的土壤中
D.在干燥、疏松的土壤中
2.某运输用铁船,在水中行驶,最易生锈的部位是( )
C
B
A.水面上的船头部分
B.水面附近的船体部分
C.水面下的船底部分
D.各部分都一样速度生锈
3.日常生活中的一些铁制品经常会被锈蚀。下列做法中不能起防锈作用的是( )
①在铁制品表面镀锌
②在铁制品表面涂油脂
③保留铁件表面的铁锈作保护层
④在铁器表面刷油漆
⑤自行车脏了用清水冲洗
⑥用废酸液冲洗铁制污水管道
⑦切完咸菜后,尽快将菜刀洗净擦干
A.②⑤ B.③⑤⑥
C.①③⑦ D.②⑥⑦
B
4.如图所示,在盛水的试管中加入一根洁净的铁钉用带U型管的胶塞塞紧,U型管内水面处于同一高度一周后观察铁钉和U型管内水面变化( )
A.铁钉未锈蚀,水面一样高
B.铁钉锈蚀,水面左低右高
C.铁钉锈蚀,水面左高右低
D.铁钉锈蚀,U型管内水从右边全部逸出
C
5.控制变量法是实验探究的重要方法。下列设计
方案探究目的不能实现的是( )
C
A
B
C
D
甲可探究可燃物的燃烧是否需要与氧气接触
甲可探究可燃物的燃烧是否需要达到一定温度
乙中①③对比可探究铁的锈蚀条件与氧气是否有关
乙中①②③对比可探究铁的锈蚀条件与氧气和水等物质是否有关
6.某同学根据铜锈的成分Cu2(OH)2CO3作出猜想:引起金属铜锈蚀的因素除有氧气和水外,还应该有二氧化碳。为证明“必须有二氧化碳”,需要进行下列实验中的( )
A.甲和乙 B.甲和丁 C.乙和丁 D.丙和丁
B
7.工业炼铁的部分反应如下所示,则( )
A.X可以是木炭
B.X与CO都具有氧化性
C.③反应后的尾气可直接排放
D.Y中铁元素以游离态存在
A
8.随着社会的不断发展,汽车已进入寻常百姓家,给我们日常出行带来了极大的方便。请按要求回答下列问题:
(1)如图所示的汽车各部件中,用到的金属材料有___________(只填一种,下同),用到的有机高分子材料有___________。
(2)汽车轮毂材料用铝合金而不用纯铝,其主要原因是___________;
(3)车身喷漆除保持汽车美观外,其主要作用是___________;
塑料保险杠
或橡胶轮胎
铝合金的强度和硬度比纯铝高
防止车身锈蚀
铝合金轮毂
同课章节目录
