高中化学人教版(2019)必修第二册第六章第二节《化学反应的速率与限度》第二课时教学设计
文档属性
| 名称 | 高中化学人教版(2019)必修第二册第六章第二节《化学反应的速率与限度》第二课时教学设计 |

|
|
| 格式 | zip | ||
| 文件大小 | 781.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-21 20:31:12 | ||
图片预览



文档简介
人教版高中化学必修二
《化学反应的速率与限度》第二课时 教学设计
课题名 《化学反应的速率与限度》第二课时
教学目标 1.掌握影响化学反应速率的因素。 2.体会变量控制探究影响化学反应速率因素。
教学重点 影响化学反应速率的因素。
教学难点 实验探究影响化学反应速率的因素。
教学准备 教师准备:PPT 学生准备:预习课本
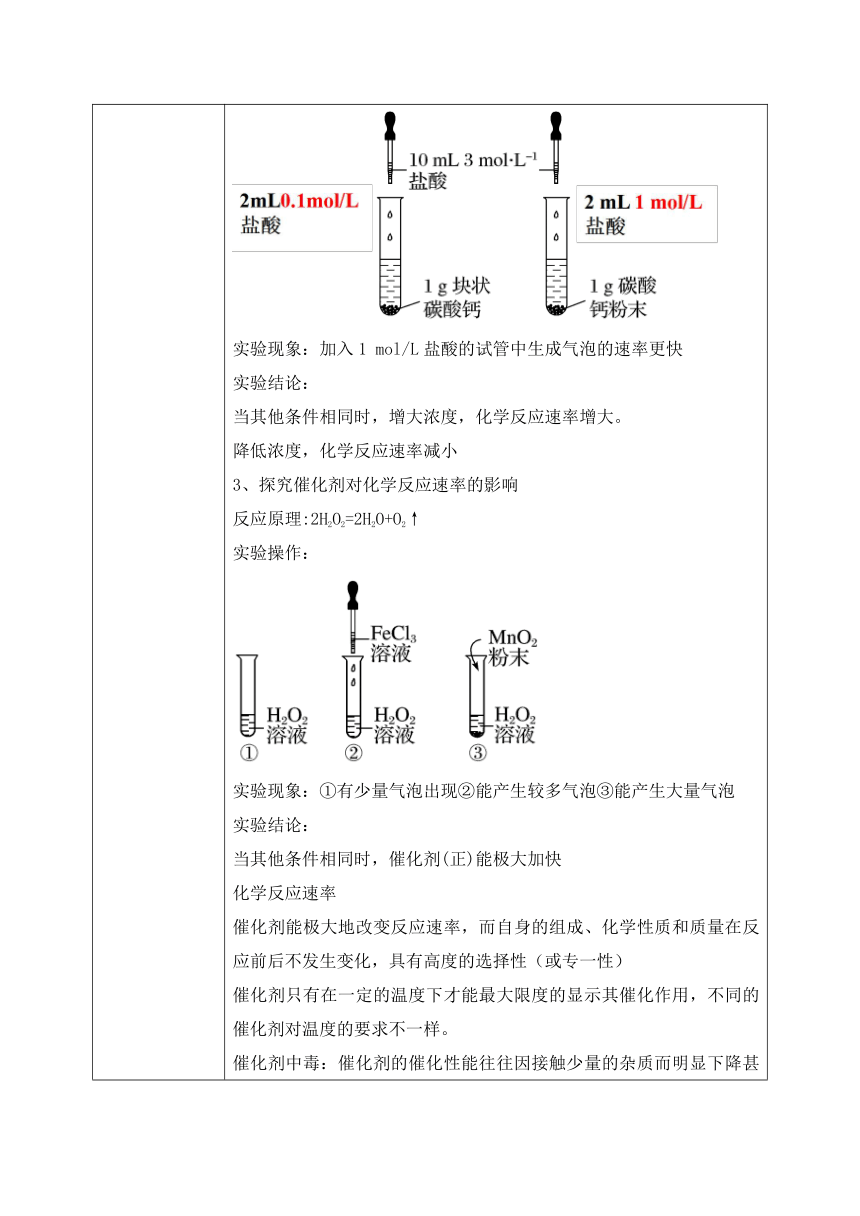
教学过程 新课导入 【思考与讨论】 对于下列反应,你是希望其反应速率越快越好还是越慢越好? ■钢铁腐蚀 ■ 食物腐坏 ■ 炼钢 ■ 合成氨 调控化学反应速率常常是决定化学实验成败或化工生产成本的关键 有哪些因素能够影响化学反应速率呢? 【设计意图】 从日常生活中的调控化学反应速率常引入影响化学反应速率的因素的学习。 新课讲授 二、影响化学反应速率的因素: 内因:反应物的性质 决定因素 外因:外界条件 温度、浓度、压强、催化剂、接触面积等 研究某一具体反应,内因已定,研究外因很重要,是我们本节课重点探究的内容 讨论:探究外界条件对化学反应速率的影响时,我们可以借助哪些实验现象比较反应的快慢? 要求:可以利用具体反应说明 怎样定性地比较和判断反应的快慢? ①冒气泡快慢 ②颜色变化③固体量减少④浑浊程度⑤温度变化等 变量控制探究影响化学反应速率因素的一般原则是“定多变一”,即要保持其他变量不变,改变其中一个变量的值进行实验,测定数据,通过系列实验,找出变量对反应速率的影响。其探究流程为 【探究实验】 实验用品:3%H2O2溶液、1mol/LFeCl3溶液、MnO2粉末、0.1mol/L盐酸、1mol/L盐酸、碳酸钙粉末、块状碳酸钙 试管、量筒、药匙、镊子、胶头滴管、冷水、热水、试管夹 1、探究温度对化学反应速率的影响 反应原理:2H2O2=2H2O+O2↑ 实验操作: 实验现象:热水中生成气泡的速率更快,冷水中生成气泡的速率变慢 实验结论: 当其他条件相同时,升高温度,化学反应速率增大。 降低温度,化学反应速率减小。 2、探究浓度对化学反应速率的影响 反应原理:CaCO3+2HCl=CaCO3+CO2↑+H2O 实验操作: 实验现象:加入1 mol/L盐酸的试管中生成气泡的速率更快 实验结论: 当其他条件相同时,增大浓度,化学反应速率增大。 降低浓度,化学反应速率减小 3、探究催化剂对化学反应速率的影响 反应原理:2H2O2=2H2O+O2↑ 实验操作: 实验现象:①有少量气泡出现②能产生较多气泡③能产生大量气泡 实验结论: 当其他条件相同时,催化剂(正)能极大加快 化学反应速率 催化剂能极大地改变反应速率,而自身的组成、化学性质和质量在反应前后不发生变化,具有高度的选择性(或专一性) 催化剂只有在一定的温度下才能最大限度的显示其催化作用,不同的催化剂对温度的要求不一样。 催化剂中毒:催化剂的催化性能往往因接触少量的杂质而明显下降甚至遭破坏,这种现象叫催化剂中毒。 4、固体反应物表面积对化学反应速率的影响 反应原理:CaCO3+2HCl=CaCO3+CO2↑+H2O 实验操作: 实验现象:加碳酸钙粉末的试管内产生气泡较快,加块状碳酸钙的试管内产生气泡较慢 实验结论: 其他条件相同时,固体反应物表面积越大, 反应速率越大 小结:影响化学反应速率的因素 内因:反应物或反应本身的性质或特点 外因: 温度:升高温度,化学反应速率增大;反之减小 注意:①温度对反应速率的影响不受反应物状态的限制。②若为可逆反应,正逆反应受温度的影响倾向相同,但程度不同③实验测得,温度每升高10度,化学反应速率通常增大原来的2~4倍。 浓度:增大浓度,化学反应速率增大;反之减小 注意:①纯液体或固体的浓度为常数无影响②对于可逆反应正逆反应都符合”浓快稀慢”的规律 催化剂:使用催化剂,化学反应速率增大 注意:催化剂能同等程度改变化学反应的速率。 其他:增大固体反应物的表面积,化学反应速率增大;反之减小 影响化学反应速率的外界因素除了浓度、温度、催化剂外,还有没有其他的因素? 为何工业合成氨,通常在2×107 ~ 5×107 Pa的压强下进行。 5、压强对化学反应速率的影响 结论:其他条件相同时,对于有气体参与的反应: 增大压强(减小容器容积)相当于增大反应物的浓度,化学反应速率增大; 减小压强(增大容器容积)相当于减小反应物的浓度,化学反应速率减小。 注意:①只对气体参与或生成的反应有影响 ②对于可逆反应,加压,正反应和逆反应速率都增大 ③改变压强的含义:引起浓度的变化 对于气体有下列几种情况: 1、恒温时:增大压强→体积减少→浓度增大→反应速率增大 2、恒容时:A、充入气体反应物→反应物浓度增大→总压增大→反应速率增大; B、充入“无关气体”(如He等)→引起总压增大,但各反应物的分压不变,各物质的浓度不变→反应速率不变 3、恒压时:充入“无关气体”(如He等)→引起体积增大,→各反应物浓度减少→反应速率减慢。 思考与交流: 1.块状CaCO3、粉末状CaCO3与0.1 mol/L的盐酸反应谁快谁慢?为什么? 增大固体表面积可以加快反应速率(接触充分) 2.实验室进行化学反应 时,常常把一些固体物质溶于水配成溶液再进行反应。为什么? 离子反应速率快,瞬间完成。固体物质溶于水后,发生了电离,离子在溶液里受水分子作用而运动,增大了离子之间的接触机会,提高了反应速率 其他影响因素:除温度、催化剂、溶液的浓度、气体的压强、固体的表面积外,反应物的状态、溶剂、光照、原电池、光波、电磁波、超声波等都可以影响化学反应速率。 实验活动7 实验目的:探究浓度、温度、催化剂对化学反应速率的影响 实验用品:烧杯、量筒、试管、恒温槽、胶头滴管、温度计、秒表。 0.1mol/LNa2S2O3溶液、0.1mol/LH2SO4溶液、3%H2O2溶液、1mol/LFeCl3溶液、MnO2粉末、蒸馏水。 实验原理:S2O32 +2H+= SO2↑+S↓+H2O 硫不溶于水,使溶液出现乳白色浑浊; S2O32 的浓度及反应温度都影响反应速率; 比较溶液中出现浑浊现象的时间,判断反应速率。 2H2O2 = O2↑+2H2O 氧气不溶于水,在溶液中产生气泡; 催化剂能影响反应速率; 比较溶液中氧气产生的快慢分析反应速率。 实验一、S2O32 +2H+= SO2↑+S↓+H2O 实验结论:前者Na2S2O3溶液浓度大,溶液中先出现乳白色浑浊,反应速率快 实验二、S2O32 +2H+= SO2↑+S↓+H2O 实验三、2H2O2 = O2↑+2H2O 问题讨论:铁和水反应的条件: 3Fe+4H2O(g) = Fe3O4+4H2(g) 1.通常条件下,铁和冷水或热水都不反应。 2.红热的铁和水蒸气可以反应,生成Fe3O4和H2。 3.说明温度对化学反应的影响比较显著。 课堂小结
布置作业 练习册上相应习题
板书设计 二、影响化学反应速率的因素: 内因:反应物的性质 决定因素 外因:外界条件 温度、浓度、压强、催化剂、接触面积等 探究温度对化学反应速率的影响 2、探究浓度对化学反应速率的影响 3、探究催化剂对化学反应速率的影响 4、固体反应物表面积对化学反应速率的影响 5、压强对化学反应速率的影响
教学反思 本节课探究实验较多,教师可以课前多让学生思考列举出实验方案,教师审核后再让学生动手做实验,提高学生学习兴趣。
《化学反应的速率与限度》第二课时 教学设计
课题名 《化学反应的速率与限度》第二课时
教学目标 1.掌握影响化学反应速率的因素。 2.体会变量控制探究影响化学反应速率因素。
教学重点 影响化学反应速率的因素。
教学难点 实验探究影响化学反应速率的因素。
教学准备 教师准备:PPT 学生准备:预习课本
教学过程 新课导入 【思考与讨论】 对于下列反应,你是希望其反应速率越快越好还是越慢越好? ■钢铁腐蚀 ■ 食物腐坏 ■ 炼钢 ■ 合成氨 调控化学反应速率常常是决定化学实验成败或化工生产成本的关键 有哪些因素能够影响化学反应速率呢? 【设计意图】 从日常生活中的调控化学反应速率常引入影响化学反应速率的因素的学习。 新课讲授 二、影响化学反应速率的因素: 内因:反应物的性质 决定因素 外因:外界条件 温度、浓度、压强、催化剂、接触面积等 研究某一具体反应,内因已定,研究外因很重要,是我们本节课重点探究的内容 讨论:探究外界条件对化学反应速率的影响时,我们可以借助哪些实验现象比较反应的快慢? 要求:可以利用具体反应说明 怎样定性地比较和判断反应的快慢? ①冒气泡快慢 ②颜色变化③固体量减少④浑浊程度⑤温度变化等 变量控制探究影响化学反应速率因素的一般原则是“定多变一”,即要保持其他变量不变,改变其中一个变量的值进行实验,测定数据,通过系列实验,找出变量对反应速率的影响。其探究流程为 【探究实验】 实验用品:3%H2O2溶液、1mol/LFeCl3溶液、MnO2粉末、0.1mol/L盐酸、1mol/L盐酸、碳酸钙粉末、块状碳酸钙 试管、量筒、药匙、镊子、胶头滴管、冷水、热水、试管夹 1、探究温度对化学反应速率的影响 反应原理:2H2O2=2H2O+O2↑ 实验操作: 实验现象:热水中生成气泡的速率更快,冷水中生成气泡的速率变慢 实验结论: 当其他条件相同时,升高温度,化学反应速率增大。 降低温度,化学反应速率减小。 2、探究浓度对化学反应速率的影响 反应原理:CaCO3+2HCl=CaCO3+CO2↑+H2O 实验操作: 实验现象:加入1 mol/L盐酸的试管中生成气泡的速率更快 实验结论: 当其他条件相同时,增大浓度,化学反应速率增大。 降低浓度,化学反应速率减小 3、探究催化剂对化学反应速率的影响 反应原理:2H2O2=2H2O+O2↑ 实验操作: 实验现象:①有少量气泡出现②能产生较多气泡③能产生大量气泡 实验结论: 当其他条件相同时,催化剂(正)能极大加快 化学反应速率 催化剂能极大地改变反应速率,而自身的组成、化学性质和质量在反应前后不发生变化,具有高度的选择性(或专一性) 催化剂只有在一定的温度下才能最大限度的显示其催化作用,不同的催化剂对温度的要求不一样。 催化剂中毒:催化剂的催化性能往往因接触少量的杂质而明显下降甚至遭破坏,这种现象叫催化剂中毒。 4、固体反应物表面积对化学反应速率的影响 反应原理:CaCO3+2HCl=CaCO3+CO2↑+H2O 实验操作: 实验现象:加碳酸钙粉末的试管内产生气泡较快,加块状碳酸钙的试管内产生气泡较慢 实验结论: 其他条件相同时,固体反应物表面积越大, 反应速率越大 小结:影响化学反应速率的因素 内因:反应物或反应本身的性质或特点 外因: 温度:升高温度,化学反应速率增大;反之减小 注意:①温度对反应速率的影响不受反应物状态的限制。②若为可逆反应,正逆反应受温度的影响倾向相同,但程度不同③实验测得,温度每升高10度,化学反应速率通常增大原来的2~4倍。 浓度:增大浓度,化学反应速率增大;反之减小 注意:①纯液体或固体的浓度为常数无影响②对于可逆反应正逆反应都符合”浓快稀慢”的规律 催化剂:使用催化剂,化学反应速率增大 注意:催化剂能同等程度改变化学反应的速率。 其他:增大固体反应物的表面积,化学反应速率增大;反之减小 影响化学反应速率的外界因素除了浓度、温度、催化剂外,还有没有其他的因素? 为何工业合成氨,通常在2×107 ~ 5×107 Pa的压强下进行。 5、压强对化学反应速率的影响 结论:其他条件相同时,对于有气体参与的反应: 增大压强(减小容器容积)相当于增大反应物的浓度,化学反应速率增大; 减小压强(增大容器容积)相当于减小反应物的浓度,化学反应速率减小。 注意:①只对气体参与或生成的反应有影响 ②对于可逆反应,加压,正反应和逆反应速率都增大 ③改变压强的含义:引起浓度的变化 对于气体有下列几种情况: 1、恒温时:增大压强→体积减少→浓度增大→反应速率增大 2、恒容时:A、充入气体反应物→反应物浓度增大→总压增大→反应速率增大; B、充入“无关气体”(如He等)→引起总压增大,但各反应物的分压不变,各物质的浓度不变→反应速率不变 3、恒压时:充入“无关气体”(如He等)→引起体积增大,→各反应物浓度减少→反应速率减慢。 思考与交流: 1.块状CaCO3、粉末状CaCO3与0.1 mol/L的盐酸反应谁快谁慢?为什么? 增大固体表面积可以加快反应速率(接触充分) 2.实验室进行化学反应 时,常常把一些固体物质溶于水配成溶液再进行反应。为什么? 离子反应速率快,瞬间完成。固体物质溶于水后,发生了电离,离子在溶液里受水分子作用而运动,增大了离子之间的接触机会,提高了反应速率 其他影响因素:除温度、催化剂、溶液的浓度、气体的压强、固体的表面积外,反应物的状态、溶剂、光照、原电池、光波、电磁波、超声波等都可以影响化学反应速率。 实验活动7 实验目的:探究浓度、温度、催化剂对化学反应速率的影响 实验用品:烧杯、量筒、试管、恒温槽、胶头滴管、温度计、秒表。 0.1mol/LNa2S2O3溶液、0.1mol/LH2SO4溶液、3%H2O2溶液、1mol/LFeCl3溶液、MnO2粉末、蒸馏水。 实验原理:S2O32 +2H+= SO2↑+S↓+H2O 硫不溶于水,使溶液出现乳白色浑浊; S2O32 的浓度及反应温度都影响反应速率; 比较溶液中出现浑浊现象的时间,判断反应速率。 2H2O2 = O2↑+2H2O 氧气不溶于水,在溶液中产生气泡; 催化剂能影响反应速率; 比较溶液中氧气产生的快慢分析反应速率。 实验一、S2O32 +2H+= SO2↑+S↓+H2O 实验结论:前者Na2S2O3溶液浓度大,溶液中先出现乳白色浑浊,反应速率快 实验二、S2O32 +2H+= SO2↑+S↓+H2O 实验三、2H2O2 = O2↑+2H2O 问题讨论:铁和水反应的条件: 3Fe+4H2O(g) = Fe3O4+4H2(g) 1.通常条件下,铁和冷水或热水都不反应。 2.红热的铁和水蒸气可以反应,生成Fe3O4和H2。 3.说明温度对化学反应的影响比较显著。 课堂小结
布置作业 练习册上相应习题
板书设计 二、影响化学反应速率的因素: 内因:反应物的性质 决定因素 外因:外界条件 温度、浓度、压强、催化剂、接触面积等 探究温度对化学反应速率的影响 2、探究浓度对化学反应速率的影响 3、探究催化剂对化学反应速率的影响 4、固体反应物表面积对化学反应速率的影响 5、压强对化学反应速率的影响
教学反思 本节课探究实验较多,教师可以课前多让学生思考列举出实验方案,教师审核后再让学生动手做实验,提高学生学习兴趣。
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
