高中化学人教版(2019)必修第二册第六章第二节《化学反应的速率与限度》第二课时课件 (21张ppt)
文档属性
| 名称 | 高中化学人教版(2019)必修第二册第六章第二节《化学反应的速率与限度》第二课时课件 (21张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 2.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-21 20:33:46 | ||
图片预览






文档简介
(共21张PPT)
人教版高中化学必修二
第六章 化学反应与能量
第二节 化学反应速率和限度 第二课时
学习目标
1.掌握影响化学反应速率的因素。
2.体会变量控制探究影响化学反应速率因素。
重点:影响化学反应速率的因素。
难点:实验探究影响化学反应速率的因素。
新知探究
【思考与讨论】
对于下列反应,你是希望其反应速率越快越好还是越慢越好?
■钢铁腐蚀 ■ 食物腐坏 ■ 炼钢 ■ 合成氨
调控化学反应速率常常是决定化学实验成败或化工生产成本的关键。
有哪些因素能够影响化学反应速率呢?
外因:外界条件
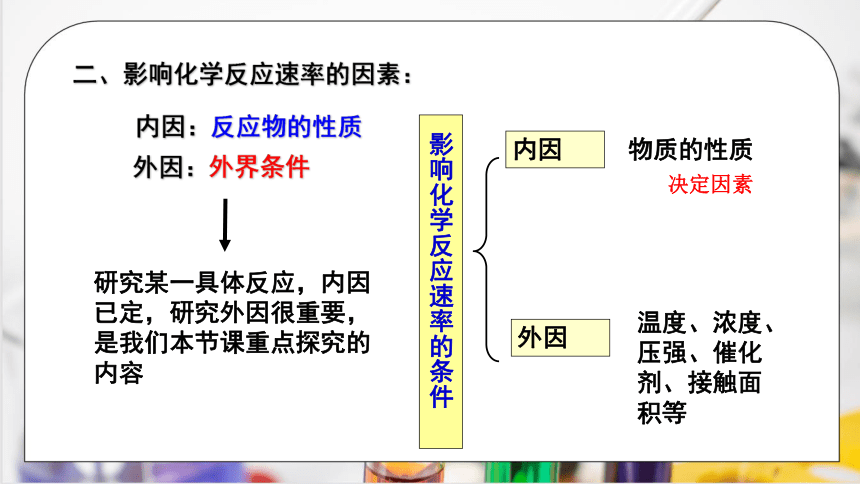
二、影响化学反应速率的因素:
内因:反应物的性质
研究某一具体反应,内因已定,研究外因很重要,是我们本节课重点探究的内容
影响化学反应速率的条件
内因
外因
物质的性质
温度、浓度、压强、催化剂、接触面积等
决定因素
讨论:探究外界条件对化学反应速率的影响时,我们可以借助哪些实验现象比较反应的快慢?
要求:可以利用具体反应说明
怎样定性地比较和判断反应的快慢?
①冒气泡快慢
②颜色变化
③固体量减少
④浑浊程度
⑤温度变化等
变量控制探究影响化学反应速率因素的一般原则是“定多变一”,即要保持其他变量不变,改变其中一个变量的值进行实验,测定数据,通过系列实验,找出变量对反应速率的影响。其探究流程为
实验用品:3%H2O2溶液、1mol/LFeCl3溶液、MnO2粉末、0.1mol/L盐酸、1mol/L盐酸、碳酸钙粉末、块状碳酸钙
试管、量筒、药匙、镊子、胶头滴管、冷水、热水、试管夹
【探究实验】
1、探究温度对化学反应速率的影响
反应原理:2H2O2=2H2O+O2↑
实验
操作
实验现象:热水中生成气泡的速率更快,冷水中生成气泡的速率变慢。
实验结论:
当其他条件相同时,升高温度,化学反应速率增大。
降低温度,化学反应速率减小。
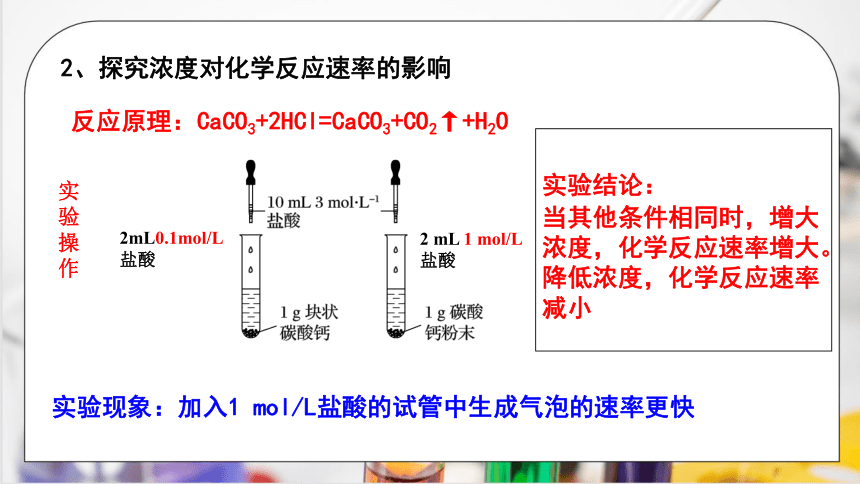
2、探究浓度对化学反应速率的影响
反应原理:CaCO3+2HCl=CaCO3+CO2↑+H2O
实验
操作
2mL0.1mol/L盐酸
2 mL 1 mol/L
盐酸
实验现象:加入1 mol/L盐酸的试管中生成气泡的速率更快
实验结论:
当其他条件相同时,增大浓度,化学反应速率增大。
降低浓度,化学反应速率减小
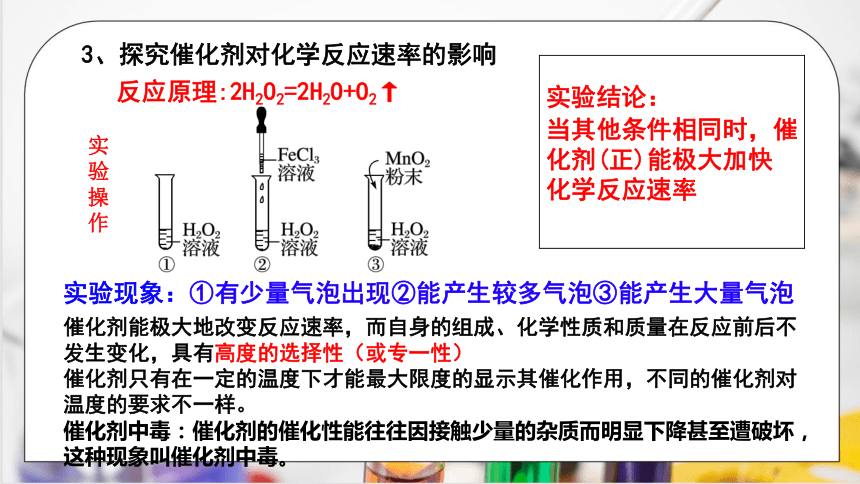
3、探究催化剂对化学反应速率的影响
反应原理:2H2O2=2H2O+O2↑
实验
操作
实验现象:①有少量气泡出现②能产生较多气泡③能产生大量气泡
实验结论:
当其他条件相同时,催化剂(正)能极大加快
化学反应速率
催化剂能极大地改变反应速率,而自身的组成、化学性质和质量在反应前后不发生变化,具有高度的选择性(或专一性)
催化剂只有在一定的温度下才能最大限度的显示其催化作用,不同的催化剂对温度的要求不一样。
催化剂中毒:催化剂的催化性能往往因接触少量的杂质而明显下降甚至遭破坏,这种现象叫催化剂中毒。
4、固体反应物表面积对化学反应速率的影响
反应原理:CaCO3+2HCl=CaCO3+CO2↑+H2O
实验
操作
实验现象:加碳酸钙粉末的试管内产生气泡较快,加块状碳酸钙的试管内产生气泡较慢
实验结论:
其他条件相同时,固体反应物表面积越大,
反应速率越大
影响化学反应速率的因素
内因:反应物或反应本身的性质或特点
外因
温度:升高温度,化学反应速率增大;反之减小
注意:①温度对反应速率的影响不受反应物状态的限制。②若为可逆反应,正逆反应受温度的影响倾向相同,但程度不同③实验测得,温度每升高10度,化学反应速率通常增大原来的2~4倍。
催化剂:使用催化剂,化学反应速率增大
注意:催化剂能同等程度改变化学反应的速率。
浓度:增大浓度,化学反应速率增大;反之减小
注意:①纯液体或固体的浓度为常数无影响②对于可逆反应正逆反应都符合”浓快稀慢”的规律
其他:增大固体反应物的表面积,化学反应速率
增大;反之减小
决定因素
影响化学反应速率的外界因素除了浓度、温度、催化剂外,还有没有其他的因素?
为何工业合成氨,通常在
2×107 ~ 5×107 Pa
的压强下进行。
N2+3H2 2NH3
铁触媒 500 C
20MPa----50MPa
5、压强对化学反应速率的影响
结论:其他条件相同时,对于有气体参与的反应:
增大压强(减小容器容积)相当于增大反应物的浓度,化学反应速率增大;
减小压强(增大容器容积)相当于减小反应物的浓度,化学反应速率减小。
注意:①只对气体参与或生成的反应有影响
②对于可逆反应,加压,正反应和逆反应速率都增大
③改变压强的含义:引起浓度的变化
对于气体有下列几种情况:1、恒温时:增大压强→体积减少→浓度增大→反应速率增大2、恒容时:A、充入气体反应物→反应物浓度增大→总压增大→反应速率增大;B、充入“无关气体”(如He等)→引起总压增大,但各反应物的分压不变,各物质的浓度不变→反应速率不变3、恒压时:充入“无关气体”(如He等)→引起体积增大,→各反应物浓度减少→反应速率减慢。1.块状CaCO3、粉末状CaCO3与0.1 mol/L的盐酸反应谁快谁慢?为什么?
增大固体表面积可以加快反应速率(接触充分)
2.实验室进行化学反应 时,常常把一些固体物质溶于水配成溶液再进行反应。为什么?
离子反应速率快,瞬间完成。固体物质溶于水后,发生了电离,离子在溶液里受水分子作用而运动,增大了离子之间的接触机会,提高了反应速率
思考与交流
其他影响因素:除温度、催化剂、溶液的浓度、气体的压强、固体的表面积外,反应物的状态、溶剂、光照、原电池、光波、电磁波、超声波等都可以影响化学反应速率。
实验活动7
实验目的:探究浓度、温度、催化剂对化学反应速率的影响
实验用品:烧杯、量筒、试管、恒温槽、胶头滴管、温度计、秒表。
0.1mol/LNa2S2O3溶液、0.1mol/LH2SO4溶液、3%H2O2溶液、1mol/LFeCl3溶液、MnO2粉末、蒸馏水。
实验原理+2H+= SO2↑+S↓+H2O
硫不溶于水,使溶液出现乳白色浑浊;
的浓度及反应温度都影响反应速率;
比较溶液中出现浑浊现象的时间,判断反应速率。
2H2O2 = O2↑+2H2O
氧气不溶于水,在溶液中产生气泡;
催化剂能影响反应速率;
比较溶液中氧气产生的快慢分析反应速率。
催化剂
实验+2H+= SO2↑+S↓+H2O
实验编号 Na2S2O3 溶液体积 Na2S2O3 溶液浓度 H2SO4 溶液体积 H2SO4 溶液浓度 加水体积 反应温度 反应时间 实验
目的
mL mol·L-1 mL mol·L-1 mL ℃ s 同样条件下,反应物浓度对反应速率的影响。
实验1 2 0.1 2 0.1 0 25 实验2 1 0.1 25 c()实验1==0.05mol·L-1
混合溶液体积≈2+2+0=4mL
c()实验2==0.025mol·L-1
混合溶液体积≈1+2+1=4mL
2 0.1 1
实验结论:前者Na2S2O3溶液浓度大,溶液中先出现乳白色浑浊,反应速率快。
实验+2H+= SO2↑+S↓+H2O
Na2S2O3 溶液体积 Na2S2O3 溶液浓度 H2SO4 溶液体积 H2SO4 溶液浓度 反应温度 反应 时间 实验
目的
mL mol·L-1 mL mol·L-1 ℃ s 实验 3 2 0.1 2 0.1 21.2 同样条件下,反应温度对反应速率的影响。
实验 4 82.3 2 0.1 2 0.1
实验结论:后者温度高,溶液中先出现乳白色浑浊,反应速率快
实验三、2H2O2 O2↑+2H2O
催化剂
几乎看不到气泡
产生大量
气泡
产生大量
气泡
H2O2 溶液体积 H2O2 溶液浓度 反应温度 催化 剂 催化剂 用量 定性观察 实验现象 实验
目的
mL 质量百分数 ℃ 种类 用量 实验 5 2 3% 25 无 无 同样条件下,催化剂对反应速率的影响。
实验 6 2 3% 25 MnO2粉末 少量 实验 7 2 3% 25 FeCl3 溶液 2滴 问题讨论:
铁和水反应的条件
干燥剂
还原铁粉
水
1.通常条件下,铁和冷水或热水
都不反应。
2.红热的铁和水蒸气可以反应,
生成Fe3O4和H2。
3.说明温度对化学反应的影响比
较显著。
高温
3Fe+4H2O(g) Fe3O4+4H2(g)
影响因素 规律
内因 反应物本 身的性质 反应物的化学性质越活泼,化学反应速率越快;反之化学反应速率越慢
外因 浓度 增大反应物的浓度,化学反应速率增大;减小反应物的浓度,化学反应速率减小
温度 升高温度,化学反应速率增大;降低温度,化学反应速率减小
压强 对于有气体物质参加的反应,增大压强(减小容器容积),化学反应速率增大;减小压强(增大容器容积),化学反应速率减小。
催化剂 一般地,使用催化剂能极大地加快反应速率
固体的表面积 增大固体反应物的表面积,化学反应速率加快
其他 光照、溶剂、形成原电池等,也能影响化学反应速率
影响化学反应速率的因素
影响程度:
催化剂
温度
其他
>
>
课堂小结
人教版高中化学必修二
第六章 化学反应与能量
第二节 化学反应速率和限度 第二课时
学习目标
1.掌握影响化学反应速率的因素。
2.体会变量控制探究影响化学反应速率因素。
重点:影响化学反应速率的因素。
难点:实验探究影响化学反应速率的因素。
新知探究
【思考与讨论】
对于下列反应,你是希望其反应速率越快越好还是越慢越好?
■钢铁腐蚀 ■ 食物腐坏 ■ 炼钢 ■ 合成氨
调控化学反应速率常常是决定化学实验成败或化工生产成本的关键。
有哪些因素能够影响化学反应速率呢?
外因:外界条件
二、影响化学反应速率的因素:
内因:反应物的性质
研究某一具体反应,内因已定,研究外因很重要,是我们本节课重点探究的内容
影响化学反应速率的条件
内因
外因
物质的性质
温度、浓度、压强、催化剂、接触面积等
决定因素
讨论:探究外界条件对化学反应速率的影响时,我们可以借助哪些实验现象比较反应的快慢?
要求:可以利用具体反应说明
怎样定性地比较和判断反应的快慢?
①冒气泡快慢
②颜色变化
③固体量减少
④浑浊程度
⑤温度变化等
变量控制探究影响化学反应速率因素的一般原则是“定多变一”,即要保持其他变量不变,改变其中一个变量的值进行实验,测定数据,通过系列实验,找出变量对反应速率的影响。其探究流程为
实验用品:3%H2O2溶液、1mol/LFeCl3溶液、MnO2粉末、0.1mol/L盐酸、1mol/L盐酸、碳酸钙粉末、块状碳酸钙
试管、量筒、药匙、镊子、胶头滴管、冷水、热水、试管夹
【探究实验】
1、探究温度对化学反应速率的影响
反应原理:2H2O2=2H2O+O2↑
实验
操作
实验现象:热水中生成气泡的速率更快,冷水中生成气泡的速率变慢。
实验结论:
当其他条件相同时,升高温度,化学反应速率增大。
降低温度,化学反应速率减小。
2、探究浓度对化学反应速率的影响
反应原理:CaCO3+2HCl=CaCO3+CO2↑+H2O
实验
操作
2mL0.1mol/L盐酸
2 mL 1 mol/L
盐酸
实验现象:加入1 mol/L盐酸的试管中生成气泡的速率更快
实验结论:
当其他条件相同时,增大浓度,化学反应速率增大。
降低浓度,化学反应速率减小
3、探究催化剂对化学反应速率的影响
反应原理:2H2O2=2H2O+O2↑
实验
操作
实验现象:①有少量气泡出现②能产生较多气泡③能产生大量气泡
实验结论:
当其他条件相同时,催化剂(正)能极大加快
化学反应速率
催化剂能极大地改变反应速率,而自身的组成、化学性质和质量在反应前后不发生变化,具有高度的选择性(或专一性)
催化剂只有在一定的温度下才能最大限度的显示其催化作用,不同的催化剂对温度的要求不一样。
催化剂中毒:催化剂的催化性能往往因接触少量的杂质而明显下降甚至遭破坏,这种现象叫催化剂中毒。
4、固体反应物表面积对化学反应速率的影响
反应原理:CaCO3+2HCl=CaCO3+CO2↑+H2O
实验
操作
实验现象:加碳酸钙粉末的试管内产生气泡较快,加块状碳酸钙的试管内产生气泡较慢
实验结论:
其他条件相同时,固体反应物表面积越大,
反应速率越大
影响化学反应速率的因素
内因:反应物或反应本身的性质或特点
外因
温度:升高温度,化学反应速率增大;反之减小
注意:①温度对反应速率的影响不受反应物状态的限制。②若为可逆反应,正逆反应受温度的影响倾向相同,但程度不同③实验测得,温度每升高10度,化学反应速率通常增大原来的2~4倍。
催化剂:使用催化剂,化学反应速率增大
注意:催化剂能同等程度改变化学反应的速率。
浓度:增大浓度,化学反应速率增大;反之减小
注意:①纯液体或固体的浓度为常数无影响②对于可逆反应正逆反应都符合”浓快稀慢”的规律
其他:增大固体反应物的表面积,化学反应速率
增大;反之减小
决定因素
影响化学反应速率的外界因素除了浓度、温度、催化剂外,还有没有其他的因素?
为何工业合成氨,通常在
2×107 ~ 5×107 Pa
的压强下进行。
N2+3H2 2NH3
铁触媒 500 C
20MPa----50MPa
5、压强对化学反应速率的影响
结论:其他条件相同时,对于有气体参与的反应:
增大压强(减小容器容积)相当于增大反应物的浓度,化学反应速率增大;
减小压强(增大容器容积)相当于减小反应物的浓度,化学反应速率减小。
注意:①只对气体参与或生成的反应有影响
②对于可逆反应,加压,正反应和逆反应速率都增大
③改变压强的含义:引起浓度的变化
对于气体有下列几种情况:1、恒温时:增大压强→体积减少→浓度增大→反应速率增大2、恒容时:A、充入气体反应物→反应物浓度增大→总压增大→反应速率增大;B、充入“无关气体”(如He等)→引起总压增大,但各反应物的分压不变,各物质的浓度不变→反应速率不变3、恒压时:充入“无关气体”(如He等)→引起体积增大,→各反应物浓度减少→反应速率减慢。1.块状CaCO3、粉末状CaCO3与0.1 mol/L的盐酸反应谁快谁慢?为什么?
增大固体表面积可以加快反应速率(接触充分)
2.实验室进行化学反应 时,常常把一些固体物质溶于水配成溶液再进行反应。为什么?
离子反应速率快,瞬间完成。固体物质溶于水后,发生了电离,离子在溶液里受水分子作用而运动,增大了离子之间的接触机会,提高了反应速率
思考与交流
其他影响因素:除温度、催化剂、溶液的浓度、气体的压强、固体的表面积外,反应物的状态、溶剂、光照、原电池、光波、电磁波、超声波等都可以影响化学反应速率。
实验活动7
实验目的:探究浓度、温度、催化剂对化学反应速率的影响
实验用品:烧杯、量筒、试管、恒温槽、胶头滴管、温度计、秒表。
0.1mol/LNa2S2O3溶液、0.1mol/LH2SO4溶液、3%H2O2溶液、1mol/LFeCl3溶液、MnO2粉末、蒸馏水。
实验原理+2H+= SO2↑+S↓+H2O
硫不溶于水,使溶液出现乳白色浑浊;
的浓度及反应温度都影响反应速率;
比较溶液中出现浑浊现象的时间,判断反应速率。
2H2O2 = O2↑+2H2O
氧气不溶于水,在溶液中产生气泡;
催化剂能影响反应速率;
比较溶液中氧气产生的快慢分析反应速率。
催化剂
实验+2H+= SO2↑+S↓+H2O
实验编号 Na2S2O3 溶液体积 Na2S2O3 溶液浓度 H2SO4 溶液体积 H2SO4 溶液浓度 加水体积 反应温度 反应时间 实验
目的
mL mol·L-1 mL mol·L-1 mL ℃ s 同样条件下,反应物浓度对反应速率的影响。
实验1 2 0.1 2 0.1 0 25 实验2 1 0.1 25 c()实验1==0.05mol·L-1
混合溶液体积≈2+2+0=4mL
c()实验2==0.025mol·L-1
混合溶液体积≈1+2+1=4mL
2 0.1 1
实验结论:前者Na2S2O3溶液浓度大,溶液中先出现乳白色浑浊,反应速率快。
实验+2H+= SO2↑+S↓+H2O
Na2S2O3 溶液体积 Na2S2O3 溶液浓度 H2SO4 溶液体积 H2SO4 溶液浓度 反应温度 反应 时间 实验
目的
mL mol·L-1 mL mol·L-1 ℃ s 实验 3 2 0.1 2 0.1 21.2 同样条件下,反应温度对反应速率的影响。
实验 4 82.3 2 0.1 2 0.1
实验结论:后者温度高,溶液中先出现乳白色浑浊,反应速率快
实验三、2H2O2 O2↑+2H2O
催化剂
几乎看不到气泡
产生大量
气泡
产生大量
气泡
H2O2 溶液体积 H2O2 溶液浓度 反应温度 催化 剂 催化剂 用量 定性观察 实验现象 实验
目的
mL 质量百分数 ℃ 种类 用量 实验 5 2 3% 25 无 无 同样条件下,催化剂对反应速率的影响。
实验 6 2 3% 25 MnO2粉末 少量 实验 7 2 3% 25 FeCl3 溶液 2滴 问题讨论:
铁和水反应的条件
干燥剂
还原铁粉
水
1.通常条件下,铁和冷水或热水
都不反应。
2.红热的铁和水蒸气可以反应,
生成Fe3O4和H2。
3.说明温度对化学反应的影响比
较显著。
高温
3Fe+4H2O(g) Fe3O4+4H2(g)
影响因素 规律
内因 反应物本 身的性质 反应物的化学性质越活泼,化学反应速率越快;反之化学反应速率越慢
外因 浓度 增大反应物的浓度,化学反应速率增大;减小反应物的浓度,化学反应速率减小
温度 升高温度,化学反应速率增大;降低温度,化学反应速率减小
压强 对于有气体物质参加的反应,增大压强(减小容器容积),化学反应速率增大;减小压强(增大容器容积),化学反应速率减小。
催化剂 一般地,使用催化剂能极大地加快反应速率
固体的表面积 增大固体反应物的表面积,化学反应速率加快
其他 光照、溶剂、形成原电池等,也能影响化学反应速率
影响化学反应速率的因素
影响程度:
催化剂
温度
其他
>
>
课堂小结
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
