专题1 第二单元 化学能与电能的转化 微专题3 电池电极反应式书写方法汇总(共43张ppt)
文档属性
| 名称 | 专题1 第二单元 化学能与电能的转化 微专题3 电池电极反应式书写方法汇总(共43张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 784.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-21 21:36:08 | ||
图片预览









文档简介
(共43张PPT)
微专题3
WEIZHUANTISAN
电池电极反应式书写方法汇总
专题1
1.简单原电池电极反应式的书写
书写简单原电池电极反应式时,可按照负极活泼金属失去电子生成阳离子,发生氧化反应,正极阳离子得到电子生成单质,发生还原反应的规律进行书写。首先判断出电极反应产物,然后结合电极反应物及转移电子数量写出电极反应式,最后结合质量守恒、电荷守恒配平各电极反应式。两电极反应式相加则得到电池总反应。
研究人员研制出一种锂水电池,可作为鱼雷和潜艇的储备电源,该电池以金属锂为负极材料,以碳素钢为正极材料,LiOH为电解质,使用时加入水即可放电。
(1)该电池负极的电极反应式:__________________。
(2)正极的电极反应式:___________________________,电池总反应:__________________________。
(3)放电时OH-向_____极移动,Li+向____极移动(填“正”或“负”)。
例1
2Li-2e-===2Li+
2H2O+2e-===H2↑+2OH-
2Li+2H2O===2LiOH+H2↑
负
正
可用于电动汽车的铝—空气燃料电池,通常以NaCl溶液或NaOH溶液为电解质溶液,铝合金为负极,空气为正极。下列说法正确的是
A.以NaCl溶液或NaOH溶液为电解质溶液时,正极电极反应式均为O2+
2H2O+4e-===4OH-
B.以NaOH溶液为电解质溶液时,负极电极反应式为Al+3OH--3e-
===Al(OH)3
C.以NaOH溶液为电解质溶液时,电池在工作过程中电解质溶液的pH保
持不变
D.电池工作时,电子通过外电路从正极流向负极
变式1
√
(2)计算该条件下50 g H2燃烧放出的热量。
电池工作时,正极上O2得到电子被还原,电极反应式为O2+2H2O+4e-===4OH-,A项正确;
电解质溶液为NaOH溶液时,在负极上产生的是NaAlO2,而不是Al(OH)3,B项错误;
电池总反应为4Al+3O2+4NaOH===4NaAlO2+2H2O,电池工作过程中消耗NaOH,电解质溶液的pH减小,C项错误;
电池工作时,电子通过外电路由负极流向正极,D项错误。
2.根据总反应写电极反应式
若题中给出总反应,可根据化合价的变化,分析此反应中的氧化反应(负极反应)和还原反应(正极反应),然后写出其中较简单的电极反应式,另一电极反应式可用总反应减去已写出的电极反应式得到。
根据下列原电池的总反应,写出其电极反应式。
(1)利用反应2Cu+O2+2H2SO4===2CuSO4+2H2O可制备硫酸铜,若将该反应设计为原电池,其负极的电极反应式是____________________,正极的电极反应式是_______________________。
例2
2Cu-4e-===2Cu2+
O2+4e-+4H+===2H2O
将总反应方程式拆成氧化反应和还原反应两个半反应,还原剂在负极上发生氧化反应:2Cu-4e-===2Cu2+;氧化剂在正极上发生还原反应:O2+4e-+4H+===2H2O。
(2)某原电池总反应为 +3H2===Fe2O3+4OH-+H2O,在该原电池中:
负极的电极反应式是________________________;正极的电极反应式是____________________________________。
3H2-6e-+6OH-===6H2O
+5H2O+6e-===Fe2O3+10OH-
将总反应方程式拆成氧化反应和还原反应两个半反应,还原剂在负极上发生氧化反应:3H2-6e-+6OH-===6H2O;氧化剂在正极上发生还原反应: +5H2O+6e-===Fe2O3+10OH-。
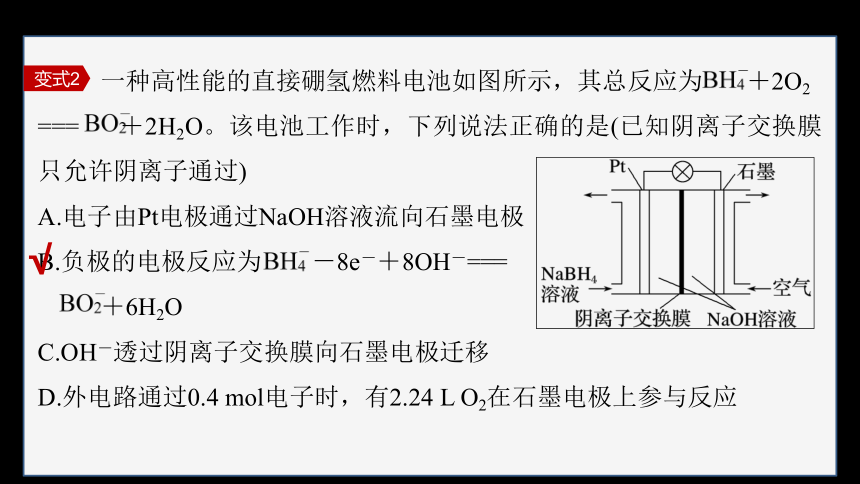
一种高性能的直接硼氢燃料电池如图所示,其总反应为 +2O2
=== +2H2O。该电池工作时,下列说法正确的是(已知阴离子交换膜只允许阴离子通过)
A.电子由Pt电极通过NaOH溶液流向石墨电极
B.负极的电极反应为 -8e-+8OH-===
+6H2O
C.OH-透过阴离子交换膜向石墨电极迁移
D.外电路通过0.4 mol电子时,有2.24 L O2在石墨电极上参与反应
变式2
√
(2)计算该条件下50 g H2燃烧放出的热量。
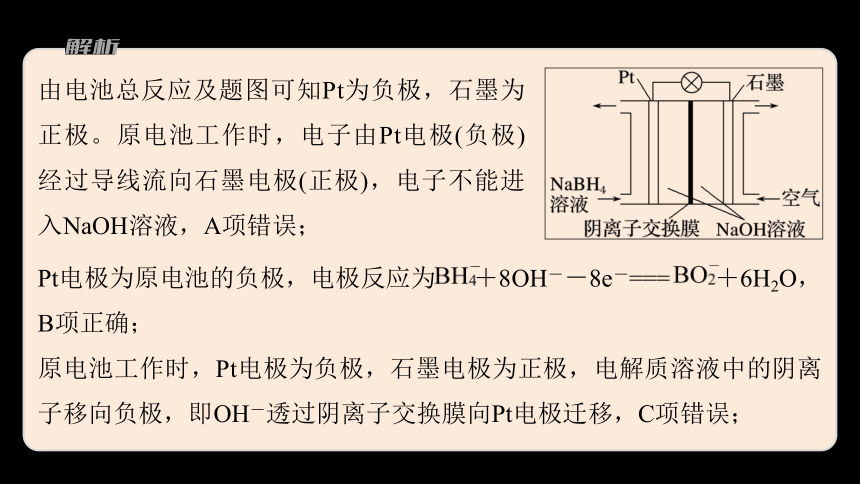
由电池总反应及题图可知Pt为负极,石墨为正极。原电池工作时,电子由Pt电极(负极)经过导线流向石墨电极(正极),电子不能进入NaOH溶液,A项错误;
Pt电极为原电池的负极,电极反应为 +8OH--8e-=== +6H2O,B项正确;
原电池工作时,Pt电极为负极,石墨电极为正极,电解质溶液中的阴离子移向负极,即OH-透过阴离子交换膜向Pt电极迁移,C项错误;
(2)计算该条件下50 g H2燃烧放出的热量。
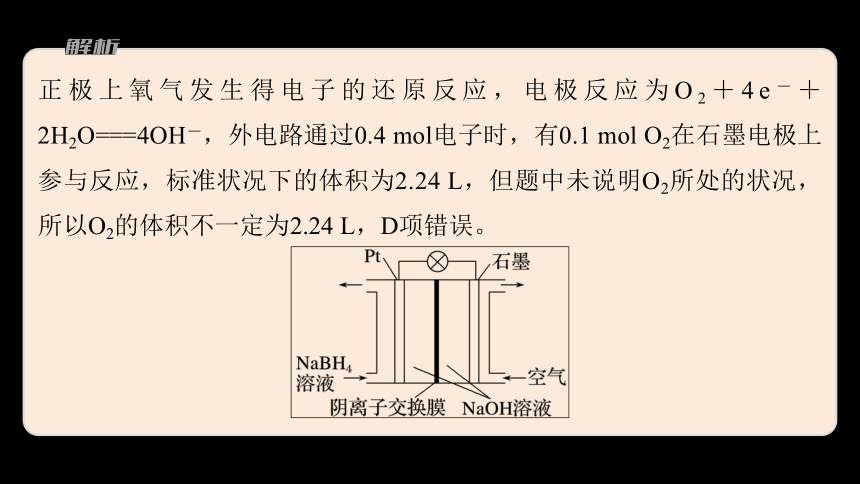
正极上氧气发生得电子的还原反应,电极反应为O2+4e-+2H2O===4OH-,外电路通过0.4 mol电子时,有0.1 mol O2在石墨电极上参与反应,标准状况下的体积为2.24 L,但题中未说明O2所处的状况,所以O2的体积不一定为2.24 L,D项错误。
3.可充电电池电极反应式的书写
在书写可充电电池电极反应时,要明确可充电电池放电时为原电池,充电时为放电的逆过程。
(1)原电池的负极与充电反应的阳极均发生氧化反应,对应元素化合价升高。
(2)原电池反应的正极与充电反应的阴极均发生还原反应,对应元素化合价降低。
某课题组以纳米Fe2O3作为电极材料制备锂离子电池(另一极为金属锂和石墨的复合材料),通过在室温条件下对锂离子电池进行循环充放电,成功地实现了对磁性的可逆调控(如图所示)。下列说法正确的是
A.放电时,正极的电极反应式为Fe2O3+6Li++6e-===2Fe+3Li2O
B.该电池可以用水溶液作电解质溶液
C.放电时,Fe在负极失电子,Fe2O3
在正极得电子
D.充电时,电池被磁铁吸引
例3
√
(2)计算该条件下50 g H2燃烧放出的热量。
电池放电的总反应为Fe2O3+6Li===
2Fe+3Li2O,单质锂在负极放电,电极反应式为Li-e-===Li+,由总反应
和负极的电极反应式可得到正极的电极反应式为Fe2O3+6Li++6e-===2Fe+3Li2O,A项正确;
因为单质锂可以与水反应,所以电解质溶液不能是水溶液,B项错误;
放电时,Li在负极失电子,Fe2O3在正极得电子,C项错误;
从图中可以看到,充电时(向左反应),电池会远离磁铁,即充电时电池中的单质铁转化为氧化铁,不能被磁铁吸引,D项错误。
某蓄电池放电、充电时反应为Fe+Ni2O3+3H2O Fe(OH)2+
2Ni(OH)2,下列推断不正确的是
A.放电时,负极的电极反应式是Fe+2OH--2e-===Fe(OH)2
B.放电时,每转移2 mol电子,正极上有1 mol Ni2O3被氧化
C.正极周围电解质溶液pH增大
D.该蓄电池的电极可浸在某种碱性电解质溶液中
变式3
√
(2)计算该条件下50 g H2燃烧放出的热量。
放电时,Fe为负极,失电子发生氧化反应生成Fe(OH)2,电极反应式为Fe-2e-+2OH-===Fe(OH)2,故A正确;
放电时,Ni2O3为正极,得电子发生还原反应生成Ni(OH)2,电极反应式是Ni2O3+2e-+3H2O===2Ni(OH)2+2OH-,故B错误、C正确;
由总反应式可知电极可浸在碱性电解质溶液中,故D正确。
4.燃料电池电极反应式的书写
(1)燃料电池的正、负极均为惰性电极,均不参与反应。
(2)正极电极反应式的书写
正极发生还原反应,通入的气体一般是氧气,氧气得到电子首先变为氧离子即O2+4e-===2O2-,根据电解质的不同,正极电极反应式的书写分以下几种情况:
①在酸性溶液中,生成的氧离子与氢离子结合生成水,电极反应式为O2+4e-+4H+===2H2O。
②在碱性溶液中,氧离子与氢氧根离子不能结合,只能与水结合生成氢氧根离子,电极反应式为O2+4e-+2H2O===4OH-。
③在熔融碳酸盐中,氧离子能与二氧化碳结合生成碳酸根离子,电极反应式为O2+2CO2+4e-===
以葡萄糖为燃料的微生物燃料电池结构示意图如图所示。
例4
(1)A为微生物燃料电池的____(填“正”或“负”)极。
正
O2→H2O发生还原反应,故A为燃料电池的正极,B为燃料电池的负极。
(2)正极反应式为___________________________。
负极反应式为________________________________
______。
6O2+24H++24e-===12H2O
C6H12O6+6H2O-24e-===6CO2+
24H+
由于电解质含有H+,故正极电极反应为6O2+24H++24e-===12H2O,负极电极反应为C6H12O6+6H2O-24e-===6CO2+24H+。
(3)放电过程中,H+由___(填“正”或“负”,下同)极区向___极区迁移。
负
正
(4)在电池反应中,每消耗1 mol氧气,理论上能生成标准状况下CO2气体______L。
22.4
葡萄糖燃料电池的总反应为C6H12O6+6O2===6CO2+6H2O,即O2~CO2,每消耗1 mol O2,理论上生成标准状况下CO2气体22.4 L。
(5)该电池_____(填“能”或“不能”)在高温下工作。
不能
高温下由于微生物蛋白质发生变性,故该电池不能在高温下工作。
某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构如图所示,电池总反应可表示为2H2+O2===2H2O。下列有关说法正确的是
A.电子通过外电路从b极流向a极
B.b极上的电极反应式为O2+2H2O+4e-
===4OH-
C.每转移0.1 mol电子,消耗1.12 L的H2
D.H+由a极通过固体电解质移向b极
变式4
√
(2)计算该条件下50 g H2燃烧放出的热量。
由电池总反应及原电池原理可知,充入H2的一极(a极)是负极,充入O2的一极(b极)是正极;电子由负极经外电路流向正极;电池内部阳离子即H+移向正极,b极的电极
反应式为O2+4H++4e-===2H2O,故A、B项错误,D项正确;
C项没有指明是否为标准状况,错误。
1
2
3
4
1.锌-空气电池(原理如图)适宜用作城市电动车的动力电源。该电池放电时Zn转化为ZnO。该电池工作时的下列说法正确的是
A.氧气在石墨电极上发生氧化反应
B.该电池的负极反应为Zn+H2O-2e-===ZnO
+2H+
C.该电池放电时OH-向石墨电极移动
D.该电池充电时应将Zn电极与电源负极相连
√
5
6
1
2
3
4
氧气得电子发生还原反应,A错误;
锌作负极,碱性条件下,负极反应为Zn+2OH--2e-===ZnO+H2O,B错误;
原电池工作时,溶液中的阴离子向负极移动,
即OH-向Zn电极移动,C错误;
充电时,电池的负极与外接电源的负极相连,D正确。
5
6
1
2
3
4
2.我国科学家研发了一种室温下“可呼吸”的Na-CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为3CO2+4Na 2Na2CO3+C。下列说法错误的是
A.放电时, 向负极移动
B.充电时释放CO2,放电时吸收CO2
C.放电时,正极反应为3CO2+4e-=== +C
D.充电时,阳极反应为Na++e-===Na
√
5
6
1
2
3
4
根据电池的总反应知,放电时
负极反应:4Na-4e-===4Na+
充电时,阴极:4Na++4e-===4Na
放电时, 向负极移动;根据充电和放电时的电极反应式知,充电时
释放CO2,放电时吸收CO2。
5
6
3.Li-Al/FeS电池是一种正在开发的车载电池,该电池中正极反应为2Li+
+FeS+2e-===Li2S+Fe。下列有关该电池的说法正确的是
A.Li-Al在电池中作为负极材料,该材料中Li的化合价为+1
B.该电池的电池反应为2Li+FeS===Li2S+Fe
C.负极的电极反应为Al-3e-===Al3+
D.充电时,阴极发生的电极反应为Li2S+Fe-2e-===2Li++FeS
1
2
3
4
√
5
6
1
2
3
4
根据题给正极的电极反应可知,FeS在电池中作为正极材料,Li—Al在电池中作为负极材料,但该材料中的Li是单质,化合价为0,A项错误;
该电池的负极反应为Li-e-===Li+,电池反应为2Li+FeS===Li2S+Fe,B项正确、C项错误;
充电时,阴极得电子,电极反应为Li++e-===Li,D项错误。
5
6
1
2
3
4
4.某种锂电池用金属锂和石墨作电极材料,电解质溶液是由四氯铝酸锂
(LiAlCl4)溶解在亚硫酰氯( )中形成的,电池总反应为4Li+2SOCl2===
4LiCl+SO2↑+S,下列叙述正确的是(已知:亚硫酰氯遇水会分解)
A.电解质溶液中混入水,对电池反应无影响
B.金属锂被还原作电池的正极
C.电池工作过程中,Cl-向金属锂电极移动
D.电池工作过程中,金属锂提供的电子与正极区析出硫的物质的量之比
为2∶1
√
5
6
1
2
3
4
Li可与水反应,且SOCl2遇水分解,A项错误;
金属锂为原电池的负极,被氧化,B项错误;
金属锂为负极,石墨为正极,阴离子向负极区移动,C项正确;
由反应方程式4Li+2SOCl2===4LiCl+SO2↑+S可知,金属锂失去4 mol电子,反应生成1 mol S,D项错误。
5
6
5.铝作为一种应用广泛的金属,在电化学领域也发挥着举足轻重的作用。回答下列问题:
(1)某同学根据氧化还原反应:2Al(s)+3Cu2+(aq)
===2Al3+(aq)+3Cu(s)设计如图所示的原电池。
①电极X的化学式为___________,电极Y的化学
式为_____。
Cu(或C)
Al
根据已知离子方程式可知Cu或石墨作正极,Al作负极。
1
2
3
4
5
6
②盐桥中的阴离子向___________(填化学式)溶液中移动。
Al2(SO4)3
原电池中阴离子向负极移动,即向Al2(SO4)3溶液中移动。
1
2
3
4
5
6
(2)新型电池中的铝电池类型较多。
①Al-空气燃料电池可用作电动汽车的电源,该电池多使用NaOH溶液为电解液。电池工作过程中电解液的pH_______(填“增大”“减小”或“不变”)。
减小
Al-空气燃料电池的总反应为4Al+3O2+4NaOH===4NaAlO2+2H2O,故溶液碱性减弱,pH减小。
1
2
3
4
5
6
②如图为Al-AgO电池的原理结构示意图,这种电池可用作水下动力电源。该电池反应方程式为2Al+3AgO+2NaOH===2NaAlO2+3Ag+H2O,当电极上析出1.08 g Ag时,电路中转移的电子为______mol。
0.02
1
2
3
4
5
6
该电池的正极反应为AgO+2e-+H2O===Ag+2OH-。AgO中Ag的化合价为+2,当电极上析出1.08 g Ag(即0.01 mol)时,电路中转移的电子为0.02 mol。
1
2
3
4
5
6
6.[2021·河北1月选考模拟,18(1)(2)(3)]我国科学家最近发明了一种Zn-PbO2电池,电解质为K2SO4、H2SO4和KOH,由a和b两种离子交换膜隔开,形成A、B、C三个电解质溶液区域,结构示意图如右:
回答下列问题:
(1)电池中,Zn为_____极,B区域的电解质为_______(填“K2SO4”
“H2SO4”或“KOH”)。
负
K2SO4
1
2
3
4
5
6
锌是活泼金属,Zn电极为负极;由图示可知A区域电解质为KOH,C区域电解质为H2SO4,则在B区域电解质为K2SO4。
1
2
3
4
5
6
(2)电池反应的离子方程式为____________
_______________________________。
1
2
3
4
5
6
(3)阳离子交换膜为图中的____膜(填“a”或“b”)。
a
1
2
3
4
5
6
专题1
本课结束
微专题3
WEIZHUANTISAN
电池电极反应式书写方法汇总
专题1
1.简单原电池电极反应式的书写
书写简单原电池电极反应式时,可按照负极活泼金属失去电子生成阳离子,发生氧化反应,正极阳离子得到电子生成单质,发生还原反应的规律进行书写。首先判断出电极反应产物,然后结合电极反应物及转移电子数量写出电极反应式,最后结合质量守恒、电荷守恒配平各电极反应式。两电极反应式相加则得到电池总反应。
研究人员研制出一种锂水电池,可作为鱼雷和潜艇的储备电源,该电池以金属锂为负极材料,以碳素钢为正极材料,LiOH为电解质,使用时加入水即可放电。
(1)该电池负极的电极反应式:__________________。
(2)正极的电极反应式:___________________________,电池总反应:__________________________。
(3)放电时OH-向_____极移动,Li+向____极移动(填“正”或“负”)。
例1
2Li-2e-===2Li+
2H2O+2e-===H2↑+2OH-
2Li+2H2O===2LiOH+H2↑
负
正
可用于电动汽车的铝—空气燃料电池,通常以NaCl溶液或NaOH溶液为电解质溶液,铝合金为负极,空气为正极。下列说法正确的是
A.以NaCl溶液或NaOH溶液为电解质溶液时,正极电极反应式均为O2+
2H2O+4e-===4OH-
B.以NaOH溶液为电解质溶液时,负极电极反应式为Al+3OH--3e-
===Al(OH)3
C.以NaOH溶液为电解质溶液时,电池在工作过程中电解质溶液的pH保
持不变
D.电池工作时,电子通过外电路从正极流向负极
变式1
√
(2)计算该条件下50 g H2燃烧放出的热量。
电池工作时,正极上O2得到电子被还原,电极反应式为O2+2H2O+4e-===4OH-,A项正确;
电解质溶液为NaOH溶液时,在负极上产生的是NaAlO2,而不是Al(OH)3,B项错误;
电池总反应为4Al+3O2+4NaOH===4NaAlO2+2H2O,电池工作过程中消耗NaOH,电解质溶液的pH减小,C项错误;
电池工作时,电子通过外电路由负极流向正极,D项错误。
2.根据总反应写电极反应式
若题中给出总反应,可根据化合价的变化,分析此反应中的氧化反应(负极反应)和还原反应(正极反应),然后写出其中较简单的电极反应式,另一电极反应式可用总反应减去已写出的电极反应式得到。
根据下列原电池的总反应,写出其电极反应式。
(1)利用反应2Cu+O2+2H2SO4===2CuSO4+2H2O可制备硫酸铜,若将该反应设计为原电池,其负极的电极反应式是____________________,正极的电极反应式是_______________________。
例2
2Cu-4e-===2Cu2+
O2+4e-+4H+===2H2O
将总反应方程式拆成氧化反应和还原反应两个半反应,还原剂在负极上发生氧化反应:2Cu-4e-===2Cu2+;氧化剂在正极上发生还原反应:O2+4e-+4H+===2H2O。
(2)某原电池总反应为 +3H2===Fe2O3+4OH-+H2O,在该原电池中:
负极的电极反应式是________________________;正极的电极反应式是____________________________________。
3H2-6e-+6OH-===6H2O
+5H2O+6e-===Fe2O3+10OH-
将总反应方程式拆成氧化反应和还原反应两个半反应,还原剂在负极上发生氧化反应:3H2-6e-+6OH-===6H2O;氧化剂在正极上发生还原反应: +5H2O+6e-===Fe2O3+10OH-。
一种高性能的直接硼氢燃料电池如图所示,其总反应为 +2O2
=== +2H2O。该电池工作时,下列说法正确的是(已知阴离子交换膜只允许阴离子通过)
A.电子由Pt电极通过NaOH溶液流向石墨电极
B.负极的电极反应为 -8e-+8OH-===
+6H2O
C.OH-透过阴离子交换膜向石墨电极迁移
D.外电路通过0.4 mol电子时,有2.24 L O2在石墨电极上参与反应
变式2
√
(2)计算该条件下50 g H2燃烧放出的热量。
由电池总反应及题图可知Pt为负极,石墨为正极。原电池工作时,电子由Pt电极(负极)经过导线流向石墨电极(正极),电子不能进入NaOH溶液,A项错误;
Pt电极为原电池的负极,电极反应为 +8OH--8e-=== +6H2O,B项正确;
原电池工作时,Pt电极为负极,石墨电极为正极,电解质溶液中的阴离子移向负极,即OH-透过阴离子交换膜向Pt电极迁移,C项错误;
(2)计算该条件下50 g H2燃烧放出的热量。
正极上氧气发生得电子的还原反应,电极反应为O2+4e-+2H2O===4OH-,外电路通过0.4 mol电子时,有0.1 mol O2在石墨电极上参与反应,标准状况下的体积为2.24 L,但题中未说明O2所处的状况,所以O2的体积不一定为2.24 L,D项错误。
3.可充电电池电极反应式的书写
在书写可充电电池电极反应时,要明确可充电电池放电时为原电池,充电时为放电的逆过程。
(1)原电池的负极与充电反应的阳极均发生氧化反应,对应元素化合价升高。
(2)原电池反应的正极与充电反应的阴极均发生还原反应,对应元素化合价降低。
某课题组以纳米Fe2O3作为电极材料制备锂离子电池(另一极为金属锂和石墨的复合材料),通过在室温条件下对锂离子电池进行循环充放电,成功地实现了对磁性的可逆调控(如图所示)。下列说法正确的是
A.放电时,正极的电极反应式为Fe2O3+6Li++6e-===2Fe+3Li2O
B.该电池可以用水溶液作电解质溶液
C.放电时,Fe在负极失电子,Fe2O3
在正极得电子
D.充电时,电池被磁铁吸引
例3
√
(2)计算该条件下50 g H2燃烧放出的热量。
电池放电的总反应为Fe2O3+6Li===
2Fe+3Li2O,单质锂在负极放电,电极反应式为Li-e-===Li+,由总反应
和负极的电极反应式可得到正极的电极反应式为Fe2O3+6Li++6e-===2Fe+3Li2O,A项正确;
因为单质锂可以与水反应,所以电解质溶液不能是水溶液,B项错误;
放电时,Li在负极失电子,Fe2O3在正极得电子,C项错误;
从图中可以看到,充电时(向左反应),电池会远离磁铁,即充电时电池中的单质铁转化为氧化铁,不能被磁铁吸引,D项错误。
某蓄电池放电、充电时反应为Fe+Ni2O3+3H2O Fe(OH)2+
2Ni(OH)2,下列推断不正确的是
A.放电时,负极的电极反应式是Fe+2OH--2e-===Fe(OH)2
B.放电时,每转移2 mol电子,正极上有1 mol Ni2O3被氧化
C.正极周围电解质溶液pH增大
D.该蓄电池的电极可浸在某种碱性电解质溶液中
变式3
√
(2)计算该条件下50 g H2燃烧放出的热量。
放电时,Fe为负极,失电子发生氧化反应生成Fe(OH)2,电极反应式为Fe-2e-+2OH-===Fe(OH)2,故A正确;
放电时,Ni2O3为正极,得电子发生还原反应生成Ni(OH)2,电极反应式是Ni2O3+2e-+3H2O===2Ni(OH)2+2OH-,故B错误、C正确;
由总反应式可知电极可浸在碱性电解质溶液中,故D正确。
4.燃料电池电极反应式的书写
(1)燃料电池的正、负极均为惰性电极,均不参与反应。
(2)正极电极反应式的书写
正极发生还原反应,通入的气体一般是氧气,氧气得到电子首先变为氧离子即O2+4e-===2O2-,根据电解质的不同,正极电极反应式的书写分以下几种情况:
①在酸性溶液中,生成的氧离子与氢离子结合生成水,电极反应式为O2+4e-+4H+===2H2O。
②在碱性溶液中,氧离子与氢氧根离子不能结合,只能与水结合生成氢氧根离子,电极反应式为O2+4e-+2H2O===4OH-。
③在熔融碳酸盐中,氧离子能与二氧化碳结合生成碳酸根离子,电极反应式为O2+2CO2+4e-===
以葡萄糖为燃料的微生物燃料电池结构示意图如图所示。
例4
(1)A为微生物燃料电池的____(填“正”或“负”)极。
正
O2→H2O发生还原反应,故A为燃料电池的正极,B为燃料电池的负极。
(2)正极反应式为___________________________。
负极反应式为________________________________
______。
6O2+24H++24e-===12H2O
C6H12O6+6H2O-24e-===6CO2+
24H+
由于电解质含有H+,故正极电极反应为6O2+24H++24e-===12H2O,负极电极反应为C6H12O6+6H2O-24e-===6CO2+24H+。
(3)放电过程中,H+由___(填“正”或“负”,下同)极区向___极区迁移。
负
正
(4)在电池反应中,每消耗1 mol氧气,理论上能生成标准状况下CO2气体______L。
22.4
葡萄糖燃料电池的总反应为C6H12O6+6O2===6CO2+6H2O,即O2~CO2,每消耗1 mol O2,理论上生成标准状况下CO2气体22.4 L。
(5)该电池_____(填“能”或“不能”)在高温下工作。
不能
高温下由于微生物蛋白质发生变性,故该电池不能在高温下工作。
某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构如图所示,电池总反应可表示为2H2+O2===2H2O。下列有关说法正确的是
A.电子通过外电路从b极流向a极
B.b极上的电极反应式为O2+2H2O+4e-
===4OH-
C.每转移0.1 mol电子,消耗1.12 L的H2
D.H+由a极通过固体电解质移向b极
变式4
√
(2)计算该条件下50 g H2燃烧放出的热量。
由电池总反应及原电池原理可知,充入H2的一极(a极)是负极,充入O2的一极(b极)是正极;电子由负极经外电路流向正极;电池内部阳离子即H+移向正极,b极的电极
反应式为O2+4H++4e-===2H2O,故A、B项错误,D项正确;
C项没有指明是否为标准状况,错误。
1
2
3
4
1.锌-空气电池(原理如图)适宜用作城市电动车的动力电源。该电池放电时Zn转化为ZnO。该电池工作时的下列说法正确的是
A.氧气在石墨电极上发生氧化反应
B.该电池的负极反应为Zn+H2O-2e-===ZnO
+2H+
C.该电池放电时OH-向石墨电极移动
D.该电池充电时应将Zn电极与电源负极相连
√
5
6
1
2
3
4
氧气得电子发生还原反应,A错误;
锌作负极,碱性条件下,负极反应为Zn+2OH--2e-===ZnO+H2O,B错误;
原电池工作时,溶液中的阴离子向负极移动,
即OH-向Zn电极移动,C错误;
充电时,电池的负极与外接电源的负极相连,D正确。
5
6
1
2
3
4
2.我国科学家研发了一种室温下“可呼吸”的Na-CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为3CO2+4Na 2Na2CO3+C。下列说法错误的是
A.放电时, 向负极移动
B.充电时释放CO2,放电时吸收CO2
C.放电时,正极反应为3CO2+4e-=== +C
D.充电时,阳极反应为Na++e-===Na
√
5
6
1
2
3
4
根据电池的总反应知,放电时
负极反应:4Na-4e-===4Na+
充电时,阴极:4Na++4e-===4Na
放电时, 向负极移动;根据充电和放电时的电极反应式知,充电时
释放CO2,放电时吸收CO2。
5
6
3.Li-Al/FeS电池是一种正在开发的车载电池,该电池中正极反应为2Li+
+FeS+2e-===Li2S+Fe。下列有关该电池的说法正确的是
A.Li-Al在电池中作为负极材料,该材料中Li的化合价为+1
B.该电池的电池反应为2Li+FeS===Li2S+Fe
C.负极的电极反应为Al-3e-===Al3+
D.充电时,阴极发生的电极反应为Li2S+Fe-2e-===2Li++FeS
1
2
3
4
√
5
6
1
2
3
4
根据题给正极的电极反应可知,FeS在电池中作为正极材料,Li—Al在电池中作为负极材料,但该材料中的Li是单质,化合价为0,A项错误;
该电池的负极反应为Li-e-===Li+,电池反应为2Li+FeS===Li2S+Fe,B项正确、C项错误;
充电时,阴极得电子,电极反应为Li++e-===Li,D项错误。
5
6
1
2
3
4
4.某种锂电池用金属锂和石墨作电极材料,电解质溶液是由四氯铝酸锂
(LiAlCl4)溶解在亚硫酰氯( )中形成的,电池总反应为4Li+2SOCl2===
4LiCl+SO2↑+S,下列叙述正确的是(已知:亚硫酰氯遇水会分解)
A.电解质溶液中混入水,对电池反应无影响
B.金属锂被还原作电池的正极
C.电池工作过程中,Cl-向金属锂电极移动
D.电池工作过程中,金属锂提供的电子与正极区析出硫的物质的量之比
为2∶1
√
5
6
1
2
3
4
Li可与水反应,且SOCl2遇水分解,A项错误;
金属锂为原电池的负极,被氧化,B项错误;
金属锂为负极,石墨为正极,阴离子向负极区移动,C项正确;
由反应方程式4Li+2SOCl2===4LiCl+SO2↑+S可知,金属锂失去4 mol电子,反应生成1 mol S,D项错误。
5
6
5.铝作为一种应用广泛的金属,在电化学领域也发挥着举足轻重的作用。回答下列问题:
(1)某同学根据氧化还原反应:2Al(s)+3Cu2+(aq)
===2Al3+(aq)+3Cu(s)设计如图所示的原电池。
①电极X的化学式为___________,电极Y的化学
式为_____。
Cu(或C)
Al
根据已知离子方程式可知Cu或石墨作正极,Al作负极。
1
2
3
4
5
6
②盐桥中的阴离子向___________(填化学式)溶液中移动。
Al2(SO4)3
原电池中阴离子向负极移动,即向Al2(SO4)3溶液中移动。
1
2
3
4
5
6
(2)新型电池中的铝电池类型较多。
①Al-空气燃料电池可用作电动汽车的电源,该电池多使用NaOH溶液为电解液。电池工作过程中电解液的pH_______(填“增大”“减小”或“不变”)。
减小
Al-空气燃料电池的总反应为4Al+3O2+4NaOH===4NaAlO2+2H2O,故溶液碱性减弱,pH减小。
1
2
3
4
5
6
②如图为Al-AgO电池的原理结构示意图,这种电池可用作水下动力电源。该电池反应方程式为2Al+3AgO+2NaOH===2NaAlO2+3Ag+H2O,当电极上析出1.08 g Ag时,电路中转移的电子为______mol。
0.02
1
2
3
4
5
6
该电池的正极反应为AgO+2e-+H2O===Ag+2OH-。AgO中Ag的化合价为+2,当电极上析出1.08 g Ag(即0.01 mol)时,电路中转移的电子为0.02 mol。
1
2
3
4
5
6
6.[2021·河北1月选考模拟,18(1)(2)(3)]我国科学家最近发明了一种Zn-PbO2电池,电解质为K2SO4、H2SO4和KOH,由a和b两种离子交换膜隔开,形成A、B、C三个电解质溶液区域,结构示意图如右:
回答下列问题:
(1)电池中,Zn为_____极,B区域的电解质为_______(填“K2SO4”
“H2SO4”或“KOH”)。
负
K2SO4
1
2
3
4
5
6
锌是活泼金属,Zn电极为负极;由图示可知A区域电解质为KOH,C区域电解质为H2SO4,则在B区域电解质为K2SO4。
1
2
3
4
5
6
(2)电池反应的离子方程式为____________
_______________________________。
1
2
3
4
5
6
(3)阳离子交换膜为图中的____膜(填“a”或“b”)。
a
1
2
3
4
5
6
专题1
本课结束
