专题1 第一单元 化学反应的热效应 第2课时 反应热的测量与计算(共81张ppt)
文档属性
| 名称 | 专题1 第一单元 化学反应的热效应 第2课时 反应热的测量与计算(共81张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-21 21:44:53 | ||
图片预览











文档简介
(共81张PPT)
第2课时
DIERKESHI
中和反应反应热的测量 / 盖斯定律及其应用 / 课时对点练
反应热的测量与计算
专题1
1.科学探究:
理解反应热测定的原理和方法,会分析产生误差的原因,不断完善和改进测定方法。
2.证据推理与模型认知:
构建盖斯定律模型,理解盖斯定律的本质,形成运用盖斯定律进行相关判断或计算的思维模型。
3.科学态度与社会责任:
了解盖斯定律对反应热测定的重要意义,增强为人类科学发展而努力的意识与社会责任感。
内容索引
一、中和反应反应热的测量
二、盖斯定律及其应用
课时对点练
中和反应反应热的测量
一
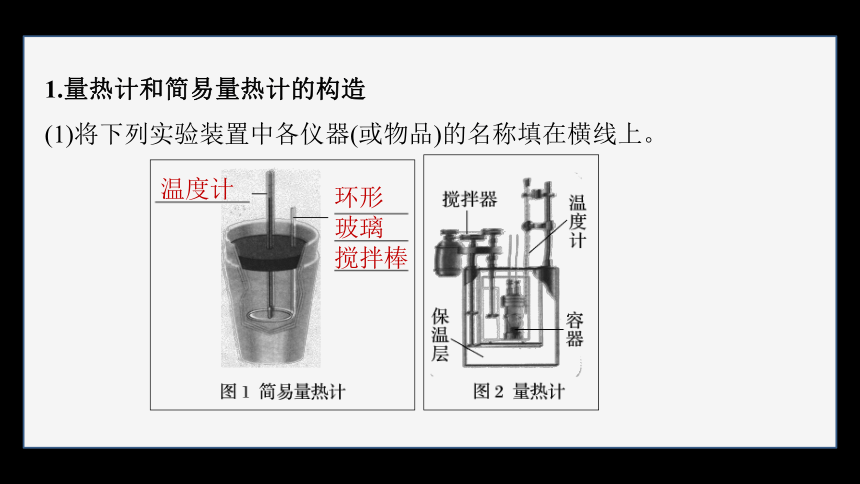
1.量热计和简易量热计的构造
(1)将下列实验装置中各仪器(或物品)的名称填在横线上。
温度计
环形
玻璃
搅拌棒
(2)仪器各部分的作用
①搅拌器或环形玻璃搅拌棒的作用是使 。
②保温层的作用是 。
③温度计的作用是测定反应前后反应体系的温度。
2.实验原理
用体积均为50 mL的一元强酸、一元强碱,它们的浓度均为0.50 mol·L-1。
由于是稀溶液,且为了计算简便,我们近似地认为,所用酸、碱溶液的密度均为1 g·cm-3,根据热化学方程式H+(aq)+ OH-(aq)===H2O (l)
ΔH=-Q kJ·mol-1,需计算稀的酸、碱中和生成1 mol水的反应热,而
反应物混合均匀充分接触
减少热量的散失
50 mL 0.50 mol·L-1的盐酸与50 mL 0.50 mol·L-1 氢氧化钠溶液反应后生成的水只有0.025 mol。
C=(VHCl·ρHCl+VNaOH·ρNaOH)×4.18 J·℃-1,生成1 mol H2O(l)时的反应热
ΔH= kJ·mol-1,其中溶液的质量m约为100 g。
3.实验步骤及测量数据
(1)初始温度:测量混合前50 mL 0.50 mol·L-1盐酸的温度为T1 ℃、50 mL 0.50 mol·L-1氢氧化钠溶液的温度为T2 ℃,取 为
(2)终止温度(T3):将酸、碱溶液迅速混合,用 不断搅动溶液,并准确读取混合溶液的 ,记录为终止温度T3。反应体
系的温度变化为ΔT=
两温度平均值
环形玻璃搅拌棒
最高温度
(3)重复实验操作三次,记录每次的实验数据,取其平均值作为计算依据。
(4)实验数据处理
该实验中盐酸和氢氧化钠溶液反应放出的热量是 kJ,
生成1 mol H2O(l)时的反应热为-16.72(T3- )kJ·mol-1[或ΔH=
- kJ·mol-1]。
(1)将酸碱迅速混合后,待温度计读数稳定后记录终止温度( )
(2)中和反应反应热的测定实验中的环形玻璃搅拌棒换成铜质搅拌器效果更好( )
(3)中和反应反应热的测定实验中,应将50 mL 0.50 mol·L-1 NaOH溶液分多次倒入小烧杯( )
(4)中和反应反应热的测定实验中,测定盐酸后的温度计没有冲洗干净,立即测NaOH溶液的温度( )
正误判断
×
×
×
×
1.根据上述测定中和反应反应热的实验,思考回答下列问题:
(1)用同体积、同浓度的KOH代替NaOH完成上述实验,用同体积、同浓度的硝酸代替盐酸完成上述实验,测得的反应热数值三者是否相同?简述其中的原因。
提示 相同。参加反应的物质都是强酸、强碱,它们在水中完全电离,中和反应的离子方程式都是H++OH-===H2O,反应都在室温下进行,且参加反应的n(H+)和n(OH-)都相同,所以反应热也相同。
(2)用浓硫酸代替盐酸对结果会产生什么影响?用醋酸代替盐酸对结果会产生什么影响?
提示 浓硫酸溶于水时放热,所测ΔH偏小;弱酸电离吸热,所测ΔH偏大。
2.为了测定酸碱中和反应生成1 mol水时的反应热,计算时至少需要的数据是____________。
①酸溶液的浓度和体积 ②碱溶液的浓度和体积 ③比热容 ④反应后溶液的质量(单位:g) ⑤生成水的物质的量 ⑥反应前后温度变化
⑦操作所需的时间
③④⑤⑥
应用体验
1.某同学通过实验测出稀盐酸和稀NaOH溶液(碱稍过量)反应生成1 mol水的反应热ΔH=-52.3 kJ·mol-1,比理论数值要小,造成这一结果的原因不可能的是
A.实验装置保温、隔热效果差
B.用量筒量取盐酸时仰视读数
C.分多次将NaOH溶液倒入量热计的内筒中
D.用测量盐酸的温度计直接测定NaOH溶液的温度
√
若装置保温、隔热效果差,会造成较多的热量损失,测得的反应热数值偏小,A项可能;
用量筒取液体,仰视读数时,实际量取的溶液体积多于应该量取的溶液体积,会导致放出的热量变多,B项不可能;
C项操作会导致较多的热量损失,C项可能;
D项操作会导致测得的NaOH溶液的初始温度偏高,最后计算出的反应放出的热量比实际放出的热量少,D项可能。
2.用如图所示的量热计测定醋酸溶液与氢氧化钠溶液中和反应的反应热。将100 mL、0.50 mol·L-1 CH3COOH溶液与100 mL、0.55 mol·L-1 NaOH溶液混合,温度从25.2 ℃升高到27.7 ℃。已知量热计的热容常数(量热计各部件每升高1 ℃所需的热量)是150 J·℃-1,0.250 mol·L-1 CH3COONa溶液的比热容为4 J·g-1·℃-1,溶液的密度为1 g·cm-3。
(1)1 mol CH3COOH完全中和的反应热ΔH=________________。
-47.5 kJ·mol-1
(2)实验中NaOH溶液过量的目的是_________________
__________。
(3)1 mol CH3COOH发生中和反应的反应热的文献值为-56 kJ·mol-1,你认为(1)中测得的实验值偏差的可能原因是______________________。
保证醋酸完全被
NaOH中和
保温效果差或测温不准
(4)你认为CH3COOH与NaOH中和反应的ΔH1和HCl与NaOH中和反应的ΔH2相比_____(填“ΔH1”“ΔH2”或“一样”)大,原因是____________
___________。
ΔH1
CH3COOH
电离需吸热
归纳总结
测定中和反应的反应热需注意的几个问题
(1)简易量热计的保温隔热效果要好。
(2)实验中要用强酸和强碱的稀溶液。
(3)碱液(或酸液)稍过量,以确保酸(或碱)完全反应。
(4)读取的温度(t)是反应体系的最高温度。
(5)实验操作动作要迅速,尽量减少热量损失。
返回
盖斯定律及其应用
二
1.盖斯定律的理解
(1)大量实验证明,一个化学反应,不论是 完成,还是 完成,其总的热效应是 的。
(2)化学反应的焓变(ΔH)只与反应体系的 和 有关,而与反应的 无关。
一步
分几步
完全相等
始态
终态
途径
始态和终态相同的某反应途径有如下三种:
例1
则:ΔH= =________________
ΔH1+ΔH2
ΔH3+ΔH4+ΔH5
2.盖斯定律的意义
应用盖斯定律可以间接计算以下情况(不能直接测定)的反应热:
(1)有些反应速率很慢。
(2)有些反应不容易直接发生。
(3)有些反应的产品不纯(有副反应发生)。
根据如下两个反应:
Ⅰ.C(s)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1
例2
(1)虚拟路径法
反应C(s)+O2(g)===CO2(g)的途径可设计如下:
则ΔH= kJ·mol-1。
-110.5
(2)加合法
①写出目标反应的热化学方程式,确定各物质在各反应中的位置:
____________________;
③将热化学方程式相加,ΔH也相加,即Ⅰ+Ⅲ得:
,则ΔH= kJ·mol-1。
-110.5
②将已知热化学方程式Ⅱ变形,得反应Ⅲ:
(1)对一个化学反应,如果反应的途径不同,其焓变也可能不同( )
(2)化学反应的反应热只与反应体系的始态和终态有关,和反应途径及条件无关( )
(3)可以通过实验直接测定任一反应的反应热( )
(4)反应热的数值和热化学方程式的化学计量数无关( )
(5)同温同压下,H2和Cl2分别在光照条件下和点燃条件下发生反应时ΔH不同( )
正误判断
×
√
×
×
×
已知25 ℃、101 kPa下,石墨、金刚石燃烧的热化学方程式分别为
①C(石墨,s)+O2(g)===CO2(g) ΔH=-393.51 kJ·mol-1
②C(金刚石,s)+O2(g)===CO2(g) ΔH=-395.41 kJ·mol-1
据此判断,石墨、金刚石哪个更稳定?写出判断依据。
提示 石墨。根据盖斯定律,将①式减去②式,得到:C(石墨,s)===C(金刚石,s) ΔH=1.90 kJ·mol-1,说明由石墨制备金刚石是吸热反应,吸收的热量作为化学能的形式贮存在金刚石中,也就是等质量的金刚石具有的能量比石墨高,能量低的稳定,所以石墨更稳定。
应用体验
1.已知:P4(白磷,s)+5O2(g)===P4O10(s) ΔH1;
设计成如下转化路径,请填空:
则ΔH= 。
ΔH1-4ΔH2
2.(2022·武汉新洲区检测)黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为
S(s)+2KNO3(s)+3C(s)===K2S(s)+N2(g)+3CO2(g) ΔH
已知:C(s)+O2(g)===CO2(g) ΔH1
S(s)+2K(s)===K2S(s) ΔH2
2K(s)+N2(g)+3O2(g)===2KNO3(s) ΔH3
则ΔH为__________________(写出计算过程)。
答案 3ΔH1+ΔH2-ΔH3
根据已知热化学方程式:
C(s)+O2(g)===CO2(g) ΔH1①
S(s)+2K(s)===K2S(s) ΔH2②
2K(s)+N2(g)+3O2(g)===2KNO3(s) ΔH3③
将方程式3×①+②-③得S(s)+2KNO3(s)+3C(s)===K2S(s)+N2(g)+3CO2(g),则ΔH=3ΔH1+ΔH2-ΔH3
归纳总结
四步分析法应用于盖斯定律的计算(思维模型)
(1)分析目标反应和已知反应的差异,明确:①目标反应物和生成物;②需要消掉的中间产物。
(2)将每个已知的热化学方程式两边同乘以某个合适的数,使已知热化学方程式中某种反应物或生成物的化学计量数与目标热化学方程式中的该物质的化学计量数一致,热化学方程式的焓变也进行相应的计算。
归纳总结
(3)将已知热化学方程式相加减消掉目标反应热化学方程式中没有的物质(同侧相减,异侧相加消去中间产物)。
(4)得出目标热化学方程式(目标热化学方程式化学计量数不能存在公约数,应为最简形式)。
以上步骤可以概括为找目标、看来源、调系数、相加减、得答案。
返回
课时对点练
题组一 中和反应的反应热及其测量
1.(2022·浙江杭州西湖高级中学月考)下列有关测定中和反应反应热实验的说法正确的是
A.用铜丝代替环形玻璃搅拌棒,测得的ΔH偏大
B.强酸的稀溶液与强碱的稀溶液反应生成1 mol H2O的ΔH均为-57.3 kJ·mol-1
C.测定中和反应反应热的实验中,混合溶液的温度不再变化时,该温度为终止温度
D.某同学通过实验测出稀盐酸和稀NaOH溶液反应生成1 mol H2O的反应热ΔH
=-52.3 kJ·mol-1,造成这一结果的原因不可能是用测量过稀盐酸温度的温
度计直接测量稀NaOH溶液的温度
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
铜为热的良导体,容易导致热量散失,使测得的ΔH偏大,A项正确;
部分强酸的稀溶液与强碱的稀溶液反应不仅生成H2O,还生成沉淀,如一定量的稀硫酸与稀Ba(OH)2溶液反应生成1 mol H2O时还有0.5 mol BaSO4沉淀生成,Ba2+与 结合生成BaSO4时放热,则该反应的ΔH≠-57.3 kJ·mol-1,B项错误;
测定中和反应反应热时,混合溶液的最高温度为终止温度,C项错误;
用测量过稀盐酸温度的温度计直接测量稀NaOH溶液的温度会导致部分酸碱提前反应,从而使测得的ΔH的绝对值偏小,D项错误。
2.下列有关H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1的说法正确的是
A. 代表所有的酸碱中和反应
B.反应物一定是强酸与强碱
C.强酸与强碱的中和反应的热化学方程式都可以这样表示
D.表示稀的强酸溶液与稀的强碱溶液反应生成可溶性盐和1 mol液态水
时放出57.3 kJ热量
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
弱酸与弱碱在溶液中主要以分子形式存在,由于电离吸热,生成1 mol液态水时放出的热量小于57.3 kJ,A项错误;
该热化学方程式表示的反应不一定是强酸与强碱的反应,也可以是硫酸氢钠与氢氧化钠的反应,B项错误;
该热化学方程式不能表示强酸与强碱生成难溶性盐的反应,如硫酸与氢氧化钡的反应,C项错误;
H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1表示稀的强酸溶液与稀的强碱溶液反应生成可溶性盐和1 mol 液态水时放出57.3 kJ热量,D项正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
3.用50 mL 0.50 mol·L-1盐酸和50 mL 0.55 mol·L-1 NaOH溶液测定H+(aq)+OH-(aq)===H2O(l)的反应热(ΔH)的实验时,下列说法不正确的是
A.酸碱混合时,量筒中NaOH溶液应缓缓倒入量热计内筒中,不断用环
形玻璃搅拌棒搅拌
B.装置中的大小烧杯之间填满碎泡沫塑料的作用是保温隔热,减少热量损失
C.用量筒量取NaOH溶液时,仰视取液,测得的反应热ΔH不变
D.改用25 mL 0.50 mol·L-1盐酸跟25 mL 0.55 mol·L-1 NaOH溶液进行测定,
ΔH数值不变
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
中和反应反应热测定实验成败的关键是做好保温工作,B正确;
用量筒量取NaOH溶液时,仰视取液,氢氧化钠溶液体积高于所需量的体积,但生成水的量不变,放出的热量不变,测得的中和反应反应热ΔH不变,C正确;
反应放出的热量与所用酸和碱的量有关,但生成1 mol水时中和反应反应热的大小与参加反应的酸碱用量无关,D正确。
4.利用如图装置测定中和反应反应热的实验,下列说法错误的是
A.若用醋酸代替HCl做实验,会使测定结果偏大
B.加入NaOH溶液的正确操作是分三次沿玻璃棒缓慢加入
C.烧杯间填满碎泡沫塑料的作用是保温隔热,减少热量的
损失
D.该实验测得的中和热ΔH的数值比理论值偏低,其原因可能是测量完
硫酸溶液温度的温度计直接用来测NaOH溶液的温度
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
醋酸是弱酸,电离吸热,所以用醋酸代替HCl做实验,放出热量减少,但因ΔH为负值,所以会使测定结果偏大,故A正确;
倒入氢氧化钠溶液时,必须一次迅速的倒入,目的是
减少热量的散失,故B错误;
大小烧杯之间填满碎泡沫塑料的作用是保温、隔热,减少实验过程中的热量散失,故C正确;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
温度计测定稀H2SO4溶液起始温度后直接插入NaOH测温度,NaOH的起始温度偏高,测得的热量偏小,中和热的数值偏低,故D正确。
5.将V1 mL 1.00 mol·L-1 HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50)。下列叙述正确的是
A.做该实验时环境温度为22 ℃
B.NaOH溶液的浓度约为1.5 mol·L-1
C.该实验中需要使用环形玻璃搅拌棒
在水平方向轻轻转动搅拌
D.该实验可用相同物质的量的氢氧化钠固体投入盐酸中测定中和反应反
应热
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
该实验开始时混合液温度是22 ℃,故A错误;
恰好完全反应时参加反应的盐酸的体积是30 mL,由V1+V2=50可知,消耗的氢氧化钠溶液的体积为20 mL,设恰好反应时氢氧化钠溶液中溶质的物质的量是n,
HCl + NaOH===NaCl+H2O
1 1
1.00 mol·L-1×0.03 L n
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
则n=1.00 mol·L-1×0.03 L=0.03 mol,所以浓度是 =1.5 mol·L-1,故B正确;
该实验中需要使用环形玻璃搅拌棒在上下方向轻轻转动搅拌,故C错误;
该实验不可用相同物质的量的氢氧化钠固体投入盐酸中测定中和反应反应热,否则会因NaOH固体溶解放热,使得测定数值偏大,故D错误。
题组二 盖斯定律的内容与本质
6.下列关于盖斯定律的说法不正确的是
A.不管反应是一步完成还是分几步完成,其反应热相同
B.反应热只与反应体系的始态和终态有关,而与反应的途径无关
C.有些反应的反应热不能直接测得,可通过盖斯定律间接计算得到
D.根据盖斯定律,热化学方程式中ΔH直接相加即可得总反应热
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
热化学方程式按一定系数比加和时其反应热也按系数比加和,D错误。
7.物质A在一定条件下可发生一系列转化,由图判断下列关系错误的是
A.A→F ΔH=-ΔH6
B.ΔH1+ΔH2+ΔH3+ΔH4+ΔH5+ΔH6=1
C.C→F |ΔH|=|ΔH1+ΔH2+ΔH6|
D.|ΔH1+ΔH2+ΔH3|=|ΔH4+ΔH5+ΔH6|
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
由盖斯定律可知:A→F ΔH=ΔH1+ΔH2+ΔH3+ΔH4+ΔH5=-ΔH6,即ΔH1+ΔH2+ΔH3+ΔH4+ΔH5+ΔH6=0,故A项正确、B项错误;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
由C→F可以判断,ΔH=ΔH3+ΔH4+ΔH5=-(ΔH1+ΔH2+ΔH6),故C项正确;
由A→D知:ΔH=ΔH1+ΔH2+ΔH3=-(ΔH4+ΔH5+ΔH6),故D项正确。
8.已知煤转化成水煤气及其燃烧过程的能量变化如图,下列说法不正确的是
A.由ΔH3可知,该步反应的反应物键
能总和小于生成物的键能总和
B.ΔH1-ΔH2+ΔH3=0
C.ΔH1<ΔH2
D.若用C(s)和H2O(l)转化为H2(g)和CO(g),则ΔH2变大
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
燃烧为放热反应,ΔH3<0,焓变等于反应物的键能总和减去生成物的
键能总和,则由ΔH3可知,该步反应的反应物键能总和小于生成物的键能总和,故A正确;
由盖斯定律可知,ΔH1=ΔH2+ΔH3,则ΔH1-ΔH2-ΔH3=0,故B错误;
ΔH2>0,而ΔH1<0,则ΔH1<ΔH2,故C正确;
C与水蒸气的反应为吸热反应,且气态水的能量比液态水的能量高,则用C(s)和H2O(l)转化为H2(g)和CO(g),则ΔH2变大,故D正确。
题组三 盖斯定律的应用
9.已知热化学方程式:
C(金刚石,s)+O2(g)===CO2(g) ΔH1;
C(石墨,s)+O2(g)===CO2(g) ΔH2;
C(石墨,s)===C(金刚石,s) ΔH3=1.9 kJ·mol-1
下列说法正确的是
A.金刚石比石墨稳定 B.ΔH1>ΔH2
C.ΔH3=ΔH1-ΔH2 D.石墨转化成金刚石的反应是吸热反应
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
石墨转化为金刚石要吸收能量,说明石墨的能量低,石墨比金刚石稳定,A错误,D正确;
石墨的能量低于金刚石的能量,故石墨燃烧放出的能量比金刚石低,放热反应的ΔH<0,则ΔH1<ΔH2,B错误;
将3个热化学方程式依次编为1式、2式、3式,根据盖斯定律,3式=2式-1式,故ΔH3=ΔH2-ΔH1,C错误。
10.室温下,CuSO4·5H2O(s)===Cu2+(aq)+ (aq)+5H2O(l) ΔH1>0;CuSO4(s)===Cu2+(aq)+ (aq) ΔH2<0。若CuSO4·5H2O受热分解的化学
方程式为CuSO4·5H2O(s) CuSO4(s)+5H2O(l),热效应为ΔH3,则下
列判断正确的是
A.ΔH1<ΔH3 B.ΔH2>ΔH3
C.ΔH1+ΔH3=ΔH2 D.ΔH1+ΔH2=ΔH3
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
已知CuSO4·5H2O(s)===Cu2+(aq)+ (aq)+5H2O(l) ΔH1>0①,CuSO4(s)===Cu2+(aq)+ (aq) ΔH2<0②,根据盖斯定律将①-②
得到CuSO4·5H2O(s)===CuSO4(s)+5H2O(l) ΔH3=ΔH1-ΔH2,因为ΔH1>0,ΔH2<0,故ΔH1<ΔH3,ΔH2<ΔH3,故A正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
11.肼(N2H4)是火箭发动机的一种燃料,反应时N2O4为氧化剂,反应生成N2和水蒸气。
已知:
①N2(g)+2O2(g)===N2O4(g) ΔH=8.7 kJ·mol-1
②N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=-534 kJ·mol-1
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
下列表示N2H4(g)和N2O4(g)反应的热化学方程式,正确的是
A.2N2H4(g)+N2O4(g)===3N2(g)+4H2O(g) ΔH=-1 076.7 kJ·mol-1
B.N2H4(g)+ N2O4(g)=== N2(g)+2H2O(g) ΔH=-542.7 kJ·mol-1
C.2N2H4(g)+N2O4(g)===3N2(g)+4H2O(g) ΔH=-542.7 kJ·mol-1
D.2N2H4(g)+N2O4(g)===3N2(g)+4H2O(l) ΔH=-1 076.7 kJ·mol-1
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
根据盖斯定律,将②×2-①得2N2H4(g)+N2O4(g)===3N2(g)+4H2O(g) ΔH=-1 076.7 kJ·mol-1。
12.某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变成H2、CO、O2。其过程如下:
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
mCeO2 (m-x)CeO2·xCe+xO2
(m-x)CeO2·xCe+xH2O+xCO2 mCeO2+xH2+xCO
下列说法不正确的是
A.该过程中CeO2没有消耗
B.该过程实现了太阳能向化学能的转化
C.图中ΔH1=ΔH2+ΔH3
D.H2(g)+ O2(g)===H2O(g)的反应热大于ΔH3
√
通过太阳能实现总反应H2O+CO2===H2+CO+O2可知,CeO2没有消耗,CeO2为催化剂,故A正确;
该过程在太阳能作用下将H2O、CO2转变为H2、CO、O2,所以把太阳能转变成化学能,故B正确;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
由图中转化关系及盖斯定律可知:-ΔH1=ΔH2+ΔH3,故C错误;
气态水转化为液态水,放出能量,故H2(g)+ O2(g)===H2O(l)放热更多,焓变更小,故D正确。
13.已知:2H2O(l)===2H2(g)+O2(g) ΔH=571.0 kJ·mol-1。以太阳能为热源分解Fe3O4,经热化学铁氧化合物循环分解水制H2的过程如下:
过程Ⅰ:2Fe3O4(s)===6FeO(s)+O2(g) ΔH=313.2 kJ·mol-1
过程Ⅱ:……
下列说法不正确的是
A.过程Ⅰ中每消耗232 g Fe3O4转移2 mol电子
B.过程Ⅱ的热化学方程式:3FeO(s)+H2O(l)===H2(g)+Fe3O4(s) ΔH=128.9 kJ·mol-1
C.过程Ⅰ、Ⅱ中能量转化的形式依次是太阳能→化学能→热能
D.铁氧化合物循环制H2具有成本低、产物易分离等优点
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
过程Ⅰ:2Fe3O4(s)===6FeO(s)+O2(g),当有2 mol Fe3O4分解时,生成1 mol氧气,而232 g Fe3O4的物质的量为1 mol,故生成0.5 mol氧气,而氧元素由-2价变为0价,故转移2 mol电子,故A正确;
已知反应①2H2O(l)===2H2(g)+O2(g) ΔH=571.0 kJ·mol-1和反应②2Fe3O4(s)===6FeO(s)+O2(g) ΔH=313.2 kJ·mol-1,根据盖斯定律,将①× -②× 可得过程Ⅱ的热化学方程式:3FeO(s)+H2O(l)===H2(g)+Fe3O4(s) ΔH=128.9 kJ·mol-1,故B正确;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
过程Ⅰ和过程Ⅱ均为吸热反应,不存在将化学能转化为热能的过程,故C错误;
反应3FeO(s)+H2O(l)===H2(g)+Fe3O4(s)的产物中,氢气为气体,而Fe3O4为固体,故铁氧化合物循环制H2的产物易分离,且由于利用太阳能,成本低,故D正确。
14.固态或气态碘分别与氢气反应的热化学方程式如下:
①H2(g)+I2(?) 2HI(g) ΔH1=-9.48 kJ·mol-1
②H2(g)+I2(?) 2HI(g) ΔH2=26.48 kJ·mol-1
下列判断不正确的是
A.反应①中的I2为气态,反应②中的I2为固态
B.反应②的反应物总能量比反应①的反应物总能量低
C.反应①的生成物比反应②的生成物热稳定性更好
D.1 mol固态碘升华时将吸收35.96 kJ热量
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
已知反应①放出能量,反应②吸收能量,所以反应①中I2的能量高,则反应①中I2为气态,反应②中的I2为固态,故A项正确;
反应②的反应物总能量比反应①的反应物总能量低,故B项正确;
反应①②的生成物都是气态碘化氢,所以二者热稳定性相同,故C项错误;
由盖斯定律知,将②-①得I2(s)===I2(g) ΔH=35.96 kJ·mol-1,故D项正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
15.用如图所示的装置测定中和反应反应热。实验药品:100 mL 0.50 mol·L-1盐酸、50 mL 0.50 mol·L-1NaOH溶液、50 mL 0.50 mol·L-1氨水。已知:弱碱电离时吸热。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
回答下列问题:
(1)从实验装置上看,还缺少_________________,其能否用铜质材料替代?_____(填“能”或“不能”),理由是__________________________
_________。
环形玻璃搅拌棒
不能
金属材料易散热,会使实验
误差增大
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
由简易量热计的构造可知该装置缺少的仪器是环形玻璃搅拌棒;金属材料易散热,会使实验误差增大,所以不可以用铜质材料替代。
(2)装置中隔热层的作用是__________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
减少实验过程中的热量损失
做中和反应反应热的测定实验要做好保温工作,隔热层的作用是减少实验过程中的热量损失。
(3)将浓度为0.50 mol·L-1的酸溶液和0.50 mol·L-1的碱溶液各50 mL混合(溶液密度均为1 g·mL-1),生成的溶液的比热c=4.18 J·g-1·℃-1,测得温度如下:
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
反应物 起始温度t1/℃ 最高温度t2/℃
甲组(HCl+NaOH) 15.0 18.3
乙组(HCl+NH3·H2O) 15.0 18.1
①两组实验结果存在差异的原因是________________________________
______________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
反应物 起始温度t1/℃ 最高温度t2/℃
甲组(HCl+NaOH) 15.0 18.3
乙组(HCl+NH3·H2O) 15.0 18.1
NH3·H2O为弱碱,电离时要吸热,
导致放热较少
两组实验一个是强酸和强碱的反应,一个是强酸和弱碱的反应,NH3·H2O为弱碱,电离时要吸热,导致放热较少。
②HCl(aq)+NH3·H2O(aq)===NH4Cl(aq)+H2O(l)的ΔH=______________
(保留一位小数)。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
-51.8 kJ·mol-1
反应物 起始温度t1/℃ 最高温度t2/℃
甲组(HCl+NaOH) 15.0 18.3
乙组(HCl+NH3·H2O) 15.0 18.1
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
50 mL 0.50 mol·L-1盐酸与50 mL 0.50 mol·L-1氨水的总质量为100 mL×1 g·mL-1
=100 g,c=4.18 J·g-1·℃-1,则生成0.025 mol水放出的热量为4.18 J·g-1·℃-1
×100 g×3.1 ℃=1.295 8 kJ,所以生成1 mol水放出的热量为 kJ≈
51.8 kJ,则反应HCl(aq)+NH3·H2O(aq)===NH4Cl(aq)+H2O(l)的ΔH=-51.8 kJ·
mol-1。
反应物 起始温度t1/℃ 最高温度t2/℃
甲组(HCl+NaOH) 15.0 18.3
乙组(HCl+NH3·H2O) 15.0 18.1
③某同学利用上述装置重新做甲组实验,测得反应热ΔH偏大,则可能的原因是_____(填字母)。
A.测完盐酸的温度直接测NaOH溶液温度 B.做该实验时室温较高
C.杯盖未盖严 D.NaOH溶液一次性迅速倒入
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
反应物 起始温度t1/℃ 最高温度t2/℃
甲组(HCl+NaOH) 15.0 18.3
乙组(HCl+NH3·H2O) 15.0 18.1
AC
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
测完盐酸的温度直接测NaOH溶液温度时,温度计上残留的酸液未用水冲洗干净,酸碱中和会放热,导致一部分反应物损失,使测得的ΔH偏大,A项可能;
做该实验时室温较高,不会影响实验结果,B项不可能;
杯盖未盖严会导致热量散失,使测得的ΔH偏大,C项可能;
NaOH溶液一次性迅速倒入可以减少实验误差,减少热量损失,D项不可能。
16.热力学标准状况(298.15 K、101 kPa)下,由稳定单质发生反应生成
1 mol化合物的反应热叫该化合物的生成热(ΔH)。图甲为第ⅥA族元素氢化物a、b、c、d的生成热数据示意图。试完成下列问题。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
(1)①请你归纳非金属元素氢化物的稳定性与氢化物的生成热ΔH的关系:_________________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
非金属元素氢化物越稳定,ΔH越小
②硒化氢在上述条件下发生分解反应的热化学方程式为______________
____________________________。
H2Se(g)===Se(s)
+H2(g) ΔH=-81 kJ·mol-1
(2)在25 ℃、101 kPa下,已知SiH4气体在氧气中完全燃烧后恢复至原状态,平均每转移1 mol电子放热190.0 kJ,该反应的热化学方程式是_________________________________________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
SiH4(g)+2O2(g)===SiO2(s)+2H2O(l) ΔH=-1 520.0 kJ·mol-1
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
SiH4气体在氧气中完全燃烧的化学方程式为SiH4+2O2 SiO2+2H2O,由化学方程式可知,1 mol SiH4完全燃烧转移8 mol电子,故热化学方程式为SiH4(g)+2O2(g)===SiO2(s)+2H2O(l) ΔH=-1 520.0 kJ·mol-1。
(3)根据图乙写出反应CO(g)+2H2(g)===CH3OH(g)的热化学方程式:______________________________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
CO(g)+2H2(g)===CH3OH(g) ΔH=-91 kJ·mol-1
ΔH=419 kJ·mol-1-510 kJ·mol-1=-91 kJ·mol-1,故该反应的热化学方程式为CO(g)+2H2(g)===CH3OH(g) ΔH=-91 kJ·mol-1。
(4)由金红石(TiO2)制取单质Ti的步骤为
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
已知:Ⅰ.C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1
Ⅱ.2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1
Ⅲ.TiO2(s)+2Cl2(g)===TiCl4(s)+O2(g) ΔH=141 kJ·mol-1
①TiO2(s)+2Cl2(g)+2C(s)===TiCl4(s)+2CO(g)的ΔH=_____________。
-80 kJ·mol-1
②反应TiCl4+2Mg 2MgCl2+Ti在Ar气氛中进行的理由是______
__________________________________________。
高温下Mg、Ti与空气中的O2(或CO2、N2)作用
防止
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
根据盖斯定律,由2×Ⅰ-Ⅱ+Ⅲ可得:TiO2(s)+2Cl2(g)+2C(s)===
TiCl4(s)+2CO(g) ΔH=-80 kJ·mol-1。
返回
专题1
本课结束
第2课时
DIERKESHI
中和反应反应热的测量 / 盖斯定律及其应用 / 课时对点练
反应热的测量与计算
专题1
1.科学探究:
理解反应热测定的原理和方法,会分析产生误差的原因,不断完善和改进测定方法。
2.证据推理与模型认知:
构建盖斯定律模型,理解盖斯定律的本质,形成运用盖斯定律进行相关判断或计算的思维模型。
3.科学态度与社会责任:
了解盖斯定律对反应热测定的重要意义,增强为人类科学发展而努力的意识与社会责任感。
内容索引
一、中和反应反应热的测量
二、盖斯定律及其应用
课时对点练
中和反应反应热的测量
一
1.量热计和简易量热计的构造
(1)将下列实验装置中各仪器(或物品)的名称填在横线上。
温度计
环形
玻璃
搅拌棒
(2)仪器各部分的作用
①搅拌器或环形玻璃搅拌棒的作用是使 。
②保温层的作用是 。
③温度计的作用是测定反应前后反应体系的温度。
2.实验原理
用体积均为50 mL的一元强酸、一元强碱,它们的浓度均为0.50 mol·L-1。
由于是稀溶液,且为了计算简便,我们近似地认为,所用酸、碱溶液的密度均为1 g·cm-3,根据热化学方程式H+(aq)+ OH-(aq)===H2O (l)
ΔH=-Q kJ·mol-1,需计算稀的酸、碱中和生成1 mol水的反应热,而
反应物混合均匀充分接触
减少热量的散失
50 mL 0.50 mol·L-1的盐酸与50 mL 0.50 mol·L-1 氢氧化钠溶液反应后生成的水只有0.025 mol。
C=(VHCl·ρHCl+VNaOH·ρNaOH)×4.18 J·℃-1,生成1 mol H2O(l)时的反应热
ΔH= kJ·mol-1,其中溶液的质量m约为100 g。
3.实验步骤及测量数据
(1)初始温度:测量混合前50 mL 0.50 mol·L-1盐酸的温度为T1 ℃、50 mL 0.50 mol·L-1氢氧化钠溶液的温度为T2 ℃,取 为
(2)终止温度(T3):将酸、碱溶液迅速混合,用 不断搅动溶液,并准确读取混合溶液的 ,记录为终止温度T3。反应体
系的温度变化为ΔT=
两温度平均值
环形玻璃搅拌棒
最高温度
(3)重复实验操作三次,记录每次的实验数据,取其平均值作为计算依据。
(4)实验数据处理
该实验中盐酸和氢氧化钠溶液反应放出的热量是 kJ,
生成1 mol H2O(l)时的反应热为-16.72(T3- )kJ·mol-1[或ΔH=
- kJ·mol-1]。
(1)将酸碱迅速混合后,待温度计读数稳定后记录终止温度( )
(2)中和反应反应热的测定实验中的环形玻璃搅拌棒换成铜质搅拌器效果更好( )
(3)中和反应反应热的测定实验中,应将50 mL 0.50 mol·L-1 NaOH溶液分多次倒入小烧杯( )
(4)中和反应反应热的测定实验中,测定盐酸后的温度计没有冲洗干净,立即测NaOH溶液的温度( )
正误判断
×
×
×
×
1.根据上述测定中和反应反应热的实验,思考回答下列问题:
(1)用同体积、同浓度的KOH代替NaOH完成上述实验,用同体积、同浓度的硝酸代替盐酸完成上述实验,测得的反应热数值三者是否相同?简述其中的原因。
提示 相同。参加反应的物质都是强酸、强碱,它们在水中完全电离,中和反应的离子方程式都是H++OH-===H2O,反应都在室温下进行,且参加反应的n(H+)和n(OH-)都相同,所以反应热也相同。
(2)用浓硫酸代替盐酸对结果会产生什么影响?用醋酸代替盐酸对结果会产生什么影响?
提示 浓硫酸溶于水时放热,所测ΔH偏小;弱酸电离吸热,所测ΔH偏大。
2.为了测定酸碱中和反应生成1 mol水时的反应热,计算时至少需要的数据是____________。
①酸溶液的浓度和体积 ②碱溶液的浓度和体积 ③比热容 ④反应后溶液的质量(单位:g) ⑤生成水的物质的量 ⑥反应前后温度变化
⑦操作所需的时间
③④⑤⑥
应用体验
1.某同学通过实验测出稀盐酸和稀NaOH溶液(碱稍过量)反应生成1 mol水的反应热ΔH=-52.3 kJ·mol-1,比理论数值要小,造成这一结果的原因不可能的是
A.实验装置保温、隔热效果差
B.用量筒量取盐酸时仰视读数
C.分多次将NaOH溶液倒入量热计的内筒中
D.用测量盐酸的温度计直接测定NaOH溶液的温度
√
若装置保温、隔热效果差,会造成较多的热量损失,测得的反应热数值偏小,A项可能;
用量筒取液体,仰视读数时,实际量取的溶液体积多于应该量取的溶液体积,会导致放出的热量变多,B项不可能;
C项操作会导致较多的热量损失,C项可能;
D项操作会导致测得的NaOH溶液的初始温度偏高,最后计算出的反应放出的热量比实际放出的热量少,D项可能。
2.用如图所示的量热计测定醋酸溶液与氢氧化钠溶液中和反应的反应热。将100 mL、0.50 mol·L-1 CH3COOH溶液与100 mL、0.55 mol·L-1 NaOH溶液混合,温度从25.2 ℃升高到27.7 ℃。已知量热计的热容常数(量热计各部件每升高1 ℃所需的热量)是150 J·℃-1,0.250 mol·L-1 CH3COONa溶液的比热容为4 J·g-1·℃-1,溶液的密度为1 g·cm-3。
(1)1 mol CH3COOH完全中和的反应热ΔH=________________。
-47.5 kJ·mol-1
(2)实验中NaOH溶液过量的目的是_________________
__________。
(3)1 mol CH3COOH发生中和反应的反应热的文献值为-56 kJ·mol-1,你认为(1)中测得的实验值偏差的可能原因是______________________。
保证醋酸完全被
NaOH中和
保温效果差或测温不准
(4)你认为CH3COOH与NaOH中和反应的ΔH1和HCl与NaOH中和反应的ΔH2相比_____(填“ΔH1”“ΔH2”或“一样”)大,原因是____________
___________。
ΔH1
CH3COOH
电离需吸热
归纳总结
测定中和反应的反应热需注意的几个问题
(1)简易量热计的保温隔热效果要好。
(2)实验中要用强酸和强碱的稀溶液。
(3)碱液(或酸液)稍过量,以确保酸(或碱)完全反应。
(4)读取的温度(t)是反应体系的最高温度。
(5)实验操作动作要迅速,尽量减少热量损失。
返回
盖斯定律及其应用
二
1.盖斯定律的理解
(1)大量实验证明,一个化学反应,不论是 完成,还是 完成,其总的热效应是 的。
(2)化学反应的焓变(ΔH)只与反应体系的 和 有关,而与反应的 无关。
一步
分几步
完全相等
始态
终态
途径
始态和终态相同的某反应途径有如下三种:
例1
则:ΔH= =________________
ΔH1+ΔH2
ΔH3+ΔH4+ΔH5
2.盖斯定律的意义
应用盖斯定律可以间接计算以下情况(不能直接测定)的反应热:
(1)有些反应速率很慢。
(2)有些反应不容易直接发生。
(3)有些反应的产品不纯(有副反应发生)。
根据如下两个反应:
Ⅰ.C(s)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1
例2
(1)虚拟路径法
反应C(s)+O2(g)===CO2(g)的途径可设计如下:
则ΔH= kJ·mol-1。
-110.5
(2)加合法
①写出目标反应的热化学方程式,确定各物质在各反应中的位置:
____________________;
③将热化学方程式相加,ΔH也相加,即Ⅰ+Ⅲ得:
,则ΔH= kJ·mol-1。
-110.5
②将已知热化学方程式Ⅱ变形,得反应Ⅲ:
(1)对一个化学反应,如果反应的途径不同,其焓变也可能不同( )
(2)化学反应的反应热只与反应体系的始态和终态有关,和反应途径及条件无关( )
(3)可以通过实验直接测定任一反应的反应热( )
(4)反应热的数值和热化学方程式的化学计量数无关( )
(5)同温同压下,H2和Cl2分别在光照条件下和点燃条件下发生反应时ΔH不同( )
正误判断
×
√
×
×
×
已知25 ℃、101 kPa下,石墨、金刚石燃烧的热化学方程式分别为
①C(石墨,s)+O2(g)===CO2(g) ΔH=-393.51 kJ·mol-1
②C(金刚石,s)+O2(g)===CO2(g) ΔH=-395.41 kJ·mol-1
据此判断,石墨、金刚石哪个更稳定?写出判断依据。
提示 石墨。根据盖斯定律,将①式减去②式,得到:C(石墨,s)===C(金刚石,s) ΔH=1.90 kJ·mol-1,说明由石墨制备金刚石是吸热反应,吸收的热量作为化学能的形式贮存在金刚石中,也就是等质量的金刚石具有的能量比石墨高,能量低的稳定,所以石墨更稳定。
应用体验
1.已知:P4(白磷,s)+5O2(g)===P4O10(s) ΔH1;
设计成如下转化路径,请填空:
则ΔH= 。
ΔH1-4ΔH2
2.(2022·武汉新洲区检测)黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为
S(s)+2KNO3(s)+3C(s)===K2S(s)+N2(g)+3CO2(g) ΔH
已知:C(s)+O2(g)===CO2(g) ΔH1
S(s)+2K(s)===K2S(s) ΔH2
2K(s)+N2(g)+3O2(g)===2KNO3(s) ΔH3
则ΔH为__________________(写出计算过程)。
答案 3ΔH1+ΔH2-ΔH3
根据已知热化学方程式:
C(s)+O2(g)===CO2(g) ΔH1①
S(s)+2K(s)===K2S(s) ΔH2②
2K(s)+N2(g)+3O2(g)===2KNO3(s) ΔH3③
将方程式3×①+②-③得S(s)+2KNO3(s)+3C(s)===K2S(s)+N2(g)+3CO2(g),则ΔH=3ΔH1+ΔH2-ΔH3
归纳总结
四步分析法应用于盖斯定律的计算(思维模型)
(1)分析目标反应和已知反应的差异,明确:①目标反应物和生成物;②需要消掉的中间产物。
(2)将每个已知的热化学方程式两边同乘以某个合适的数,使已知热化学方程式中某种反应物或生成物的化学计量数与目标热化学方程式中的该物质的化学计量数一致,热化学方程式的焓变也进行相应的计算。
归纳总结
(3)将已知热化学方程式相加减消掉目标反应热化学方程式中没有的物质(同侧相减,异侧相加消去中间产物)。
(4)得出目标热化学方程式(目标热化学方程式化学计量数不能存在公约数,应为最简形式)。
以上步骤可以概括为找目标、看来源、调系数、相加减、得答案。
返回
课时对点练
题组一 中和反应的反应热及其测量
1.(2022·浙江杭州西湖高级中学月考)下列有关测定中和反应反应热实验的说法正确的是
A.用铜丝代替环形玻璃搅拌棒,测得的ΔH偏大
B.强酸的稀溶液与强碱的稀溶液反应生成1 mol H2O的ΔH均为-57.3 kJ·mol-1
C.测定中和反应反应热的实验中,混合溶液的温度不再变化时,该温度为终止温度
D.某同学通过实验测出稀盐酸和稀NaOH溶液反应生成1 mol H2O的反应热ΔH
=-52.3 kJ·mol-1,造成这一结果的原因不可能是用测量过稀盐酸温度的温
度计直接测量稀NaOH溶液的温度
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
铜为热的良导体,容易导致热量散失,使测得的ΔH偏大,A项正确;
部分强酸的稀溶液与强碱的稀溶液反应不仅生成H2O,还生成沉淀,如一定量的稀硫酸与稀Ba(OH)2溶液反应生成1 mol H2O时还有0.5 mol BaSO4沉淀生成,Ba2+与 结合生成BaSO4时放热,则该反应的ΔH≠-57.3 kJ·mol-1,B项错误;
测定中和反应反应热时,混合溶液的最高温度为终止温度,C项错误;
用测量过稀盐酸温度的温度计直接测量稀NaOH溶液的温度会导致部分酸碱提前反应,从而使测得的ΔH的绝对值偏小,D项错误。
2.下列有关H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1的说法正确的是
A. 代表所有的酸碱中和反应
B.反应物一定是强酸与强碱
C.强酸与强碱的中和反应的热化学方程式都可以这样表示
D.表示稀的强酸溶液与稀的强碱溶液反应生成可溶性盐和1 mol液态水
时放出57.3 kJ热量
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
弱酸与弱碱在溶液中主要以分子形式存在,由于电离吸热,生成1 mol液态水时放出的热量小于57.3 kJ,A项错误;
该热化学方程式表示的反应不一定是强酸与强碱的反应,也可以是硫酸氢钠与氢氧化钠的反应,B项错误;
该热化学方程式不能表示强酸与强碱生成难溶性盐的反应,如硫酸与氢氧化钡的反应,C项错误;
H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1表示稀的强酸溶液与稀的强碱溶液反应生成可溶性盐和1 mol 液态水时放出57.3 kJ热量,D项正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
3.用50 mL 0.50 mol·L-1盐酸和50 mL 0.55 mol·L-1 NaOH溶液测定H+(aq)+OH-(aq)===H2O(l)的反应热(ΔH)的实验时,下列说法不正确的是
A.酸碱混合时,量筒中NaOH溶液应缓缓倒入量热计内筒中,不断用环
形玻璃搅拌棒搅拌
B.装置中的大小烧杯之间填满碎泡沫塑料的作用是保温隔热,减少热量损失
C.用量筒量取NaOH溶液时,仰视取液,测得的反应热ΔH不变
D.改用25 mL 0.50 mol·L-1盐酸跟25 mL 0.55 mol·L-1 NaOH溶液进行测定,
ΔH数值不变
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
中和反应反应热测定实验成败的关键是做好保温工作,B正确;
用量筒量取NaOH溶液时,仰视取液,氢氧化钠溶液体积高于所需量的体积,但生成水的量不变,放出的热量不变,测得的中和反应反应热ΔH不变,C正确;
反应放出的热量与所用酸和碱的量有关,但生成1 mol水时中和反应反应热的大小与参加反应的酸碱用量无关,D正确。
4.利用如图装置测定中和反应反应热的实验,下列说法错误的是
A.若用醋酸代替HCl做实验,会使测定结果偏大
B.加入NaOH溶液的正确操作是分三次沿玻璃棒缓慢加入
C.烧杯间填满碎泡沫塑料的作用是保温隔热,减少热量的
损失
D.该实验测得的中和热ΔH的数值比理论值偏低,其原因可能是测量完
硫酸溶液温度的温度计直接用来测NaOH溶液的温度
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
醋酸是弱酸,电离吸热,所以用醋酸代替HCl做实验,放出热量减少,但因ΔH为负值,所以会使测定结果偏大,故A正确;
倒入氢氧化钠溶液时,必须一次迅速的倒入,目的是
减少热量的散失,故B错误;
大小烧杯之间填满碎泡沫塑料的作用是保温、隔热,减少实验过程中的热量散失,故C正确;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
温度计测定稀H2SO4溶液起始温度后直接插入NaOH测温度,NaOH的起始温度偏高,测得的热量偏小,中和热的数值偏低,故D正确。
5.将V1 mL 1.00 mol·L-1 HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50)。下列叙述正确的是
A.做该实验时环境温度为22 ℃
B.NaOH溶液的浓度约为1.5 mol·L-1
C.该实验中需要使用环形玻璃搅拌棒
在水平方向轻轻转动搅拌
D.该实验可用相同物质的量的氢氧化钠固体投入盐酸中测定中和反应反
应热
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
该实验开始时混合液温度是22 ℃,故A错误;
恰好完全反应时参加反应的盐酸的体积是30 mL,由V1+V2=50可知,消耗的氢氧化钠溶液的体积为20 mL,设恰好反应时氢氧化钠溶液中溶质的物质的量是n,
HCl + NaOH===NaCl+H2O
1 1
1.00 mol·L-1×0.03 L n
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
则n=1.00 mol·L-1×0.03 L=0.03 mol,所以浓度是 =1.5 mol·L-1,故B正确;
该实验中需要使用环形玻璃搅拌棒在上下方向轻轻转动搅拌,故C错误;
该实验不可用相同物质的量的氢氧化钠固体投入盐酸中测定中和反应反应热,否则会因NaOH固体溶解放热,使得测定数值偏大,故D错误。
题组二 盖斯定律的内容与本质
6.下列关于盖斯定律的说法不正确的是
A.不管反应是一步完成还是分几步完成,其反应热相同
B.反应热只与反应体系的始态和终态有关,而与反应的途径无关
C.有些反应的反应热不能直接测得,可通过盖斯定律间接计算得到
D.根据盖斯定律,热化学方程式中ΔH直接相加即可得总反应热
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
热化学方程式按一定系数比加和时其反应热也按系数比加和,D错误。
7.物质A在一定条件下可发生一系列转化,由图判断下列关系错误的是
A.A→F ΔH=-ΔH6
B.ΔH1+ΔH2+ΔH3+ΔH4+ΔH5+ΔH6=1
C.C→F |ΔH|=|ΔH1+ΔH2+ΔH6|
D.|ΔH1+ΔH2+ΔH3|=|ΔH4+ΔH5+ΔH6|
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
由盖斯定律可知:A→F ΔH=ΔH1+ΔH2+ΔH3+ΔH4+ΔH5=-ΔH6,即ΔH1+ΔH2+ΔH3+ΔH4+ΔH5+ΔH6=0,故A项正确、B项错误;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
由C→F可以判断,ΔH=ΔH3+ΔH4+ΔH5=-(ΔH1+ΔH2+ΔH6),故C项正确;
由A→D知:ΔH=ΔH1+ΔH2+ΔH3=-(ΔH4+ΔH5+ΔH6),故D项正确。
8.已知煤转化成水煤气及其燃烧过程的能量变化如图,下列说法不正确的是
A.由ΔH3可知,该步反应的反应物键
能总和小于生成物的键能总和
B.ΔH1-ΔH2+ΔH3=0
C.ΔH1<ΔH2
D.若用C(s)和H2O(l)转化为H2(g)和CO(g),则ΔH2变大
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
燃烧为放热反应,ΔH3<0,焓变等于反应物的键能总和减去生成物的
键能总和,则由ΔH3可知,该步反应的反应物键能总和小于生成物的键能总和,故A正确;
由盖斯定律可知,ΔH1=ΔH2+ΔH3,则ΔH1-ΔH2-ΔH3=0,故B错误;
ΔH2>0,而ΔH1<0,则ΔH1<ΔH2,故C正确;
C与水蒸气的反应为吸热反应,且气态水的能量比液态水的能量高,则用C(s)和H2O(l)转化为H2(g)和CO(g),则ΔH2变大,故D正确。
题组三 盖斯定律的应用
9.已知热化学方程式:
C(金刚石,s)+O2(g)===CO2(g) ΔH1;
C(石墨,s)+O2(g)===CO2(g) ΔH2;
C(石墨,s)===C(金刚石,s) ΔH3=1.9 kJ·mol-1
下列说法正确的是
A.金刚石比石墨稳定 B.ΔH1>ΔH2
C.ΔH3=ΔH1-ΔH2 D.石墨转化成金刚石的反应是吸热反应
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
石墨转化为金刚石要吸收能量,说明石墨的能量低,石墨比金刚石稳定,A错误,D正确;
石墨的能量低于金刚石的能量,故石墨燃烧放出的能量比金刚石低,放热反应的ΔH<0,则ΔH1<ΔH2,B错误;
将3个热化学方程式依次编为1式、2式、3式,根据盖斯定律,3式=2式-1式,故ΔH3=ΔH2-ΔH1,C错误。
10.室温下,CuSO4·5H2O(s)===Cu2+(aq)+ (aq)+5H2O(l) ΔH1>0;CuSO4(s)===Cu2+(aq)+ (aq) ΔH2<0。若CuSO4·5H2O受热分解的化学
方程式为CuSO4·5H2O(s) CuSO4(s)+5H2O(l),热效应为ΔH3,则下
列判断正确的是
A.ΔH1<ΔH3 B.ΔH2>ΔH3
C.ΔH1+ΔH3=ΔH2 D.ΔH1+ΔH2=ΔH3
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
已知CuSO4·5H2O(s)===Cu2+(aq)+ (aq)+5H2O(l) ΔH1>0①,CuSO4(s)===Cu2+(aq)+ (aq) ΔH2<0②,根据盖斯定律将①-②
得到CuSO4·5H2O(s)===CuSO4(s)+5H2O(l) ΔH3=ΔH1-ΔH2,因为ΔH1>0,ΔH2<0,故ΔH1<ΔH3,ΔH2<ΔH3,故A正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
11.肼(N2H4)是火箭发动机的一种燃料,反应时N2O4为氧化剂,反应生成N2和水蒸气。
已知:
①N2(g)+2O2(g)===N2O4(g) ΔH=8.7 kJ·mol-1
②N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=-534 kJ·mol-1
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
下列表示N2H4(g)和N2O4(g)反应的热化学方程式,正确的是
A.2N2H4(g)+N2O4(g)===3N2(g)+4H2O(g) ΔH=-1 076.7 kJ·mol-1
B.N2H4(g)+ N2O4(g)=== N2(g)+2H2O(g) ΔH=-542.7 kJ·mol-1
C.2N2H4(g)+N2O4(g)===3N2(g)+4H2O(g) ΔH=-542.7 kJ·mol-1
D.2N2H4(g)+N2O4(g)===3N2(g)+4H2O(l) ΔH=-1 076.7 kJ·mol-1
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
根据盖斯定律,将②×2-①得2N2H4(g)+N2O4(g)===3N2(g)+4H2O(g) ΔH=-1 076.7 kJ·mol-1。
12.某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变成H2、CO、O2。其过程如下:
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
mCeO2 (m-x)CeO2·xCe+xO2
(m-x)CeO2·xCe+xH2O+xCO2 mCeO2+xH2+xCO
下列说法不正确的是
A.该过程中CeO2没有消耗
B.该过程实现了太阳能向化学能的转化
C.图中ΔH1=ΔH2+ΔH3
D.H2(g)+ O2(g)===H2O(g)的反应热大于ΔH3
√
通过太阳能实现总反应H2O+CO2===H2+CO+O2可知,CeO2没有消耗,CeO2为催化剂,故A正确;
该过程在太阳能作用下将H2O、CO2转变为H2、CO、O2,所以把太阳能转变成化学能,故B正确;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
由图中转化关系及盖斯定律可知:-ΔH1=ΔH2+ΔH3,故C错误;
气态水转化为液态水,放出能量,故H2(g)+ O2(g)===H2O(l)放热更多,焓变更小,故D正确。
13.已知:2H2O(l)===2H2(g)+O2(g) ΔH=571.0 kJ·mol-1。以太阳能为热源分解Fe3O4,经热化学铁氧化合物循环分解水制H2的过程如下:
过程Ⅰ:2Fe3O4(s)===6FeO(s)+O2(g) ΔH=313.2 kJ·mol-1
过程Ⅱ:……
下列说法不正确的是
A.过程Ⅰ中每消耗232 g Fe3O4转移2 mol电子
B.过程Ⅱ的热化学方程式:3FeO(s)+H2O(l)===H2(g)+Fe3O4(s) ΔH=128.9 kJ·mol-1
C.过程Ⅰ、Ⅱ中能量转化的形式依次是太阳能→化学能→热能
D.铁氧化合物循环制H2具有成本低、产物易分离等优点
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
过程Ⅰ:2Fe3O4(s)===6FeO(s)+O2(g),当有2 mol Fe3O4分解时,生成1 mol氧气,而232 g Fe3O4的物质的量为1 mol,故生成0.5 mol氧气,而氧元素由-2价变为0价,故转移2 mol电子,故A正确;
已知反应①2H2O(l)===2H2(g)+O2(g) ΔH=571.0 kJ·mol-1和反应②2Fe3O4(s)===6FeO(s)+O2(g) ΔH=313.2 kJ·mol-1,根据盖斯定律,将①× -②× 可得过程Ⅱ的热化学方程式:3FeO(s)+H2O(l)===H2(g)+Fe3O4(s) ΔH=128.9 kJ·mol-1,故B正确;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
过程Ⅰ和过程Ⅱ均为吸热反应,不存在将化学能转化为热能的过程,故C错误;
反应3FeO(s)+H2O(l)===H2(g)+Fe3O4(s)的产物中,氢气为气体,而Fe3O4为固体,故铁氧化合物循环制H2的产物易分离,且由于利用太阳能,成本低,故D正确。
14.固态或气态碘分别与氢气反应的热化学方程式如下:
①H2(g)+I2(?) 2HI(g) ΔH1=-9.48 kJ·mol-1
②H2(g)+I2(?) 2HI(g) ΔH2=26.48 kJ·mol-1
下列判断不正确的是
A.反应①中的I2为气态,反应②中的I2为固态
B.反应②的反应物总能量比反应①的反应物总能量低
C.反应①的生成物比反应②的生成物热稳定性更好
D.1 mol固态碘升华时将吸收35.96 kJ热量
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
已知反应①放出能量,反应②吸收能量,所以反应①中I2的能量高,则反应①中I2为气态,反应②中的I2为固态,故A项正确;
反应②的反应物总能量比反应①的反应物总能量低,故B项正确;
反应①②的生成物都是气态碘化氢,所以二者热稳定性相同,故C项错误;
由盖斯定律知,将②-①得I2(s)===I2(g) ΔH=35.96 kJ·mol-1,故D项正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
15.用如图所示的装置测定中和反应反应热。实验药品:100 mL 0.50 mol·L-1盐酸、50 mL 0.50 mol·L-1NaOH溶液、50 mL 0.50 mol·L-1氨水。已知:弱碱电离时吸热。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
回答下列问题:
(1)从实验装置上看,还缺少_________________,其能否用铜质材料替代?_____(填“能”或“不能”),理由是__________________________
_________。
环形玻璃搅拌棒
不能
金属材料易散热,会使实验
误差增大
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
由简易量热计的构造可知该装置缺少的仪器是环形玻璃搅拌棒;金属材料易散热,会使实验误差增大,所以不可以用铜质材料替代。
(2)装置中隔热层的作用是__________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
减少实验过程中的热量损失
做中和反应反应热的测定实验要做好保温工作,隔热层的作用是减少实验过程中的热量损失。
(3)将浓度为0.50 mol·L-1的酸溶液和0.50 mol·L-1的碱溶液各50 mL混合(溶液密度均为1 g·mL-1),生成的溶液的比热c=4.18 J·g-1·℃-1,测得温度如下:
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
反应物 起始温度t1/℃ 最高温度t2/℃
甲组(HCl+NaOH) 15.0 18.3
乙组(HCl+NH3·H2O) 15.0 18.1
①两组实验结果存在差异的原因是________________________________
______________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
反应物 起始温度t1/℃ 最高温度t2/℃
甲组(HCl+NaOH) 15.0 18.3
乙组(HCl+NH3·H2O) 15.0 18.1
NH3·H2O为弱碱,电离时要吸热,
导致放热较少
两组实验一个是强酸和强碱的反应,一个是强酸和弱碱的反应,NH3·H2O为弱碱,电离时要吸热,导致放热较少。
②HCl(aq)+NH3·H2O(aq)===NH4Cl(aq)+H2O(l)的ΔH=______________
(保留一位小数)。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
-51.8 kJ·mol-1
反应物 起始温度t1/℃ 最高温度t2/℃
甲组(HCl+NaOH) 15.0 18.3
乙组(HCl+NH3·H2O) 15.0 18.1
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
50 mL 0.50 mol·L-1盐酸与50 mL 0.50 mol·L-1氨水的总质量为100 mL×1 g·mL-1
=100 g,c=4.18 J·g-1·℃-1,则生成0.025 mol水放出的热量为4.18 J·g-1·℃-1
×100 g×3.1 ℃=1.295 8 kJ,所以生成1 mol水放出的热量为 kJ≈
51.8 kJ,则反应HCl(aq)+NH3·H2O(aq)===NH4Cl(aq)+H2O(l)的ΔH=-51.8 kJ·
mol-1。
反应物 起始温度t1/℃ 最高温度t2/℃
甲组(HCl+NaOH) 15.0 18.3
乙组(HCl+NH3·H2O) 15.0 18.1
③某同学利用上述装置重新做甲组实验,测得反应热ΔH偏大,则可能的原因是_____(填字母)。
A.测完盐酸的温度直接测NaOH溶液温度 B.做该实验时室温较高
C.杯盖未盖严 D.NaOH溶液一次性迅速倒入
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
反应物 起始温度t1/℃ 最高温度t2/℃
甲组(HCl+NaOH) 15.0 18.3
乙组(HCl+NH3·H2O) 15.0 18.1
AC
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
测完盐酸的温度直接测NaOH溶液温度时,温度计上残留的酸液未用水冲洗干净,酸碱中和会放热,导致一部分反应物损失,使测得的ΔH偏大,A项可能;
做该实验时室温较高,不会影响实验结果,B项不可能;
杯盖未盖严会导致热量散失,使测得的ΔH偏大,C项可能;
NaOH溶液一次性迅速倒入可以减少实验误差,减少热量损失,D项不可能。
16.热力学标准状况(298.15 K、101 kPa)下,由稳定单质发生反应生成
1 mol化合物的反应热叫该化合物的生成热(ΔH)。图甲为第ⅥA族元素氢化物a、b、c、d的生成热数据示意图。试完成下列问题。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
(1)①请你归纳非金属元素氢化物的稳定性与氢化物的生成热ΔH的关系:_________________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
非金属元素氢化物越稳定,ΔH越小
②硒化氢在上述条件下发生分解反应的热化学方程式为______________
____________________________。
H2Se(g)===Se(s)
+H2(g) ΔH=-81 kJ·mol-1
(2)在25 ℃、101 kPa下,已知SiH4气体在氧气中完全燃烧后恢复至原状态,平均每转移1 mol电子放热190.0 kJ,该反应的热化学方程式是_________________________________________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
SiH4(g)+2O2(g)===SiO2(s)+2H2O(l) ΔH=-1 520.0 kJ·mol-1
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
SiH4气体在氧气中完全燃烧的化学方程式为SiH4+2O2 SiO2+2H2O,由化学方程式可知,1 mol SiH4完全燃烧转移8 mol电子,故热化学方程式为SiH4(g)+2O2(g)===SiO2(s)+2H2O(l) ΔH=-1 520.0 kJ·mol-1。
(3)根据图乙写出反应CO(g)+2H2(g)===CH3OH(g)的热化学方程式:______________________________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
CO(g)+2H2(g)===CH3OH(g) ΔH=-91 kJ·mol-1
ΔH=419 kJ·mol-1-510 kJ·mol-1=-91 kJ·mol-1,故该反应的热化学方程式为CO(g)+2H2(g)===CH3OH(g) ΔH=-91 kJ·mol-1。
(4)由金红石(TiO2)制取单质Ti的步骤为
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
已知:Ⅰ.C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1
Ⅱ.2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1
Ⅲ.TiO2(s)+2Cl2(g)===TiCl4(s)+O2(g) ΔH=141 kJ·mol-1
①TiO2(s)+2Cl2(g)+2C(s)===TiCl4(s)+2CO(g)的ΔH=_____________。
-80 kJ·mol-1
②反应TiCl4+2Mg 2MgCl2+Ti在Ar气氛中进行的理由是______
__________________________________________。
高温下Mg、Ti与空气中的O2(或CO2、N2)作用
防止
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
根据盖斯定律,由2×Ⅰ-Ⅱ+Ⅲ可得:TiO2(s)+2Cl2(g)+2C(s)===
TiCl4(s)+2CO(g) ΔH=-80 kJ·mol-1。
返回
专题1
本课结束
