专题1 第一单元 化学反应的热效应 微专题2 “四根据”破解热化学方程式的书写(共20张ppt)
文档属性
| 名称 | 专题1 第一单元 化学反应的热效应 微专题2 “四根据”破解热化学方程式的书写(共20张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 385.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-21 22:04:10 | ||
图片预览







文档简介
(共20张PPT)
微专题2
WEIZHUANTIER
“四根据”破解热化学方程式的书写
专题1
题型1 根据反应的热量变化
ΔH与化学方程式一一对应,利用已知的质量或物质的量及对应的能量变化换算成化学方程式的计量数对应的ΔH,一定要标注物质的聚集状态。
NaBH4(s)与H2O(l)反应生成NaBO2(s)和H2(g),在25 ℃、101 kPa下,
已知每消耗3.8 g NaBH4(s)放热21.6 kJ,该反应的热化学方程式是_________
________________________________________________。
例1
+2H2O(l)===NaBO2(s)+4H2(g) ΔH=-216 kJ·mol-1
在25 ℃、101 kPa下,已知每消耗3.8 g NaBH4(s)放热21.6 kJ,则消耗1 mol
NaBH4(s)即38 g放热216 kJ,因此该反应的热化学方程式是NaBH4(s)+2H2O(l)===NaBO2(s)+4H2(g) ΔH=-216 kJ·mol-1。
NaBH4(s)
题型2 根据化学键的键能
(1)明确每种物质的化学键种类和数目,且按照化学计量数表示的物质的量计算。
(2)ΔH=E(反应物的总键能)-E(生成物的总键能)。
氮的化合物在生产、生活中广泛存在。键能是将1 mol理想气体分子AB拆开为中性气态原子A和B所需的能量。已知化学键的键能如下表:
例2
化学键 N≡N O==O N—N N—H O—H
键能/ (kJ·mol-1) 946 497 193 391 463
写出1 mol气态肼(H2N—NH2)燃烧生成氮气和水蒸气的热化学方程式:_______________________________________________________。
N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=-544 kJ·mol-1
根据焓变=反应物的总键能-生成物的总键能,1 mol 气态肼(H2N—NH2)
燃烧生成氮气和水蒸气的焓变为193 kJ·mol-1+391 kJ·mol-1×4+497 kJ·
mol-1-946 kJ·mol-1-463 kJ·mol-1×4=-544 kJ·mol-1,所以1 mol气态肼(H2N—NH2)燃烧生成氮气和水蒸气的热化学方程式是N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=-544 kJ·mol-1。
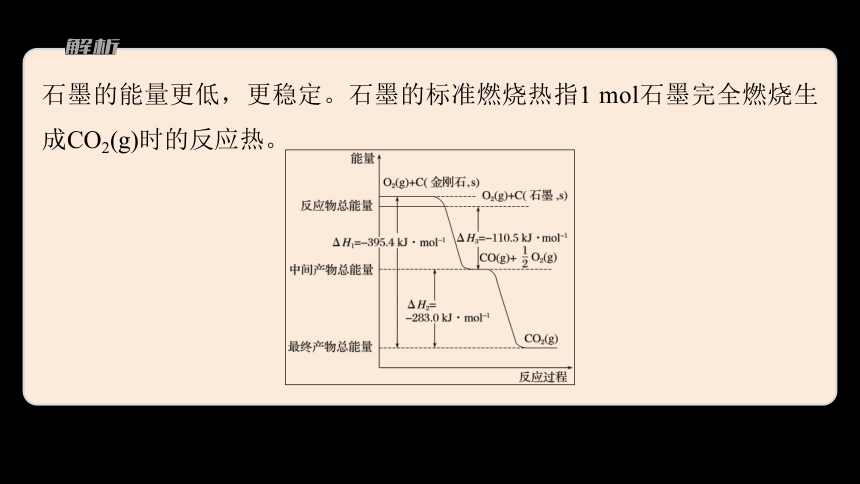
金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,充分燃烧生成二氧化碳,反应中放出的热量如图所示。
例3
题型3 根据能量图像
(1)在通常状况下,______(填“金刚石”或“石墨”)更稳定,石墨的标准燃烧热为_________________。
石墨
-393.5 kJ·mol-1
石墨的能量更低,更稳定。石墨的标准燃烧热指1 mol石墨完全燃烧生成CO2(g)时的反应热。
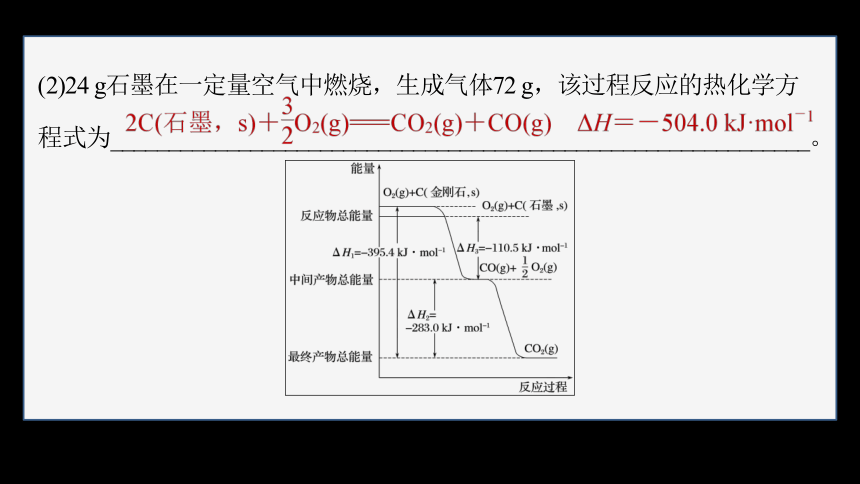
(2)24 g石墨在一定量空气中燃烧,生成气体72 g,该过程反应的热化学方
程式为____________________________________________________________。
24 g石墨和48 g O2反应,即2 mol C和1.5 mol O2反应,生成1 mol CO2和1 mol CO,放出的热量为1 mol×110.5 kJ·mol-1+1 mol×(110.5 kJ·mol-1
+283.0 kJ·mol-1)=504 kJ,故该过程反应的热化学方程式:
2C(石墨,s)+ O2(g)===CO2(g)+CO(g) ΔH=-504.0 kJ·mol-1。
当今,世界多国相继规划了碳达峰、碳中和的时间节点。因此,研发二氧化碳利用技术,降低空气中二氧化碳含量成为研究热点。
大气中的二氧化碳主要来自于煤、石油及其他含碳化合物的燃烧。已知25 ℃时,相关物质的标准燃烧热数据如表:
例3
题型4 根据盖斯定律
物质 H2(g) C(石墨,s) C6H6(l)
标准燃烧热ΔH/ (kJ·mol-1) -285.8 -393.5 -3 267.5
则25 ℃时H2(g)和C(石墨,s)生成C6H6(l)的热化学方程式为____________
____________________________________。
物质 H2(g) C(石墨,s) C6H6(l)
标准燃烧热ΔH/ (kJ·mol-1) -285.8 -393.5 -3 267.5
6C(石墨,s)
+3H2(g)===C6H6(l) ΔH=49.1 kJ·mol-1
根据表格中标准燃烧热数据可知,存在反应①C(石墨,s)+O2(g)===
CO2(g) ΔH1=-393.5 kJ·mol-1,②H2(g)+ O2(g)===H2O(l) ΔH2=-285.8 kJ·
mol-1,③C6H6(l)+ O2(g)===6CO2(g)+3H2O(l) ΔH3=-3 267.5 kJ·mol-1,
根据盖斯定律,①×6+②×3-③得反应:6C(石墨,s)+3H2(g)===C6H6(l)
ΔH=(-393.5 kJ·mol-1)×6+(-285.8 kJ·mol-1)×3-(-3 267.5 kJ·mol-1)=49.1 kJ·mol-1。
物质 H2(g) C(石墨,s) C6H6(l)
标准燃烧热ΔH/ (kJ·mol-1) -285.8 -393.5 -3 267.5
1
2
3
4
1.生产液晶显示器的过程中使用的化学清洗剂NF3是一种温室气体,其存储能量的能力是CO2的12 000~20 000 倍,在大气中的寿命可长达740年之久,表中是几种化学键的键能:
化学键 N≡N F—F N—F
键能/(kJ·mol-1) 941.7 154.8 283.0
写出利用N2和F2制备NF3的热化学方程式:_________________________
_____________________。
N2(g)+3F2(g)===2NF3(g)
ΔH=-291.9 kJ·mol-1
1
2
3
4
ΔH=(941.7+154.8×3-283.0×6) kJ·mol-1=-291.9 kJ·mol-1。
化学键 N≡N F—F N—F
键能/(kJ·mol-1) 941.7 154.8 283.0
2.在化工生产过程中,少量CO的存在会引起催化剂中毒。为了防止催化剂中毒,常用SO2将CO氧化,SO2被还原为S。已知:
1
2
3
4
①C(s)+ O2(g)===CO(g) ΔH1=-126.4 kJ·mol-1
②C(s)+O2(g)===CO2(g) ΔH2=-393.5 kJ·mol-1
③S(s)+O2(g)===SO2(g) ΔH3=-296.8 kJ·mol-1
则SO2氧化CO的热化学方程式为__________________________________
________________________。
SO2(g)+2CO(g)===S(s)+2CO2(g)
ΔH=-237.4 kJ·mol-1
3.用O2将HCl转化为Cl2,可提高效率,减少污染。传统上该转化通过如图所示的催化循环实现。
1
2
3
4
其中,反应①为2HCl(g)+CuO(s)===H2O(g)+CuCl2(s) ΔH1
反应②生成1 mol Cl2的反应热为ΔH2,则总反应的热化学方程式为____________________________________________________(反应热用ΔH1和ΔH2表示)。
4HCl(g)+O2(g)===2H2O(g)+2Cl2(g) ΔH=2ΔH1+2ΔH2
1
2
3
4
2HCl(g)+CuO(s)===H2O(g)+CuCl2(s) ΔH1 ①
由图得2CuCl2(s)+O2(g)===2CuO(s)+2Cl2(g) 2ΔH2 ②
运用盖斯定律:①×2+②得总反应:
4HCl(g)+O2(g)===2H2O(g)+2Cl2(g) ΔH=2ΔH1+2ΔH2。
1
2
3
4
4.工业上合成氨用的H2有多种制取的方法:
①用焦炭跟水反应:C(s)+H2O(g)===CO(g)+H2(g);
②用天然气跟水蒸气反应:CH4(g)+H2O(g)===
CO(g)+3H2(g)
已知有关反应的能量变化如图所示,则方法②中反应的ΔH=___________________。
(a+3b-c) kJ·mol-1
专题1
本课结束
微专题2
WEIZHUANTIER
“四根据”破解热化学方程式的书写
专题1
题型1 根据反应的热量变化
ΔH与化学方程式一一对应,利用已知的质量或物质的量及对应的能量变化换算成化学方程式的计量数对应的ΔH,一定要标注物质的聚集状态。
NaBH4(s)与H2O(l)反应生成NaBO2(s)和H2(g),在25 ℃、101 kPa下,
已知每消耗3.8 g NaBH4(s)放热21.6 kJ,该反应的热化学方程式是_________
________________________________________________。
例1
+2H2O(l)===NaBO2(s)+4H2(g) ΔH=-216 kJ·mol-1
在25 ℃、101 kPa下,已知每消耗3.8 g NaBH4(s)放热21.6 kJ,则消耗1 mol
NaBH4(s)即38 g放热216 kJ,因此该反应的热化学方程式是NaBH4(s)+2H2O(l)===NaBO2(s)+4H2(g) ΔH=-216 kJ·mol-1。
NaBH4(s)
题型2 根据化学键的键能
(1)明确每种物质的化学键种类和数目,且按照化学计量数表示的物质的量计算。
(2)ΔH=E(反应物的总键能)-E(生成物的总键能)。
氮的化合物在生产、生活中广泛存在。键能是将1 mol理想气体分子AB拆开为中性气态原子A和B所需的能量。已知化学键的键能如下表:
例2
化学键 N≡N O==O N—N N—H O—H
键能/ (kJ·mol-1) 946 497 193 391 463
写出1 mol气态肼(H2N—NH2)燃烧生成氮气和水蒸气的热化学方程式:_______________________________________________________。
N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=-544 kJ·mol-1
根据焓变=反应物的总键能-生成物的总键能,1 mol 气态肼(H2N—NH2)
燃烧生成氮气和水蒸气的焓变为193 kJ·mol-1+391 kJ·mol-1×4+497 kJ·
mol-1-946 kJ·mol-1-463 kJ·mol-1×4=-544 kJ·mol-1,所以1 mol气态肼(H2N—NH2)燃烧生成氮气和水蒸气的热化学方程式是N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=-544 kJ·mol-1。
金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,充分燃烧生成二氧化碳,反应中放出的热量如图所示。
例3
题型3 根据能量图像
(1)在通常状况下,______(填“金刚石”或“石墨”)更稳定,石墨的标准燃烧热为_________________。
石墨
-393.5 kJ·mol-1
石墨的能量更低,更稳定。石墨的标准燃烧热指1 mol石墨完全燃烧生成CO2(g)时的反应热。
(2)24 g石墨在一定量空气中燃烧,生成气体72 g,该过程反应的热化学方
程式为____________________________________________________________。
24 g石墨和48 g O2反应,即2 mol C和1.5 mol O2反应,生成1 mol CO2和1 mol CO,放出的热量为1 mol×110.5 kJ·mol-1+1 mol×(110.5 kJ·mol-1
+283.0 kJ·mol-1)=504 kJ,故该过程反应的热化学方程式:
2C(石墨,s)+ O2(g)===CO2(g)+CO(g) ΔH=-504.0 kJ·mol-1。
当今,世界多国相继规划了碳达峰、碳中和的时间节点。因此,研发二氧化碳利用技术,降低空气中二氧化碳含量成为研究热点。
大气中的二氧化碳主要来自于煤、石油及其他含碳化合物的燃烧。已知25 ℃时,相关物质的标准燃烧热数据如表:
例3
题型4 根据盖斯定律
物质 H2(g) C(石墨,s) C6H6(l)
标准燃烧热ΔH/ (kJ·mol-1) -285.8 -393.5 -3 267.5
则25 ℃时H2(g)和C(石墨,s)生成C6H6(l)的热化学方程式为____________
____________________________________。
物质 H2(g) C(石墨,s) C6H6(l)
标准燃烧热ΔH/ (kJ·mol-1) -285.8 -393.5 -3 267.5
6C(石墨,s)
+3H2(g)===C6H6(l) ΔH=49.1 kJ·mol-1
根据表格中标准燃烧热数据可知,存在反应①C(石墨,s)+O2(g)===
CO2(g) ΔH1=-393.5 kJ·mol-1,②H2(g)+ O2(g)===H2O(l) ΔH2=-285.8 kJ·
mol-1,③C6H6(l)+ O2(g)===6CO2(g)+3H2O(l) ΔH3=-3 267.5 kJ·mol-1,
根据盖斯定律,①×6+②×3-③得反应:6C(石墨,s)+3H2(g)===C6H6(l)
ΔH=(-393.5 kJ·mol-1)×6+(-285.8 kJ·mol-1)×3-(-3 267.5 kJ·mol-1)=49.1 kJ·mol-1。
物质 H2(g) C(石墨,s) C6H6(l)
标准燃烧热ΔH/ (kJ·mol-1) -285.8 -393.5 -3 267.5
1
2
3
4
1.生产液晶显示器的过程中使用的化学清洗剂NF3是一种温室气体,其存储能量的能力是CO2的12 000~20 000 倍,在大气中的寿命可长达740年之久,表中是几种化学键的键能:
化学键 N≡N F—F N—F
键能/(kJ·mol-1) 941.7 154.8 283.0
写出利用N2和F2制备NF3的热化学方程式:_________________________
_____________________。
N2(g)+3F2(g)===2NF3(g)
ΔH=-291.9 kJ·mol-1
1
2
3
4
ΔH=(941.7+154.8×3-283.0×6) kJ·mol-1=-291.9 kJ·mol-1。
化学键 N≡N F—F N—F
键能/(kJ·mol-1) 941.7 154.8 283.0
2.在化工生产过程中,少量CO的存在会引起催化剂中毒。为了防止催化剂中毒,常用SO2将CO氧化,SO2被还原为S。已知:
1
2
3
4
①C(s)+ O2(g)===CO(g) ΔH1=-126.4 kJ·mol-1
②C(s)+O2(g)===CO2(g) ΔH2=-393.5 kJ·mol-1
③S(s)+O2(g)===SO2(g) ΔH3=-296.8 kJ·mol-1
则SO2氧化CO的热化学方程式为__________________________________
________________________。
SO2(g)+2CO(g)===S(s)+2CO2(g)
ΔH=-237.4 kJ·mol-1
3.用O2将HCl转化为Cl2,可提高效率,减少污染。传统上该转化通过如图所示的催化循环实现。
1
2
3
4
其中,反应①为2HCl(g)+CuO(s)===H2O(g)+CuCl2(s) ΔH1
反应②生成1 mol Cl2的反应热为ΔH2,则总反应的热化学方程式为____________________________________________________(反应热用ΔH1和ΔH2表示)。
4HCl(g)+O2(g)===2H2O(g)+2Cl2(g) ΔH=2ΔH1+2ΔH2
1
2
3
4
2HCl(g)+CuO(s)===H2O(g)+CuCl2(s) ΔH1 ①
由图得2CuCl2(s)+O2(g)===2CuO(s)+2Cl2(g) 2ΔH2 ②
运用盖斯定律:①×2+②得总反应:
4HCl(g)+O2(g)===2H2O(g)+2Cl2(g) ΔH=2ΔH1+2ΔH2。
1
2
3
4
4.工业上合成氨用的H2有多种制取的方法:
①用焦炭跟水反应:C(s)+H2O(g)===CO(g)+H2(g);
②用天然气跟水蒸气反应:CH4(g)+H2O(g)===
CO(g)+3H2(g)
已知有关反应的能量变化如图所示,则方法②中反应的ΔH=___________________。
(a+3b-c) kJ·mol-1
专题1
本课结束
