专题1 化学反应与能量变化 体系构建 体验高考(共28张ppt)
文档属性
| 名称 | 专题1 化学反应与能量变化 体系构建 体验高考(共28张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 626.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-21 22:08:20 | ||
图片预览








文档简介
(共28张PPT)
体系构建 理清脉络 / 体验高考 素养提升
体系构建 体验高考
专题1
内容索引
体系构建 理清脉络
体验高考 素养提升
体系构建 理清脉络
1.化学反应的热效应
化学反应的热效应
化学反应中的热量变化
本质原因:化学反应是旧键断裂和新键形成的过程
焓变:符号为ΔH,单位是kJ·mol-1或J·mol-1
吸热反应:ΔH>0
放热反应:ΔH<0
反应热的测量:一般利用量热计进行测量
反应热的计算:可利用盖斯定律计算无法直接测量
的反应热
化学反应的热效应
热化学方程式
概念:能够表示反应热的化学方程式
书写
①注明各物质的聚集状态
②化学计量数可以是整数,也可以是分数
③注明温度、压强(25 ℃、101 kPa时可以不注明)
④标出ΔH的数值、符号和单位
应用:反应热计算的依据
化学反应的热效应
燃料的燃烧利用
①标准燃烧热:在101 kPa下,1 mol物质完全燃烧
的反应热
②热值:1 g物质完全燃烧的反应热
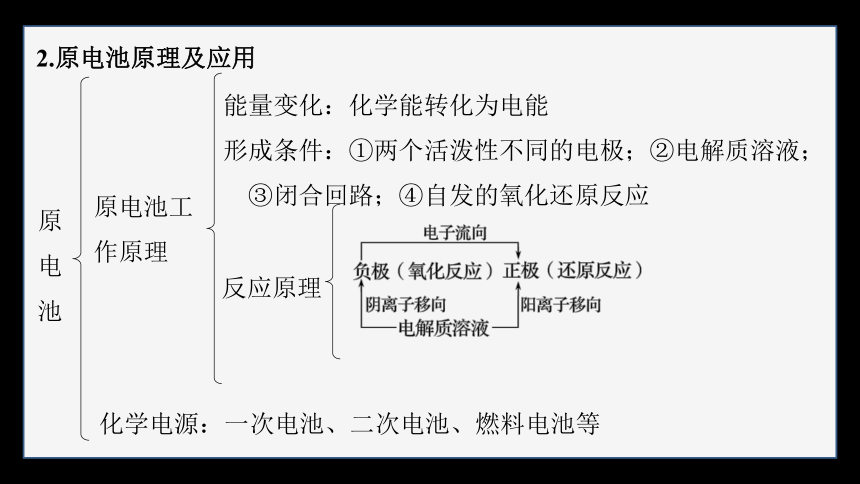
2.原电池原理及应用
原电池
原电池工作原理
能量变化:化学能转化为电能
形成条件:①两个活泼性不同的电极;②电解质溶液;
③闭合回路;④自发的氧化还原反应
反应原理
化学电源:一次电池、二次电池、燃料电池等
3.电解原理及应用
电解
概念:在直流电的作用下,在两电极上分别发生氧化反应和还原
反应的过程
电解池
能量变化:电能转化为化学能
形成条件:①与直流电源相连的两个电极;②电解质
溶液;③闭合回路
反应原理
电解
应用
氯碱工业:2NaCl+2H2O 2NaOH+H2↑+Cl2↑
电镀
概念:应用电解的原理在某些金属或其他材料
制品表面镀上一薄层其他金属或合金的过程
形成条件:①待镀金属制品作阴极;②镀层金
属作阳极;③电镀液中含有镀层金属离子
铜的电解精炼
金属的腐蚀与防护
金属腐蚀
化学腐蚀
电化学腐蚀
4.金属的腐蚀与防护
金属防护
牺牲阳极的阴极保护法
外加电流的阴极保护法
析氢腐蚀
吸氧腐蚀
电化学防护
改变金属组成或结构、在表面覆盖保护层等
返回
体验高考 素养提升
考向一 反应热的计算及盖斯定律的应用
例1
(1)[2021·湖南,16(1)]氨气中氢含量高,是一种优良的小分子储氢载体,且安全、易储运,可通过下面两种方法由氨气得到氢气。
方法Ⅰ.氨热分解法制氢气
相关化学键的键能数据
化学键 N≡N H—H N—H
键能E/(kJ·mol-1) 946 436.0 390.8
在一定温度下,利用催化剂将NH3分解为N2和H2。回答下列问题:
反应2NH3(g) N2(g)+3H2(g) ΔH=_______kJ·mol-1。
化学键 N≡N H—H N—H
键能E/(kJ·mol-1) 946 436.0 390.8
90.8
根据反应热=反应物的总键能-生成物的总键能,2NH3(g) N2(g)+3H2(g) ΔH=390.8 kJ·mol-1×3×2-(946 kJ·mol-1+436.0 kJ·mol-1×3)=90.8 kJ·mol-1。
化学键 N≡N H—H N—H
键能E/(kJ·mol-1) 946 436.0 390.8
(2)[2021·全国甲卷,28(1)]二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。回答下列问题:
二氧化碳加氢制甲醇的总反应可表示为:
CO2(g)+3H2(g)===CH3OH(g)+H2O(g)
该反应一般认为通过如下步骤来实现:
①CO2(g)+H2(g)===CO(g)+H2O(g) ΔH1=41 kJ·mol-1
②CO(g)+2H2(g)===CH3OH(g) ΔH2=-90 kJ·mol-1
总反应的ΔH=______kJ·mol-1;若反应①为慢反应,下列示意图中能体现题述反应能量变化的是____(填标号),判断的理由是___________
_____________________________________________________。
-49
A
ΔH1为正值,
ΔH2和ΔH为负值,反应①的活化能大于反应②的活化能
根据盖斯定律可知,①+②可得二氧化碳加氢制甲醇的总反应为CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH=41 kJ·mol-1+(-90 kJ·mol-1)=-49 kJ·mol-1;该反应总反应为放热反应,因此生成物总能量低于反应物总能量,反应①为慢反应,因此反应①的活化能高于反应②,同时反应①的反应物总能量低于生成物总能量,反应②的反应物总能量高于生成物总能量,因此示意图中能体现反应能量变化的是A项。
考向二 原电池工作原理及新型电池
例2
(2021·浙江1月选考,22)镍镉电池是二次电池,其工作原理示意图如下(L为小灯泡,K1、K2为开关,a、b为直流电源的两极)。下列说法不正确的是
A.断开K2、合上K1,镍镉电池能量转化形式:化学
能→电能
B.断开K1、合上K2,电极A为阴极,发生还原反应
C.电极B发生氧化反应过程中,溶液中KOH浓度不变
D.镍镉二次电池的总反应式:Cd+2NiOOH+2H2O Cd(OH)2+
2Ni(OH)2
√
断开K2、闭合K1时该装置为原电池,能量转化形式为化学能转化为电能,A正确;
断开K1、闭合K2时该装置为电解池,电极A与外接电源负极相连作阴极,发生还原反应,B正确;
电极B发生氧化反应过程中电池充电,阳极反应为2Ni(OH)2-2e-+2OH-
===2NiOOH+2H2O,阴极反应为Cd(OH)2+2e-===Cd+2OH-,电池总反应为2Ni(OH)2+Cd(OH)2===Cd+2NiOOH+2H2O,因生成了水,则溶液中KOH浓度减小,C错误;
二次电池的充、放电是一个相反的过程,则该电池的总反应式为Cd+2NiOOH+2H2O Cd(OH)2+2Ni(OH)2,D正确。
(2020·山东,10)微生物脱盐电池是一种高效、经济的能源装置,利用微生物处理有机废水获得电能,同时可实现海水淡化。现以NaCl溶液模拟海水,采用惰性电极,用如图装置处理有机废水(以含CH3COO-的溶液为例)。下列说法错误的是
A.负极反应为CH3COO-+2H2O-8e-===2CO2↑
+7H+
B.隔膜1为阳离子交换膜,隔膜2为阴离子交换膜
C.当电路中转移1 mol电子时,模拟海水理论上除盐58.5 g
D.电池工作一段时间后,正、负极产生气体的物质的量之比为2∶1
例3
√
由装置示意图可知,负极区CH3COO-发生氧化反应生成CO2和H+,A项正确;
隔膜1为阴离子交换膜,隔膜2为阳离子交换膜,才能使模拟海水中的氯离子移向负极,钠离子移向正极,达到海水淡化的目的,B项错误;
电路中有1 mol 电子通过时,电解质溶液中有1 mol钠离子移向正极,1 mol氯离子移向负极,C项正确;
负极产生CO2:CH3COO-+2H2O-8e-===2CO2↑+7H+,正极产生H2:2H++2e-===H2↑,根据电荷守恒,正、负极产生气体的物质的量之比为2∶1,D项正确。
考向三 电解池工作原理及应用
例4
(2021·全国甲卷,13)乙醛酸是一种重要的化工中间体,可采用如图所示的电化学装置合成。图中的双极膜中间层中的H2O解离为H+和OH-,并在直流电场作用下分别向两极迁移。下列说法正确的是
A.KBr在上述电化学合成过程中只起电解质的作用
B.阳极上的反应式为: +2H++2e-
―→ +H2O
C.制得2 mol乙醛酸,理论上外电路中迁移了1 mol电子
D.双极膜中间层中的H+在外电场作用下向铅电极方向迁移
√
KBr在上述电化学合成过程中除作电解质外,同时还是电解过程中阳极的反应物,生成的Br2为乙二醛制备乙醛酸的中间产物,故A错误;
阳极上Br-失去电子生成Br2,Br2将乙二醛氧化为乙醛酸,故B错误;
电解过程中阴、阳极均生成乙醛酸,1 mol乙二酸生成1 mol乙醛酸转移的电子为2 mol,1 mol乙二醛生成1 mol乙醛酸转移的电子为2 mol,根据转移电子守恒可知制得2 mol乙醛酸时,理论上外电路中迁移了2 mol电子,故C错误;
由上述分析可知,双极膜中间层的H+在外电场作用下移向阴极,即H+移向铅电极,故D正确。
考向四 金属的腐蚀与防护
例5
(2020·江苏,11)将金属M连接在钢铁设施表面,可减缓水体中钢铁设施的腐蚀。在如图所示的情境中,下列有关说法正确的是
A.阴极的电极反应式为Fe-2e-===Fe2+
B.金属M的活动性比Fe的活动性弱
C.钢铁设施表面因积累大量电子而被保护
D.钢铁设施在河水中的腐蚀速率比在海水中的快
√
阴极得电子,A错误;
金属M失电子,其活动性应比铁强,B错误;
M失去的电子流入钢铁设施表面,钢铁设施不易失去电子而被保护,C正确;
海水中所含电解质的浓度远大于河水中的,因此钢铁设施在海水中被腐蚀的速率快,D错误。
例6
(2017·全国卷Ⅰ,11)支撑海港码头基础的钢桩,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极。下列有关表述不正确的是
A.通入保护电流使钢管桩表面腐蚀电流接近于零
B.通电后外电路电子被强制从高硅铸铁流向钢管桩
C.高硅铸铁的作用是作为损耗阳极材料和传递电流
D.通入的保护电流应该根据环境条件变化进行调整
√
依题意,钢管桩为阴极,电子流向阴极,阴极被保护,铁不容易失去电子,故钢管桩表面的腐蚀电流(指铁失去电子形成的电流)接近于0,A项正确;
阳极上发生氧化反应,失去电子,电子经外电路流向阴极,B项正确;
高硅铸铁作阳极,阳极上发生氧化反应,阳极上主要是海水中的水被氧化生成氧气,惰性辅助阳极不被损耗,C项错误;
根据海水对钢管桩的腐蚀情况,增大或减小电流强度,D项正确。
返回
专题1
本课结束
体系构建 理清脉络 / 体验高考 素养提升
体系构建 体验高考
专题1
内容索引
体系构建 理清脉络
体验高考 素养提升
体系构建 理清脉络
1.化学反应的热效应
化学反应的热效应
化学反应中的热量变化
本质原因:化学反应是旧键断裂和新键形成的过程
焓变:符号为ΔH,单位是kJ·mol-1或J·mol-1
吸热反应:ΔH>0
放热反应:ΔH<0
反应热的测量:一般利用量热计进行测量
反应热的计算:可利用盖斯定律计算无法直接测量
的反应热
化学反应的热效应
热化学方程式
概念:能够表示反应热的化学方程式
书写
①注明各物质的聚集状态
②化学计量数可以是整数,也可以是分数
③注明温度、压强(25 ℃、101 kPa时可以不注明)
④标出ΔH的数值、符号和单位
应用:反应热计算的依据
化学反应的热效应
燃料的燃烧利用
①标准燃烧热:在101 kPa下,1 mol物质完全燃烧
的反应热
②热值:1 g物质完全燃烧的反应热
2.原电池原理及应用
原电池
原电池工作原理
能量变化:化学能转化为电能
形成条件:①两个活泼性不同的电极;②电解质溶液;
③闭合回路;④自发的氧化还原反应
反应原理
化学电源:一次电池、二次电池、燃料电池等
3.电解原理及应用
电解
概念:在直流电的作用下,在两电极上分别发生氧化反应和还原
反应的过程
电解池
能量变化:电能转化为化学能
形成条件:①与直流电源相连的两个电极;②电解质
溶液;③闭合回路
反应原理
电解
应用
氯碱工业:2NaCl+2H2O 2NaOH+H2↑+Cl2↑
电镀
概念:应用电解的原理在某些金属或其他材料
制品表面镀上一薄层其他金属或合金的过程
形成条件:①待镀金属制品作阴极;②镀层金
属作阳极;③电镀液中含有镀层金属离子
铜的电解精炼
金属的腐蚀与防护
金属腐蚀
化学腐蚀
电化学腐蚀
4.金属的腐蚀与防护
金属防护
牺牲阳极的阴极保护法
外加电流的阴极保护法
析氢腐蚀
吸氧腐蚀
电化学防护
改变金属组成或结构、在表面覆盖保护层等
返回
体验高考 素养提升
考向一 反应热的计算及盖斯定律的应用
例1
(1)[2021·湖南,16(1)]氨气中氢含量高,是一种优良的小分子储氢载体,且安全、易储运,可通过下面两种方法由氨气得到氢气。
方法Ⅰ.氨热分解法制氢气
相关化学键的键能数据
化学键 N≡N H—H N—H
键能E/(kJ·mol-1) 946 436.0 390.8
在一定温度下,利用催化剂将NH3分解为N2和H2。回答下列问题:
反应2NH3(g) N2(g)+3H2(g) ΔH=_______kJ·mol-1。
化学键 N≡N H—H N—H
键能E/(kJ·mol-1) 946 436.0 390.8
90.8
根据反应热=反应物的总键能-生成物的总键能,2NH3(g) N2(g)+3H2(g) ΔH=390.8 kJ·mol-1×3×2-(946 kJ·mol-1+436.0 kJ·mol-1×3)=90.8 kJ·mol-1。
化学键 N≡N H—H N—H
键能E/(kJ·mol-1) 946 436.0 390.8
(2)[2021·全国甲卷,28(1)]二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。回答下列问题:
二氧化碳加氢制甲醇的总反应可表示为:
CO2(g)+3H2(g)===CH3OH(g)+H2O(g)
该反应一般认为通过如下步骤来实现:
①CO2(g)+H2(g)===CO(g)+H2O(g) ΔH1=41 kJ·mol-1
②CO(g)+2H2(g)===CH3OH(g) ΔH2=-90 kJ·mol-1
总反应的ΔH=______kJ·mol-1;若反应①为慢反应,下列示意图中能体现题述反应能量变化的是____(填标号),判断的理由是___________
_____________________________________________________。
-49
A
ΔH1为正值,
ΔH2和ΔH为负值,反应①的活化能大于反应②的活化能
根据盖斯定律可知,①+②可得二氧化碳加氢制甲醇的总反应为CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH=41 kJ·mol-1+(-90 kJ·mol-1)=-49 kJ·mol-1;该反应总反应为放热反应,因此生成物总能量低于反应物总能量,反应①为慢反应,因此反应①的活化能高于反应②,同时反应①的反应物总能量低于生成物总能量,反应②的反应物总能量高于生成物总能量,因此示意图中能体现反应能量变化的是A项。
考向二 原电池工作原理及新型电池
例2
(2021·浙江1月选考,22)镍镉电池是二次电池,其工作原理示意图如下(L为小灯泡,K1、K2为开关,a、b为直流电源的两极)。下列说法不正确的是
A.断开K2、合上K1,镍镉电池能量转化形式:化学
能→电能
B.断开K1、合上K2,电极A为阴极,发生还原反应
C.电极B发生氧化反应过程中,溶液中KOH浓度不变
D.镍镉二次电池的总反应式:Cd+2NiOOH+2H2O Cd(OH)2+
2Ni(OH)2
√
断开K2、闭合K1时该装置为原电池,能量转化形式为化学能转化为电能,A正确;
断开K1、闭合K2时该装置为电解池,电极A与外接电源负极相连作阴极,发生还原反应,B正确;
电极B发生氧化反应过程中电池充电,阳极反应为2Ni(OH)2-2e-+2OH-
===2NiOOH+2H2O,阴极反应为Cd(OH)2+2e-===Cd+2OH-,电池总反应为2Ni(OH)2+Cd(OH)2===Cd+2NiOOH+2H2O,因生成了水,则溶液中KOH浓度减小,C错误;
二次电池的充、放电是一个相反的过程,则该电池的总反应式为Cd+2NiOOH+2H2O Cd(OH)2+2Ni(OH)2,D正确。
(2020·山东,10)微生物脱盐电池是一种高效、经济的能源装置,利用微生物处理有机废水获得电能,同时可实现海水淡化。现以NaCl溶液模拟海水,采用惰性电极,用如图装置处理有机废水(以含CH3COO-的溶液为例)。下列说法错误的是
A.负极反应为CH3COO-+2H2O-8e-===2CO2↑
+7H+
B.隔膜1为阳离子交换膜,隔膜2为阴离子交换膜
C.当电路中转移1 mol电子时,模拟海水理论上除盐58.5 g
D.电池工作一段时间后,正、负极产生气体的物质的量之比为2∶1
例3
√
由装置示意图可知,负极区CH3COO-发生氧化反应生成CO2和H+,A项正确;
隔膜1为阴离子交换膜,隔膜2为阳离子交换膜,才能使模拟海水中的氯离子移向负极,钠离子移向正极,达到海水淡化的目的,B项错误;
电路中有1 mol 电子通过时,电解质溶液中有1 mol钠离子移向正极,1 mol氯离子移向负极,C项正确;
负极产生CO2:CH3COO-+2H2O-8e-===2CO2↑+7H+,正极产生H2:2H++2e-===H2↑,根据电荷守恒,正、负极产生气体的物质的量之比为2∶1,D项正确。
考向三 电解池工作原理及应用
例4
(2021·全国甲卷,13)乙醛酸是一种重要的化工中间体,可采用如图所示的电化学装置合成。图中的双极膜中间层中的H2O解离为H+和OH-,并在直流电场作用下分别向两极迁移。下列说法正确的是
A.KBr在上述电化学合成过程中只起电解质的作用
B.阳极上的反应式为: +2H++2e-
―→ +H2O
C.制得2 mol乙醛酸,理论上外电路中迁移了1 mol电子
D.双极膜中间层中的H+在外电场作用下向铅电极方向迁移
√
KBr在上述电化学合成过程中除作电解质外,同时还是电解过程中阳极的反应物,生成的Br2为乙二醛制备乙醛酸的中间产物,故A错误;
阳极上Br-失去电子生成Br2,Br2将乙二醛氧化为乙醛酸,故B错误;
电解过程中阴、阳极均生成乙醛酸,1 mol乙二酸生成1 mol乙醛酸转移的电子为2 mol,1 mol乙二醛生成1 mol乙醛酸转移的电子为2 mol,根据转移电子守恒可知制得2 mol乙醛酸时,理论上外电路中迁移了2 mol电子,故C错误;
由上述分析可知,双极膜中间层的H+在外电场作用下移向阴极,即H+移向铅电极,故D正确。
考向四 金属的腐蚀与防护
例5
(2020·江苏,11)将金属M连接在钢铁设施表面,可减缓水体中钢铁设施的腐蚀。在如图所示的情境中,下列有关说法正确的是
A.阴极的电极反应式为Fe-2e-===Fe2+
B.金属M的活动性比Fe的活动性弱
C.钢铁设施表面因积累大量电子而被保护
D.钢铁设施在河水中的腐蚀速率比在海水中的快
√
阴极得电子,A错误;
金属M失电子,其活动性应比铁强,B错误;
M失去的电子流入钢铁设施表面,钢铁设施不易失去电子而被保护,C正确;
海水中所含电解质的浓度远大于河水中的,因此钢铁设施在海水中被腐蚀的速率快,D错误。
例6
(2017·全国卷Ⅰ,11)支撑海港码头基础的钢桩,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极。下列有关表述不正确的是
A.通入保护电流使钢管桩表面腐蚀电流接近于零
B.通电后外电路电子被强制从高硅铸铁流向钢管桩
C.高硅铸铁的作用是作为损耗阳极材料和传递电流
D.通入的保护电流应该根据环境条件变化进行调整
√
依题意,钢管桩为阴极,电子流向阴极,阴极被保护,铁不容易失去电子,故钢管桩表面的腐蚀电流(指铁失去电子形成的电流)接近于0,A项正确;
阳极上发生氧化反应,失去电子,电子经外电路流向阴极,B项正确;
高硅铸铁作阳极,阳极上发生氧化反应,阳极上主要是海水中的水被氧化生成氧气,惰性辅助阳极不被损耗,C项错误;
根据海水对钢管桩的腐蚀情况,增大或减小电流强度,D项正确。
返回
专题1
本课结束
