化学人教版(2019)选择性必修1 4.1.2 化学电源(共38张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 4.1.2 化学电源(共38张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 6.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-21 22:30:40 | ||
图片预览







文档简介
(共38张PPT)
第2课时 化学电源
第四章 第一节 化学反应与电能
学习目标
1.通过交流讨论了解一次电池、二次电池和燃料电池的基本构造,学会书写常见的电极反应式和电池反应。
2.通过相关的信息分析了解化学电源的工作原理,初步建立化学电源工作原理的认知模型。
3.通过学习各类电池的实际应用,感受化学给人类带来的进步和文明,通过了解废旧电池对环境的危害,树立环保意识。
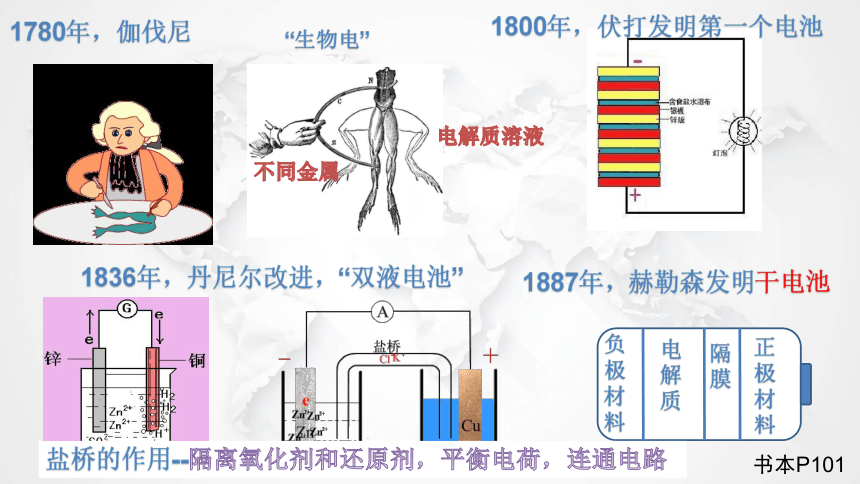
1780年,伽伐尼
“生物电”
不同金属
电解质溶液
1800年,伏打发明第一个电池
1836年,丹尼尔改进,“双液电池”
负极材料
电解质
隔膜
正极材料
1887年,赫勒森发明干电池
盐桥的作用--隔离氧化剂和还原剂,平衡电荷,连通电路
书本P101
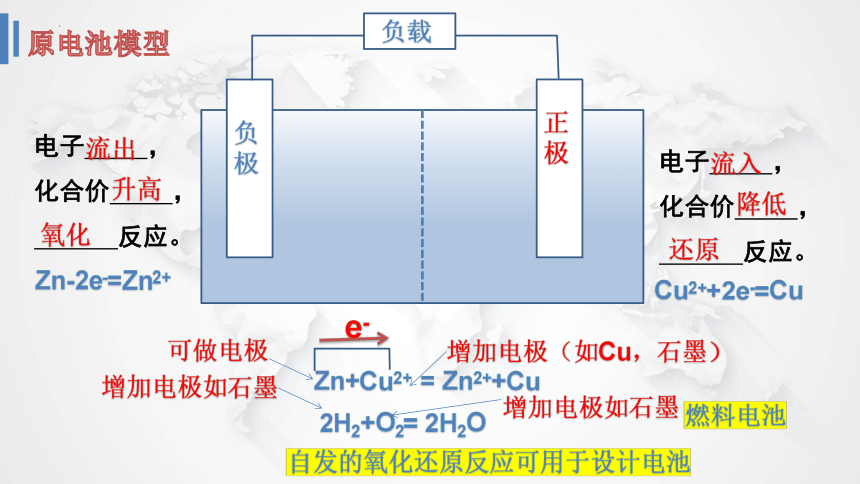
负极
正极
负载
电子 ,
化合价 ,
反应。
电子 ,
化合价 ,
反应。
Zn-2e-=Zn2+
Cu2++2e-=Cu
Zn+Cu2+ = Zn2++Cu
可做电极
增加电极(如Cu,石墨)
2H2+O2= 2H2O
增加电极如石墨
增加电极如石墨
燃料电池
自发的氧化还原反应可用于设计电池
流出
升高
氧化
流入
降低
还原
原电池模型
e-
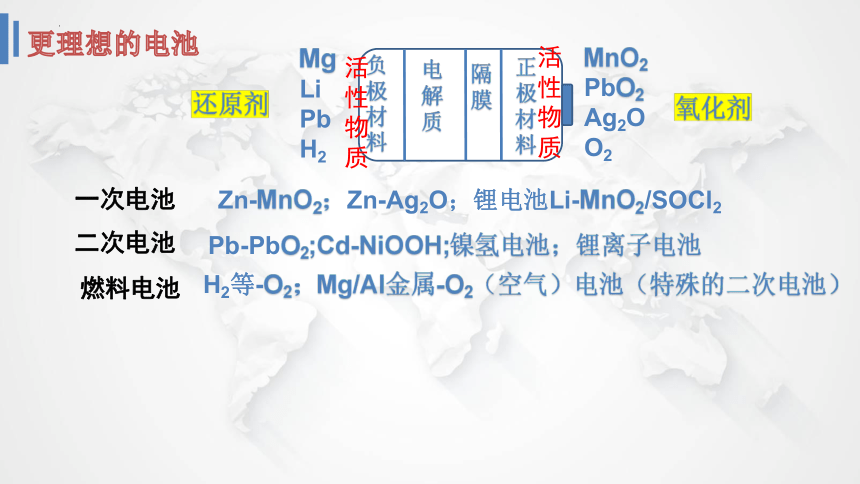
更理想的电池
负极材料
电解质
隔膜
正极材料
还原剂
氧化剂
Mg
Li
Pb
H2
MnO2
PbO2
Ag2O
O2
一次电池
二次电池
燃料电池
Zn-MnO2;Zn-Ag2O;锂电池Li-MnO2/SOCl2
Pb-PbO2;Cd-NiOOH;镍氢电池;锂离子电池
H2等-O2;Mg/Al金属-O2(空气)电池(特殊的二次电池)
活性物质
活性物质
化学电源
1.化学电源优点:
化学电源
与其他能源相比
①方便携带、易于维护
②能量转化效率较高,供能稳定可靠
③可制成各种形状、大小和容量不同的电池及电池组
化学电源
2.判断电池优劣的主要标准:
(1)比能量:电池单位质量或单位体积所能输出电能的多少。
(2)比功率:电池单位质量或单位体积所能输出功率的大小。
(3)电池的可储存时间的长短。
(4)除了特殊情况,质量小、体积小、输出功率大和储存时间长的电池,更易满足使用要求。
(W·h)/kg或(W·h)/L
W/kg或W/L
化学电源
3.化学电源的分类:
就是放电后不可再充电的电池。随着使用,一次电池中能发生氧化还原反应的物质逐渐被消耗,当这些物质被消耗到一定程度时,电池就不能继续使用了。一次电池中电解质溶液制成胶状,不流动,也叫做干电池。
①一次电池:
例如:普通锌锰干电池、碱性锌锰电池、锌银纽扣电池
一次电池
二次电池
燃料电池
锌筒
石墨棒
MnO2和炭黑
NH4Cl糊
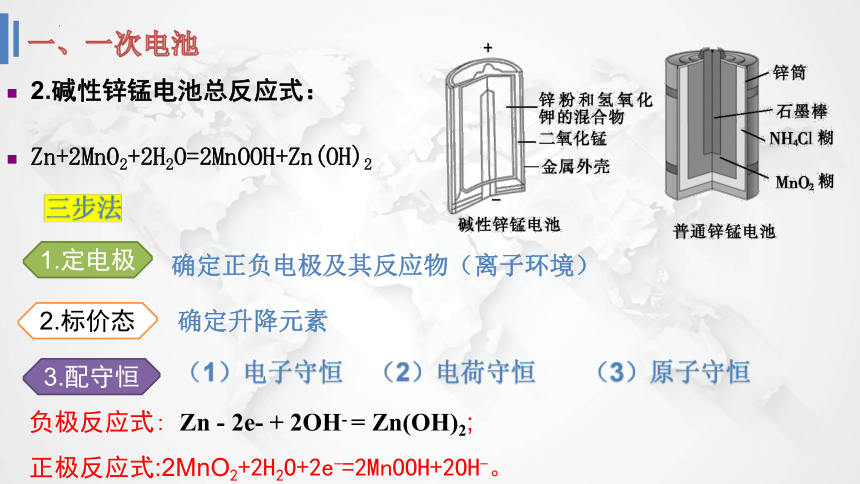
1.普通锌锰电池
干电池用锌皮制成桶形外壳作负极,
中央的带有铜帽顶盖的石墨作正极,在石墨周围填充NH4Cl、ZnCl2和淀粉作电解质溶液,还填充MnO2黑色粉末吸收正极放出的H2,防止产生极化现象。
一、一次电池
一、一次电池
2.碱性锌锰电池总反应式:
Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2
1.定电极
2.标价态
3.配守恒
三步法
确定正负电极及其反应物(离子环境)
确定升降元素
(1)电子守恒 (2)电荷守恒 (3)原子守恒
负极反应式: Zn - 2e- + 2OH- = Zn(OH)2;
正极反应式:2MnO2+2H2O+2e-=2MnOOH+2OH-。
思考交流
锌锰干电池即使不用,放置过久,也可能会漏液失效,这是为什么?在使用和保存时又应该注意哪些方面?
作为电解质的糊状NH4Cl显酸性。锌锰电池在使用和放置过程中,锌会溶解,锌筒会逐渐变薄,内部糊状电解质会泄漏出来,使电器腐蚀,长时间不用,应从电器中取出,密封储存于低温干燥处。为了防止泄露,外壳套上防腐金属或塑料筒,制成防漏电池。
碱性锌锰电池比普通锌锰电池性能好,比能量和可储存时间均有所提高,适用于大电流和连续放电。
3.锌银电池(纽扣电池)
锌银电池如图,所示两电极分别是Zn和Ag2O,电解质溶液为 KOH溶液
总反应:Zn+Ag2O+H2O=Zn(OH)2+2Ag
优点:比能量大、电压稳定,储存时间长,适宜小电流连续放电。广泛用于电子手表、照相机、计算器和其他微型电子仪器。
负极反应:Zn+2OH--2e- =Zn(OH)2
正极反应:Ag2O+H2O+2e-=2Ag+2OH-
二、二次电池:
又称可充电电池或蓄电池,是一类放电后
可以再充电而反复使用的电池。
(1)特点:
放电时所进行的氧化还原反应,在充电时可以逆向进行,使电池恢复到放电前的状态。
(2)实例:
铅酸蓄电池、镍氢电池、锂离子电池等。
1、铅酸蓄电池:
构造:
铅酸蓄电池由两组栅状极板交替排列而成,塑料外壳防止酸液泄漏。正极上覆盖有棕褐色的PbO2,
负极上覆盖有海绵状的金属Pb,正负电极之间用微孔塑料隔开,
两极均浸入30%H2SO4中。
铅酸蓄电池是典型的二次电池,其性能优良、价格低廉、安全可靠、可多次充放电,所以在生产、生活中使用广泛,如汽车、电动自行车等都使用这种电池。其充、放电时的电池反应为
Pb(s)+PbO2(s)+2H2SO4(aq) 2PbSO4(s)+2H2O(l)。
负极:Pb(s)+SO42-(aq)-2e-=PbSO4(s);
正极:PbO2(s)+4H+(aq)+SO42-(aq)+2e-=PbSO4(s)+2H2O(l);
放电过程中,负极的质量增大,电解质溶液的pH升高。
②充电过程:与其放电过程相反
分析电极反应和电极现象
铅酸蓄电池:
铅蓄电池的优缺点:
①优点:可重复使用、电压稳定、使用方便、安全可靠、价格低廉,在生产、生活中应用广泛。
②缺点:比能量低、笨重,废弃的电池污染环境。
常见锂离子电池的材料组成:
负极材料:
正极材料:
电解质溶液:
嵌锂石墨(LixCy)
钴酸锂(LiCoO2)
六氟磷酸锂(LiPF6)的碳酸酯无水溶液
锂离子电池的优点:质量小,体积小,储存和输出能量大。
P99
2、
锂离子电池工作原理:
放电时:
负极反应:
正极反应:
总反应:
LixCy-xe-=xLi++Cy
Li1-xCoO2+xe-+xLi+=LiCoO2
Li1-xCoO2+LixCy=LiCoO2+Cy
Li+由石墨中脱嵌移向正极,嵌入LiCoO2晶体
充电时:
Li+从LiCoO2晶体中脱嵌,由正极回到负极,嵌入石墨中
例1.锂锰电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2。回答下列问题:
(1)外电路的电流方向是由____极流向____极(填字母)。
(2)电池正极反应式为:
(3能否用水代替电池中的混合有机溶剂?
____(填“是”或“否”),原因是____
a
b
MnO2+e-+Li+=LiMnO2
否
锂比较活泼可以和水反应
减少污染、节约资源
电池中含有大量的重金属如锌、铅、镉、汞、锰等。据专家测试,一节纽扣电池能污染60万升水;一节一号电池烂在地里,能使一平方米的土地失去利用价值。若将废旧电池混入生活垃圾一起填埋,渗出的重金属物质就会渗透土壤、污染地下水,进而进入鱼类、农作物等,破坏人类的生存环境,间接威胁到人类的健康,有的还能致癌。所以我们不要乱扔电池,要及时回收。
作业
1今天学习的一次电池和二次电池模板写好电极式上笔记本
2课后作业p183
燃料电池
将燃料和氧化剂的化学能直接转化为电能的化学电池
负极
H2,CO,烃类,醇类,其他有机物
失电子
不同电解质体系下的特定结构形式
正极
通常为氧气
得电子
不同电解质体系下的特定结构形式
如OH-,H2O,O2-
不同电解质体系下两极生成物结构
电解质体系 平衡电荷的离子 正极 负极
酸性溶液
碱性溶液
固体电解质
熔融碳酸盐
H+
OH-
O2-
CO32-
O2+4H++4e-=2H2O
O2+2H2O+4e-=4OH-
O2+4e-=2O2-
O2+CO2+4e=2CO32-
C、H类燃料
通常
C CO2
H H+
碱性
C CO32-
H H2O
当堂训练
负
4H2O+2O2+8e-=8OH-
减弱
大于
燃料电池是将H2、CH4、CH3OH、肼等燃料
与O2的化学能直接转化成电能的化学电源。
③燃料电池:
燃料电池的电极不含活性物质,不参与反应 ,但具有很强的催化活性,如铂电极,活性炭电极等。
反应物不是储存在电池内部,而是由外部提供燃料和氧化剂。
燃料电池的结构特点:
燃料电池的优点:
能量转化率高(近80%)、可持续使用、低污染
1、氢氧燃料电池:
电极材料:铂电极(镀铂粉)
电解质溶液
2、甲烷燃料电池:
a b
电解质溶液
CH4
O2
①判断正、负极?
电解质 H2SO4 KOH
负极反应
正极反应
总反应
3.固体燃料电池
以熔融金属氧化物为介质,高温下能传导O2-
电池总反应: 2H2 +O2 = 2H2O
写出正、负极反应:
电池总反应:CH4+2O2=CO2+2H2O
写出正、负极反应:
4.熔融盐电池
以熔融碳酸盐(K2CO3)为介质,高温下能传导CO32-
在工作过程中,电解质熔融盐的组成、浓度不变。
总反应:2CO+O2=2CO2
写出正、负极反应:
总反应:2H2 +O2 =2H2O
写出正、负极反应:
总反应:CH4+2O2=CO2+2H2O
写出正、负极反应:
例2.如图为一种微生物燃料电池结构示意图,叙述正确的是( )
A.分子组成为Cm(H2O)n的物质
一定是糖类
B.微生物所在电极区放电时
发生还原反应
C.放电过程中,H+从正极区移向负极区
D.正极反应式为MnO2+4H++2e- = Mn2++2H2O
微电池
太阳能电池
将太阳能转换成电能的装置
原子能电池
将放射性同位素自然衰变时产生的热能通过热电转换器转变为电能的装置
(1)碱性锌锰电池、铅酸蓄电池、锂离子电池都属于二次电池。 ( )
(2)二次电池充电时,化学能转化为电能。 ( )
(3)二次电池充电时发生的反应不能自发进行。 ( )
(4)某些导电非金属单质、某些导电金属氧化物都可作原电池的电极。 ( )
(5)燃料电池工作时需要点燃条件才可发生。 ( )
(6)燃料电池的燃料可以是氢气、烃、甲醇、氨等物质。 ( )
(7)太阳能电池不属于原电池。 ( )
(8)二次电池充电时,充电器的正极接二次电池的正极。 ( )
(9)铅蓄电池放电时的负极发生还原反应。 ( )
(10)Zn具有还原性和导电性,可用作锌锰干电池的负极材料。( )
1.判断正误
×
×
×
√
√
√
√
√
√
×
2.在碱性锌锰干电池中,氢氧化钾为电解质,发生的电池总反应式为:Zn+2MnO2+2H2O=2MnO(OH)+Zn(OH)2。下列关于该电池的电极反应,正确的是( )
A.负极反应为Zn-2e-===Zn2+
B.负极反应为Zn+2H2O-2e-===Zn(OH)2+2H+
C.正极反应为2MnO2+2H++2e-===2MnOOH
D.正极反应为2MnO2+2H2O+2e-===2MnO(OH)+2OH-
D
3.如图所示的水溶液锂离子电池体系。叙述错误的是( )
A.a为电池的正极
B.电池充电反应为
LiMn2O4=Li1-xMn2O4+xLi
C.放电时,a极锂的化合价发生变化
D.放电时,溶液中Li+从b向a迁移
C
4.镍 镉电池是一种可充电电池,其总反应为Cd+2NiO(OH)+2H2O 2Ni(OH)2+Cd(OH)2。下列不正确的是( )A.放电时,负极发生氧化反应,反应为Cd+2OH--2e-=Cd(OH)2B.充电时,阳极反应为Ni(OH)2-e-+OH-===NiO(OH)+H2OC.电池工作时,负极区pH增大,正极区pH减小D.该电池充电时将电能转化为化学能
C
6.一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是
当堂训练
D
当堂训练
B
第2课时 化学电源
第四章 第一节 化学反应与电能
学习目标
1.通过交流讨论了解一次电池、二次电池和燃料电池的基本构造,学会书写常见的电极反应式和电池反应。
2.通过相关的信息分析了解化学电源的工作原理,初步建立化学电源工作原理的认知模型。
3.通过学习各类电池的实际应用,感受化学给人类带来的进步和文明,通过了解废旧电池对环境的危害,树立环保意识。
1780年,伽伐尼
“生物电”
不同金属
电解质溶液
1800年,伏打发明第一个电池
1836年,丹尼尔改进,“双液电池”
负极材料
电解质
隔膜
正极材料
1887年,赫勒森发明干电池
盐桥的作用--隔离氧化剂和还原剂,平衡电荷,连通电路
书本P101
负极
正极
负载
电子 ,
化合价 ,
反应。
电子 ,
化合价 ,
反应。
Zn-2e-=Zn2+
Cu2++2e-=Cu
Zn+Cu2+ = Zn2++Cu
可做电极
增加电极(如Cu,石墨)
2H2+O2= 2H2O
增加电极如石墨
增加电极如石墨
燃料电池
自发的氧化还原反应可用于设计电池
流出
升高
氧化
流入
降低
还原
原电池模型
e-
更理想的电池
负极材料
电解质
隔膜
正极材料
还原剂
氧化剂
Mg
Li
Pb
H2
MnO2
PbO2
Ag2O
O2
一次电池
二次电池
燃料电池
Zn-MnO2;Zn-Ag2O;锂电池Li-MnO2/SOCl2
Pb-PbO2;Cd-NiOOH;镍氢电池;锂离子电池
H2等-O2;Mg/Al金属-O2(空气)电池(特殊的二次电池)
活性物质
活性物质
化学电源
1.化学电源优点:
化学电源
与其他能源相比
①方便携带、易于维护
②能量转化效率较高,供能稳定可靠
③可制成各种形状、大小和容量不同的电池及电池组
化学电源
2.判断电池优劣的主要标准:
(1)比能量:电池单位质量或单位体积所能输出电能的多少。
(2)比功率:电池单位质量或单位体积所能输出功率的大小。
(3)电池的可储存时间的长短。
(4)除了特殊情况,质量小、体积小、输出功率大和储存时间长的电池,更易满足使用要求。
(W·h)/kg或(W·h)/L
W/kg或W/L
化学电源
3.化学电源的分类:
就是放电后不可再充电的电池。随着使用,一次电池中能发生氧化还原反应的物质逐渐被消耗,当这些物质被消耗到一定程度时,电池就不能继续使用了。一次电池中电解质溶液制成胶状,不流动,也叫做干电池。
①一次电池:
例如:普通锌锰干电池、碱性锌锰电池、锌银纽扣电池
一次电池
二次电池
燃料电池
锌筒
石墨棒
MnO2和炭黑
NH4Cl糊
1.普通锌锰电池
干电池用锌皮制成桶形外壳作负极,
中央的带有铜帽顶盖的石墨作正极,在石墨周围填充NH4Cl、ZnCl2和淀粉作电解质溶液,还填充MnO2黑色粉末吸收正极放出的H2,防止产生极化现象。
一、一次电池
一、一次电池
2.碱性锌锰电池总反应式:
Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2
1.定电极
2.标价态
3.配守恒
三步法
确定正负电极及其反应物(离子环境)
确定升降元素
(1)电子守恒 (2)电荷守恒 (3)原子守恒
负极反应式: Zn - 2e- + 2OH- = Zn(OH)2;
正极反应式:2MnO2+2H2O+2e-=2MnOOH+2OH-。
思考交流
锌锰干电池即使不用,放置过久,也可能会漏液失效,这是为什么?在使用和保存时又应该注意哪些方面?
作为电解质的糊状NH4Cl显酸性。锌锰电池在使用和放置过程中,锌会溶解,锌筒会逐渐变薄,内部糊状电解质会泄漏出来,使电器腐蚀,长时间不用,应从电器中取出,密封储存于低温干燥处。为了防止泄露,外壳套上防腐金属或塑料筒,制成防漏电池。
碱性锌锰电池比普通锌锰电池性能好,比能量和可储存时间均有所提高,适用于大电流和连续放电。
3.锌银电池(纽扣电池)
锌银电池如图,所示两电极分别是Zn和Ag2O,电解质溶液为 KOH溶液
总反应:Zn+Ag2O+H2O=Zn(OH)2+2Ag
优点:比能量大、电压稳定,储存时间长,适宜小电流连续放电。广泛用于电子手表、照相机、计算器和其他微型电子仪器。
负极反应:Zn+2OH--2e- =Zn(OH)2
正极反应:Ag2O+H2O+2e-=2Ag+2OH-
二、二次电池:
又称可充电电池或蓄电池,是一类放电后
可以再充电而反复使用的电池。
(1)特点:
放电时所进行的氧化还原反应,在充电时可以逆向进行,使电池恢复到放电前的状态。
(2)实例:
铅酸蓄电池、镍氢电池、锂离子电池等。
1、铅酸蓄电池:
构造:
铅酸蓄电池由两组栅状极板交替排列而成,塑料外壳防止酸液泄漏。正极上覆盖有棕褐色的PbO2,
负极上覆盖有海绵状的金属Pb,正负电极之间用微孔塑料隔开,
两极均浸入30%H2SO4中。
铅酸蓄电池是典型的二次电池,其性能优良、价格低廉、安全可靠、可多次充放电,所以在生产、生活中使用广泛,如汽车、电动自行车等都使用这种电池。其充、放电时的电池反应为
Pb(s)+PbO2(s)+2H2SO4(aq) 2PbSO4(s)+2H2O(l)。
负极:Pb(s)+SO42-(aq)-2e-=PbSO4(s);
正极:PbO2(s)+4H+(aq)+SO42-(aq)+2e-=PbSO4(s)+2H2O(l);
放电过程中,负极的质量增大,电解质溶液的pH升高。
②充电过程:与其放电过程相反
分析电极反应和电极现象
铅酸蓄电池:
铅蓄电池的优缺点:
①优点:可重复使用、电压稳定、使用方便、安全可靠、价格低廉,在生产、生活中应用广泛。
②缺点:比能量低、笨重,废弃的电池污染环境。
常见锂离子电池的材料组成:
负极材料:
正极材料:
电解质溶液:
嵌锂石墨(LixCy)
钴酸锂(LiCoO2)
六氟磷酸锂(LiPF6)的碳酸酯无水溶液
锂离子电池的优点:质量小,体积小,储存和输出能量大。
P99
2、
锂离子电池工作原理:
放电时:
负极反应:
正极反应:
总反应:
LixCy-xe-=xLi++Cy
Li1-xCoO2+xe-+xLi+=LiCoO2
Li1-xCoO2+LixCy=LiCoO2+Cy
Li+由石墨中脱嵌移向正极,嵌入LiCoO2晶体
充电时:
Li+从LiCoO2晶体中脱嵌,由正极回到负极,嵌入石墨中
例1.锂锰电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2。回答下列问题:
(1)外电路的电流方向是由____极流向____极(填字母)。
(2)电池正极反应式为:
(3能否用水代替电池中的混合有机溶剂?
____(填“是”或“否”),原因是____
a
b
MnO2+e-+Li+=LiMnO2
否
锂比较活泼可以和水反应
减少污染、节约资源
电池中含有大量的重金属如锌、铅、镉、汞、锰等。据专家测试,一节纽扣电池能污染60万升水;一节一号电池烂在地里,能使一平方米的土地失去利用价值。若将废旧电池混入生活垃圾一起填埋,渗出的重金属物质就会渗透土壤、污染地下水,进而进入鱼类、农作物等,破坏人类的生存环境,间接威胁到人类的健康,有的还能致癌。所以我们不要乱扔电池,要及时回收。
作业
1今天学习的一次电池和二次电池模板写好电极式上笔记本
2课后作业p183
燃料电池
将燃料和氧化剂的化学能直接转化为电能的化学电池
负极
H2,CO,烃类,醇类,其他有机物
失电子
不同电解质体系下的特定结构形式
正极
通常为氧气
得电子
不同电解质体系下的特定结构形式
如OH-,H2O,O2-
不同电解质体系下两极生成物结构
电解质体系 平衡电荷的离子 正极 负极
酸性溶液
碱性溶液
固体电解质
熔融碳酸盐
H+
OH-
O2-
CO32-
O2+4H++4e-=2H2O
O2+2H2O+4e-=4OH-
O2+4e-=2O2-
O2+CO2+4e=2CO32-
C、H类燃料
通常
C CO2
H H+
碱性
C CO32-
H H2O
当堂训练
负
4H2O+2O2+8e-=8OH-
减弱
大于
燃料电池是将H2、CH4、CH3OH、肼等燃料
与O2的化学能直接转化成电能的化学电源。
③燃料电池:
燃料电池的电极不含活性物质,不参与反应 ,但具有很强的催化活性,如铂电极,活性炭电极等。
反应物不是储存在电池内部,而是由外部提供燃料和氧化剂。
燃料电池的结构特点:
燃料电池的优点:
能量转化率高(近80%)、可持续使用、低污染
1、氢氧燃料电池:
电极材料:铂电极(镀铂粉)
电解质溶液
2、甲烷燃料电池:
a b
电解质溶液
CH4
O2
①判断正、负极?
电解质 H2SO4 KOH
负极反应
正极反应
总反应
3.固体燃料电池
以熔融金属氧化物为介质,高温下能传导O2-
电池总反应: 2H2 +O2 = 2H2O
写出正、负极反应:
电池总反应:CH4+2O2=CO2+2H2O
写出正、负极反应:
4.熔融盐电池
以熔融碳酸盐(K2CO3)为介质,高温下能传导CO32-
在工作过程中,电解质熔融盐的组成、浓度不变。
总反应:2CO+O2=2CO2
写出正、负极反应:
总反应:2H2 +O2 =2H2O
写出正、负极反应:
总反应:CH4+2O2=CO2+2H2O
写出正、负极反应:
例2.如图为一种微生物燃料电池结构示意图,叙述正确的是( )
A.分子组成为Cm(H2O)n的物质
一定是糖类
B.微生物所在电极区放电时
发生还原反应
C.放电过程中,H+从正极区移向负极区
D.正极反应式为MnO2+4H++2e- = Mn2++2H2O
微电池
太阳能电池
将太阳能转换成电能的装置
原子能电池
将放射性同位素自然衰变时产生的热能通过热电转换器转变为电能的装置
(1)碱性锌锰电池、铅酸蓄电池、锂离子电池都属于二次电池。 ( )
(2)二次电池充电时,化学能转化为电能。 ( )
(3)二次电池充电时发生的反应不能自发进行。 ( )
(4)某些导电非金属单质、某些导电金属氧化物都可作原电池的电极。 ( )
(5)燃料电池工作时需要点燃条件才可发生。 ( )
(6)燃料电池的燃料可以是氢气、烃、甲醇、氨等物质。 ( )
(7)太阳能电池不属于原电池。 ( )
(8)二次电池充电时,充电器的正极接二次电池的正极。 ( )
(9)铅蓄电池放电时的负极发生还原反应。 ( )
(10)Zn具有还原性和导电性,可用作锌锰干电池的负极材料。( )
1.判断正误
×
×
×
√
√
√
√
√
√
×
2.在碱性锌锰干电池中,氢氧化钾为电解质,发生的电池总反应式为:Zn+2MnO2+2H2O=2MnO(OH)+Zn(OH)2。下列关于该电池的电极反应,正确的是( )
A.负极反应为Zn-2e-===Zn2+
B.负极反应为Zn+2H2O-2e-===Zn(OH)2+2H+
C.正极反应为2MnO2+2H++2e-===2MnOOH
D.正极反应为2MnO2+2H2O+2e-===2MnO(OH)+2OH-
D
3.如图所示的水溶液锂离子电池体系。叙述错误的是( )
A.a为电池的正极
B.电池充电反应为
LiMn2O4=Li1-xMn2O4+xLi
C.放电时,a极锂的化合价发生变化
D.放电时,溶液中Li+从b向a迁移
C
4.镍 镉电池是一种可充电电池,其总反应为Cd+2NiO(OH)+2H2O 2Ni(OH)2+Cd(OH)2。下列不正确的是( )A.放电时,负极发生氧化反应,反应为Cd+2OH--2e-=Cd(OH)2B.充电时,阳极反应为Ni(OH)2-e-+OH-===NiO(OH)+H2OC.电池工作时,负极区pH增大,正极区pH减小D.该电池充电时将电能转化为化学能
C
6.一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是
当堂训练
D
当堂训练
B
