专题1 第二单元 化学能与电能的转化 第5课时 电解原理的应用(共81张ppt)
文档属性
| 名称 | 专题1 第二单元 化学能与电能的转化 第5课时 电解原理的应用(共81张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-21 00:00:00 | ||
图片预览






文档简介
(共81张PPT)
第5课时
DIWUKESHI
氯碱工业 / 铜的电解精炼 电镀 / 课时对点练
电解原理的应用
专题1
1.变化观念与平衡思想:
通过对氯碱工业、电镀、铜的电解精炼等原理的分析,认识电能与化学能之间的能量转化。
2.证据推理与模型认知:
建立电解应用问题的分析思维模型和电解相关计算的思维模型,加深对电解原理的理解和应用。
内容索引
一、氯碱工业
二、铜的电解精炼 电镀
课时对点练
氯碱工业
一
1.氯碱工业概念
用电解 的方法来制取氢氧化钠、氢气和氯气,并以它们为原料生产一系列化工产品的工业,称为氯碱工业。
2.氯碱工业原理
(1)通电前,氯化钠溶液中含有四种自由移动的离子,它们是__________
。
(2)通电时,移向阳极的离子是 , 在阳极放电,移向阴极的离子是 , 在阴极放电,因 放电,使阴极区溶液呈 性。
饱和食盐水
Na+、Cl-、
H+、OH-
Cl-、OH-
Cl-
Na+、H+
H+
H+
碱
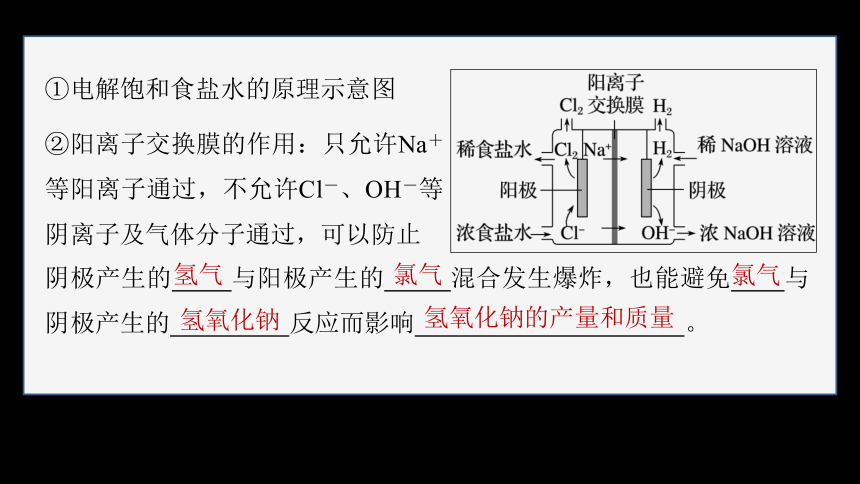
①电解饱和食盐水的原理示意图
②阳离子交换膜的作用:只允许Na+等阳离子通过,不允许Cl-、OH-等阴离子及气体分子通过,可以防止
阴极产生的 与阳极产生的 混合发生爆炸,也能避免 与阴极产生的 反应而影响 。
氢气
氯气
氯气
氢氧化钠
氢氧化钠的产量和质量
(3)电极反应式和总反应方程式
①阳极: ;
阴极: 。
②总反应的化学方程式为 ;
总反应的离子方程式为 。
2Cl--2e-===Cl2↑
2H++2e-===H2↑
(1)电解饱和食盐水时,阴极发生氧化反应:2Cl--2e-===Cl2↑( )
(2)氯碱工业电解槽中滴入酚酞溶液,变红色的为阳极区( )
(3)电解饱和食盐水时,阳极和阴极都可以选择金属材料(如铁)( )
(4)电解饱和NaCl溶液可以制取金属钠( )
(5)利用电解饱和食盐水可制得“84”消毒液( )
正误判断
×
×
×
×
√
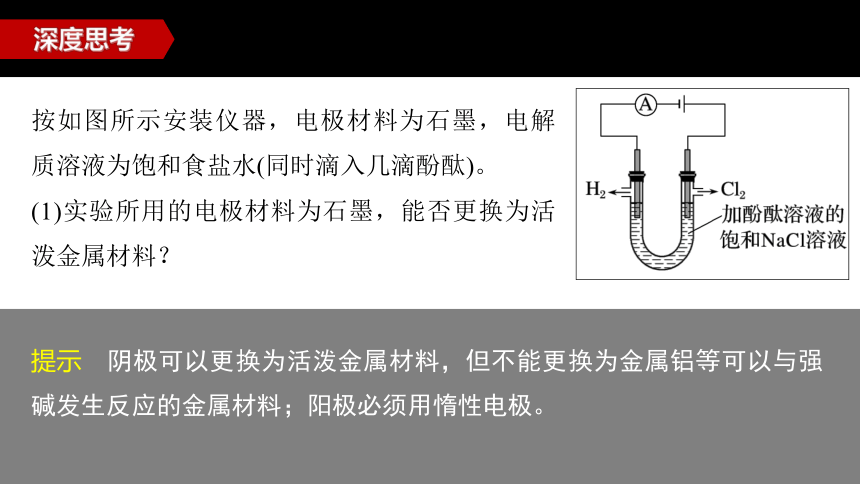
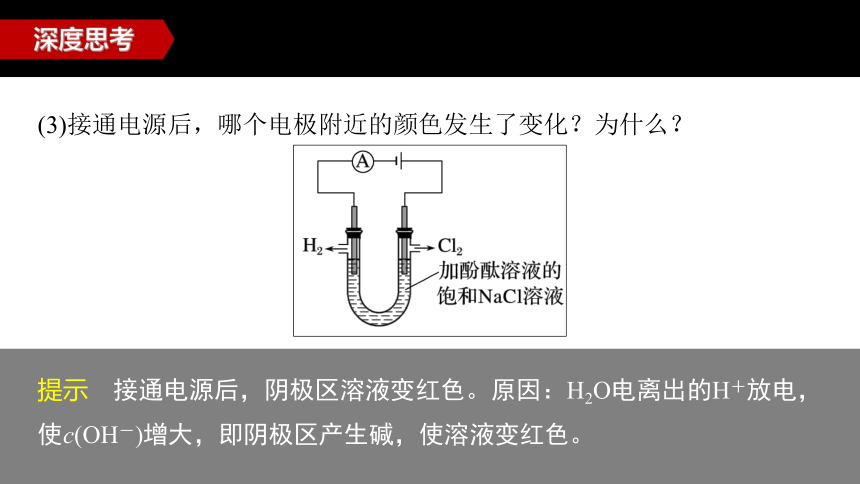
按如图所示安装仪器,电极材料为石墨,电解质溶液为饱和食盐水(同时滴入几滴酚酞)。
(1)实验所用的电极材料为石墨,能否更换为活泼金属材料?
提示 阴极可以更换为活泼金属材料,但不能更换为金属铝等可以与强碱发生反应的金属材料;阳极必须用惰性电极。
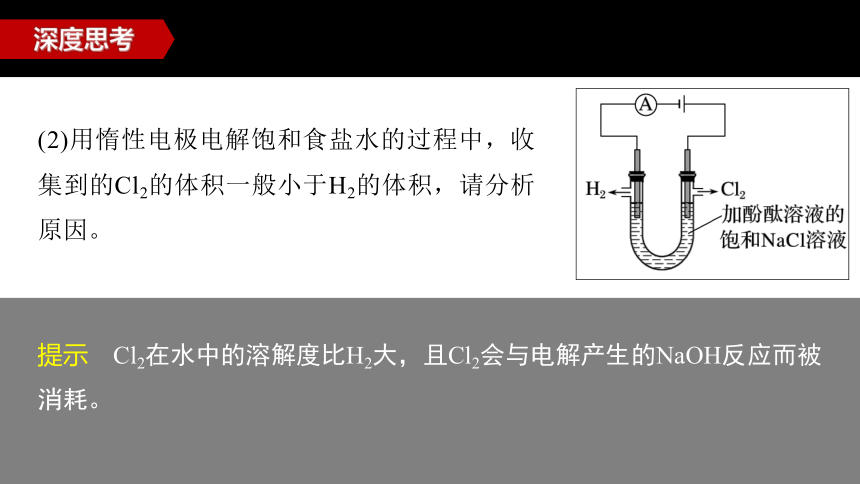
(2)用惰性电极电解饱和食盐水的过程中,收集到的Cl2的体积一般小于H2的体积,请分析原因。
提示 Cl2在水中的溶解度比H2大,且Cl2会与电解产生的NaOH反应而被消耗。
(3)接通电源后,哪个电极附近的颜色发生了变化?为什么?
提示 接通电源后,阴极区溶液变红色。原因:H2O电离出的H+放电,使c(OH-)增大,即阴极区产生碱,使溶液变红色。
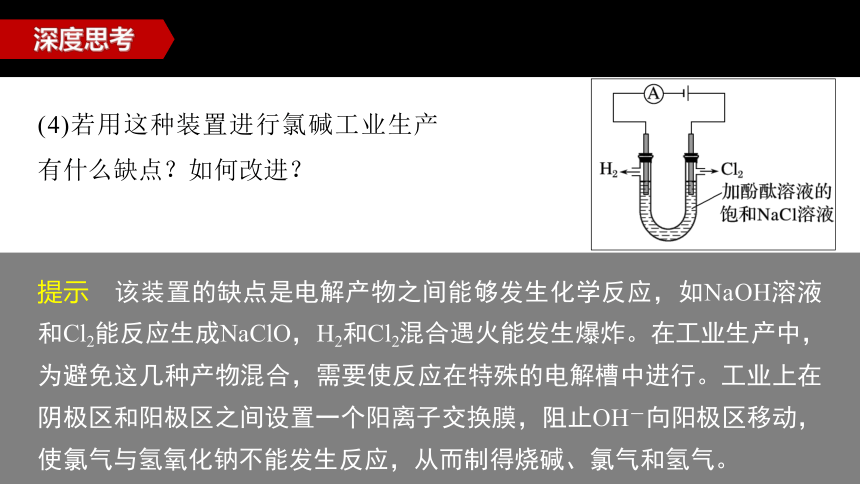
(4)若用这种装置进行氯碱工业生产有什么缺点?如何改进?
提示 该装置的缺点是电解产物之间能够发生化学反应,如NaOH溶液和Cl2能反应生成NaClO,H2和Cl2混合遇火能发生爆炸。在工业生产中,为避免这几种产物混合,需要使反应在特殊的电解槽中进行。工业上在阴极区和阳极区之间设置一个阳离子交换膜,阻止OH-向阳极区移动,使氯气与氢氧化钠不能发生反应,从而制得烧碱、氯气和氢气。
应用体验
1.工业电解饱和食盐水制烧碱时需阻止OH-移向阳极,目前采用阳离子交换膜将两极溶液分开(如图)(F处加少量NaOH以增加溶液导电性)。
(1)C、D分别是直流电源的两电极,C是电源____极,D是电源____极。
负
正
阳离子向阴极移动,由Na+移动方向知右侧电极为阴极,C、D分别是直流电源的两电极,故C是电源负极,D是电源正极。
(2)电解一段时间后,_____由A口导出,___由B口导出。阴极附近碱性增强的原因是______
____________(用电极反应式表示)。
Cl2
H2
2H++
2e-===H2↑
电解一段时间后,左侧电极产生Cl2,右侧电极产生H2和NaOH,可知Cl2从A口导出,H2从B口导出;由于阴极附近发生的是电解水的反应,产生的H+不断形成氢气析出,导致溶液中OH-浓度增大,碱性增强,用电极反应式表示为2H++2e-===H2↑。
(3)若不采用阳离子交换膜,OH-向阳极移动,发生的反应可用离子方程式表示为__________
_____________________。
Cl2+2OH-
===Cl-+ClO-+H2O
若不采用阳离子交换膜,OH-向阳极移动,与Cl2发生反应,离子方程式表示为Cl2+2OH-===Cl-+ClO-+H2O。
2.在新冠肺炎疫情期间,“84”消毒液是环境消毒液之一。某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和食盐水,通电时,为使Cl2被完全吸收制得有较强杀菌能力的消毒液,设计了如图所示的装置。c、d都为石墨电极。
完成下列填空:
(1)a为电源的_____(填“正”“负”“阴”或“阳”,下同)极,c为电解池的____极。
负
阳
(2)d电极上发生的电极反应式:__________________,电解产生消毒液的总化学方程式为____________________________。
2H++2e-===H2↑
电解饱和食盐水的化学方程式为2NaCl+2H2O 2NaOH+H2↑+Cl2↑,
该学生的目的是使Cl2被完全吸收制得NaClO溶液,即要让Cl2与NaOH溶液充分混合反应。所以应在下端产生Cl2,上端产生NaOH,
则a为负极,b为正极,c为阳极,d为阴极,Cl2和NaOH
溶液发生反应:Cl2+2NaOH===NaCl+NaClO+H2O,故
电解产生消毒液的总化学方程式为NaCl+H2O
NaClO+H2↑。
归纳总结
在氯碱工业中,采用了离子交换膜,离子交换膜将电解槽隔成阴极室和阳极室,它只允许阳离子(Na+)通过,而且阻止阴离子(Cl-、OH-)和气体通过。这样既能防止阴极产生的H2和阳极产生的Cl2相混合而引起爆炸,又能避免Cl2和NaOH作用生成NaClO而影响烧碱的质量和产量。
返回
铜的电解精炼 电镀
二
1.铜的电解精炼
(1)装置
(2)粗铜成分
①主要成分: 。
②杂质金属:比铜活泼的有 等,不如铜活泼的有 等。
Cu
Zn
Ag、Au
(3)电极反应
Cu(粗铜)-2e-===Cu2+
Ag、Au
Cu2++2e-===Cu(精铜)
2.电镀
(1)概念:应用 原理在某些金属或其他材料制品表面镀上一薄层其他 或 的过程。电镀除了提升美观和增加表面硬度之外,更主要的目的是增强材料的 ,防止金属氧化等。
电解
金属
合金
抗腐蚀能力
(2)基础实验:铁钉镀锌
根据电解原理,设计在铁钉上镀锌的实验方案。
电解原理 阳极:________ , 阴极:_________ _______ 电镀方案 电极 材料 阳极: ,
阴极:_____
电镀液 ZnCl2溶液
镀件 铁钉
锌片
铁钉
Zn-2e-
===Zn2+
Zn2++2e-
===Zn
(3)某电镀银实验装置如图所示。
请回答下列问题:
①银为 金属,与直流电源的 相连,作阳极;待镀金属制品与直流电源的 相连,作阴极;含银离子的溶液为 ,含有镀层金属离子。
②阳极反应式为 ;
阴极反应式为 。
镀层
正极
负极
电镀液
Ag-e-===Ag+
Ag++e-===Ag
③可观察到的现象是待镀金属制品表面___________
,银 。
④含银离子的溶液浓度的变化是 。
(4)电镀的特点是阳极参与电极反应,电镀过程中相关离子的浓度、溶液pH等保持不变。
不变
镀上一层光
亮的银
不断溶解
(1)在Fe上镀Ag,应用Fe作阳极,Ag作阴极,用AgNO3溶液作电镀液
( )
(2)电解精炼铜和电镀铜,电解质溶液中的c(Cu2+)均保持不变( )
(3)在镀件上电镀铜时,镀件应连接电源的正极( )
(4)电解精炼铜时,阳极泥可以作为提炼贵重金属的原料( )
(5)电解精炼铜和电镀铜过程中,阳极质量的减少与阴极质量的增加都相等( )
正误判断
×
√
×
×
×
1.在铁上镀锌时,溶液中的阳离子有两种,为什么在阴极是锌离子得电子而不是氢离子得电子被还原?
提示 因为锌离子浓度远大于氢离子浓度,所以是锌离子得电子。
2.构成电镀池的条件是什么?
提示 ①镀层金属与直流电源的正极相连,作阳极;
②待镀金属制品与直流电源的负极相连,作阴极;
③用含有镀层金属离子的电解质溶液作电镀液;
④形成闭合回路。
3.电镀的两个主要特点是什么?
提示 ①阳极本身参与电极反应;
②电镀过程中相关离子的浓度、溶液pH等保持不变。
4.电解精炼铜的过程中,溶液中Cu2+的浓度如何变化?
提示 电解精炼铜的过程中,阳极上金属铜和比铜活泼的金属杂质(如锌等)转化为阳离子进入溶液,阴极上只发生反应:Cu2++2e-===Cu,电解精炼过程中电解质溶液中Cu2+的浓度减小。
应用体验
1.欲在金属表面镀银,应把镀件挂在电镀池的阴极。下列各组中,选用的阳极金属和电镀液均正确的是
A.Ag和AgCl溶液 B.Ag和AgNO3溶液
C.Pt和Ag2CO3溶液 D.Pt和Ag2SO4溶液
√
在金属表面镀银,应把镀件挂在电镀池的阴极,镀层金属银作阳极,电镀液是含有银离子的溶液,AgCl溶解度太小,不适合作电镀液,硝酸银溶液满足条件,故B正确。
2.金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍。电解时,下列有关叙述正确的是(已知氧化性:Fe2+<Ni2+<Cu2+)
A.阳极发生还原反应,电极反应式:Ni2++2e-===Ni
B.电解过程中,阳极减少的质量与阴极增加的质量相等
C.电解后,电解槽底部的阳极泥中主要有Cu和Pt
D.电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+
√
根据电解原理,阳极上发生失电子的氧化反应,故A错误;
粗镍作阳极,根据金属活动性顺序,金属活动性强的先放电,因此阳极发生反应:Zn-2e-===Zn2+、Fe-2e-===Fe2+、Ni-2e-===Ni2+,阴极发生反应:Ni2++2e-===Ni,因此电解过程中阳极减少的质量与阴极增加的质量不相等,故B错误;
根据相应离子的氧化性强弱顺序,推出Ni比Cu活泼,Ni放电,Cu不放电,阳极泥中主要有Cu和Pt,故C正确;
精炼时,电解液中含有Ni2+,因此电解后溶液中存在的金属阳离子除Fe2+、Zn2+外,还有Ni2+,故D错误。
3.如图所示,甲、乙为相互串联的两个电解池。
(1)甲池若为电解精炼铜的装置,则A极为____极,电极材料是______,电极反应式为_________________,电解质溶液可以是_______________
___________。
阴
纯铜
Cu2++2e-===Cu
CuSO4溶液(答案
合理即可)
由题图可知,甲池中A极为阴极,B极为阳极,在电解精炼铜时,粗铜作阳极,纯铜作阴极,故A极材料为纯铜,电极反应式为Cu2++2e-===Cu。电解质溶液应为含有Cu2+的盐溶液,如CuSO4溶液等。
(2)乙池中铁极的电极反应为________________。
Ag++e-===Ag
由题图可知,乙池中铁作阴极,石墨作阳极,故铁极的电极反应式为
Ag++e-===Ag。
(3)若将乙池中的石墨电极改为银电极,则乙池为______装置,电解一段时间后,电解质溶液的浓度______。
电镀
不变
若将乙池中的石墨电极改为银电极,则乙池为电镀池,电镀过程中电解质溶液的浓度不变。
归纳总结
(1)电解精炼过程中的“两不等”:电解质溶液浓度在电解前后不相等;阴极增加的质量和阳极减少的质量不相等。
(2)电镀过程中“一不变”:电镀液(电解质溶液)的浓度不变。
返回
课时对点练
题组一 氯碱工业
1.用石墨电极电解饱和食盐水,下列分析错误的是
A.得电子能力:H+>Na+,故阴极得到H2
B.促进了水的电离,故阴极区得到OH-
C.失电子能力:Cl->OH-,故阳极得到Cl2
D.电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后,溶液呈中性
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
得电子能力:H+>Na+,电解饱和食盐水阴极发生反应:2H++2e-===H2↑,故A正确;
电解饱和食盐水过程中,H+被消耗,阴极消耗H+的同时得到OH-,故B正确;
失电子能力:Cl->OH-,电解饱和食盐水,阳极发生反应:2Cl--2e-
===Cl2↑,故C正确;
电解池中,总反应化学方程式为2NaCl+2H2O 2NaOH+Cl2↑+H2↑,所以溶液呈碱性,故D错误。
2.某同学设计如图所示装置,探究氯碱工业原理,下列说法正确的是
A.石墨电极与直流电源负极相连
B.用湿润淀粉-KI试纸在铜电极附近检验气体,试纸变蓝色
C.氢氧化钠在石墨电极附近产生,Na+向石墨电极迁移
D.铜电极的电极反应式为2H++2e-===H2↑
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
3.在氯碱工业中,离子交换膜法电解饱和食盐水示意图如图,下列说法不正确的是
A.离子交换膜为阳离子交换膜
B.OH-迁移的数量等于导线上通过电子的数量
C.电极A为阳极,发生氧化反应生成氯气
D.饱和NaCl溶液从a处进,NaOH溶液从d处出
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
为防止阳极生成的Cl2与阴极生成的H2、NaOH发生反应,所以离子交换膜为阳离子交换膜,OH-不迁移,故A正确、B错误;
电解饱和食盐水时氯离子在阳极放电生成Cl2,所以电极A为阳极,发生氧化反应,故C正确;
依据装置图分析可知饱和NaCl溶液从阳极进入,即a处进,NaOH在阴极生成,NaOH溶液从d处出,故D正确。
4.如图为电解饱和食盐水的简易装置,下列有关说法正确的是
A.电解一段时间后,往蛋壳内的溶液中滴加几滴酚酞溶液,呈红色
B.蛋壳表面缠绕的铁丝发生氧化反应
C.铁丝表面生成的气体能使湿润的淀粉碘化钾
试纸变蓝
D.蛋壳可阻止生成的氯气与氢气、氢氧化钠溶
液接触
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
碳棒与电源正极相连,作阳极,溶液中的Cl-在该电极上发生氧化反应:2Cl--2e-===Cl2↑,滴加酚酞溶液,溶液颜色无变化,A错误;
铁丝与电源负极相连,作阴极,H+在该电极上
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
发生还原反应生成氢气:2H++2e-===H2↑,B错误;
铁丝表面生成的气体是氢气,不能使湿润的淀粉碘化钾试纸变蓝,C错误;
蛋壳相当于隔膜,阻止氯气与氢气、氢氧化钠溶液接触,D正确。
题组二 电镀和铜的电解精炼
5.下列图示关于铜电极的连接错误的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
电镀时,镀件作阴极,镀层金属作阳极,连接错误,C项符合题意。
6.利用如图所示装置可以在铜牌表面电镀一层银。下列有关说法正确的是
A.通电后,Ag+向阳极移动
B.银片与电源负极相连
C.该电解池的阴极反应可表示为Ag++e-===Ag
D.当电镀一段时间后,将电源反接,铜牌可恢复如初
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
铜牌上镀银,银片为阳极,Ag+向阴极移动,阴极反应为Ag++e-===Ag。由于实验中镀层不可能非常均匀致密,所以将电源反接,阳极上Cu、Ag均会溶解,铜牌不可能恢复如初。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
7.用碱性氢氧燃料电池为电源进行电解的实验装置示意图如图所示。下列说法正确的是
A.燃料电池工作时负极反应为H2===2H++
2e-
B.若要实现铁上镀铜,则a极是铁,b极是铜
C.若要实现电解精炼铜,则a极发生氧化反应,b极上有铜析出
D.a、b两极均是石墨时,在相同条件下,当电池中消耗22.4 L(标准状
况)H2时,a极析出64 g铜
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
碱性氢氧燃料电池工作时负极通入H2,电极反应式为H2-2e-+2OH-===2H2O,A错误;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
若要实现铁上镀铜,则a极(阳极)是铜,b极(阴极)是铁,B错误;
若要实现电解精炼铜,则a极连接粗铜,发生氧化反应,b极为阴极,Cu2+得电子,b极上有铜析出,C正确;
a、b两极均是石墨时,在相同条件下,当电池中消耗22.4 L(标准状况)H2时,外电路转移2 mole-,b极为阴极,析出64 g铜,a极为阳极,不能析出铜,D错误。
题组三 电解应用的有关计算
8.用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得溶液中加入0.1 mol Cu2(OH)2CO3后恰好恢复到电解前的状态(不考虑二氧化碳的溶解),则电解过程中阳极产生气体的体积(标准状况)为
A.3.36 L B.4.48 L
C.6.72 L D.2.24 L
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
电解CuSO4溶液可得到H2SO4,碱式碳酸铜和硫酸反应生成硫酸铜、水和二氧化碳,所以加入0.1 mol碱式碳酸铜[Cu2(OH)2CO3]相当于加入0.2 mol CuO、0.1 mol H2O,电解过程分为两个阶段,第一阶段阳极生成O2,阴极生成Cu,加入0.2 mol CuO可恢复原状,第二阶段阳极生成O2,阴极生成H2,加入0.1 mol H2O可恢复原状;根据氧原子守恒可知阳极生成O2的物质的量为 =0.15 mol,标准状况下体积为0.15 mol×22.4 L·mol-1=3.36 L,选A。
9.如图所示,a、b是石墨电极,通电一段时间后,b极附近溶液显红色。下列说法正确的是
A.X极是电源负极,Y极是电源正极
B.a极上的电极反应是2Cl--2e-===Cl2↑
C.电解过程中CuSO4溶液的pH逐渐增大
D.b极上产生2.24 L(标准状况下)气体时,Pt电极上有6.4 g Cu析出
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
b极附近溶液显红色,所以b极上的电极反应为2H++2e-===H2↑,a极上的电极反应为2Cl--2e-===Cl2↑,则Y为电源负极,X为电源正极,Pt为阳极,Cu为阴极,a为阳极,b为阴极,A项错误、B项正确;
2CuSO4+2H2O 2Cu+O2↑+2H2SO4,电解过程中CuSO4溶液的pH逐渐变小,C项错误;
Pt电极上发生氧化反应,不会有Cu析出,D项错误。
题组四 电解原理的综合应用
10.中学阶段介绍的应用电解法制备物质主要有三种:一是铝的工业制备,二是氯碱工业,三是金属钠的制备。下列关于这三种工业生产的描述正确的是
A.电解法制金属钠时,阳极反应式:Na++e-===Na
B.电解法生产铝时,需对铝土矿进行提纯,在提纯过程中应用了氧化铝或氢
氧化铝的两性
C.在氯碱工业中,电解池的阴极产生的是H2,NaOH在阳极附近产生
D.氯碱工业和金属钠的冶炼都用到了NaCl,在电解时它们的阴极都是Cl-失
电子
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
A项,阴极反应式为Na++e-===Na,错误;
B项,氧化铝和氢氧化铝具有两性,在分离提纯时可用NaOH溶液将其溶解,过滤除去难溶物,再将 转化成Al(OH)3,Al(OH)3热分解即得Al2O3,正确;
C项,阴极产物为H2和NaOH,阳极产物为Cl2,错误;
D项,阳极都是Cl-失电子,错误。
11.氢氧化锂是合成其他锂产品的基本原料,也可以直接用于其他工业领域。用如图所示的双膜电解装置可制备氢氧化锂。下列有关叙述正确的是
A.甲膜为阴离子交换膜,乙膜为阳离子
交换膜
B.通电后Li+向阳极移动,阳极附近的溶
液的pH减小
C.阴极的电极反应为H2O+2e-===H2↑+O2-
D.当电路中通过1 mol电子时,可生成49 g H2SO4
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
连接电源负极的a电极为阴极,连接电源正极的b电极为阳极,通电后,阳离子向电解池的阴极移动,阴离子向电解池的阳极移动,故甲膜为阳离子交换膜,乙膜为阴离子交换膜,A、B项错误;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
阴极发生还原反应,但在水溶液中不可能生成O2-,C项错误;
阳极电极反应式为2H2O-4e-===O2↑+4H+,当电路中通过1 mol电子时,生成1 mol H+,即生成49 g H2SO4,D项正确。
12.电解法处理酸性含铬废水(主要含有 )时,以铁板作阴、阳极,处理过程中存在反应: +6Fe2++14H+===2Cr3++6Fe3++7H2O,最后Cr3+以Cr(OH)3形式除去。下列说法不正确的是
A.阳极反应为Fe-2e-===Fe2+
B.电解过程中溶液pH不会变化
C.过程中有Fe(OH)3沉淀生成
D.电路中每转移12 mol电子,最多有1 mol 被还原
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
电解时铁作阳极,失去电子生成Fe2+,Fe2+将废水中的 还原为Cr3+,A项正确;
阴极反应式为2H++2e-===H2↑,Fe2+还原 时也消耗H+,使溶液的pH变大, Fe3+转化为Fe(OH)3沉淀,B项错误、C项正确;
根据电极反应式:Fe-2e-===Fe2+,可知每转移12 mol e-生成6 mol Fe2+,6 mol Fe2+可还原1 mol ,D项正确。
13.知识的梳理和感悟是有效学习的方法之一。某学习小组将有关“电解饱和食盐水”的相关内容进行梳理,形成如下问题(显示的电极均为石墨)。
(1)图甲中,电解一段时间后,气球b中的气体是_______(填化学式)。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
H2
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
图甲中,根据电子流向知右边电极是电解池的阴极,阴极上氢离子放电生成氢气,所以气球b中的气体是氢气。
(2)二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。如图乙是目前已开发的用电解法制取ClO2的新工艺。
①阳极产生ClO2的电极反应式为________________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
Cl--5e-+2H2O===ClO2↑+4H+
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
由题意可知,氯离子在阳极失去电子生成ClO2,根据化合价变化情况和电荷守恒写出阳极的电极反应式为Cl--5e-+2H2O===ClO2↑+4H+。
②当阴极产生标准状况下112 mL气体时,通过阳离子交换膜离子的物质的量为__________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
0.01 mol
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
阴极产生的标准状况下112 mL气体是H2,物质的量为0.005 mol,阴极电极反应式为2H2O+2e-===H2↑+2OH-,所以电路中转移电子0.01 mol,钠离子所带电荷数与电子所带电荷数相同,所以通过阳离子交换膜的钠离子的物质的量为0.01 mol。
14.SO2和NOx是主要大气污染物,利用如图装置可同时吸收SO2和NO。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
试回答下列问题:
(1)b为直流电源的____极(填“正”或“负”),d电极的电极反应式为
______________________________。
正
由装置示意图可知,电解池右侧进入稀H2SO4和SO2,产生较浓H2SO4,说明SO2在d电极上失电子生成 ,故d电极反应式为SO2+2H2O-2e-=== +4H+,d电极为阳极,则b为电源的正极。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
(2)已知电解池的阴极室中溶液的pH在4~7(常温下)之间,阴极的电极反应式为__________________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
(3)用离子方程式表示吸收NO的原理:_____________________________
_________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
15.电解的应用比较广泛。根据下列电解的应用,回答问题:
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
(1)如图为电解精炼银的示意图,____(填“a”或“b”)极为含有杂质的粗银,若b极有少量红棕色气体生成,则生成该气体的电极反应式为_________________________________________
a
__________________________________________。
+2H++e-===NO2↑+H2O(或 +4H+
+3e-===NO↑+2H2O、2NO+O2===2NO2
电解精炼银与电解精炼铜原理相似。电解精炼银装置中,含有杂质的粗银作阳极,电解池的阳极与电源的正极相连,则该装置中a极为含有杂质的粗银。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
(2)利用如图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液。电极B区电解液为___________(填化学式)溶液,阳极电极反应式为
___________________,电解过程中Li+向电极______(填“A”或“B”)迁移。
LiOH
2Cl--2e-===Cl2↑
B
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
根据电解装置图,两电极区电解液分别为LiOH和LiCl溶液,电极B区生成H2,电极反应式为2H++2e-===H2↑,剩余OH-与Li+结合生成LiOH,所以电极B区电解液为LiOH溶液,电极B为阴极,则电极A为阳极,阳极区电解液为LiCl溶液,电极反应式为2Cl--2e-===Cl2↑,电解过程中Li+向电极B迁移。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
(3)离子液体是一种室温熔融盐,为非水体系。由有机阳离子、 和
组成的离子液体作电解液时,可在钢制品上电镀铝。钢制品应接电源的____极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极反应式为____________________________。若改用氯化铝水溶液作电解液,则阴极产物为_____。
负
H2
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
在钢制品上电镀铝,故钢制品作阴极,与电源负极相连。由于电镀过程中“不产生其他阳离子且有机阳离子不参与电极反应”,Al元素在熔融盐中以 和 形式存在,则电镀过程中阴极反应式为4 +
3e-===Al+7 。若电解液改为氯化铝水溶液,水溶液中得电子能力:Al3+返回
专题1
本课结束
第5课时
DIWUKESHI
氯碱工业 / 铜的电解精炼 电镀 / 课时对点练
电解原理的应用
专题1
1.变化观念与平衡思想:
通过对氯碱工业、电镀、铜的电解精炼等原理的分析,认识电能与化学能之间的能量转化。
2.证据推理与模型认知:
建立电解应用问题的分析思维模型和电解相关计算的思维模型,加深对电解原理的理解和应用。
内容索引
一、氯碱工业
二、铜的电解精炼 电镀
课时对点练
氯碱工业
一
1.氯碱工业概念
用电解 的方法来制取氢氧化钠、氢气和氯气,并以它们为原料生产一系列化工产品的工业,称为氯碱工业。
2.氯碱工业原理
(1)通电前,氯化钠溶液中含有四种自由移动的离子,它们是__________
。
(2)通电时,移向阳极的离子是 , 在阳极放电,移向阴极的离子是 , 在阴极放电,因 放电,使阴极区溶液呈 性。
饱和食盐水
Na+、Cl-、
H+、OH-
Cl-、OH-
Cl-
Na+、H+
H+
H+
碱
①电解饱和食盐水的原理示意图
②阳离子交换膜的作用:只允许Na+等阳离子通过,不允许Cl-、OH-等阴离子及气体分子通过,可以防止
阴极产生的 与阳极产生的 混合发生爆炸,也能避免 与阴极产生的 反应而影响 。
氢气
氯气
氯气
氢氧化钠
氢氧化钠的产量和质量
(3)电极反应式和总反应方程式
①阳极: ;
阴极: 。
②总反应的化学方程式为 ;
总反应的离子方程式为 。
2Cl--2e-===Cl2↑
2H++2e-===H2↑
(1)电解饱和食盐水时,阴极发生氧化反应:2Cl--2e-===Cl2↑( )
(2)氯碱工业电解槽中滴入酚酞溶液,变红色的为阳极区( )
(3)电解饱和食盐水时,阳极和阴极都可以选择金属材料(如铁)( )
(4)电解饱和NaCl溶液可以制取金属钠( )
(5)利用电解饱和食盐水可制得“84”消毒液( )
正误判断
×
×
×
×
√
按如图所示安装仪器,电极材料为石墨,电解质溶液为饱和食盐水(同时滴入几滴酚酞)。
(1)实验所用的电极材料为石墨,能否更换为活泼金属材料?
提示 阴极可以更换为活泼金属材料,但不能更换为金属铝等可以与强碱发生反应的金属材料;阳极必须用惰性电极。
(2)用惰性电极电解饱和食盐水的过程中,收集到的Cl2的体积一般小于H2的体积,请分析原因。
提示 Cl2在水中的溶解度比H2大,且Cl2会与电解产生的NaOH反应而被消耗。
(3)接通电源后,哪个电极附近的颜色发生了变化?为什么?
提示 接通电源后,阴极区溶液变红色。原因:H2O电离出的H+放电,使c(OH-)增大,即阴极区产生碱,使溶液变红色。
(4)若用这种装置进行氯碱工业生产有什么缺点?如何改进?
提示 该装置的缺点是电解产物之间能够发生化学反应,如NaOH溶液和Cl2能反应生成NaClO,H2和Cl2混合遇火能发生爆炸。在工业生产中,为避免这几种产物混合,需要使反应在特殊的电解槽中进行。工业上在阴极区和阳极区之间设置一个阳离子交换膜,阻止OH-向阳极区移动,使氯气与氢氧化钠不能发生反应,从而制得烧碱、氯气和氢气。
应用体验
1.工业电解饱和食盐水制烧碱时需阻止OH-移向阳极,目前采用阳离子交换膜将两极溶液分开(如图)(F处加少量NaOH以增加溶液导电性)。
(1)C、D分别是直流电源的两电极,C是电源____极,D是电源____极。
负
正
阳离子向阴极移动,由Na+移动方向知右侧电极为阴极,C、D分别是直流电源的两电极,故C是电源负极,D是电源正极。
(2)电解一段时间后,_____由A口导出,___由B口导出。阴极附近碱性增强的原因是______
____________(用电极反应式表示)。
Cl2
H2
2H++
2e-===H2↑
电解一段时间后,左侧电极产生Cl2,右侧电极产生H2和NaOH,可知Cl2从A口导出,H2从B口导出;由于阴极附近发生的是电解水的反应,产生的H+不断形成氢气析出,导致溶液中OH-浓度增大,碱性增强,用电极反应式表示为2H++2e-===H2↑。
(3)若不采用阳离子交换膜,OH-向阳极移动,发生的反应可用离子方程式表示为__________
_____________________。
Cl2+2OH-
===Cl-+ClO-+H2O
若不采用阳离子交换膜,OH-向阳极移动,与Cl2发生反应,离子方程式表示为Cl2+2OH-===Cl-+ClO-+H2O。
2.在新冠肺炎疫情期间,“84”消毒液是环境消毒液之一。某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和食盐水,通电时,为使Cl2被完全吸收制得有较强杀菌能力的消毒液,设计了如图所示的装置。c、d都为石墨电极。
完成下列填空:
(1)a为电源的_____(填“正”“负”“阴”或“阳”,下同)极,c为电解池的____极。
负
阳
(2)d电极上发生的电极反应式:__________________,电解产生消毒液的总化学方程式为____________________________。
2H++2e-===H2↑
电解饱和食盐水的化学方程式为2NaCl+2H2O 2NaOH+H2↑+Cl2↑,
该学生的目的是使Cl2被完全吸收制得NaClO溶液,即要让Cl2与NaOH溶液充分混合反应。所以应在下端产生Cl2,上端产生NaOH,
则a为负极,b为正极,c为阳极,d为阴极,Cl2和NaOH
溶液发生反应:Cl2+2NaOH===NaCl+NaClO+H2O,故
电解产生消毒液的总化学方程式为NaCl+H2O
NaClO+H2↑。
归纳总结
在氯碱工业中,采用了离子交换膜,离子交换膜将电解槽隔成阴极室和阳极室,它只允许阳离子(Na+)通过,而且阻止阴离子(Cl-、OH-)和气体通过。这样既能防止阴极产生的H2和阳极产生的Cl2相混合而引起爆炸,又能避免Cl2和NaOH作用生成NaClO而影响烧碱的质量和产量。
返回
铜的电解精炼 电镀
二
1.铜的电解精炼
(1)装置
(2)粗铜成分
①主要成分: 。
②杂质金属:比铜活泼的有 等,不如铜活泼的有 等。
Cu
Zn
Ag、Au
(3)电极反应
Cu(粗铜)-2e-===Cu2+
Ag、Au
Cu2++2e-===Cu(精铜)
2.电镀
(1)概念:应用 原理在某些金属或其他材料制品表面镀上一薄层其他 或 的过程。电镀除了提升美观和增加表面硬度之外,更主要的目的是增强材料的 ,防止金属氧化等。
电解
金属
合金
抗腐蚀能力
(2)基础实验:铁钉镀锌
根据电解原理,设计在铁钉上镀锌的实验方案。
电解原理 阳极:________ , 阴极:_________ _______ 电镀方案 电极 材料 阳极: ,
阴极:_____
电镀液 ZnCl2溶液
镀件 铁钉
锌片
铁钉
Zn-2e-
===Zn2+
Zn2++2e-
===Zn
(3)某电镀银实验装置如图所示。
请回答下列问题:
①银为 金属,与直流电源的 相连,作阳极;待镀金属制品与直流电源的 相连,作阴极;含银离子的溶液为 ,含有镀层金属离子。
②阳极反应式为 ;
阴极反应式为 。
镀层
正极
负极
电镀液
Ag-e-===Ag+
Ag++e-===Ag
③可观察到的现象是待镀金属制品表面___________
,银 。
④含银离子的溶液浓度的变化是 。
(4)电镀的特点是阳极参与电极反应,电镀过程中相关离子的浓度、溶液pH等保持不变。
不变
镀上一层光
亮的银
不断溶解
(1)在Fe上镀Ag,应用Fe作阳极,Ag作阴极,用AgNO3溶液作电镀液
( )
(2)电解精炼铜和电镀铜,电解质溶液中的c(Cu2+)均保持不变( )
(3)在镀件上电镀铜时,镀件应连接电源的正极( )
(4)电解精炼铜时,阳极泥可以作为提炼贵重金属的原料( )
(5)电解精炼铜和电镀铜过程中,阳极质量的减少与阴极质量的增加都相等( )
正误判断
×
√
×
×
×
1.在铁上镀锌时,溶液中的阳离子有两种,为什么在阴极是锌离子得电子而不是氢离子得电子被还原?
提示 因为锌离子浓度远大于氢离子浓度,所以是锌离子得电子。
2.构成电镀池的条件是什么?
提示 ①镀层金属与直流电源的正极相连,作阳极;
②待镀金属制品与直流电源的负极相连,作阴极;
③用含有镀层金属离子的电解质溶液作电镀液;
④形成闭合回路。
3.电镀的两个主要特点是什么?
提示 ①阳极本身参与电极反应;
②电镀过程中相关离子的浓度、溶液pH等保持不变。
4.电解精炼铜的过程中,溶液中Cu2+的浓度如何变化?
提示 电解精炼铜的过程中,阳极上金属铜和比铜活泼的金属杂质(如锌等)转化为阳离子进入溶液,阴极上只发生反应:Cu2++2e-===Cu,电解精炼过程中电解质溶液中Cu2+的浓度减小。
应用体验
1.欲在金属表面镀银,应把镀件挂在电镀池的阴极。下列各组中,选用的阳极金属和电镀液均正确的是
A.Ag和AgCl溶液 B.Ag和AgNO3溶液
C.Pt和Ag2CO3溶液 D.Pt和Ag2SO4溶液
√
在金属表面镀银,应把镀件挂在电镀池的阴极,镀层金属银作阳极,电镀液是含有银离子的溶液,AgCl溶解度太小,不适合作电镀液,硝酸银溶液满足条件,故B正确。
2.金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍。电解时,下列有关叙述正确的是(已知氧化性:Fe2+<Ni2+<Cu2+)
A.阳极发生还原反应,电极反应式:Ni2++2e-===Ni
B.电解过程中,阳极减少的质量与阴极增加的质量相等
C.电解后,电解槽底部的阳极泥中主要有Cu和Pt
D.电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+
√
根据电解原理,阳极上发生失电子的氧化反应,故A错误;
粗镍作阳极,根据金属活动性顺序,金属活动性强的先放电,因此阳极发生反应:Zn-2e-===Zn2+、Fe-2e-===Fe2+、Ni-2e-===Ni2+,阴极发生反应:Ni2++2e-===Ni,因此电解过程中阳极减少的质量与阴极增加的质量不相等,故B错误;
根据相应离子的氧化性强弱顺序,推出Ni比Cu活泼,Ni放电,Cu不放电,阳极泥中主要有Cu和Pt,故C正确;
精炼时,电解液中含有Ni2+,因此电解后溶液中存在的金属阳离子除Fe2+、Zn2+外,还有Ni2+,故D错误。
3.如图所示,甲、乙为相互串联的两个电解池。
(1)甲池若为电解精炼铜的装置,则A极为____极,电极材料是______,电极反应式为_________________,电解质溶液可以是_______________
___________。
阴
纯铜
Cu2++2e-===Cu
CuSO4溶液(答案
合理即可)
由题图可知,甲池中A极为阴极,B极为阳极,在电解精炼铜时,粗铜作阳极,纯铜作阴极,故A极材料为纯铜,电极反应式为Cu2++2e-===Cu。电解质溶液应为含有Cu2+的盐溶液,如CuSO4溶液等。
(2)乙池中铁极的电极反应为________________。
Ag++e-===Ag
由题图可知,乙池中铁作阴极,石墨作阳极,故铁极的电极反应式为
Ag++e-===Ag。
(3)若将乙池中的石墨电极改为银电极,则乙池为______装置,电解一段时间后,电解质溶液的浓度______。
电镀
不变
若将乙池中的石墨电极改为银电极,则乙池为电镀池,电镀过程中电解质溶液的浓度不变。
归纳总结
(1)电解精炼过程中的“两不等”:电解质溶液浓度在电解前后不相等;阴极增加的质量和阳极减少的质量不相等。
(2)电镀过程中“一不变”:电镀液(电解质溶液)的浓度不变。
返回
课时对点练
题组一 氯碱工业
1.用石墨电极电解饱和食盐水,下列分析错误的是
A.得电子能力:H+>Na+,故阴极得到H2
B.促进了水的电离,故阴极区得到OH-
C.失电子能力:Cl->OH-,故阳极得到Cl2
D.电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后,溶液呈中性
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
得电子能力:H+>Na+,电解饱和食盐水阴极发生反应:2H++2e-===H2↑,故A正确;
电解饱和食盐水过程中,H+被消耗,阴极消耗H+的同时得到OH-,故B正确;
失电子能力:Cl->OH-,电解饱和食盐水,阳极发生反应:2Cl--2e-
===Cl2↑,故C正确;
电解池中,总反应化学方程式为2NaCl+2H2O 2NaOH+Cl2↑+H2↑,所以溶液呈碱性,故D错误。
2.某同学设计如图所示装置,探究氯碱工业原理,下列说法正确的是
A.石墨电极与直流电源负极相连
B.用湿润淀粉-KI试纸在铜电极附近检验气体,试纸变蓝色
C.氢氧化钠在石墨电极附近产生,Na+向石墨电极迁移
D.铜电极的电极反应式为2H++2e-===H2↑
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
3.在氯碱工业中,离子交换膜法电解饱和食盐水示意图如图,下列说法不正确的是
A.离子交换膜为阳离子交换膜
B.OH-迁移的数量等于导线上通过电子的数量
C.电极A为阳极,发生氧化反应生成氯气
D.饱和NaCl溶液从a处进,NaOH溶液从d处出
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
为防止阳极生成的Cl2与阴极生成的H2、NaOH发生反应,所以离子交换膜为阳离子交换膜,OH-不迁移,故A正确、B错误;
电解饱和食盐水时氯离子在阳极放电生成Cl2,所以电极A为阳极,发生氧化反应,故C正确;
依据装置图分析可知饱和NaCl溶液从阳极进入,即a处进,NaOH在阴极生成,NaOH溶液从d处出,故D正确。
4.如图为电解饱和食盐水的简易装置,下列有关说法正确的是
A.电解一段时间后,往蛋壳内的溶液中滴加几滴酚酞溶液,呈红色
B.蛋壳表面缠绕的铁丝发生氧化反应
C.铁丝表面生成的气体能使湿润的淀粉碘化钾
试纸变蓝
D.蛋壳可阻止生成的氯气与氢气、氢氧化钠溶
液接触
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
碳棒与电源正极相连,作阳极,溶液中的Cl-在该电极上发生氧化反应:2Cl--2e-===Cl2↑,滴加酚酞溶液,溶液颜色无变化,A错误;
铁丝与电源负极相连,作阴极,H+在该电极上
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
发生还原反应生成氢气:2H++2e-===H2↑,B错误;
铁丝表面生成的气体是氢气,不能使湿润的淀粉碘化钾试纸变蓝,C错误;
蛋壳相当于隔膜,阻止氯气与氢气、氢氧化钠溶液接触,D正确。
题组二 电镀和铜的电解精炼
5.下列图示关于铜电极的连接错误的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
电镀时,镀件作阴极,镀层金属作阳极,连接错误,C项符合题意。
6.利用如图所示装置可以在铜牌表面电镀一层银。下列有关说法正确的是
A.通电后,Ag+向阳极移动
B.银片与电源负极相连
C.该电解池的阴极反应可表示为Ag++e-===Ag
D.当电镀一段时间后,将电源反接,铜牌可恢复如初
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
铜牌上镀银,银片为阳极,Ag+向阴极移动,阴极反应为Ag++e-===Ag。由于实验中镀层不可能非常均匀致密,所以将电源反接,阳极上Cu、Ag均会溶解,铜牌不可能恢复如初。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
7.用碱性氢氧燃料电池为电源进行电解的实验装置示意图如图所示。下列说法正确的是
A.燃料电池工作时负极反应为H2===2H++
2e-
B.若要实现铁上镀铜,则a极是铁,b极是铜
C.若要实现电解精炼铜,则a极发生氧化反应,b极上有铜析出
D.a、b两极均是石墨时,在相同条件下,当电池中消耗22.4 L(标准状
况)H2时,a极析出64 g铜
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
碱性氢氧燃料电池工作时负极通入H2,电极反应式为H2-2e-+2OH-===2H2O,A错误;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
若要实现铁上镀铜,则a极(阳极)是铜,b极(阴极)是铁,B错误;
若要实现电解精炼铜,则a极连接粗铜,发生氧化反应,b极为阴极,Cu2+得电子,b极上有铜析出,C正确;
a、b两极均是石墨时,在相同条件下,当电池中消耗22.4 L(标准状况)H2时,外电路转移2 mole-,b极为阴极,析出64 g铜,a极为阳极,不能析出铜,D错误。
题组三 电解应用的有关计算
8.用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得溶液中加入0.1 mol Cu2(OH)2CO3后恰好恢复到电解前的状态(不考虑二氧化碳的溶解),则电解过程中阳极产生气体的体积(标准状况)为
A.3.36 L B.4.48 L
C.6.72 L D.2.24 L
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
电解CuSO4溶液可得到H2SO4,碱式碳酸铜和硫酸反应生成硫酸铜、水和二氧化碳,所以加入0.1 mol碱式碳酸铜[Cu2(OH)2CO3]相当于加入0.2 mol CuO、0.1 mol H2O,电解过程分为两个阶段,第一阶段阳极生成O2,阴极生成Cu,加入0.2 mol CuO可恢复原状,第二阶段阳极生成O2,阴极生成H2,加入0.1 mol H2O可恢复原状;根据氧原子守恒可知阳极生成O2的物质的量为 =0.15 mol,标准状况下体积为0.15 mol×22.4 L·mol-1=3.36 L,选A。
9.如图所示,a、b是石墨电极,通电一段时间后,b极附近溶液显红色。下列说法正确的是
A.X极是电源负极,Y极是电源正极
B.a极上的电极反应是2Cl--2e-===Cl2↑
C.电解过程中CuSO4溶液的pH逐渐增大
D.b极上产生2.24 L(标准状况下)气体时,Pt电极上有6.4 g Cu析出
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
b极附近溶液显红色,所以b极上的电极反应为2H++2e-===H2↑,a极上的电极反应为2Cl--2e-===Cl2↑,则Y为电源负极,X为电源正极,Pt为阳极,Cu为阴极,a为阳极,b为阴极,A项错误、B项正确;
2CuSO4+2H2O 2Cu+O2↑+2H2SO4,电解过程中CuSO4溶液的pH逐渐变小,C项错误;
Pt电极上发生氧化反应,不会有Cu析出,D项错误。
题组四 电解原理的综合应用
10.中学阶段介绍的应用电解法制备物质主要有三种:一是铝的工业制备,二是氯碱工业,三是金属钠的制备。下列关于这三种工业生产的描述正确的是
A.电解法制金属钠时,阳极反应式:Na++e-===Na
B.电解法生产铝时,需对铝土矿进行提纯,在提纯过程中应用了氧化铝或氢
氧化铝的两性
C.在氯碱工业中,电解池的阴极产生的是H2,NaOH在阳极附近产生
D.氯碱工业和金属钠的冶炼都用到了NaCl,在电解时它们的阴极都是Cl-失
电子
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
A项,阴极反应式为Na++e-===Na,错误;
B项,氧化铝和氢氧化铝具有两性,在分离提纯时可用NaOH溶液将其溶解,过滤除去难溶物,再将 转化成Al(OH)3,Al(OH)3热分解即得Al2O3,正确;
C项,阴极产物为H2和NaOH,阳极产物为Cl2,错误;
D项,阳极都是Cl-失电子,错误。
11.氢氧化锂是合成其他锂产品的基本原料,也可以直接用于其他工业领域。用如图所示的双膜电解装置可制备氢氧化锂。下列有关叙述正确的是
A.甲膜为阴离子交换膜,乙膜为阳离子
交换膜
B.通电后Li+向阳极移动,阳极附近的溶
液的pH减小
C.阴极的电极反应为H2O+2e-===H2↑+O2-
D.当电路中通过1 mol电子时,可生成49 g H2SO4
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
连接电源负极的a电极为阴极,连接电源正极的b电极为阳极,通电后,阳离子向电解池的阴极移动,阴离子向电解池的阳极移动,故甲膜为阳离子交换膜,乙膜为阴离子交换膜,A、B项错误;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
阴极发生还原反应,但在水溶液中不可能生成O2-,C项错误;
阳极电极反应式为2H2O-4e-===O2↑+4H+,当电路中通过1 mol电子时,生成1 mol H+,即生成49 g H2SO4,D项正确。
12.电解法处理酸性含铬废水(主要含有 )时,以铁板作阴、阳极,处理过程中存在反应: +6Fe2++14H+===2Cr3++6Fe3++7H2O,最后Cr3+以Cr(OH)3形式除去。下列说法不正确的是
A.阳极反应为Fe-2e-===Fe2+
B.电解过程中溶液pH不会变化
C.过程中有Fe(OH)3沉淀生成
D.电路中每转移12 mol电子,最多有1 mol 被还原
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
电解时铁作阳极,失去电子生成Fe2+,Fe2+将废水中的 还原为Cr3+,A项正确;
阴极反应式为2H++2e-===H2↑,Fe2+还原 时也消耗H+,使溶液的pH变大, Fe3+转化为Fe(OH)3沉淀,B项错误、C项正确;
根据电极反应式:Fe-2e-===Fe2+,可知每转移12 mol e-生成6 mol Fe2+,6 mol Fe2+可还原1 mol ,D项正确。
13.知识的梳理和感悟是有效学习的方法之一。某学习小组将有关“电解饱和食盐水”的相关内容进行梳理,形成如下问题(显示的电极均为石墨)。
(1)图甲中,电解一段时间后,气球b中的气体是_______(填化学式)。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
H2
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
图甲中,根据电子流向知右边电极是电解池的阴极,阴极上氢离子放电生成氢气,所以气球b中的气体是氢气。
(2)二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。如图乙是目前已开发的用电解法制取ClO2的新工艺。
①阳极产生ClO2的电极反应式为________________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
Cl--5e-+2H2O===ClO2↑+4H+
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
由题意可知,氯离子在阳极失去电子生成ClO2,根据化合价变化情况和电荷守恒写出阳极的电极反应式为Cl--5e-+2H2O===ClO2↑+4H+。
②当阴极产生标准状况下112 mL气体时,通过阳离子交换膜离子的物质的量为__________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
0.01 mol
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
阴极产生的标准状况下112 mL气体是H2,物质的量为0.005 mol,阴极电极反应式为2H2O+2e-===H2↑+2OH-,所以电路中转移电子0.01 mol,钠离子所带电荷数与电子所带电荷数相同,所以通过阳离子交换膜的钠离子的物质的量为0.01 mol。
14.SO2和NOx是主要大气污染物,利用如图装置可同时吸收SO2和NO。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
试回答下列问题:
(1)b为直流电源的____极(填“正”或“负”),d电极的电极反应式为
______________________________。
正
由装置示意图可知,电解池右侧进入稀H2SO4和SO2,产生较浓H2SO4,说明SO2在d电极上失电子生成 ,故d电极反应式为SO2+2H2O-2e-=== +4H+,d电极为阳极,则b为电源的正极。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
(2)已知电解池的阴极室中溶液的pH在4~7(常温下)之间,阴极的电极反应式为__________________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
(3)用离子方程式表示吸收NO的原理:_____________________________
_________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
15.电解的应用比较广泛。根据下列电解的应用,回答问题:
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
(1)如图为电解精炼银的示意图,____(填“a”或“b”)极为含有杂质的粗银,若b极有少量红棕色气体生成,则生成该气体的电极反应式为_________________________________________
a
__________________________________________。
+2H++e-===NO2↑+H2O(或 +4H+
+3e-===NO↑+2H2O、2NO+O2===2NO2
电解精炼银与电解精炼铜原理相似。电解精炼银装置中,含有杂质的粗银作阳极,电解池的阳极与电源的正极相连,则该装置中a极为含有杂质的粗银。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
(2)利用如图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液。电极B区电解液为___________(填化学式)溶液,阳极电极反应式为
___________________,电解过程中Li+向电极______(填“A”或“B”)迁移。
LiOH
2Cl--2e-===Cl2↑
B
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
根据电解装置图,两电极区电解液分别为LiOH和LiCl溶液,电极B区生成H2,电极反应式为2H++2e-===H2↑,剩余OH-与Li+结合生成LiOH,所以电极B区电解液为LiOH溶液,电极B为阴极,则电极A为阳极,阳极区电解液为LiCl溶液,电极反应式为2Cl--2e-===Cl2↑,电解过程中Li+向电极B迁移。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
(3)离子液体是一种室温熔融盐,为非水体系。由有机阳离子、 和
组成的离子液体作电解液时,可在钢制品上电镀铝。钢制品应接电源的____极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极反应式为____________________________。若改用氯化铝水溶液作电解液,则阴极产物为_____。
负
H2
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
在钢制品上电镀铝,故钢制品作阴极,与电源负极相连。由于电镀过程中“不产生其他阳离子且有机阳离子不参与电极反应”,Al元素在熔融盐中以 和 形式存在,则电镀过程中阴极反应式为4 +
3e-===Al+7 。若电解液改为氯化铝水溶液,水溶液中得电子能力:Al3+
专题1
本课结束
