第三章《晶体结构与性质》练习题2022-2023学年下学期高二化学人教版(2019)选择性必修2(Word含答案)
文档属性
| 名称 | 第三章《晶体结构与性质》练习题2022-2023学年下学期高二化学人教版(2019)选择性必修2(Word含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 335.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-22 08:31:14 | ||
图片预览



文档简介
第三章《晶体结构与性质》练习题
一、单选题
1.下列有关晶胞的叙述中,正确的是。
A.晶胞是晶体结构中最小的重复单元
B.晶胞中的任何一个粒子都属于该晶胞
C.所有晶体都是由平行六面体无隙组合而成
D.不同晶体中的晶胞的大小和形状均相同
2.有关原子晶体的叙述,错误的是
A.原子晶体中,原子不遵循紧密堆积原则 B.原子晶体中不存在独立的分子
C.原子晶体的熔点和硬度较高 D.原子晶体熔化时不破坏化学键
3.已知晶体属立方晶系,晶胞边长a。将掺杂到该晶胞中,可得到一种高性能的p型太阳能电池材料,其结构单元如图所示。
假定掺杂后的晶胞参数不发生变化,下列说法正确的是
A.该结构单元中O原子数为3 B.Ni和Mg间的最短距离是
C.Ni的配位数为4 D.该物质的化学式为
4.下列有关分子晶体的叙述正确的是
A.分子内均存在共价键
B.分子晶体的熔点较高
C.分子晶体中一定存在氢键
D.分子晶体熔化时一定破坏了范德华力
5.下列各组物质的晶体类型相同的是
A.SiO2和SO3 B.I2和NaCl C.Cu和Ag D.SiC和MgO
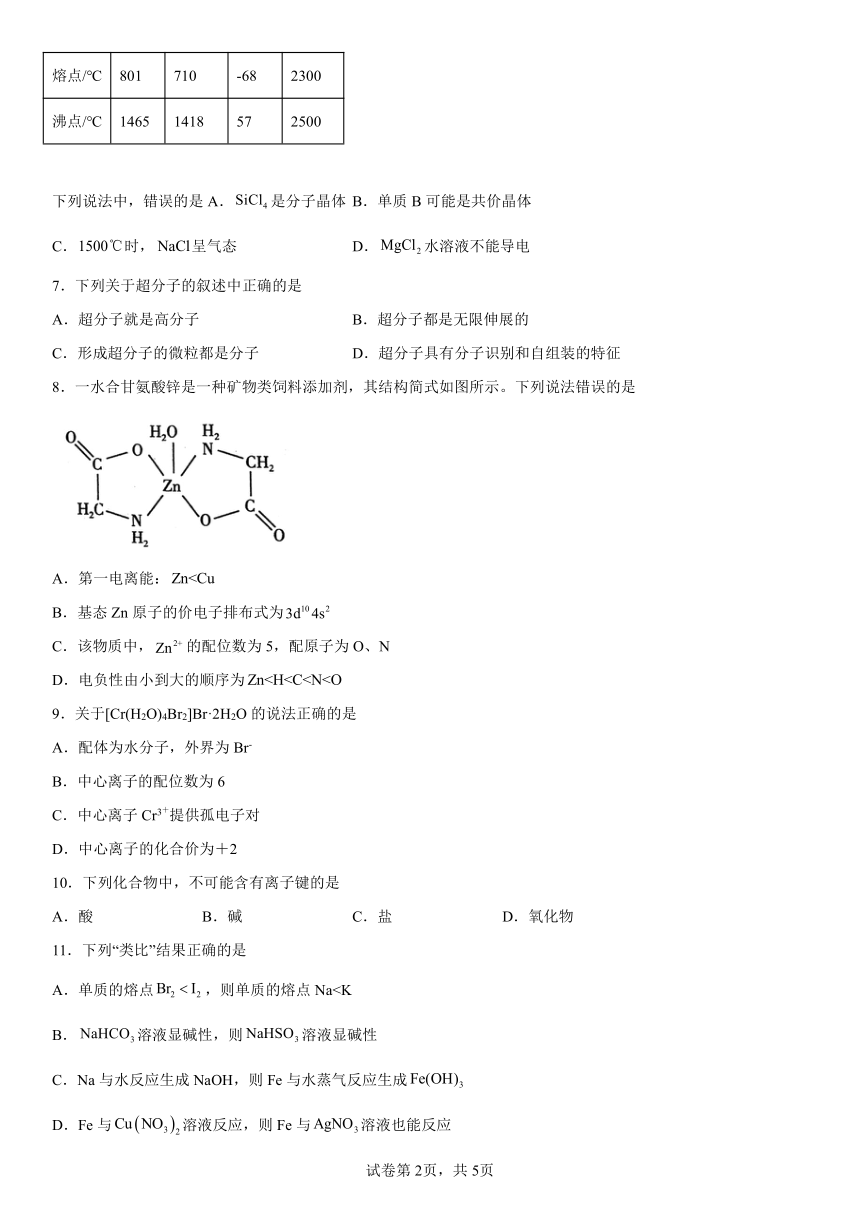
6.下表给出了几种物质的熔点和沸点:
单质B
熔点/℃ 801 710 -68 2300
沸点/℃ 1465 1418 57 2500
下列说法中,错误的是A.是分子晶体 B.单质B可能是共价晶体
C.时,呈气态 D.水溶液不能导电
7.下列关于超分子的叙述中正确的是
A.超分子就是高分子 B.超分子都是无限伸展的
C.形成超分子的微粒都是分子 D.超分子具有分子识别和自组装的特征
8.一水合甘氨酸锌是一种矿物类饲料添加剂,其结构简式如图所示。下列说法错误的是
A.第一电离能:
B.基态Zn原子的价电子排布式为
C.该物质中,的配位数为5,配原子为O、N
D.电负性由小到大的顺序为
9.关于[Cr(H2O)4Br2]Br·2H2O的说法正确的是
A.配体为水分子,外界为Br-
B.中心离子的配位数为6
C.中心离子Cr3+提供孤电子对
D.中心离子的化合价为+2
10.下列化合物中,不可能含有离子键的是
A.酸 B.碱 C.盐 D.氧化物
11.下列“类比”结果正确的是
A.单质的熔点,则单质的熔点NaB.溶液显碱性,则溶液显碱性
C.Na与水反应生成NaOH,则Fe与水蒸气反应生成
D.Fe与溶液反应,则Fe与溶液也能反应
12.等离子体的用途十分广泛运用等离子体束来切割金属或者进行外科手术,利用了等离子体的特点是
A.微粒带有电荷 B.高能量
C.基本构成微粒多样化 D.准电中性
13.有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期, Z、M同主族; X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料。下列说法中,正确的是
A.元素W和M的某些单质可作为水处理中的消毒剂
B.由于W、Z、M元素的氢化物相对分子质量依次减小,所以其沸点依次降低
C.元素Y、Z、W的单质晶体属于同种类型的晶体
D.X、M两种元素只能形成X2M型化合物
14.下列关于金刚石、石墨、SiO2、白磷说法正确的是
A.金刚石中碳原子与碳碳键的数目比为1:4
B.SiO2中硅原子与硅氧键的数目比为1:2
C.石墨中碳原子与碳碳键的数目比为2:3
D.金刚石、石墨、SiO2、白磷都为原子晶体
二、填空题
15.现有下列八种晶体:
A.水晶 B.冰醋酸 C.氧化镁 D.白磷 E.晶体氩 F.氯化铵 G.铝 H.金刚石
(1)属于共价晶体的是___________,直接由原子构成的晶体是___________,直接由原子构成的分子晶体是___________。
(2)由极性分子构成的晶体是___________,含有共价键的离子晶体是___________,属于分子晶体的单质是___________。
(3)在一定条件下能导电而不发生化学变化的是___________,受热熔化后化学键不发生变化的是___________,熔化时需克服共价键的是___________。
16.一种立方钙钛矿结构的金属卤化物光电材料的组成为、和有机碱离子,其晶胞如图(b)所示。其中与图(a)中_______的空间位置相同,有机碱中,N原子的杂化轨道类型是_______;若晶胞参数为anm,则晶体密度为_______(列出计算式,设为阿伏加德罗常数的值)。
17.因生产金属铁的工艺和温度等因素不同,产生的铁单质的晶体结构、密度和性质均不同,对铁晶体用X射线衍射进行测定,测得A、B两种晶胞,其晶胞结构示意图如下:
则A、B两种晶胞中含有的铁原子数分别是:___________、___________个。
18.三价铬离子能形成多种配位化合物。[Cr(NH3)3(H2O)2Cl]2+中提供电子对形成配位键的原子是_______,中心离子的配位数为_______。
19.在金属材料中添加AlCr2颗粒,可以增强材料的耐腐蚀性、硬度和机械性能。AlCr2具有体心四方结构,如图所示,处于顶角位置的是___________原子。设Cr和Al原子半径分别为和,则金属原子空间占有率为___________%(列出计算表达式)。
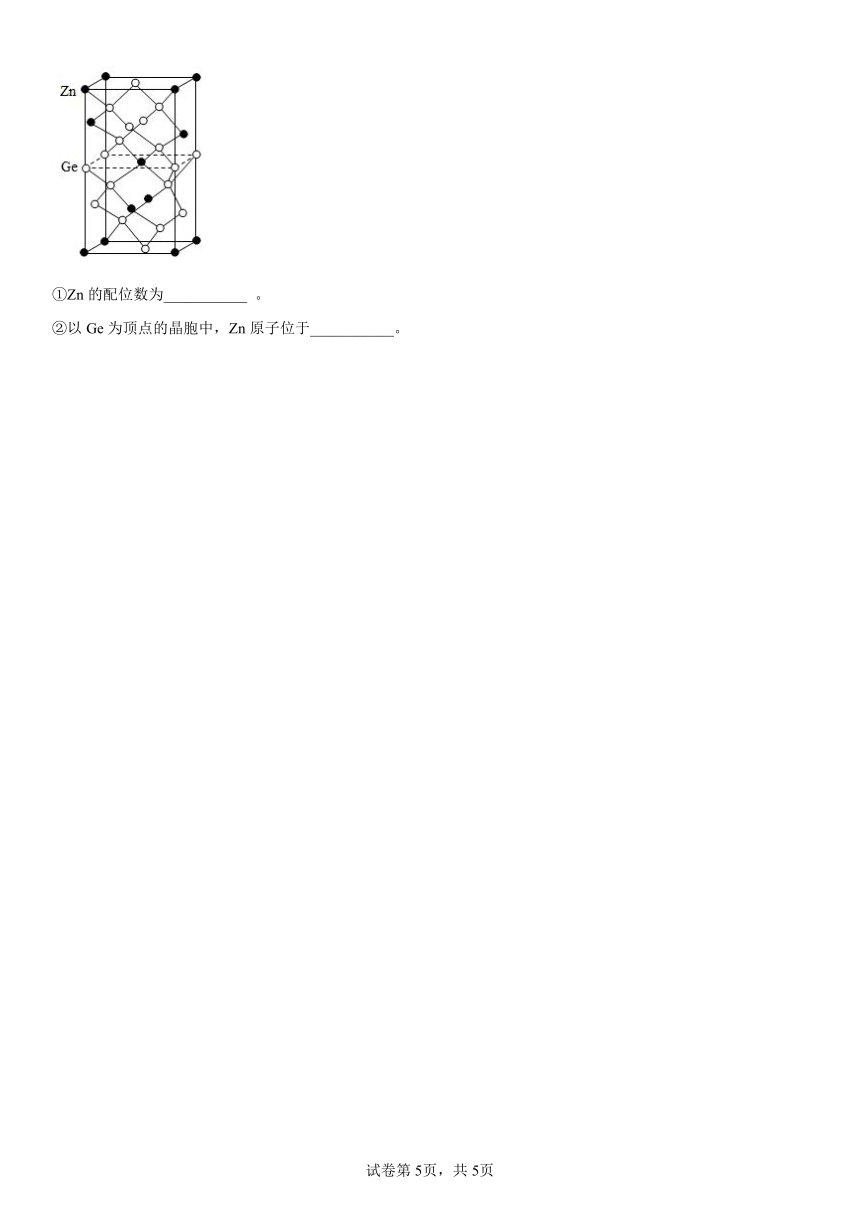
20.ZnGeP2和KTiOPO4都是非线性光学晶体材料,在激光技术方面有广泛用途。回答下列问题:
以Zn为顶点的ZnGeP2晶胞结构如图所示。
①Zn的配位数为___________ 。
②以Ge为顶点的晶胞中,Zn原子位于___________。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
【详解】A.晶体结构中的最小重复单元是晶胞,A正确;
B.由于晶胞要无隙并置排列,必然出现相邻晶胞共用粒子的情况,B错误;
C.大部分晶体是由平行六面体形晶胞无隙并置而成,但不是所有晶体,C错误;
D.不同晶体中的晶胞形状可能相同,但晶胞的大小不相同,如果形状和大小均相同,则是同一种晶胞,D错误;
答案选A。
2.D
【详解】A.原子晶体中原子之间通过共价键相连,而共价键具有方向性和饱和性,所以原子晶体中,原子不遵循紧密堆积原理,故A正确;
B.原子晶体是相邻原子之间通过共价键结合而形成的空间网状结构的晶体,不存在独立的分子,故B正确;
C.原子晶体是由原子以共价键相结合而形成的,键能较大,则原子晶体的熔点和硬度较高,故C正确;
D.原子晶体是原子间通过共价键结合而形成的,熔化时需要破坏共价键,故D错误;
故答案选:D。
3.B
【详解】A.由均摊法可知该结构单元中O原子数=1+12×=4,A错误;
B.由图可知,Ni和Mg间的最短距离为晶胞面对角线的一半,即=,B正确;
C.由晶胞可知Ni的配位数为6,C错误;
D.1个晶胞中Li的个数=1×0.5=0.5,Mg的个数=2×0.5+1×=1.125,Ni的个数=7×+3×0.5=2.375,O的个数=4,因此该物质的化学式为,D错误;
答案选B。
4.D
【详解】A.稀有气体分子内无化学键,A项错误;
B.分子晶体有低熔点的特性,B项错误;
C.分子晶体中不一定存在氢键,如晶体,C项错误;
D.分子晶体中分子间一定存在范德华力,可能存在氢键,所以分子晶体熔化时一定破坏了范德华力,D项正确。
故选:D。
5.C
【详解】A.SiO2为原子晶体,SO3为分子晶体,晶体类型不同,故A错误;
B.I2为分子晶体,NaCl为离子晶体,晶体类型不同,故B错误;
C.Cu和Ag都为金属晶体,晶体类型相同,故C正确;
D.SiC为原子晶体,MgO为离子晶体,晶体类型不同,故D错误;
故选C。
6.D
【详解】A.由题表中所给熔、沸点数据可知,的熔、沸点最低,应为分子晶体,A正确;
B.单质B的熔、沸点最高,可能为共价晶体,B正确;
C.的沸点是,则时,呈气态,C正确;
D.属于易溶的离子晶体,水溶液能导电,D错误;
故答案选D。
7.D
【详解】A.超分子通常是指由两种或两种以上分子依靠分子间相互作用结合在一起,组成复杂的、有组织的聚集体,有的是高分子,有的不是,故A错误;
B.超分子这种分子聚集体有的是无限伸展的,有的的是有限的,故B错误;
C.形成超分子的微粒也包括离子,故C错误;
D.超分子的特征是分子识别和自组装,故D正确。
答案选D。
8.A
【详解】A.锌与29号铜相邻,由于锌原子的所有排布电子的原子轨道均处于较稳定的全充满状态,故其第一电离能大于铜的,故A错误;
B.锌原子的核外电子数为30,其位于元素周期表第4周期第ⅡB族,基态Zn原子价电子排布式为,故B正确;
C.由一水合甘氨酸锌的分子结构可知,锌离子与相邻的5个原子(N和O)成键,故其配位数为5,配位原子为O、N,故C正确;
D.根据电负性的变化规律可知,非金属元素的电负性大于金属元素,非金属性越强其电负性越大,因此,由小到大的顺序为Zn<H<C<N<O,故D正确;
故选A。
9.B
【详解】A.[Cr(H2O)4Br2]Br 2H2O中配位体是H2O、Br,外界为Br-,选项A错误;
B.[Cr(H2O)4Br2]-中的中心离子的配体是H2O、Br,该配离子中含有4个H2O、2个Br,所以配位数是6,选项B正确;
C. [Cr(H2O)4Br2]Br·2H2O中内界为[Cr(H2O)4Br2]+,Cr3+为中心离子,配体为H2O、Br-,配位数为6,外界为Br-,Cr3+提供的空轨道,选项C错误;
D.[Cr(H2O)4Br2]Br 2H2O中阴离子是溴离子,溴离子的化合价是-1价,所以铬离子的化合价是+3价,选项D错误;
答案选B。
10.A
【分析】阴阳离子间通过静电作用形成的化学键是离子键,据此判断。
【详解】A.酸对应的物质一定是共价化合物,因此一定不存在离子键,A符合;
B.碱中可以含有离子键,例如NaOH等,B不符合;
C.盐中可以含有离子键,例如NaCl等,C不符合;
D.氧化物中可以含有离子键,例如Na2O等,D不符合;
答案选A。
11.D
【详解】A.Br2,I2是分子晶体,分子量越大熔沸点越高,但是Na,K是金属晶体,原子半径越大,熔沸点越低,A错误;
B.的电离大于水解,所以溶液显示酸性,B错误;
C.Fe与水蒸气反应生成Fe3O4,C错误;
D.铁比银活泼,可以置换出硝酸银中的银,D正确;
故选D。
12.B
【详解】切割金属或者进行外科手术,是利用了等离子体高能量的特点,
故选:B。
13.A
【详解】有X、Y、Z、W、M五种短周期元素,Y的单质晶体熔点高、硬度大,是一种重要的半导体材料,Y为Si元素;X、Y、Z、W同周期, Z、M同主族; X+与M2-具有相同的电子层结构,离子半径:Z2->W-,则X是Na,Z是S,W是Cl,M是O;
A.O3、Cl2都可作为水处理中的消毒剂,故A正确;
B.W、Z、M的氢化物依次为HCl、H2S、HCl,由于水分子间存在氢键,故三者中水的沸点最高,B错误;
C.Y、Z、W的单质依次为硅、硫、Cl2,硅单质是原子晶体,硫单质、氯气是分子晶体,故C错误;
D.X、M能形成Na2O、Na2O2两种常见化合物,故D错误;
答案选A。
14.C
【详解】A.在金刚石晶体中每个碳原子形成4个碳碳键,每个碳碳键被2个碳原子所共有,则晶体中碳原子与碳碳键的数目比为1:2,故A错误;
B.二氧化硅晶体中每个硅原子能与4个氧原子形成硅氧键,晶体中硅原子与硅氧键的数目比为1:4,故B错误;
C.石墨晶体中每个碳原子形成3个碳碳键,每个碳碳键被2个碳原子所共有,碳原子与碳碳键的数目比为1:(3×)=2:3,故C正确;
D.石墨属于过渡性晶体、白磷属于分子晶体,都不属于原子晶体,故D错误;
故选C。
15. AH AEH E B F DE G BDE AH
【详解】(1)水晶为SiO2晶体,由Si原子和O原子构成,属于共价晶体,金刚石由C原子构成,属于共价晶体,故此处填A、H;直接由原子构成的晶体包括原子晶体A、H,以及由单原子分子构成的分子晶体E,故此处填A、E、H;稀有气体是单原子分子,其晶体是直接由原子构成的分子晶体,故此处填E;
(2)醋酸分子正负电荷中心不重合,属于极性分子,故此处填B;NH4Cl由离子构成,其晶体属于离子晶体,且铵根离子内部存在共价键,故此处填F;白磷、氩都是由分子构成的单质,故此处填D、E;
(3)金属晶体能导电且不发生化学变化,故此处填G;分子晶体受热熔化后分子不变,化学键不发生变化,故此处填BDE;共价晶体熔化时需克服共价键,故此处填AH。
16. Ti4+ sp3
【详解】距离最近的是处于面心的,的配位数为6,图(a)中的配位数也为6,其与图(b)中的空间位置相同;中,氮原子形成4个单键,其中有1个是配位键,N原子采取杂化;根据均摊法,1个晶胞中含有的个数为,的个数为,的个数为1,化学式为,摩尔质量为,一个晶胞的质量为,体积为,则晶体密度为。
17. 2 4
【详解】A晶胞中铁原子在8个顶点和1个中心,则含有铁原子是8×+1=2个;B晶胞中铁原子在8个顶点和6个面心,含有铁原子为8×+6×=4个。
18. N、O、Cl 6
【详解】根据该配离子的结构可知,NH3、H2O、Cl-均为配体,其中N、O、Cl均含有孤电子对,提高孤电子对;3个NH3、2个H2O和1个Cl-配位,所以配位数为3+2+1=6。
19. Al
【详解】已知AlCr2具有体心四方结构,如图所示,黑球个数为,白球个数为,结合化学式AlCr2可知,白球为Cr,黑球为Al,即处于顶角位置的是Al原子。设Cr和Al原子半径分别为rCr和rAl,则金属原子的体积为,故金属原子空间占有率=%。
20. 4 棱心、面心
【详解】①以体心的Zn为例,距离其最近且距离相等的原子有4个,所以配位数为4;
②结合晶胞结构示意图可知,若以以Ge为顶点的晶胞中,Zn原子位于棱心、面心。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.下列有关晶胞的叙述中,正确的是。
A.晶胞是晶体结构中最小的重复单元
B.晶胞中的任何一个粒子都属于该晶胞
C.所有晶体都是由平行六面体无隙组合而成
D.不同晶体中的晶胞的大小和形状均相同
2.有关原子晶体的叙述,错误的是
A.原子晶体中,原子不遵循紧密堆积原则 B.原子晶体中不存在独立的分子
C.原子晶体的熔点和硬度较高 D.原子晶体熔化时不破坏化学键
3.已知晶体属立方晶系,晶胞边长a。将掺杂到该晶胞中,可得到一种高性能的p型太阳能电池材料,其结构单元如图所示。
假定掺杂后的晶胞参数不发生变化,下列说法正确的是
A.该结构单元中O原子数为3 B.Ni和Mg间的最短距离是
C.Ni的配位数为4 D.该物质的化学式为
4.下列有关分子晶体的叙述正确的是
A.分子内均存在共价键
B.分子晶体的熔点较高
C.分子晶体中一定存在氢键
D.分子晶体熔化时一定破坏了范德华力
5.下列各组物质的晶体类型相同的是
A.SiO2和SO3 B.I2和NaCl C.Cu和Ag D.SiC和MgO
6.下表给出了几种物质的熔点和沸点:
单质B
熔点/℃ 801 710 -68 2300
沸点/℃ 1465 1418 57 2500
下列说法中,错误的是A.是分子晶体 B.单质B可能是共价晶体
C.时,呈气态 D.水溶液不能导电
7.下列关于超分子的叙述中正确的是
A.超分子就是高分子 B.超分子都是无限伸展的
C.形成超分子的微粒都是分子 D.超分子具有分子识别和自组装的特征
8.一水合甘氨酸锌是一种矿物类饲料添加剂,其结构简式如图所示。下列说法错误的是
A.第一电离能:
B.基态Zn原子的价电子排布式为
C.该物质中,的配位数为5,配原子为O、N
D.电负性由小到大的顺序为
9.关于[Cr(H2O)4Br2]Br·2H2O的说法正确的是
A.配体为水分子,外界为Br-
B.中心离子的配位数为6
C.中心离子Cr3+提供孤电子对
D.中心离子的化合价为+2
10.下列化合物中,不可能含有离子键的是
A.酸 B.碱 C.盐 D.氧化物
11.下列“类比”结果正确的是
A.单质的熔点,则单质的熔点Na
C.Na与水反应生成NaOH,则Fe与水蒸气反应生成
D.Fe与溶液反应,则Fe与溶液也能反应
12.等离子体的用途十分广泛运用等离子体束来切割金属或者进行外科手术,利用了等离子体的特点是
A.微粒带有电荷 B.高能量
C.基本构成微粒多样化 D.准电中性
13.有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期, Z、M同主族; X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料。下列说法中,正确的是
A.元素W和M的某些单质可作为水处理中的消毒剂
B.由于W、Z、M元素的氢化物相对分子质量依次减小,所以其沸点依次降低
C.元素Y、Z、W的单质晶体属于同种类型的晶体
D.X、M两种元素只能形成X2M型化合物
14.下列关于金刚石、石墨、SiO2、白磷说法正确的是
A.金刚石中碳原子与碳碳键的数目比为1:4
B.SiO2中硅原子与硅氧键的数目比为1:2
C.石墨中碳原子与碳碳键的数目比为2:3
D.金刚石、石墨、SiO2、白磷都为原子晶体
二、填空题
15.现有下列八种晶体:
A.水晶 B.冰醋酸 C.氧化镁 D.白磷 E.晶体氩 F.氯化铵 G.铝 H.金刚石
(1)属于共价晶体的是___________,直接由原子构成的晶体是___________,直接由原子构成的分子晶体是___________。
(2)由极性分子构成的晶体是___________,含有共价键的离子晶体是___________,属于分子晶体的单质是___________。
(3)在一定条件下能导电而不发生化学变化的是___________,受热熔化后化学键不发生变化的是___________,熔化时需克服共价键的是___________。
16.一种立方钙钛矿结构的金属卤化物光电材料的组成为、和有机碱离子,其晶胞如图(b)所示。其中与图(a)中_______的空间位置相同,有机碱中,N原子的杂化轨道类型是_______;若晶胞参数为anm,则晶体密度为_______(列出计算式,设为阿伏加德罗常数的值)。
17.因生产金属铁的工艺和温度等因素不同,产生的铁单质的晶体结构、密度和性质均不同,对铁晶体用X射线衍射进行测定,测得A、B两种晶胞,其晶胞结构示意图如下:
则A、B两种晶胞中含有的铁原子数分别是:___________、___________个。
18.三价铬离子能形成多种配位化合物。[Cr(NH3)3(H2O)2Cl]2+中提供电子对形成配位键的原子是_______,中心离子的配位数为_______。
19.在金属材料中添加AlCr2颗粒,可以增强材料的耐腐蚀性、硬度和机械性能。AlCr2具有体心四方结构,如图所示,处于顶角位置的是___________原子。设Cr和Al原子半径分别为和,则金属原子空间占有率为___________%(列出计算表达式)。
20.ZnGeP2和KTiOPO4都是非线性光学晶体材料,在激光技术方面有广泛用途。回答下列问题:
以Zn为顶点的ZnGeP2晶胞结构如图所示。
①Zn的配位数为___________ 。
②以Ge为顶点的晶胞中,Zn原子位于___________。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
【详解】A.晶体结构中的最小重复单元是晶胞,A正确;
B.由于晶胞要无隙并置排列,必然出现相邻晶胞共用粒子的情况,B错误;
C.大部分晶体是由平行六面体形晶胞无隙并置而成,但不是所有晶体,C错误;
D.不同晶体中的晶胞形状可能相同,但晶胞的大小不相同,如果形状和大小均相同,则是同一种晶胞,D错误;
答案选A。
2.D
【详解】A.原子晶体中原子之间通过共价键相连,而共价键具有方向性和饱和性,所以原子晶体中,原子不遵循紧密堆积原理,故A正确;
B.原子晶体是相邻原子之间通过共价键结合而形成的空间网状结构的晶体,不存在独立的分子,故B正确;
C.原子晶体是由原子以共价键相结合而形成的,键能较大,则原子晶体的熔点和硬度较高,故C正确;
D.原子晶体是原子间通过共价键结合而形成的,熔化时需要破坏共价键,故D错误;
故答案选:D。
3.B
【详解】A.由均摊法可知该结构单元中O原子数=1+12×=4,A错误;
B.由图可知,Ni和Mg间的最短距离为晶胞面对角线的一半,即=,B正确;
C.由晶胞可知Ni的配位数为6,C错误;
D.1个晶胞中Li的个数=1×0.5=0.5,Mg的个数=2×0.5+1×=1.125,Ni的个数=7×+3×0.5=2.375,O的个数=4,因此该物质的化学式为,D错误;
答案选B。
4.D
【详解】A.稀有气体分子内无化学键,A项错误;
B.分子晶体有低熔点的特性,B项错误;
C.分子晶体中不一定存在氢键,如晶体,C项错误;
D.分子晶体中分子间一定存在范德华力,可能存在氢键,所以分子晶体熔化时一定破坏了范德华力,D项正确。
故选:D。
5.C
【详解】A.SiO2为原子晶体,SO3为分子晶体,晶体类型不同,故A错误;
B.I2为分子晶体,NaCl为离子晶体,晶体类型不同,故B错误;
C.Cu和Ag都为金属晶体,晶体类型相同,故C正确;
D.SiC为原子晶体,MgO为离子晶体,晶体类型不同,故D错误;
故选C。
6.D
【详解】A.由题表中所给熔、沸点数据可知,的熔、沸点最低,应为分子晶体,A正确;
B.单质B的熔、沸点最高,可能为共价晶体,B正确;
C.的沸点是,则时,呈气态,C正确;
D.属于易溶的离子晶体,水溶液能导电,D错误;
故答案选D。
7.D
【详解】A.超分子通常是指由两种或两种以上分子依靠分子间相互作用结合在一起,组成复杂的、有组织的聚集体,有的是高分子,有的不是,故A错误;
B.超分子这种分子聚集体有的是无限伸展的,有的的是有限的,故B错误;
C.形成超分子的微粒也包括离子,故C错误;
D.超分子的特征是分子识别和自组装,故D正确。
答案选D。
8.A
【详解】A.锌与29号铜相邻,由于锌原子的所有排布电子的原子轨道均处于较稳定的全充满状态,故其第一电离能大于铜的,故A错误;
B.锌原子的核外电子数为30,其位于元素周期表第4周期第ⅡB族,基态Zn原子价电子排布式为,故B正确;
C.由一水合甘氨酸锌的分子结构可知,锌离子与相邻的5个原子(N和O)成键,故其配位数为5,配位原子为O、N,故C正确;
D.根据电负性的变化规律可知,非金属元素的电负性大于金属元素,非金属性越强其电负性越大,因此,由小到大的顺序为Zn<H<C<N<O,故D正确;
故选A。
9.B
【详解】A.[Cr(H2O)4Br2]Br 2H2O中配位体是H2O、Br,外界为Br-,选项A错误;
B.[Cr(H2O)4Br2]-中的中心离子的配体是H2O、Br,该配离子中含有4个H2O、2个Br,所以配位数是6,选项B正确;
C. [Cr(H2O)4Br2]Br·2H2O中内界为[Cr(H2O)4Br2]+,Cr3+为中心离子,配体为H2O、Br-,配位数为6,外界为Br-,Cr3+提供的空轨道,选项C错误;
D.[Cr(H2O)4Br2]Br 2H2O中阴离子是溴离子,溴离子的化合价是-1价,所以铬离子的化合价是+3价,选项D错误;
答案选B。
10.A
【分析】阴阳离子间通过静电作用形成的化学键是离子键,据此判断。
【详解】A.酸对应的物质一定是共价化合物,因此一定不存在离子键,A符合;
B.碱中可以含有离子键,例如NaOH等,B不符合;
C.盐中可以含有离子键,例如NaCl等,C不符合;
D.氧化物中可以含有离子键,例如Na2O等,D不符合;
答案选A。
11.D
【详解】A.Br2,I2是分子晶体,分子量越大熔沸点越高,但是Na,K是金属晶体,原子半径越大,熔沸点越低,A错误;
B.的电离大于水解,所以溶液显示酸性,B错误;
C.Fe与水蒸气反应生成Fe3O4,C错误;
D.铁比银活泼,可以置换出硝酸银中的银,D正确;
故选D。
12.B
【详解】切割金属或者进行外科手术,是利用了等离子体高能量的特点,
故选:B。
13.A
【详解】有X、Y、Z、W、M五种短周期元素,Y的单质晶体熔点高、硬度大,是一种重要的半导体材料,Y为Si元素;X、Y、Z、W同周期, Z、M同主族; X+与M2-具有相同的电子层结构,离子半径:Z2->W-,则X是Na,Z是S,W是Cl,M是O;
A.O3、Cl2都可作为水处理中的消毒剂,故A正确;
B.W、Z、M的氢化物依次为HCl、H2S、HCl,由于水分子间存在氢键,故三者中水的沸点最高,B错误;
C.Y、Z、W的单质依次为硅、硫、Cl2,硅单质是原子晶体,硫单质、氯气是分子晶体,故C错误;
D.X、M能形成Na2O、Na2O2两种常见化合物,故D错误;
答案选A。
14.C
【详解】A.在金刚石晶体中每个碳原子形成4个碳碳键,每个碳碳键被2个碳原子所共有,则晶体中碳原子与碳碳键的数目比为1:2,故A错误;
B.二氧化硅晶体中每个硅原子能与4个氧原子形成硅氧键,晶体中硅原子与硅氧键的数目比为1:4,故B错误;
C.石墨晶体中每个碳原子形成3个碳碳键,每个碳碳键被2个碳原子所共有,碳原子与碳碳键的数目比为1:(3×)=2:3,故C正确;
D.石墨属于过渡性晶体、白磷属于分子晶体,都不属于原子晶体,故D错误;
故选C。
15. AH AEH E B F DE G BDE AH
【详解】(1)水晶为SiO2晶体,由Si原子和O原子构成,属于共价晶体,金刚石由C原子构成,属于共价晶体,故此处填A、H;直接由原子构成的晶体包括原子晶体A、H,以及由单原子分子构成的分子晶体E,故此处填A、E、H;稀有气体是单原子分子,其晶体是直接由原子构成的分子晶体,故此处填E;
(2)醋酸分子正负电荷中心不重合,属于极性分子,故此处填B;NH4Cl由离子构成,其晶体属于离子晶体,且铵根离子内部存在共价键,故此处填F;白磷、氩都是由分子构成的单质,故此处填D、E;
(3)金属晶体能导电且不发生化学变化,故此处填G;分子晶体受热熔化后分子不变,化学键不发生变化,故此处填BDE;共价晶体熔化时需克服共价键,故此处填AH。
16. Ti4+ sp3
【详解】距离最近的是处于面心的,的配位数为6,图(a)中的配位数也为6,其与图(b)中的空间位置相同;中,氮原子形成4个单键,其中有1个是配位键,N原子采取杂化;根据均摊法,1个晶胞中含有的个数为,的个数为,的个数为1,化学式为,摩尔质量为,一个晶胞的质量为,体积为,则晶体密度为。
17. 2 4
【详解】A晶胞中铁原子在8个顶点和1个中心,则含有铁原子是8×+1=2个;B晶胞中铁原子在8个顶点和6个面心,含有铁原子为8×+6×=4个。
18. N、O、Cl 6
【详解】根据该配离子的结构可知,NH3、H2O、Cl-均为配体,其中N、O、Cl均含有孤电子对,提高孤电子对;3个NH3、2个H2O和1个Cl-配位,所以配位数为3+2+1=6。
19. Al
【详解】已知AlCr2具有体心四方结构,如图所示,黑球个数为,白球个数为,结合化学式AlCr2可知,白球为Cr,黑球为Al,即处于顶角位置的是Al原子。设Cr和Al原子半径分别为rCr和rAl,则金属原子的体积为,故金属原子空间占有率=%。
20. 4 棱心、面心
【详解】①以体心的Zn为例,距离其最近且距离相等的原子有4个,所以配位数为4;
②结合晶胞结构示意图可知,若以以Ge为顶点的晶胞中,Zn原子位于棱心、面心。
答案第1页,共2页
答案第1页,共2页
