第二章《分子结构与性质》检测题2022---2023学年下学期高二化学人教版(2019)选择性必修2(Word含答案)
文档属性
| 名称 | 第二章《分子结构与性质》检测题2022---2023学年下学期高二化学人教版(2019)选择性必修2(Word含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 394.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-22 19:08:18 | ||
图片预览




文档简介
第二章《 分子结构与性质》检测题
一、单选题
1.在氯化氢分子中,形成共价键的原子轨道是
A.氯原子的2p轨道和氢原子的1s轨道
B.氯原子的2p轨道和氢原子的2p轨道
C.氯原子的3p轨道和氢原子的1s轨道
D.氯原子的3p轨道和氢原子的2s轨道
2.下列关于NH、NH3、NH三种微粒的说法不正确的是
A.三种微粒所含有的电子数相等 B.三种微粒中氮原子的杂化方式相同
C.三种微粒的空间构型相同 D.键角大小关系:NH>NH3>NH
3.氯化亚硫(SOCl2)是一种很重要的化学试剂,可以作为氯化剂和脱水剂。下列关于氯化亚硫分子的VSEPR模型、空间结构和中心原子(S)采取何种杂化方式的说法正确的是
A.四面体形、三角锥形、sp3 B.平面三角形、平面三角形、sp2
C.四面体形、平面三角形、sp3 D.四面体形、三角锥形、sp2
4.已知N—N、N=N和N≡N键能之比为1.00∶2.17∶4.90,而C—C、C=C和C≡C键能之比为1.00∶1.77∶2.34,下列说法正确的是
A.σ键一定比π键稳定
B.N2较易发生加成反应
C.乙烯、乙炔较易发生加成反应
D.乙烯、乙炔中的π键比σ键稳定
5.下列有机化合物中σ键与π键个数比为3∶2的是
A.CH3CH3 B.CH2=CH2
C.CH≡CH D.CH4
6.人们常用表示卤化氢(X代表F、、、I),下列说法中,正确的是
A.形成共价键的两个原子之间的核间距叫做键长
B.的键长是中最长的
C.是键
D.的键能是中最小的
7.下列说法正确的是
A.σ键强度小,容易断裂,而π键强度较大,不易断裂
B.共价键都具有方向性
C.π键是由两个原子的p轨道“头碰头”重叠形成的
D.两个原子之间形成共价键时,最多有一个σ键
8.有A、B、C、D、E五种元素,质子数都小于18。B原子的最外层电子数是其电子层数的3倍;C原子失去1个电子所得到的微粒具有与氖原子相同的电子层结构;D是地壳中含量最多的金属元素;E的最高正价与最低负价的代数和为6;A单质可以在E单质中燃烧,生成AE,燃烧时火焰呈苍白色。下列说法错误的是
A.A2B中只含极性共价键
B.B和C两种元素形成的化合物--定含有离子键也可能含有共价键
C.E单质可以使干燥的红色布条褪色
D.D单质常温下既能溶于稀盐酸也能溶于氢氧化钠溶液
9.氯的含氧酸根离子有、、、等,关于它们的说法不正确的是
A.的中心Cl原子采取杂化
B.的空间结构为三角锥形
C.的空间结构为直线形
D.中Cl原子的杂化类型与相同
10.下列分子中存在的共价键类型完全相同(从σ键、π键的形成方式角度分析)的是
A.CH4与C2H2 B.H2O与HCl
C.H2与Cl2 D.Cl2与N2
11.NH3分子的空间结构是三角锥形结构而不是平面正三角形结构,最充分的理由是
A.NH3分子内3个N—H键长均相等
B.NH3分子内3个价键的键角和键长均相等
C.NH3分子内3个N—H的键长相等,键角都等于107°
D.NH3分子内3个N—H的键长相等,键角都等于120°
12.下列各组物质中,都是由极性键构成的极性分子的是
A.CH4和CCl4 B.H2S和HCl C.CO2和CS2 D.NH3和CH4
13.短周期元素X、Y、Z原子序数依次增大,X元素基态原子有2个未成对电子,Y元素基态原子的核外p电子数比s电子数少1个,Z的一种“超原子”()具有40个价电子,下列说法错误的是
A.简单离子半径: B.的空间构型为平面三角形
C.中心原子的杂化方式为杂化 D.X、Y、Z的电负性:
14.下列描述中正确的是
A.CS2分子的立体构型为V形
B.ClO的立体构型为平面三角形
C.NH3、CO、CO2的中心原子都有孤电子对
D.SiF4和SO的中心原子均采取sp3杂化
15.下列有机物分子中的碳原子既有sp3杂化又有sp杂化的是
A.CH3CH=CH2 B.CH3-C≡CH C.CH3CH2OH D.CH≡CH
二、填空题
16.中心原子若通过杂化轨道成键,则该分子一定为正四面体形结构。(______)
17.为三角锥形,N发生杂化。(______)
18.按要求填空:
(1)柠檬酸的结构简式见图。1mol柠檬酸分子中碳原子与氧原子形成的键的数目为_________mol。
(2)CO2分子中存在_________个键和_________个键。
(3)N2分子中键与键的数目比 _________。
19.请解释下列现象:
(1)同样是三原子分子,水分子有极性而二氧化碳分子没有极性___________。
(2)同样是直线形非极性分子,常温下二氧化碳是气体而二硫化碳是液体___________。
(3)乙醇与水互溶,而1-戊醇在水中的溶解度却很小___________。
(4)同样是三角锥形的氢化物,氨气在水中极易溶解,并且很容易液化(常用作冷库中的制冷剂),而同主族的磷化氢()却没有这些性质___________。
20.元素As与N同族。预测As的氢化物分子的立体结构为___________,其沸点比NH3的___________(填“高”或“低”),其判断理由是___________。
21.CO2分子中存在_______个键和_______个键。
22.回答下列问题
(1)利用模型推测分子或离子的空间结构。
:___________;(共价分子):___________。
(2)按要求写出由第二周期非金属元素的原子构成的中性分子的化学式。
平面三角形分子:___________,三角锥形分子:___________,正四面体形分子:___________。
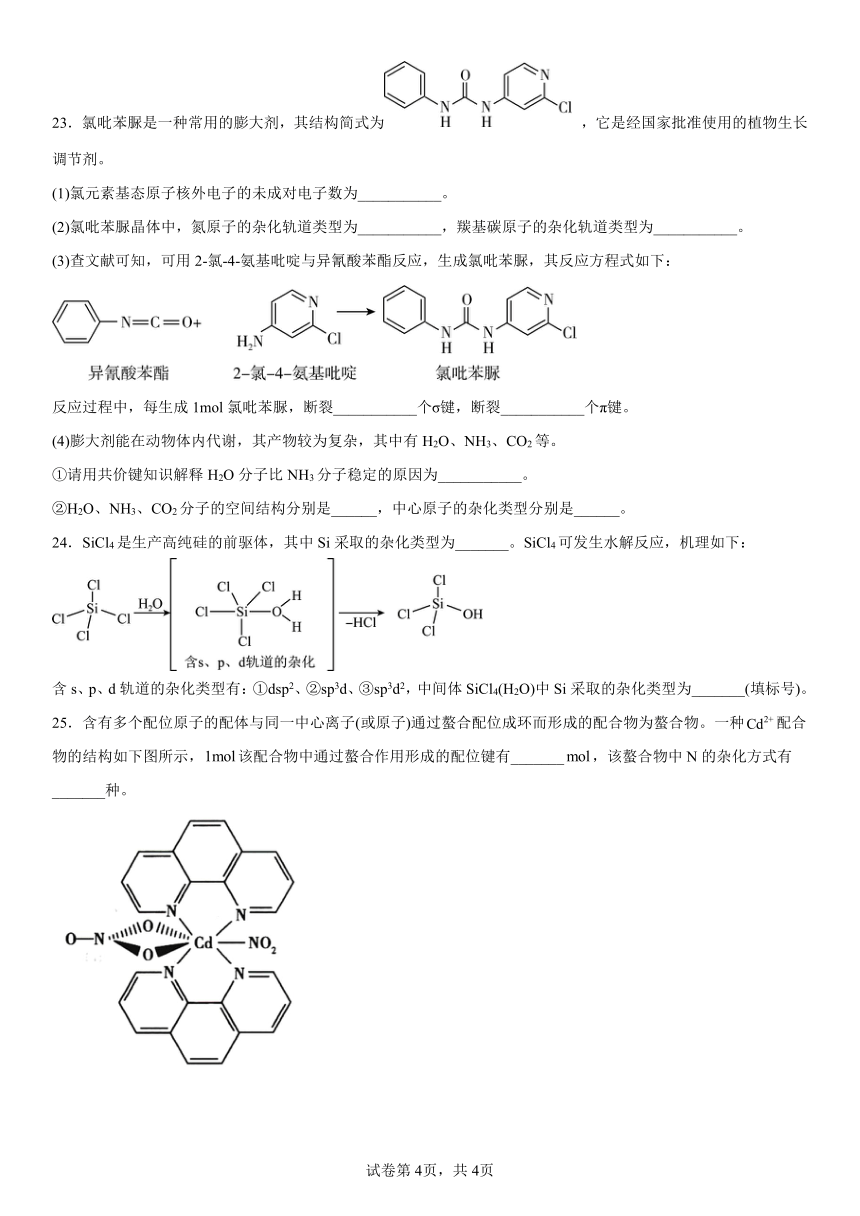
23.氯吡苯脲是一种常用的膨大剂,其结构简式为 ,它是经国家批准使用的植物生长调节剂。
(1)氯元素基态原子核外电子的未成对电子数为___________。
(2)氯吡苯脲晶体中,氮原子的杂化轨道类型为___________,羰基碳原子的杂化轨道类型为___________。
(3)查文献可知,可用2-氯-4-氨基吡啶与异氰酸苯酯反应,生成氯吡苯脲,其反应方程式如下:
反应过程中,每生成1mol氯吡苯脲,断裂___________个σ键,断裂___________个π键。
(4)膨大剂能在动物体内代谢,其产物较为复杂,其中有H2O、NH3、CO2等。
①请用共价键知识解释H2O分子比NH3分子稳定的原因为___________。
②H2O、NH3、CO2分子的空间结构分别是______,中心原子的杂化类型分别是______。
24.SiCl4是生产高纯硅的前驱体,其中Si采取的杂化类型为_______。SiCl4可发生水解反应,机理如下:
含s、p、d轨道的杂化类型有:①dsp2、②sp3d、③sp3d2,中间体SiCl4(H2O)中Si采取的杂化类型为_______(填标号)。
25.含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种配合物的结构如下图所示,该配合物中通过螯合作用形成的配位键有_______,该螯合物中N的杂化方式有_______种。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
【解析】氢原子和氯原子的核外电子排布式分别为1s1和1s22s22p63s23p5,由此可以看出,氢原子的1s轨道和氯原子的3p轨道上各有一个未成对电子,故两者在形成氯化氢分子时,形成共价键的原子轨道是氯原子的3p轨道和氢原子的1s轨道。
2.C
【解析】A.NH、NH3、NH三种微粒,每个NH、NH3、NH所含有的电子数都为10个电子,故A正确;
B.铵根离子中氮原子价层电子对个数=σ键个数+孤电子对个数=4+(5 1 4×1)=4,所以其采用sp3杂化,氨气分子中价层电子对个数=σ键个数+孤电子对个数=3+(5-3×1)=4,所以氮原子杂化方式是sp3,NH中氮原子价层电子对个数=σ键个数+孤电子对个数=2+(5 1×2+1) =4,所以其采用sp3杂化,故B正确;
C.根据三种微粒的杂化方式可知,铵根离子为正四面体结构;氨气分子空间构型为三角锥形,NH空间构型为V形,故C错误;
D.铵根离子中,含0对孤电子,氨气分子中含1对孤电子,NH含2对孤电子,含有孤电子对越多,分子中的键角越小,所以键角大小关系:NH>NH3>NH,故D正确;
故选C。
3.A
【解析】SOCl2的中心原子(S原子)的价层电子对数=3+=4,孤对电子数为1,所以中心原子(S)采取sp3杂化,分子的VSEPR模型为四面体形,空间结构为三角锥形,故A正确;
答案选A。
4.C
【解析】A.根据N—N、N=N和N≡N键能之比为1.00∶2.17∶4.90,N≡N、N=N中π键比σ键稳定,故A错误;
B.N≡N、N=N中π键比σ键稳定,难发生加成,故B错误;
C.根据C—C、C=C和C≡C键能之比为1.00∶1.77∶2.34,C=C,C≡C中π键比σ键弱,π键不稳定,较易发生加成,故C正确;
D.根据C—C、C=C和C≡C键能之比为1.00∶1.77∶2.34,C=C,C≡C中π键比σ键弱,π键没有σ键稳定,故D错误;
故选C。
5.C
【解析】A.CH3CH3中有7个σ键,没有π键,故A不符合题意;
B.CH2=CH2中有5个σ键,1个π键,故B不符合题意;
C.CH≡CH中有3个σ键,2个π键,故C符合题意;
D.CH4中有4个σ键,没有π键,故D不符合题意。
综上所述,答案为C。
6.A
【解析】A.形成共价键的两个原子之间的核间距叫做键长,A正确;
B.F、、、I中F原子半径最小,的键长是中最短的,B错误;
C.是H的1s轨道与F的2p轨道“头碰头”成键,是键,C错误;
D.键长越短键能越大,的键长是中最短的,键能是中最大的,D错误;
故选A。
7.D
【解析】A.一般σ键比π键更稳定,不易断裂,A项错误;
B.s-sσ键无方向性,B项错误;
C.原子轨道以“头碰头”方式相互重叠形成的共价键为σ键,π键是由两个原子的p轨道“肩并肩”重叠形成的,C项错误;
D.两个原子之间形成共价键时,单键为σ键,双键和三键中都只有一个σ键,所以两个原子之间形成共价键时,最多有一个σ键,D项正确。
答案选D。
8.C
【解析】B原子的最外层电子数是其电子层数的3倍,则B为氧元素;C原子失去1个电子所得到的微粒具有与氖原子相同的电子层结构,则C原子核外有11个电子,即核电荷数为11,C为钠元素;地壳中含量最多的金属元素是铝,D为铝元素;氯的最高正价+7价与最低负价-1价,代数和为6,E为氯元素;氢气可以在氯气中燃烧,火焰呈苍白色,所以A为氢元素。即A、B、C、D、E分别为H、O、Na、A1、C1。
【解析】A.A2B为H2O,水分子结构式为H-O-H,所以水分子中只含极性共价键,A项正确;
B.B和C两种元素形成的化合物Na2O,是离子化合物,只含有离子键,B和C两种元素形成的化合物Na2O2是离子化合物,既含有离子键又含有共价键,B项正确;
C.氯气和水反应生成的次氯酸有漂白性,氯气使湿润红色布条褪色,干燥的氯气不能使干燥的红色布条褪色,C项错误;
D.铝单质常温下与稀盐酸生成氯化铝和氢气,铝单质常温下和氢氧化钠溶液反应生成偏铝酸钠和氢气,D项正确;
答案选C。
9.C
【解析】A.的中心原子的孤电子对数为0,与中心原子结合的O原子数为4,则原子采取杂化,A正确;
B.的中心原子的价层电子对数为,且含有1个孤电子对,空间结构为三角锥形,B正确;
C.的中心原子的价层电子对数为,且含有2个孤电子对,空间结构为V形,C错误;
D.中原子的孤电子对数为3,与原子结合的O原子数为1,原子采取杂化,中原子的孤电子对数为2,与原子结合的O原子数为2,原子采取杂化,D正确;
故选C。
10.B
【解析】根据单键为σ键,双键和三键中既有σ键又有π键,结合分子结构判断。
【解析】A.CH4分子中存在s-pσ键,C2H2分子中存在σ键和π键,所以共价键类型不完全相同,故A错误;
B.H2O与HCl都含有H原子,分子中的共价键均是s电子云与p电子云形成的s-pσ键,故B正确;
C.H2分子中存在s—sσ键,Cl2分子中存在p—pσ键,所以共价键类型不完全相同,故C错误;
D.Cl2分子中只有单键,全部为σ键,N2分子中有三键既有σ键又有π键,所以共价键类型不完全相同,故D错误。
故选B。
11.C
【解析】NH3分子内的键角和键长都相等,可能有两种情况,一是平面正三角形,二是三角锥形结构。如果键角为120°,则必然为平面正三角形,故选:C。
12.B
【解析】A.CH4和CCl4中的C-H键和C-Cl键均为极性键,CH4和CCl4分子均为正四面体构型,高度对称,分子中正负电荷的中心重合,均为非极性分子,故A不符合题意;
B.H2S含有H-S极性键,正负电荷的中心不重合,是极性分子;HCl含有H-Cl极性键,正负电荷的中心不重合,是极性分子,故B符合题意;
C.CO2含有C=O极性键,正负电荷的中心重合,是非极性分子,CS2含有C=S极性键,正负电荷的中心重合,是非极性分子,故C不符合题意;
D.NH3含有N-H极性键,分子构型为三角锥型,正负电荷中心不重合,为极性分子;CH4含有C-H极性键,为正四面体构型,高度对称,分子中正负电荷的中心重合,为非极性分子,故D不符合题意;
答案选B。
13.A
【解析】短周期元素X、Y、Z原子序数依次增大,Z的一种超原子具有40个价电子,则Z的价电子数为 个,Z为Al元素,Y元素基态原子的核外p电子数比s电子数少1个,Y为N元素,X元素基态原子有2个未成对电子,X为C元素。
【解析】A.N3-和Al3+的核外电子层数相同,而N的核电荷数小于Al,则离子半径:N3-> Al3+,A错误;
B.的中心原子的价电子对数为 ,不含孤电子对,采用sp2杂化,空间构型为平面三角形,B正确;
C. 的中心原子的价电子对数为,不含孤电子对,采用sp2杂化,C正确;
D.元素的非金属越强,电负性越大,故N>C>Al,D正确;
故选A
14.D
【解析】A.CS2中C原子孤电子对数、价电子对数,是直线型结构,A不正确;
B.ClO中中心原子价层电子对数为3+=4,孤对电子对数是1,所以是三角锥形结构,B不正确;
C.NH3中N原子孤电子对数、CO中C原子孤电子对数、CO2中C原子孤电子对数,C不正确;
D.SiF4的中心原子孤电子对数=、价层电子对数=4+0=4,故中心原子为sp3杂化;SO内中心原子孤电子对数=、价层电子对数=3+1=4,故中心原子为sp3杂化,D正确;
答案选D。
15.B
【解析】A.CH3CH=CH2中双键碳为sp2、单键碳为sp3,故不选A;
B.CH3-C≡CH中三键碳为sp、单键碳为sp3,故选B;
C.CH3CH2OH中碳原子均为sp3杂化,故不选C;
D.CH≡CH中碳原子只有sp杂化,故不选D;
选B。
16.错误,分子的中心原子若通过杂化轨道成键,该分子不一定为正四面体形结构,如CH4中C原子发生杂化,为正四面体结构;NH3中N原子发生杂化,但其分子为三角锥形,水中O原子发生杂化,但其分子构型V型。
【解析】子的中心原子若通过杂化轨道成键,该分子不一定为正四面体形结构,如CH4中C原子发生杂化,为正四面体结构;NH3中N原子发生杂化,但其分子为三角锥形,水中O原子发生杂化,但其分子构型V型。
17.错误,中,存在3个σ键,有一个孤电子对,N发生杂化,为三角锥形
【解析】中,存在3个σ键,有一个孤电子对,N发生杂化,为三角锥形,故为三角锥形,N发生杂化的说法是错误的。
18.(1)7
(2) 2 2
(3)
【解析】(1)
1个柠檬酸分子中有4个C-O键和3个C=O键,则1mol柠檬酸分子中碳原子与氧原子形成的键共7mol。
(2)
CO2的结构式为O=C=O,则1个CO2分子中存在2个键和2个键。
(3)
N2的结构式为,则。
19.(1)H2O分子的立体结构为V形,正、负电荷中心不重合,CO2分子的立体结构为直线形,正、负电荷中心重合。
(2)二氧化碳与二硫化碳的晶体都是分子晶体,且两者的组成与结构相似,二硫化碳比二氧化碳的相对分子质量大,分子间作用力较大,熔沸点较高。
(3)乙醇和1-戊醇的结构简式分别为C2 H5 OH和CH3(CH2)4OH,羟基是亲水基,烃基为憎水基,乙醇中羟基起主导作用,1-戊醇中烃基起主导作用。
(4)氮元素的电负性大,NH3分子与H2O分子之间能形成氢键,且NH3分子之间能形成氢键,磷元素的电负性较小,PH3分子与H2O分子之间不能形成氢键,且PH3分子之间不能形成氢键。
【解析】(1)
H2O分子的立体结构为V形,正、负电荷中心不重合,水是极性分子,CO2分子的立体结构为直线形,正、负电荷中心重合,二氧化碳是非极性分子。
(2)
二氧化碳与二硫化碳的晶体都是分子晶体,且两者的组成与结构相似,二硫化碳比二氧化碳的相对分子质量大,分子间作用力较大,熔沸点较高,所以常温下二氧化碳是气体,而二硫化碳是液体。
(3)
乙醇和1-戊醇的结构简式分别为C2 H5 OH和CH3(CH2)4OH,两者都含有羟基,羟基是亲水基,烃基为憎水基,乙醇中烃基小,羟基起主导作用,1-戊醇中烃基大,烃基起主导作用,所以乙醇与水互溶,1-戊醇在水中的溶解度却很小。
(4)
氮元素的电负性大,NH3分子与H2O分子之间能形成氢键,且NH3分子之间能形成氢键,因此氨气极易溶于水,氨的沸点高,容易液化。磷元素的电负性较小,PH3分子与H2O分子之间不能形成氢键,且PH3分子之间不能形成氢键,因此PH3在水中溶解度较小,PH3的沸点低,不易液化。
20. 三角锥形 低 NH3分子间存在氢键
【解析】As的氢化物同NH3分子,中心原子sp3杂化,一对孤电子对,故为三角锥形;因NH3中存在分子间氢键,故沸点比AsH3高。
21. 2 2
【解析】二氧化碳分子的空间构型为直线形,是结构对称的非极性分子,结构式为O=C=O,分子中双键含有1个σ键和1个π键,则二氧化碳分子中含有2个σ键和2个π键。
22.(1) 正四面体形 平面三角形
(2)
【解析】中心原子价层电子对个数=σ键个数+孤电子对个数;σ键个数=配原子个数,孤电子对个数=,a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数;据此确定VSEPR模型,实际空间构型要去掉孤电子对。
(1)
利用模型推测分子或离子的空间结构。
中的中心原子价层电子对数是4,没有孤电子对,空间结构为正四面体形。分子中心原子价层电子对数是3,没有孤电子对,空间结构是平面三角形。
(2)
第二周期非金属元素有硼、碳、氮、氧、氟,按要求写出由第二周期非金属元素的原子构成的中性分子的化学式:
平面三角形分子:BF3(中心原子价层电子对数是3,没有孤电子对),三角锥形分子:NF3(中心原子价层电子对数是4,有1对孤电子对),正四面体形分子:CF4(中心原子价层电子对数是4,没有孤电子对)。
23.(1)1
(2) sp2、sp3 sp2
(3) NA NA
(4) H—O键的键能大于H—N键的键能 V形、三角锥形、直线形 sp3、sp3、sp
【解析】(1)
根据构造原理可知,氯元素基态原子核外电子排布式是1s22s22p63s23p5,所以未成对电子数为1;
(2)
根据氯吡苯脲的结构简式可知,有2个氮原子均形成3个单键,孤电子对数为1,属于sp3杂化;剩余1个氮原子形成1个双键和1个单键,孤电子对数为1,是sp2杂化;羰基碳原子形成2个单键和1个双键,为sp2杂化。
(3)
由于σ键比π键更稳定,根据反应方程式可以看出,断裂的化学键为异氰酸苯酯分子中的N=C键中的π键和2-氯-4-氨基吡啶分子中的N—H键;故每生成1mol氯吡苯脲,断裂1mol σ键,断裂1mol π键,则断裂NA个σ键,断裂NA个π键。
(4)
①O、N属于同周期元素,O的原子半径小于N,H—O键的键能大于H—N键的键能,所以H2O分子比NH3分子稳定。
②H2O分子中O原子的价层电子对数=2+=4,孤电子对数为2,所以为V形结构,O原子采用sp3杂化;
NH3分子中N原子的价层电子对数=3+=4,孤电子对数为1,所以为三角锥形结构,N原子采用sp3杂化;
CO2分子中C原子的价层电子对数=2+=2,不含孤电子对,所以是直线形结构,C原子采用sp杂化。
24. sp3 ②
【解析】Si的原子序数为14,最外层有4个电子,则其价电子层的电子排布式为3s23p2;单晶硅的晶体类型为原子晶体;SiCl4的中心Si原子的价层电子对数为 =4,为sp3杂化;中间体SiCl4(H2O)中Si分别与C1、O形成5个共价键,为sp3d杂化,故答案为:sp3;②。
25. 6 1
【解析】由题意可知,只有成环的配位键才能起到螯合作用,再结合题给结构可知中的2个O原子和C、N杂环上的4个N原子通过螯合作用与形成配位键,故该配合物中通过螯合作用形成配位键;中N原子价电子对数为3+0=3,中N原子价电子对数为2+1=3,C、N杂环上的4个N原子价电子对数为3,故该配合物中N原子均采取杂化,即N的杂化方式有1种。
故答案为:6;1。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.在氯化氢分子中,形成共价键的原子轨道是
A.氯原子的2p轨道和氢原子的1s轨道
B.氯原子的2p轨道和氢原子的2p轨道
C.氯原子的3p轨道和氢原子的1s轨道
D.氯原子的3p轨道和氢原子的2s轨道
2.下列关于NH、NH3、NH三种微粒的说法不正确的是
A.三种微粒所含有的电子数相等 B.三种微粒中氮原子的杂化方式相同
C.三种微粒的空间构型相同 D.键角大小关系:NH>NH3>NH
3.氯化亚硫(SOCl2)是一种很重要的化学试剂,可以作为氯化剂和脱水剂。下列关于氯化亚硫分子的VSEPR模型、空间结构和中心原子(S)采取何种杂化方式的说法正确的是
A.四面体形、三角锥形、sp3 B.平面三角形、平面三角形、sp2
C.四面体形、平面三角形、sp3 D.四面体形、三角锥形、sp2
4.已知N—N、N=N和N≡N键能之比为1.00∶2.17∶4.90,而C—C、C=C和C≡C键能之比为1.00∶1.77∶2.34,下列说法正确的是
A.σ键一定比π键稳定
B.N2较易发生加成反应
C.乙烯、乙炔较易发生加成反应
D.乙烯、乙炔中的π键比σ键稳定
5.下列有机化合物中σ键与π键个数比为3∶2的是
A.CH3CH3 B.CH2=CH2
C.CH≡CH D.CH4
6.人们常用表示卤化氢(X代表F、、、I),下列说法中,正确的是
A.形成共价键的两个原子之间的核间距叫做键长
B.的键长是中最长的
C.是键
D.的键能是中最小的
7.下列说法正确的是
A.σ键强度小,容易断裂,而π键强度较大,不易断裂
B.共价键都具有方向性
C.π键是由两个原子的p轨道“头碰头”重叠形成的
D.两个原子之间形成共价键时,最多有一个σ键
8.有A、B、C、D、E五种元素,质子数都小于18。B原子的最外层电子数是其电子层数的3倍;C原子失去1个电子所得到的微粒具有与氖原子相同的电子层结构;D是地壳中含量最多的金属元素;E的最高正价与最低负价的代数和为6;A单质可以在E单质中燃烧,生成AE,燃烧时火焰呈苍白色。下列说法错误的是
A.A2B中只含极性共价键
B.B和C两种元素形成的化合物--定含有离子键也可能含有共价键
C.E单质可以使干燥的红色布条褪色
D.D单质常温下既能溶于稀盐酸也能溶于氢氧化钠溶液
9.氯的含氧酸根离子有、、、等,关于它们的说法不正确的是
A.的中心Cl原子采取杂化
B.的空间结构为三角锥形
C.的空间结构为直线形
D.中Cl原子的杂化类型与相同
10.下列分子中存在的共价键类型完全相同(从σ键、π键的形成方式角度分析)的是
A.CH4与C2H2 B.H2O与HCl
C.H2与Cl2 D.Cl2与N2
11.NH3分子的空间结构是三角锥形结构而不是平面正三角形结构,最充分的理由是
A.NH3分子内3个N—H键长均相等
B.NH3分子内3个价键的键角和键长均相等
C.NH3分子内3个N—H的键长相等,键角都等于107°
D.NH3分子内3个N—H的键长相等,键角都等于120°
12.下列各组物质中,都是由极性键构成的极性分子的是
A.CH4和CCl4 B.H2S和HCl C.CO2和CS2 D.NH3和CH4
13.短周期元素X、Y、Z原子序数依次增大,X元素基态原子有2个未成对电子,Y元素基态原子的核外p电子数比s电子数少1个,Z的一种“超原子”()具有40个价电子,下列说法错误的是
A.简单离子半径: B.的空间构型为平面三角形
C.中心原子的杂化方式为杂化 D.X、Y、Z的电负性:
14.下列描述中正确的是
A.CS2分子的立体构型为V形
B.ClO的立体构型为平面三角形
C.NH3、CO、CO2的中心原子都有孤电子对
D.SiF4和SO的中心原子均采取sp3杂化
15.下列有机物分子中的碳原子既有sp3杂化又有sp杂化的是
A.CH3CH=CH2 B.CH3-C≡CH C.CH3CH2OH D.CH≡CH
二、填空题
16.中心原子若通过杂化轨道成键,则该分子一定为正四面体形结构。(______)
17.为三角锥形,N发生杂化。(______)
18.按要求填空:
(1)柠檬酸的结构简式见图。1mol柠檬酸分子中碳原子与氧原子形成的键的数目为_________mol。
(2)CO2分子中存在_________个键和_________个键。
(3)N2分子中键与键的数目比 _________。
19.请解释下列现象:
(1)同样是三原子分子,水分子有极性而二氧化碳分子没有极性___________。
(2)同样是直线形非极性分子,常温下二氧化碳是气体而二硫化碳是液体___________。
(3)乙醇与水互溶,而1-戊醇在水中的溶解度却很小___________。
(4)同样是三角锥形的氢化物,氨气在水中极易溶解,并且很容易液化(常用作冷库中的制冷剂),而同主族的磷化氢()却没有这些性质___________。
20.元素As与N同族。预测As的氢化物分子的立体结构为___________,其沸点比NH3的___________(填“高”或“低”),其判断理由是___________。
21.CO2分子中存在_______个键和_______个键。
22.回答下列问题
(1)利用模型推测分子或离子的空间结构。
:___________;(共价分子):___________。
(2)按要求写出由第二周期非金属元素的原子构成的中性分子的化学式。
平面三角形分子:___________,三角锥形分子:___________,正四面体形分子:___________。
23.氯吡苯脲是一种常用的膨大剂,其结构简式为 ,它是经国家批准使用的植物生长调节剂。
(1)氯元素基态原子核外电子的未成对电子数为___________。
(2)氯吡苯脲晶体中,氮原子的杂化轨道类型为___________,羰基碳原子的杂化轨道类型为___________。
(3)查文献可知,可用2-氯-4-氨基吡啶与异氰酸苯酯反应,生成氯吡苯脲,其反应方程式如下:
反应过程中,每生成1mol氯吡苯脲,断裂___________个σ键,断裂___________个π键。
(4)膨大剂能在动物体内代谢,其产物较为复杂,其中有H2O、NH3、CO2等。
①请用共价键知识解释H2O分子比NH3分子稳定的原因为___________。
②H2O、NH3、CO2分子的空间结构分别是______,中心原子的杂化类型分别是______。
24.SiCl4是生产高纯硅的前驱体,其中Si采取的杂化类型为_______。SiCl4可发生水解反应,机理如下:
含s、p、d轨道的杂化类型有:①dsp2、②sp3d、③sp3d2,中间体SiCl4(H2O)中Si采取的杂化类型为_______(填标号)。
25.含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种配合物的结构如下图所示,该配合物中通过螯合作用形成的配位键有_______,该螯合物中N的杂化方式有_______种。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
【解析】氢原子和氯原子的核外电子排布式分别为1s1和1s22s22p63s23p5,由此可以看出,氢原子的1s轨道和氯原子的3p轨道上各有一个未成对电子,故两者在形成氯化氢分子时,形成共价键的原子轨道是氯原子的3p轨道和氢原子的1s轨道。
2.C
【解析】A.NH、NH3、NH三种微粒,每个NH、NH3、NH所含有的电子数都为10个电子,故A正确;
B.铵根离子中氮原子价层电子对个数=σ键个数+孤电子对个数=4+(5 1 4×1)=4,所以其采用sp3杂化,氨气分子中价层电子对个数=σ键个数+孤电子对个数=3+(5-3×1)=4,所以氮原子杂化方式是sp3,NH中氮原子价层电子对个数=σ键个数+孤电子对个数=2+(5 1×2+1) =4,所以其采用sp3杂化,故B正确;
C.根据三种微粒的杂化方式可知,铵根离子为正四面体结构;氨气分子空间构型为三角锥形,NH空间构型为V形,故C错误;
D.铵根离子中,含0对孤电子,氨气分子中含1对孤电子,NH含2对孤电子,含有孤电子对越多,分子中的键角越小,所以键角大小关系:NH>NH3>NH,故D正确;
故选C。
3.A
【解析】SOCl2的中心原子(S原子)的价层电子对数=3+=4,孤对电子数为1,所以中心原子(S)采取sp3杂化,分子的VSEPR模型为四面体形,空间结构为三角锥形,故A正确;
答案选A。
4.C
【解析】A.根据N—N、N=N和N≡N键能之比为1.00∶2.17∶4.90,N≡N、N=N中π键比σ键稳定,故A错误;
B.N≡N、N=N中π键比σ键稳定,难发生加成,故B错误;
C.根据C—C、C=C和C≡C键能之比为1.00∶1.77∶2.34,C=C,C≡C中π键比σ键弱,π键不稳定,较易发生加成,故C正确;
D.根据C—C、C=C和C≡C键能之比为1.00∶1.77∶2.34,C=C,C≡C中π键比σ键弱,π键没有σ键稳定,故D错误;
故选C。
5.C
【解析】A.CH3CH3中有7个σ键,没有π键,故A不符合题意;
B.CH2=CH2中有5个σ键,1个π键,故B不符合题意;
C.CH≡CH中有3个σ键,2个π键,故C符合题意;
D.CH4中有4个σ键,没有π键,故D不符合题意。
综上所述,答案为C。
6.A
【解析】A.形成共价键的两个原子之间的核间距叫做键长,A正确;
B.F、、、I中F原子半径最小,的键长是中最短的,B错误;
C.是H的1s轨道与F的2p轨道“头碰头”成键,是键,C错误;
D.键长越短键能越大,的键长是中最短的,键能是中最大的,D错误;
故选A。
7.D
【解析】A.一般σ键比π键更稳定,不易断裂,A项错误;
B.s-sσ键无方向性,B项错误;
C.原子轨道以“头碰头”方式相互重叠形成的共价键为σ键,π键是由两个原子的p轨道“肩并肩”重叠形成的,C项错误;
D.两个原子之间形成共价键时,单键为σ键,双键和三键中都只有一个σ键,所以两个原子之间形成共价键时,最多有一个σ键,D项正确。
答案选D。
8.C
【解析】B原子的最外层电子数是其电子层数的3倍,则B为氧元素;C原子失去1个电子所得到的微粒具有与氖原子相同的电子层结构,则C原子核外有11个电子,即核电荷数为11,C为钠元素;地壳中含量最多的金属元素是铝,D为铝元素;氯的最高正价+7价与最低负价-1价,代数和为6,E为氯元素;氢气可以在氯气中燃烧,火焰呈苍白色,所以A为氢元素。即A、B、C、D、E分别为H、O、Na、A1、C1。
【解析】A.A2B为H2O,水分子结构式为H-O-H,所以水分子中只含极性共价键,A项正确;
B.B和C两种元素形成的化合物Na2O,是离子化合物,只含有离子键,B和C两种元素形成的化合物Na2O2是离子化合物,既含有离子键又含有共价键,B项正确;
C.氯气和水反应生成的次氯酸有漂白性,氯气使湿润红色布条褪色,干燥的氯气不能使干燥的红色布条褪色,C项错误;
D.铝单质常温下与稀盐酸生成氯化铝和氢气,铝单质常温下和氢氧化钠溶液反应生成偏铝酸钠和氢气,D项正确;
答案选C。
9.C
【解析】A.的中心原子的孤电子对数为0,与中心原子结合的O原子数为4,则原子采取杂化,A正确;
B.的中心原子的价层电子对数为,且含有1个孤电子对,空间结构为三角锥形,B正确;
C.的中心原子的价层电子对数为,且含有2个孤电子对,空间结构为V形,C错误;
D.中原子的孤电子对数为3,与原子结合的O原子数为1,原子采取杂化,中原子的孤电子对数为2,与原子结合的O原子数为2,原子采取杂化,D正确;
故选C。
10.B
【解析】根据单键为σ键,双键和三键中既有σ键又有π键,结合分子结构判断。
【解析】A.CH4分子中存在s-pσ键,C2H2分子中存在σ键和π键,所以共价键类型不完全相同,故A错误;
B.H2O与HCl都含有H原子,分子中的共价键均是s电子云与p电子云形成的s-pσ键,故B正确;
C.H2分子中存在s—sσ键,Cl2分子中存在p—pσ键,所以共价键类型不完全相同,故C错误;
D.Cl2分子中只有单键,全部为σ键,N2分子中有三键既有σ键又有π键,所以共价键类型不完全相同,故D错误。
故选B。
11.C
【解析】NH3分子内的键角和键长都相等,可能有两种情况,一是平面正三角形,二是三角锥形结构。如果键角为120°,则必然为平面正三角形,故选:C。
12.B
【解析】A.CH4和CCl4中的C-H键和C-Cl键均为极性键,CH4和CCl4分子均为正四面体构型,高度对称,分子中正负电荷的中心重合,均为非极性分子,故A不符合题意;
B.H2S含有H-S极性键,正负电荷的中心不重合,是极性分子;HCl含有H-Cl极性键,正负电荷的中心不重合,是极性分子,故B符合题意;
C.CO2含有C=O极性键,正负电荷的中心重合,是非极性分子,CS2含有C=S极性键,正负电荷的中心重合,是非极性分子,故C不符合题意;
D.NH3含有N-H极性键,分子构型为三角锥型,正负电荷中心不重合,为极性分子;CH4含有C-H极性键,为正四面体构型,高度对称,分子中正负电荷的中心重合,为非极性分子,故D不符合题意;
答案选B。
13.A
【解析】短周期元素X、Y、Z原子序数依次增大,Z的一种超原子具有40个价电子,则Z的价电子数为 个,Z为Al元素,Y元素基态原子的核外p电子数比s电子数少1个,Y为N元素,X元素基态原子有2个未成对电子,X为C元素。
【解析】A.N3-和Al3+的核外电子层数相同,而N的核电荷数小于Al,则离子半径:N3-> Al3+,A错误;
B.的中心原子的价电子对数为 ,不含孤电子对,采用sp2杂化,空间构型为平面三角形,B正确;
C. 的中心原子的价电子对数为,不含孤电子对,采用sp2杂化,C正确;
D.元素的非金属越强,电负性越大,故N>C>Al,D正确;
故选A
14.D
【解析】A.CS2中C原子孤电子对数、价电子对数,是直线型结构,A不正确;
B.ClO中中心原子价层电子对数为3+=4,孤对电子对数是1,所以是三角锥形结构,B不正确;
C.NH3中N原子孤电子对数、CO中C原子孤电子对数、CO2中C原子孤电子对数,C不正确;
D.SiF4的中心原子孤电子对数=、价层电子对数=4+0=4,故中心原子为sp3杂化;SO内中心原子孤电子对数=、价层电子对数=3+1=4,故中心原子为sp3杂化,D正确;
答案选D。
15.B
【解析】A.CH3CH=CH2中双键碳为sp2、单键碳为sp3,故不选A;
B.CH3-C≡CH中三键碳为sp、单键碳为sp3,故选B;
C.CH3CH2OH中碳原子均为sp3杂化,故不选C;
D.CH≡CH中碳原子只有sp杂化,故不选D;
选B。
16.错误,分子的中心原子若通过杂化轨道成键,该分子不一定为正四面体形结构,如CH4中C原子发生杂化,为正四面体结构;NH3中N原子发生杂化,但其分子为三角锥形,水中O原子发生杂化,但其分子构型V型。
【解析】子的中心原子若通过杂化轨道成键,该分子不一定为正四面体形结构,如CH4中C原子发生杂化,为正四面体结构;NH3中N原子发生杂化,但其分子为三角锥形,水中O原子发生杂化,但其分子构型V型。
17.错误,中,存在3个σ键,有一个孤电子对,N发生杂化,为三角锥形
【解析】中,存在3个σ键,有一个孤电子对,N发生杂化,为三角锥形,故为三角锥形,N发生杂化的说法是错误的。
18.(1)7
(2) 2 2
(3)
【解析】(1)
1个柠檬酸分子中有4个C-O键和3个C=O键,则1mol柠檬酸分子中碳原子与氧原子形成的键共7mol。
(2)
CO2的结构式为O=C=O,则1个CO2分子中存在2个键和2个键。
(3)
N2的结构式为,则。
19.(1)H2O分子的立体结构为V形,正、负电荷中心不重合,CO2分子的立体结构为直线形,正、负电荷中心重合。
(2)二氧化碳与二硫化碳的晶体都是分子晶体,且两者的组成与结构相似,二硫化碳比二氧化碳的相对分子质量大,分子间作用力较大,熔沸点较高。
(3)乙醇和1-戊醇的结构简式分别为C2 H5 OH和CH3(CH2)4OH,羟基是亲水基,烃基为憎水基,乙醇中羟基起主导作用,1-戊醇中烃基起主导作用。
(4)氮元素的电负性大,NH3分子与H2O分子之间能形成氢键,且NH3分子之间能形成氢键,磷元素的电负性较小,PH3分子与H2O分子之间不能形成氢键,且PH3分子之间不能形成氢键。
【解析】(1)
H2O分子的立体结构为V形,正、负电荷中心不重合,水是极性分子,CO2分子的立体结构为直线形,正、负电荷中心重合,二氧化碳是非极性分子。
(2)
二氧化碳与二硫化碳的晶体都是分子晶体,且两者的组成与结构相似,二硫化碳比二氧化碳的相对分子质量大,分子间作用力较大,熔沸点较高,所以常温下二氧化碳是气体,而二硫化碳是液体。
(3)
乙醇和1-戊醇的结构简式分别为C2 H5 OH和CH3(CH2)4OH,两者都含有羟基,羟基是亲水基,烃基为憎水基,乙醇中烃基小,羟基起主导作用,1-戊醇中烃基大,烃基起主导作用,所以乙醇与水互溶,1-戊醇在水中的溶解度却很小。
(4)
氮元素的电负性大,NH3分子与H2O分子之间能形成氢键,且NH3分子之间能形成氢键,因此氨气极易溶于水,氨的沸点高,容易液化。磷元素的电负性较小,PH3分子与H2O分子之间不能形成氢键,且PH3分子之间不能形成氢键,因此PH3在水中溶解度较小,PH3的沸点低,不易液化。
20. 三角锥形 低 NH3分子间存在氢键
【解析】As的氢化物同NH3分子,中心原子sp3杂化,一对孤电子对,故为三角锥形;因NH3中存在分子间氢键,故沸点比AsH3高。
21. 2 2
【解析】二氧化碳分子的空间构型为直线形,是结构对称的非极性分子,结构式为O=C=O,分子中双键含有1个σ键和1个π键,则二氧化碳分子中含有2个σ键和2个π键。
22.(1) 正四面体形 平面三角形
(2)
【解析】中心原子价层电子对个数=σ键个数+孤电子对个数;σ键个数=配原子个数,孤电子对个数=,a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数;据此确定VSEPR模型,实际空间构型要去掉孤电子对。
(1)
利用模型推测分子或离子的空间结构。
中的中心原子价层电子对数是4,没有孤电子对,空间结构为正四面体形。分子中心原子价层电子对数是3,没有孤电子对,空间结构是平面三角形。
(2)
第二周期非金属元素有硼、碳、氮、氧、氟,按要求写出由第二周期非金属元素的原子构成的中性分子的化学式:
平面三角形分子:BF3(中心原子价层电子对数是3,没有孤电子对),三角锥形分子:NF3(中心原子价层电子对数是4,有1对孤电子对),正四面体形分子:CF4(中心原子价层电子对数是4,没有孤电子对)。
23.(1)1
(2) sp2、sp3 sp2
(3) NA NA
(4) H—O键的键能大于H—N键的键能 V形、三角锥形、直线形 sp3、sp3、sp
【解析】(1)
根据构造原理可知,氯元素基态原子核外电子排布式是1s22s22p63s23p5,所以未成对电子数为1;
(2)
根据氯吡苯脲的结构简式可知,有2个氮原子均形成3个单键,孤电子对数为1,属于sp3杂化;剩余1个氮原子形成1个双键和1个单键,孤电子对数为1,是sp2杂化;羰基碳原子形成2个单键和1个双键,为sp2杂化。
(3)
由于σ键比π键更稳定,根据反应方程式可以看出,断裂的化学键为异氰酸苯酯分子中的N=C键中的π键和2-氯-4-氨基吡啶分子中的N—H键;故每生成1mol氯吡苯脲,断裂1mol σ键,断裂1mol π键,则断裂NA个σ键,断裂NA个π键。
(4)
①O、N属于同周期元素,O的原子半径小于N,H—O键的键能大于H—N键的键能,所以H2O分子比NH3分子稳定。
②H2O分子中O原子的价层电子对数=2+=4,孤电子对数为2,所以为V形结构,O原子采用sp3杂化;
NH3分子中N原子的价层电子对数=3+=4,孤电子对数为1,所以为三角锥形结构,N原子采用sp3杂化;
CO2分子中C原子的价层电子对数=2+=2,不含孤电子对,所以是直线形结构,C原子采用sp杂化。
24. sp3 ②
【解析】Si的原子序数为14,最外层有4个电子,则其价电子层的电子排布式为3s23p2;单晶硅的晶体类型为原子晶体;SiCl4的中心Si原子的价层电子对数为 =4,为sp3杂化;中间体SiCl4(H2O)中Si分别与C1、O形成5个共价键,为sp3d杂化,故答案为:sp3;②。
25. 6 1
【解析】由题意可知,只有成环的配位键才能起到螯合作用,再结合题给结构可知中的2个O原子和C、N杂环上的4个N原子通过螯合作用与形成配位键,故该配合物中通过螯合作用形成配位键;中N原子价电子对数为3+0=3,中N原子价电子对数为2+1=3,C、N杂环上的4个N原子价电子对数为3,故该配合物中N原子均采取杂化,即N的杂化方式有1种。
故答案为:6;1。
答案第1页,共2页
答案第1页,共2页
