化学人教版(2019)必修第一册4.2.2元素周期表和元素周期律的应用(共35张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册4.2.2元素周期表和元素周期律的应用(共35张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-23 08:13:39 | ||
图片预览








文档简介
(共35张PPT)
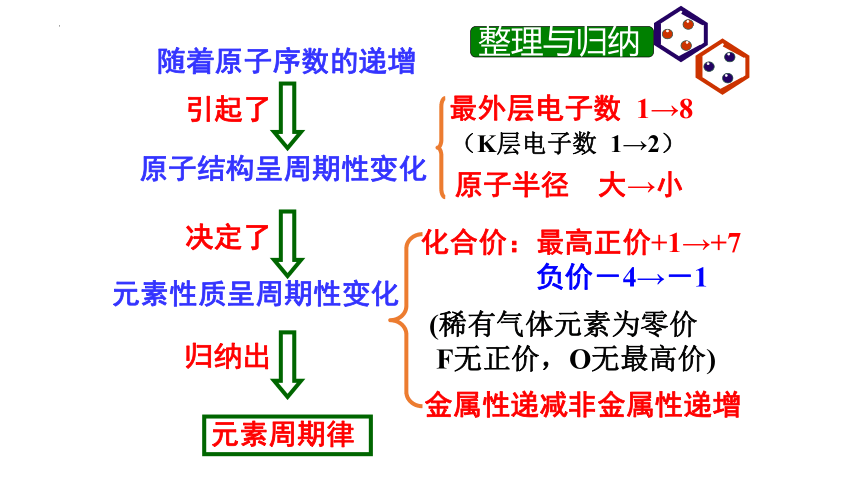
元素性质 同周期(从左到右) 同主族(从上到下)
最外层电子数
电子层数
主要化合价
原子半径
失电子能力(金属性)
得电子能力(非金属性)
气态氢化物的稳定性
单质的氧化性
单质的还原性
最高价氧化物 酸性 对应水化物 碱性
金属单质与水或酸反应
+1→+7 -4→-1
↘
↘
↗
↗
↗
↘
↗
↘
由易到难
元素性质的递变小结
依次递增
相同
相同
依次递增
相同
↗
↗
↘
↘
↘
↗
↘
↗
由难到易
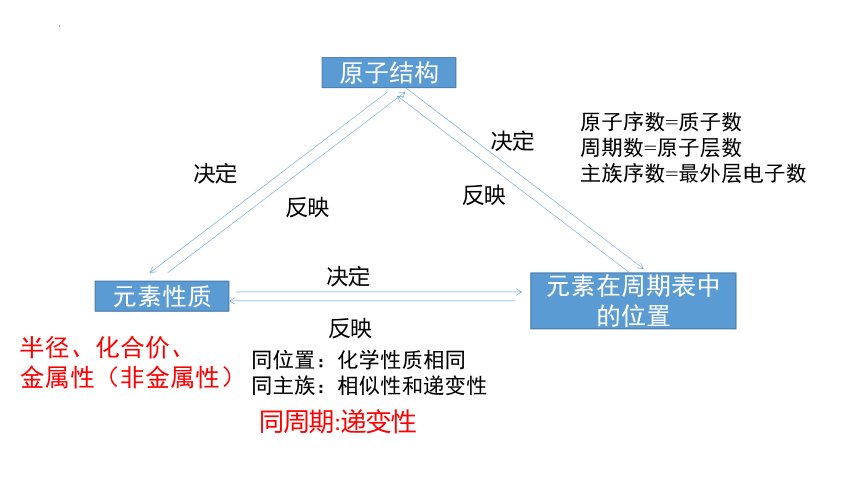
元素性质呈周期性变化
决定了
元素周期律
归纳出
最外层电子数 1→8
(K层电子数 1→2)
原子半径 大→小
随着原子序数的递增
原子结构呈周期性变化
引起了
化合价:最高正价+1→+7
负价-4→-1
(稀有气体元素为零价
F无正价,O无最高价)
金属性递减非金属性递增
整理与归纳
元素周期律
1、概念:
元素的性质随着原子序数的递增而呈现周期性变化的规律叫做元素周期律。
2、本质:
元素性质的周期性变化规律是元素原子核外电子排布周期性变化的必然结果。
原子半径;
元素化合价;
原子核外电子排布;
元素的金属性、非金属性
周期性变化
最高正价数=最外层电子数
元素的负价=最外层电子数-8
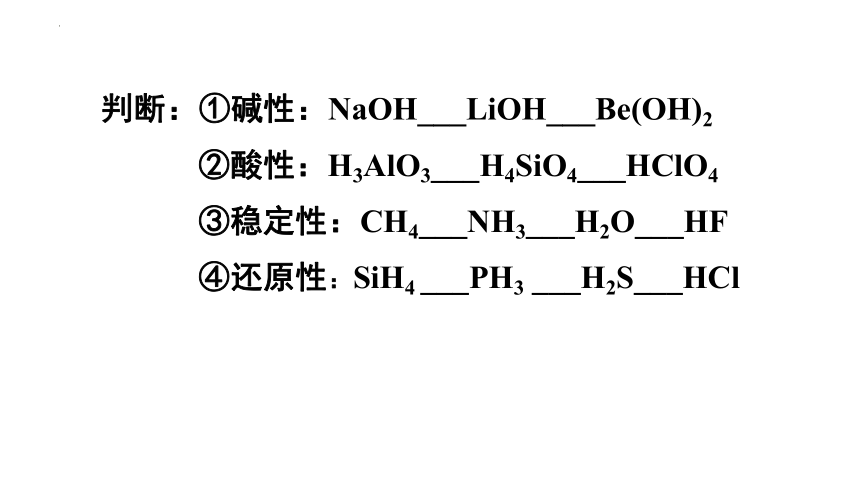
原子结构
元素性质
元素在周期表中的位置
决定
反映
原子序数=质子数
周期数=原子层数
主族序数=最外层电子数
决定
同位置:化学性质相同
同主族:相似性和递变性
反映
决定
反映
半径、化合价、
金属性(非金属性)
同周期:递变性
判断:①碱性:NaOH___LiOH___Be(OH)2
②酸性:H3AlO3___H4SiO4___HClO4
③稳定性:CH4___NH3___H2O___HF
④还原性:SiH4 ___PH3 ___H2S___HCl
2.判断正误(正确的打“√”,错误的打“×”)。
(1)同周期元素从左到右,原子半径逐渐减小,离子半径也逐渐减小( )
(2)第二周期元素从左到右,最高正价从+1递增到+7( )
(3)元素的原子得电子越多,非金属性越强;失电子越多,金属性越强( )
(4)Al(OH)3为两性氢氧化物,与氨水、盐酸均可反应( )
(5)AlCl3溶液中加足量氨水可生成Al(OH)3沉淀( )
(6)元素的氧化物的水化物酸性越强,非金属性越强;碱性越强,金属性越强
( )
(7)第二周期非金属元素的气态氢化物溶于水后,水溶液均为酸性( )
×
×
×
×
×
×
√
如何变化?
3.X、Y两元素是同周期的非金属主族元素,如果X原子半径比Y的大,下面说法正确的是 ( )
A.最高价氧化物对应水化物的酸性,X的比Y的强
B.X的非金属性比Y的强
C.X的阴离子比Y的阴离子还原性强
D.X的气态氢化物比Y的稳定
C
可否作为非金属性的判断依据?
一般情况下可以
单质的还原性(单质之间的置换)
离子的氧化性
金属性
与水或酸置换氢气难易程度
最高价氧化物的水化物碱性强弱
非金属性
单质的氧化性(单质之间置换)
离子的还原性
与氢气反应难易程度
气态氢化物稳定性
最高价氧化物的水化物酸性强弱
元素在周期表的相对位置
第四章 物质结构 元素周期律
第二节 元素周期律
第2课时 元素周期表和元素周期律的应用
生活连接
在“脑白金”中含有一种营养元素---34号元素,大量基础研究和临床实践证实:34号是一种维持生命的物质,当摄入量不足时,将会出现细胞病变,造成多种疾病发生。 34号对心脏病、心血管疾病、肝脏疾病、消化性溃疡、肿瘤等有显著的预防作用,并能有效清除人体自由基,解除重金属毒性,增强免疫功能,延缓衰老。
1、由结构确定位置
请推导34号元素在周期表的具体位置并标出其符号。
方法一、原子结构示意图法。
a.周期序数=电子层数
b.主族序数=最外层电子数
方法二、利用稀有气体原子序数,通过加减判断。
第四周期第VIA族
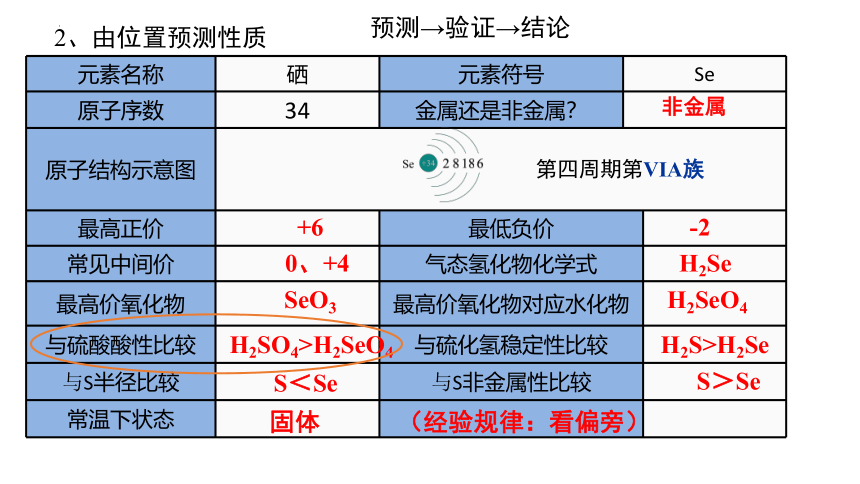
2、由位置预测性质
元素名称 硒 元素符号 Se 原子序数 34 金属还是非金属? 原子结构示意图 最高正价 最低负价
常见中间价 气态氢化物化学式
最高价氧化物 最高价氧化物对应水化物
与硫酸酸性比较 与硫化氢稳定性比较
与S半径比较 与S非金属性比较
常温下状态
非金属
+6
-2
0、+4
H2Se
SeO3
H2SO4>H2SeO4
H2S>H2Se
H2SeO4
S<Se
S>Se
固体
(经验规律:看偏旁)
第四周期第VIA族
预测→验证→结论
一、元素“位置—结构—性质”之间的关系
原子结构
元素性质
元素在周期表中的位置
决定
反映
决定
同位置:化学性质相同
同主族:相似性和递变性
反映
决定
反映
半径、化合价、
金属性(非金属性)
同周期:递变性
原子序数=质子数
周期数=原子层数
主族序数=最外层电子数
价电子数→化合价
核电荷数、半径→金属性、非金属性
1.结构与位置的互推
工具:(1)电子层数=周期数。
(2)质子数=原子序数。
(3)主族元素原子最外层电子数=主族序数。
(4)主族元素的最高正价=族序数(氧、氟除外),最低负价=主族序数-8。
一、元素“位置—结构—性质”之间的关系
若已知A2+、B-、C+、D2-离子具有相同的核外电子排布,他们在周期表中的位置关系是?
1、X、Y、Z均是短周期元素,X、Y位于同一周期,X、Z的最低价离子分别为X2-和Z-,且Y+和Z-离子具有相同的电子层结构.下列说法正确的是( )
A. 原子最外层电子数:X>Y>Z
B. 对应气态氢化物的稳定性:X>Z
C. 离子半径:X2->Y+>Z-
D. 原子序数:X>Y>Z
D
X、Y、Z的位置是?
正确顺序?
如何比较?
正确顺序?
2.(2017·全国卷Ⅱ)a,b,c,d为原子序数依次增大的短周期主族元素,a原子核外电子总数与b原子次外层的电子数相同;c所在周期数与族数相同;d与a同族,下列叙述正确的是 ( )
A.原子半径:d>c>b>a
B.4种元素中b的金属性最强
C.c的氧化物的水化物是强碱
D.d单质的氧化性比a单质的氧化性强
B
四种元素分别是?
一般解题步骤:结构→位置→性质
正确顺序?
2.性质与位置的互推
(1)根据元素的性质可以推知元素在周期表中的位置:
若同周期元素A、B、C的金属性逐渐增强,则A、B、C在同周期中的从左到右的排列顺序为?
(2)根据元素在周期表中的位置关系可以推断元素的性质:
若同主族元素A、B、C在同一主族中从上往下排列,则可推知A、B、C的单质的氧化性依次减弱顺序为?
二、元素“位置—结构—性质”之间的关系
C、B、A
A、B、C
小试牛刀
3、运用元素周期律分析,下列推断中错误的是
已知Ra是第七周期第IIA族元素,故Ra(OH)2的碱性比Mg(OH)2的碱性强
已知As是第四周期第VA族元素,故AsH3的稳定性比NH3的稳定性弱
已知Cs是第六周期第IA族元素,原子半径比Na的原子半径大,故Cs与水反应比Na与水反应更剧烈
已知Cl的非金属性比S强,故HClO的酸性比H2SO3的强
D
4、四种短周期元素在周期表中的位置如图,
其中只有M为金属元素。下列说法不正确的是( )
A. Y的最高价氧化物对应水化物的酸性比X的弱
B. Z位于元素周期表中第二周期,第ⅥA族
C. X的气态氢化物的稳定性比Z的弱
D. M的原子半径比Y的原子半径大
A
分别是?
3.结构与性质的互推
(1)若某元素原子的最外层电子数小于4,则该元素原子在反应中容易 ;若某元素原子的最外层电子数大于4,则该元素原子在反应中容易 。
(2)若某元素原子在反应中容易得电子,则该元素原子的最外层电子数 ;若某元素原子在反应中容易失电子,则该元素原子的最外层电子数 。
二、元素“位置—结构—性质”之间的关系
失去电子
得到电子
>4
<4
5.W、X、Y、Z均是短周期主族元素,X、Y、Z处于同一周期,W、X、Z的简单离子具有相同的电子层结构,W的最高价氧化物对应的水化物与其气态氢化物能反应生成盐,X的氧化物既能溶于强酸又能溶于强碱,Y的最高正价与最低负价的代数和为0。下列说法正确的是 ( )
A.离子半径:W>X>Z B.原子半径:Z>X>Y
C.单质的熔点:W>Z>Y D.最高正价:Z>W>X
B
正确顺序?
如何比较?
正确顺序?
6、 几种短周期元素的原子半径及主要化合价如下表,下列叙述正确的是( )
A.X、Y 元素的金属性:XB.工业上常用电解Y与W组成的化合物Y2W3来制备单质Y
C.W、Q 两种元素的气态氢化物的热稳定性:H2Q>H2W
D.X 的最高价氧化物对应的水化物的碱性弱于Y的
B
元素代号 X Y Z W Q
原子半径/pm 160 143 75 74 102
主要化合价 +2 +3 +5、-3 -2 +6、-2
分别是?
7.在新研制的超导材料中,铊(Tl)是主要组成元素之一。已知铊为第IIIA族原子序数最大的金属元素。则下列关于铊元素性质的推测中不正确的是 ( )
A.铊是易导电的银白色金属
B.Tl(OH)3与Al(OH)3相似,也是两性氢氧化物
C.铊可以形成氧化物Tl2O3
D.铊与酸反应比铝剧烈
E.Tl3+氧化性强于Al3+
BE
导入
二、寻找新材料
请将金属、非金属进行分区,并标出分界线附近元素
第n周期第n主族都是____第n周期含非金属元素种类= (除1、7周期外)
8-n
处于分界线附近的元素,有怎样的性质?
既能表现出金属性,又能表现出非金属性。
金属
元素周期表和元素周期律的应用
在金属与非金属元素分界线附近寻找半导体材料
位于金属和非金属分界线附近的元素,既能表现出一定的金属性,又能表现出一定非金属性
在F、Cl、S等元素附近区域进行研究,有利于制造出新品种的农药,如由含砷的有机物发展成对人畜毒性较低的含磷有机物
在过渡元素中寻找耐高温、耐腐蚀的合金元素以及制造催化剂的元素
Si、Ge、Ga
P As S Cl F
Fe Ni Pt Pd Rh
根据元素周期律推测
1.找元素之最
最活泼金属 、最活泼非金属 ;
最轻的金属 、最轻的非金属 ;
最稳定的气态氢化物 ,其中含H%最大的氢化物是 ;
最高价氧化物的水化物中,最强酸 、最强碱 ;地壳中含量最多的金属和非金属 ;
2.找半导体:
3.找农药:
4.找催化剂、耐高温、耐腐蚀材料:
Cs
F2
Li
H2
HF
CH4
HClO4
CsOH
Al 和O
在金属与非金属交界附近 Si Ge Ga
在磷附近 P As S Cl F
过渡元素 Fe Ni Pt Pd Rh
A B A B
①制半导体的元素 (a)F、Cl、Br、N、S“三角地带” ①
②制催化剂的元素 (b)金属与非金属元素分界线附近 ②
③制制冷剂的元素 (c)金属元素和非金属元素的分界线附近 ③
④制半导体的元素 (d)过渡元素 ④
元素周期表在指导科学研究和生产实践方面具有十分重要的意义,请将下表中A、B两栏描述的内容对应起来。
【知识迁移应用】
(b)
(d)
(a)
(c)
门捷列夫在研究元素周期表时,科学地预言了11种尚未发现的元素,为它们在周期表中留下了空位。例如,他认为在铝的下方有一个与铝类似的元素“类铝”,并预测了它的性质。1875年,法国化学家发现了这种元素,将它命名为镓。镓的性质与门捷列夫推测的一样。门捷列夫还预测在硅和锡之间存在一种元素——“类硅”,15年后该元素被德国化学家文克勒发现,为了纪念他的祖国,将其命名为“锗”。
预测 锗
相对原子质量 72 72.6
密度(g·cm-3) 5.5 5.32
氧化物 MO2 GeO2
氧化物的密度(g·cm-3) 4.7 4.72
氯化物 MCl4 GeCl4
氯化物的沸点(℃) <100 84
三、预测新元素
四
ⅣA
②③
Na
11钠
H
1氢
He
2氦
Li
3锂
Be
4铍
B
5硼
C
6碳
N
7氮
O
8氧
F
9氟
Ne
10氖
Mg
12镁
Al
13铝
Si
14硅
P
15磷
S
16硫
Cl
17氯
Ar
18氩
IA
IIA
IIIA
IVA
VA
VIA
VIIA
0
1
2
3
周期表左上右下对角元素性质相似
已知Be(OH)2性质与Al(OH)3相似。
写出Be(OH)2与HCl、NaOH反应的化学方程式
[2019·浙江温州选考模拟] X、Y、Z、W四种短周期元素在元素周期表中的相对位置如图所示,这四种元素原子的最外层电子数之和为20。下列判断正确的是 ( )
A.Z、X、Y形成的气态氢化物稳定性依次增强
B.四种元素形成的单质最多有6种
C.四种元素的原子半径:rZ>rY>rX>rW
D.四种元素中,X的氧化物对应的水化物酸性最强
W X Y
Z
A
小试牛刀
例:四种短周期主族元素X、Y、Z、W的原子序数依次增大,X最外层有6个电子,Y是至今发现的非金属性最强的元素,Z在周期表中处于周期序数等于族序数的位置,W的单质广泛用作半导体材料,下列叙述中正确的是
原子最外层电子数由多到少的顺序:Y、X、W、Z
原子半径由大到小的顺序,W、Z、Y、X
元素非金属性由强到弱的顺序:Z、W、X
简单气态氢化物的稳定性由强到弱的顺序:X、Y、W
tips
根据题干信息,判断未知元素
O
F
Al
Si
5.如图是部分短周期元素原子半径与原子序数的关系图。则下列说法正确的是( )
A.Z、N两种元素的离子半径相比,前者较大
B.N、P两种元素的气态氢化物的
稳定性相比,前者较稳定
C.由X与M两种元素组成的化合物
不能与任何酸反应,但能与强碱反应
D.Z的氧化物能分别溶解于Y的氢氧
化物和P的氢化物的水溶液中
D
6.如图为周期表中短周期的一部分。已知a原子的最外层电子数是电子总数的三分之一,下列说法中正确的是( )
A.a的最高价氧化物对应水化
物有两性
B.b与d组成的化合物不能与水反应
C.c的单质能与强碱反应生成两种盐
D.非金属性:c>d>b>a
C
4、某主族元素R的最高正化合价与负化合价的代数和为4,下列有关叙述正确的是
A、R一定是第四周期元素
B、R的气态氢化物分子式为H2R
C、R的气态氢化物比同周期其他元素的气态氢化物稳定
D、R的气态氢化物的水溶液显碱性
B
元素性质 同周期(从左到右) 同主族(从上到下)
最外层电子数
电子层数
主要化合价
原子半径
失电子能力(金属性)
得电子能力(非金属性)
气态氢化物的稳定性
单质的氧化性
单质的还原性
最高价氧化物 酸性 对应水化物 碱性
金属单质与水或酸反应
+1→+7 -4→-1
↘
↘
↗
↗
↗
↘
↗
↘
由易到难
元素性质的递变小结
依次递增
相同
相同
依次递增
相同
↗
↗
↘
↘
↘
↗
↘
↗
由难到易
元素性质呈周期性变化
决定了
元素周期律
归纳出
最外层电子数 1→8
(K层电子数 1→2)
原子半径 大→小
随着原子序数的递增
原子结构呈周期性变化
引起了
化合价:最高正价+1→+7
负价-4→-1
(稀有气体元素为零价
F无正价,O无最高价)
金属性递减非金属性递增
整理与归纳
元素周期律
1、概念:
元素的性质随着原子序数的递增而呈现周期性变化的规律叫做元素周期律。
2、本质:
元素性质的周期性变化规律是元素原子核外电子排布周期性变化的必然结果。
原子半径;
元素化合价;
原子核外电子排布;
元素的金属性、非金属性
周期性变化
最高正价数=最外层电子数
元素的负价=最外层电子数-8
原子结构
元素性质
元素在周期表中的位置
决定
反映
原子序数=质子数
周期数=原子层数
主族序数=最外层电子数
决定
同位置:化学性质相同
同主族:相似性和递变性
反映
决定
反映
半径、化合价、
金属性(非金属性)
同周期:递变性
判断:①碱性:NaOH___LiOH___Be(OH)2
②酸性:H3AlO3___H4SiO4___HClO4
③稳定性:CH4___NH3___H2O___HF
④还原性:SiH4 ___PH3 ___H2S___HCl
2.判断正误(正确的打“√”,错误的打“×”)。
(1)同周期元素从左到右,原子半径逐渐减小,离子半径也逐渐减小( )
(2)第二周期元素从左到右,最高正价从+1递增到+7( )
(3)元素的原子得电子越多,非金属性越强;失电子越多,金属性越强( )
(4)Al(OH)3为两性氢氧化物,与氨水、盐酸均可反应( )
(5)AlCl3溶液中加足量氨水可生成Al(OH)3沉淀( )
(6)元素的氧化物的水化物酸性越强,非金属性越强;碱性越强,金属性越强
( )
(7)第二周期非金属元素的气态氢化物溶于水后,水溶液均为酸性( )
×
×
×
×
×
×
√
如何变化?
3.X、Y两元素是同周期的非金属主族元素,如果X原子半径比Y的大,下面说法正确的是 ( )
A.最高价氧化物对应水化物的酸性,X的比Y的强
B.X的非金属性比Y的强
C.X的阴离子比Y的阴离子还原性强
D.X的气态氢化物比Y的稳定
C
可否作为非金属性的判断依据?
一般情况下可以
单质的还原性(单质之间的置换)
离子的氧化性
金属性
与水或酸置换氢气难易程度
最高价氧化物的水化物碱性强弱
非金属性
单质的氧化性(单质之间置换)
离子的还原性
与氢气反应难易程度
气态氢化物稳定性
最高价氧化物的水化物酸性强弱
元素在周期表的相对位置
第四章 物质结构 元素周期律
第二节 元素周期律
第2课时 元素周期表和元素周期律的应用
生活连接
在“脑白金”中含有一种营养元素---34号元素,大量基础研究和临床实践证实:34号是一种维持生命的物质,当摄入量不足时,将会出现细胞病变,造成多种疾病发生。 34号对心脏病、心血管疾病、肝脏疾病、消化性溃疡、肿瘤等有显著的预防作用,并能有效清除人体自由基,解除重金属毒性,增强免疫功能,延缓衰老。
1、由结构确定位置
请推导34号元素在周期表的具体位置并标出其符号。
方法一、原子结构示意图法。
a.周期序数=电子层数
b.主族序数=最外层电子数
方法二、利用稀有气体原子序数,通过加减判断。
第四周期第VIA族
2、由位置预测性质
元素名称 硒 元素符号 Se 原子序数 34 金属还是非金属? 原子结构示意图 最高正价 最低负价
常见中间价 气态氢化物化学式
最高价氧化物 最高价氧化物对应水化物
与硫酸酸性比较 与硫化氢稳定性比较
与S半径比较 与S非金属性比较
常温下状态
非金属
+6
-2
0、+4
H2Se
SeO3
H2SO4>H2SeO4
H2S>H2Se
H2SeO4
S<Se
S>Se
固体
(经验规律:看偏旁)
第四周期第VIA族
预测→验证→结论
一、元素“位置—结构—性质”之间的关系
原子结构
元素性质
元素在周期表中的位置
决定
反映
决定
同位置:化学性质相同
同主族:相似性和递变性
反映
决定
反映
半径、化合价、
金属性(非金属性)
同周期:递变性
原子序数=质子数
周期数=原子层数
主族序数=最外层电子数
价电子数→化合价
核电荷数、半径→金属性、非金属性
1.结构与位置的互推
工具:(1)电子层数=周期数。
(2)质子数=原子序数。
(3)主族元素原子最外层电子数=主族序数。
(4)主族元素的最高正价=族序数(氧、氟除外),最低负价=主族序数-8。
一、元素“位置—结构—性质”之间的关系
若已知A2+、B-、C+、D2-离子具有相同的核外电子排布,他们在周期表中的位置关系是?
1、X、Y、Z均是短周期元素,X、Y位于同一周期,X、Z的最低价离子分别为X2-和Z-,且Y+和Z-离子具有相同的电子层结构.下列说法正确的是( )
A. 原子最外层电子数:X>Y>Z
B. 对应气态氢化物的稳定性:X>Z
C. 离子半径:X2->Y+>Z-
D. 原子序数:X>Y>Z
D
X、Y、Z的位置是?
正确顺序?
如何比较?
正确顺序?
2.(2017·全国卷Ⅱ)a,b,c,d为原子序数依次增大的短周期主族元素,a原子核外电子总数与b原子次外层的电子数相同;c所在周期数与族数相同;d与a同族,下列叙述正确的是 ( )
A.原子半径:d>c>b>a
B.4种元素中b的金属性最强
C.c的氧化物的水化物是强碱
D.d单质的氧化性比a单质的氧化性强
B
四种元素分别是?
一般解题步骤:结构→位置→性质
正确顺序?
2.性质与位置的互推
(1)根据元素的性质可以推知元素在周期表中的位置:
若同周期元素A、B、C的金属性逐渐增强,则A、B、C在同周期中的从左到右的排列顺序为?
(2)根据元素在周期表中的位置关系可以推断元素的性质:
若同主族元素A、B、C在同一主族中从上往下排列,则可推知A、B、C的单质的氧化性依次减弱顺序为?
二、元素“位置—结构—性质”之间的关系
C、B、A
A、B、C
小试牛刀
3、运用元素周期律分析,下列推断中错误的是
已知Ra是第七周期第IIA族元素,故Ra(OH)2的碱性比Mg(OH)2的碱性强
已知As是第四周期第VA族元素,故AsH3的稳定性比NH3的稳定性弱
已知Cs是第六周期第IA族元素,原子半径比Na的原子半径大,故Cs与水反应比Na与水反应更剧烈
已知Cl的非金属性比S强,故HClO的酸性比H2SO3的强
D
4、四种短周期元素在周期表中的位置如图,
其中只有M为金属元素。下列说法不正确的是( )
A. Y的最高价氧化物对应水化物的酸性比X的弱
B. Z位于元素周期表中第二周期,第ⅥA族
C. X的气态氢化物的稳定性比Z的弱
D. M的原子半径比Y的原子半径大
A
分别是?
3.结构与性质的互推
(1)若某元素原子的最外层电子数小于4,则该元素原子在反应中容易 ;若某元素原子的最外层电子数大于4,则该元素原子在反应中容易 。
(2)若某元素原子在反应中容易得电子,则该元素原子的最外层电子数 ;若某元素原子在反应中容易失电子,则该元素原子的最外层电子数 。
二、元素“位置—结构—性质”之间的关系
失去电子
得到电子
>4
<4
5.W、X、Y、Z均是短周期主族元素,X、Y、Z处于同一周期,W、X、Z的简单离子具有相同的电子层结构,W的最高价氧化物对应的水化物与其气态氢化物能反应生成盐,X的氧化物既能溶于强酸又能溶于强碱,Y的最高正价与最低负价的代数和为0。下列说法正确的是 ( )
A.离子半径:W>X>Z B.原子半径:Z>X>Y
C.单质的熔点:W>Z>Y D.最高正价:Z>W>X
B
正确顺序?
如何比较?
正确顺序?
6、 几种短周期元素的原子半径及主要化合价如下表,下列叙述正确的是( )
A.X、Y 元素的金属性:X
C.W、Q 两种元素的气态氢化物的热稳定性:H2Q>H2W
D.X 的最高价氧化物对应的水化物的碱性弱于Y的
B
元素代号 X Y Z W Q
原子半径/pm 160 143 75 74 102
主要化合价 +2 +3 +5、-3 -2 +6、-2
分别是?
7.在新研制的超导材料中,铊(Tl)是主要组成元素之一。已知铊为第IIIA族原子序数最大的金属元素。则下列关于铊元素性质的推测中不正确的是 ( )
A.铊是易导电的银白色金属
B.Tl(OH)3与Al(OH)3相似,也是两性氢氧化物
C.铊可以形成氧化物Tl2O3
D.铊与酸反应比铝剧烈
E.Tl3+氧化性强于Al3+
BE
导入
二、寻找新材料
请将金属、非金属进行分区,并标出分界线附近元素
第n周期第n主族都是____第n周期含非金属元素种类= (除1、7周期外)
8-n
处于分界线附近的元素,有怎样的性质?
既能表现出金属性,又能表现出非金属性。
金属
元素周期表和元素周期律的应用
在金属与非金属元素分界线附近寻找半导体材料
位于金属和非金属分界线附近的元素,既能表现出一定的金属性,又能表现出一定非金属性
在F、Cl、S等元素附近区域进行研究,有利于制造出新品种的农药,如由含砷的有机物发展成对人畜毒性较低的含磷有机物
在过渡元素中寻找耐高温、耐腐蚀的合金元素以及制造催化剂的元素
Si、Ge、Ga
P As S Cl F
Fe Ni Pt Pd Rh
根据元素周期律推测
1.找元素之最
最活泼金属 、最活泼非金属 ;
最轻的金属 、最轻的非金属 ;
最稳定的气态氢化物 ,其中含H%最大的氢化物是 ;
最高价氧化物的水化物中,最强酸 、最强碱 ;地壳中含量最多的金属和非金属 ;
2.找半导体:
3.找农药:
4.找催化剂、耐高温、耐腐蚀材料:
Cs
F2
Li
H2
HF
CH4
HClO4
CsOH
Al 和O
在金属与非金属交界附近 Si Ge Ga
在磷附近 P As S Cl F
过渡元素 Fe Ni Pt Pd Rh
A B A B
①制半导体的元素 (a)F、Cl、Br、N、S“三角地带” ①
②制催化剂的元素 (b)金属与非金属元素分界线附近 ②
③制制冷剂的元素 (c)金属元素和非金属元素的分界线附近 ③
④制半导体的元素 (d)过渡元素 ④
元素周期表在指导科学研究和生产实践方面具有十分重要的意义,请将下表中A、B两栏描述的内容对应起来。
【知识迁移应用】
(b)
(d)
(a)
(c)
门捷列夫在研究元素周期表时,科学地预言了11种尚未发现的元素,为它们在周期表中留下了空位。例如,他认为在铝的下方有一个与铝类似的元素“类铝”,并预测了它的性质。1875年,法国化学家发现了这种元素,将它命名为镓。镓的性质与门捷列夫推测的一样。门捷列夫还预测在硅和锡之间存在一种元素——“类硅”,15年后该元素被德国化学家文克勒发现,为了纪念他的祖国,将其命名为“锗”。
预测 锗
相对原子质量 72 72.6
密度(g·cm-3) 5.5 5.32
氧化物 MO2 GeO2
氧化物的密度(g·cm-3) 4.7 4.72
氯化物 MCl4 GeCl4
氯化物的沸点(℃) <100 84
三、预测新元素
四
ⅣA
②③
Na
11钠
H
1氢
He
2氦
Li
3锂
Be
4铍
B
5硼
C
6碳
N
7氮
O
8氧
F
9氟
Ne
10氖
Mg
12镁
Al
13铝
Si
14硅
P
15磷
S
16硫
Cl
17氯
Ar
18氩
IA
IIA
IIIA
IVA
VA
VIA
VIIA
0
1
2
3
周期表左上右下对角元素性质相似
已知Be(OH)2性质与Al(OH)3相似。
写出Be(OH)2与HCl、NaOH反应的化学方程式
[2019·浙江温州选考模拟] X、Y、Z、W四种短周期元素在元素周期表中的相对位置如图所示,这四种元素原子的最外层电子数之和为20。下列判断正确的是 ( )
A.Z、X、Y形成的气态氢化物稳定性依次增强
B.四种元素形成的单质最多有6种
C.四种元素的原子半径:rZ>rY>rX>rW
D.四种元素中,X的氧化物对应的水化物酸性最强
W X Y
Z
A
小试牛刀
例:四种短周期主族元素X、Y、Z、W的原子序数依次增大,X最外层有6个电子,Y是至今发现的非金属性最强的元素,Z在周期表中处于周期序数等于族序数的位置,W的单质广泛用作半导体材料,下列叙述中正确的是
原子最外层电子数由多到少的顺序:Y、X、W、Z
原子半径由大到小的顺序,W、Z、Y、X
元素非金属性由强到弱的顺序:Z、W、X
简单气态氢化物的稳定性由强到弱的顺序:X、Y、W
tips
根据题干信息,判断未知元素
O
F
Al
Si
5.如图是部分短周期元素原子半径与原子序数的关系图。则下列说法正确的是( )
A.Z、N两种元素的离子半径相比,前者较大
B.N、P两种元素的气态氢化物的
稳定性相比,前者较稳定
C.由X与M两种元素组成的化合物
不能与任何酸反应,但能与强碱反应
D.Z的氧化物能分别溶解于Y的氢氧
化物和P的氢化物的水溶液中
D
6.如图为周期表中短周期的一部分。已知a原子的最外层电子数是电子总数的三分之一,下列说法中正确的是( )
A.a的最高价氧化物对应水化
物有两性
B.b与d组成的化合物不能与水反应
C.c的单质能与强碱反应生成两种盐
D.非金属性:c>d>b>a
C
4、某主族元素R的最高正化合价与负化合价的代数和为4,下列有关叙述正确的是
A、R一定是第四周期元素
B、R的气态氢化物分子式为H2R
C、R的气态氢化物比同周期其他元素的气态氢化物稳定
D、R的气态氢化物的水溶液显碱性
B
