化学人教版(2019)选择性必修1 3.1.2弱电解质的电离平衡(共19张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 3.1.2弱电解质的电离平衡(共19张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-23 19:32:23 | ||
图片预览



文档简介
(共19张PPT)
第2课时
弱电解质的电离平衡
1、认识弱电解质的电离平衡。
2、能运用电离平衡描述和解释化学现象,并预测可能的结果,树立对立统一、联系发展和动态平衡的观点。
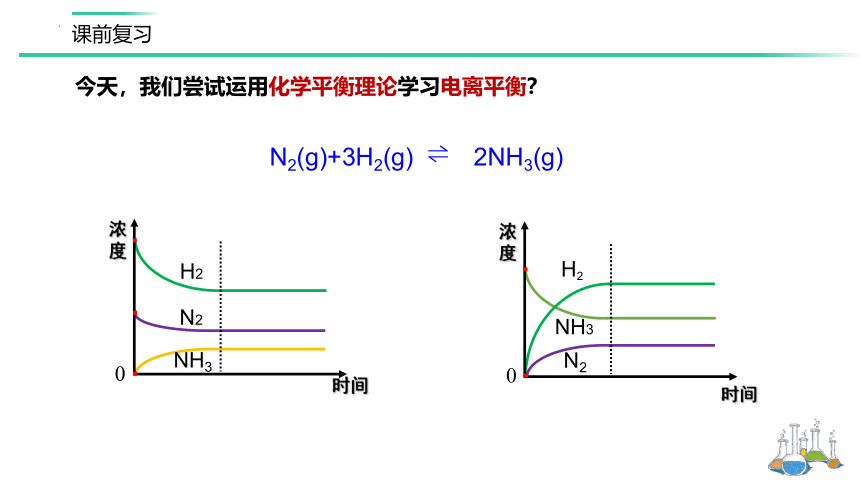
时间
浓度
0
NH3
H2
N2
时间
浓度
0
N2
H2
NH3
N2(g)+3H2(g) 2NH3(g)
今天,我们尝试运用化学平衡理论学习电离平衡?
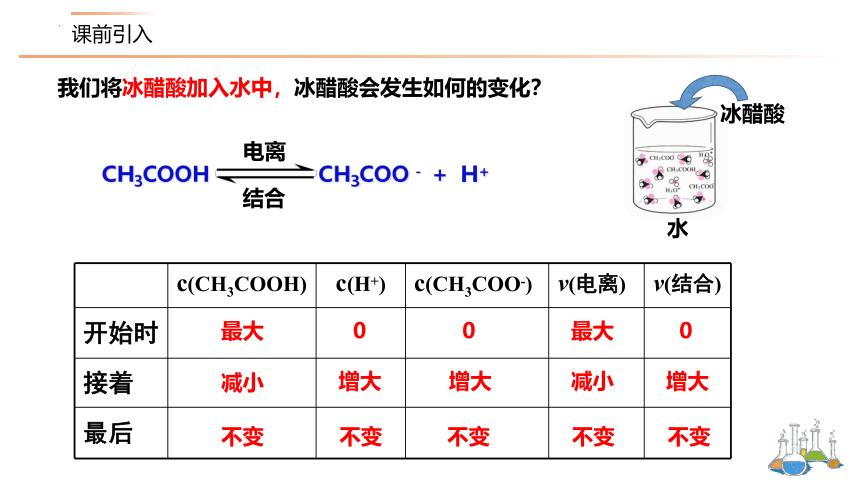
我们将冰醋酸加入水中,冰醋酸会发生如何的变化?
水
冰醋酸
c(CH3COOH) c(H+) c(CH3COO-) v(电离) v(结合)
开始时
接着
最后
0
0
最大
最大
0
增大
增大
减小
减小
增大
不变
不变
不变
不变
不变
CH3COOH CH3COO - + H+
电离
结合
v(电离)
v(结合)
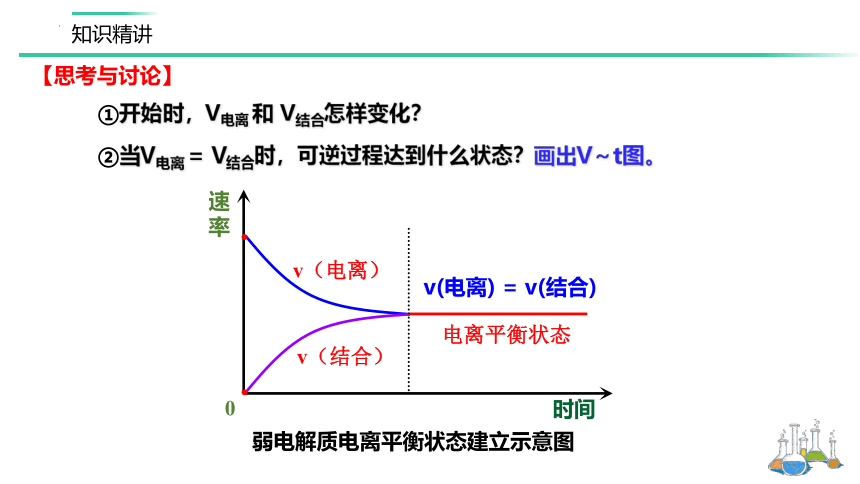
①开始时,V电离 和 V结合怎样变化?
②当V电离 = V结合时,可逆过程达到什么状态?画出V~t图。
【思考与讨论】
速率
弱电解质电离平衡状态建立示意图
时间
v(电离) = v(结合)
电离平衡状态
0
1、定义:在一定条件下,当弱电解质分子电离成离子的速率和离子重新结合生成分子的速率相等时,电离过程就达到了电离平衡状态。
一、电离平衡
2、电离平衡的特征
动:电离平衡是一种动态平衡
变:条件改变时,电离平衡发生移动
等:V电离 = V结合≠0
逆:弱电解质的电离是可逆过程
定:平衡时分子、离子的浓度不再变化
平衡移动规律—勒夏特列原理
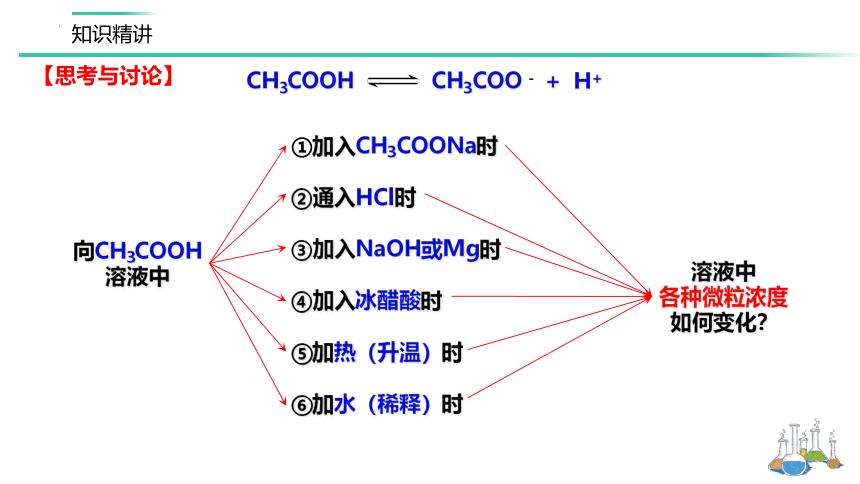
【思考与讨论】
①加入CH3COONa时
②通入HCl时
③加入NaOH或Mg时
④加入冰醋酸时
⑤加热(升温)时
⑥加水(稀释)时
CH3COOH CH3COO - + H+
向CH3COOH
溶液中
溶液中
各种微粒浓度
如何变化?
1、本身性质——越弱越难电离。
2、外界条件:
①浓度
②温度——越热越电离
③稀释——越稀越电离
二、电离平衡的影响因素
a增加电解质本身,平衡正向移动。
b减小电解质本身,平衡逆向移动。
d减小离子浓度,平衡正向移动。
c增大离子浓度,平衡逆向移动。
电离程度增大
电离程度减小
小孩大哭过后,容易出现抽抽搭搭,停不下来、喘不上气,或者手脚僵硬等症状。
已知人体血液中存在如下平衡:
人体血液的pH需维持在7.35~7.45。当pH<7.35会导致酸中毒,pH大于7.45会导致碱中毒。
H2O + CO2 H2CO3H+ +
你知道吗?
小孩大哭后出现的生理症状,与上述平衡相关,是随着哭泣,呼出大量CO2,平衡状态改变后,发生了轻微碱中毒。
如何缓解呢?
pH
时间/s
0
50
100
150
1
2
3
4
盐酸和醋酸稀释过程中溶液的pH随时间的变化示意图
同时将0.1mol/L盐酸和醋酸中溶质的浓度稀释到原浓度的1/10,稀释过程中溶液的pH随时间的变化
a
b
【思考与讨论】
1、哪条曲线代表盐酸(或醋酸)稀释过程中溶液的pH变化?你的理由是什么?
2、分别将0.1mol/L盐酸和醋酸中溶质的浓度稀释到原浓度的1/10,二者的pH各变化了多少?为什么?
3、你对该实验中两种溶液pH的变化还能提出其他问题吗?
【思考与讨论】
改变条件 平衡移动方向 n(OH-) c(OH-) c(NH4+) c(NH3 H2O) 电离 程度 导电
能力
加水稀释
通入NH3
通HCl(g)
加NaOH(s)
加入NH4Cl(s)
加入镁粉
升高温度
减小
增大
增大
增大
增大
向右
增强
减小
增大
减小
减小
增大
向右
减弱
减小
增大
增大
增大
增大
向右
增强
减小
减小
增大
增大
增大
向左
增强
减小
减小
减小
增大
增大
向右
增强
减小
减小
增大
增大
减小
向左
增强
向右
增大
减小
减小
减小
增大
增强
分析改变下列条件对氨水电离平衡 的影响
NH3 H2O NH4 + + OH-
弱电解质的电离平衡
练习1、0.1 mol·L-1CH3COOH溶液中存在电离平衡:CH3COOH H++ CH3COO- 。加水稀释或加入少量CH3COONa晶体时,都会引起( )
A、溶液的酸性减弱
B、CH3COOH电离程度变大
C、溶液的导电能力减弱
D、溶液中c(CH3COO-)减小
E、溶液中醋酸分子减少
A
练习2、化合物HIn在水溶液中存在以下电离平衡,故可作酸碱指示剂
HIn(aq) H+(aq) +In-(aq)
(红色) (黄色)
现把下列物质溶于水配成0.02 mol·L-1的水溶液,其中能使指示剂显黄色的是( )
①HCl ②SO2 ③NaCl ④NaHSO4 ⑤氨气 ⑥Na2O2 ⑦Na2CO3
A.①②④ B.①④ C.⑤⑥⑦ D.⑤⑦
D
练习3、将0.l mol·L-1醋酸溶液加水稀释,下列说法正确的是( )
A.溶液中c(H+)和c(OH-)都减小
B.溶液中c(H+)增大
C.醋酸电离平衡向左移动
D.溶液的pH增大
D
练习4、已知①氢硫酸是二元弱酸,②CuSO4+H2S=CuS↓+H2SO4。在氢硫酸溶液中,通入或加入少量的下列物质:① O2、② Cl2、③ SO2、④ CuSO4能使溶液中的c(H+)增大的是( )
A.①② B.②④ C.②③④ D.①
B
第2课时
弱电解质的电离平衡
1、认识弱电解质的电离平衡。
2、能运用电离平衡描述和解释化学现象,并预测可能的结果,树立对立统一、联系发展和动态平衡的观点。
时间
浓度
0
NH3
H2
N2
时间
浓度
0
N2
H2
NH3
N2(g)+3H2(g) 2NH3(g)
今天,我们尝试运用化学平衡理论学习电离平衡?
我们将冰醋酸加入水中,冰醋酸会发生如何的变化?
水
冰醋酸
c(CH3COOH) c(H+) c(CH3COO-) v(电离) v(结合)
开始时
接着
最后
0
0
最大
最大
0
增大
增大
减小
减小
增大
不变
不变
不变
不变
不变
CH3COOH CH3COO - + H+
电离
结合
v(电离)
v(结合)
①开始时,V电离 和 V结合怎样变化?
②当V电离 = V结合时,可逆过程达到什么状态?画出V~t图。
【思考与讨论】
速率
弱电解质电离平衡状态建立示意图
时间
v(电离) = v(结合)
电离平衡状态
0
1、定义:在一定条件下,当弱电解质分子电离成离子的速率和离子重新结合生成分子的速率相等时,电离过程就达到了电离平衡状态。
一、电离平衡
2、电离平衡的特征
动:电离平衡是一种动态平衡
变:条件改变时,电离平衡发生移动
等:V电离 = V结合≠0
逆:弱电解质的电离是可逆过程
定:平衡时分子、离子的浓度不再变化
平衡移动规律—勒夏特列原理
【思考与讨论】
①加入CH3COONa时
②通入HCl时
③加入NaOH或Mg时
④加入冰醋酸时
⑤加热(升温)时
⑥加水(稀释)时
CH3COOH CH3COO - + H+
向CH3COOH
溶液中
溶液中
各种微粒浓度
如何变化?
1、本身性质——越弱越难电离。
2、外界条件:
①浓度
②温度——越热越电离
③稀释——越稀越电离
二、电离平衡的影响因素
a增加电解质本身,平衡正向移动。
b减小电解质本身,平衡逆向移动。
d减小离子浓度,平衡正向移动。
c增大离子浓度,平衡逆向移动。
电离程度增大
电离程度减小
小孩大哭过后,容易出现抽抽搭搭,停不下来、喘不上气,或者手脚僵硬等症状。
已知人体血液中存在如下平衡:
人体血液的pH需维持在7.35~7.45。当pH<7.35会导致酸中毒,pH大于7.45会导致碱中毒。
H2O + CO2 H2CO3H+ +
你知道吗?
小孩大哭后出现的生理症状,与上述平衡相关,是随着哭泣,呼出大量CO2,平衡状态改变后,发生了轻微碱中毒。
如何缓解呢?
pH
时间/s
0
50
100
150
1
2
3
4
盐酸和醋酸稀释过程中溶液的pH随时间的变化示意图
同时将0.1mol/L盐酸和醋酸中溶质的浓度稀释到原浓度的1/10,稀释过程中溶液的pH随时间的变化
a
b
【思考与讨论】
1、哪条曲线代表盐酸(或醋酸)稀释过程中溶液的pH变化?你的理由是什么?
2、分别将0.1mol/L盐酸和醋酸中溶质的浓度稀释到原浓度的1/10,二者的pH各变化了多少?为什么?
3、你对该实验中两种溶液pH的变化还能提出其他问题吗?
【思考与讨论】
改变条件 平衡移动方向 n(OH-) c(OH-) c(NH4+) c(NH3 H2O) 电离 程度 导电
能力
加水稀释
通入NH3
通HCl(g)
加NaOH(s)
加入NH4Cl(s)
加入镁粉
升高温度
减小
增大
增大
增大
增大
向右
增强
减小
增大
减小
减小
增大
向右
减弱
减小
增大
增大
增大
增大
向右
增强
减小
减小
增大
增大
增大
向左
增强
减小
减小
减小
增大
增大
向右
增强
减小
减小
增大
增大
减小
向左
增强
向右
增大
减小
减小
减小
增大
增强
分析改变下列条件对氨水电离平衡 的影响
NH3 H2O NH4 + + OH-
弱电解质的电离平衡
练习1、0.1 mol·L-1CH3COOH溶液中存在电离平衡:CH3COOH H++ CH3COO- 。加水稀释或加入少量CH3COONa晶体时,都会引起( )
A、溶液的酸性减弱
B、CH3COOH电离程度变大
C、溶液的导电能力减弱
D、溶液中c(CH3COO-)减小
E、溶液中醋酸分子减少
A
练习2、化合物HIn在水溶液中存在以下电离平衡,故可作酸碱指示剂
HIn(aq) H+(aq) +In-(aq)
(红色) (黄色)
现把下列物质溶于水配成0.02 mol·L-1的水溶液,其中能使指示剂显黄色的是( )
①HCl ②SO2 ③NaCl ④NaHSO4 ⑤氨气 ⑥Na2O2 ⑦Na2CO3
A.①②④ B.①④ C.⑤⑥⑦ D.⑤⑦
D
练习3、将0.l mol·L-1醋酸溶液加水稀释,下列说法正确的是( )
A.溶液中c(H+)和c(OH-)都减小
B.溶液中c(H+)增大
C.醋酸电离平衡向左移动
D.溶液的pH增大
D
练习4、已知①氢硫酸是二元弱酸,②CuSO4+H2S=CuS↓+H2SO4。在氢硫酸溶液中,通入或加入少量的下列物质:① O2、② Cl2、③ SO2、④ CuSO4能使溶液中的c(H+)增大的是( )
A.①② B.②④ C.②③④ D.①
B
