课题1 质量守恒定律(第一课时)
文档属性
| 名称 | 课题1 质量守恒定律(第一课时) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2013-12-17 00:00:00 | ||
图片预览







文档简介
课件34张PPT。 1、化学反应的实质是什么? 2、怎样判断化学反应已经发生?化学反应的实质:
被破坏 重新组合 聚集成
分子-→原子--→新分子-→新物质
变成 形成 化学变化发生时,一定有新物质生成,还会伴随着能量的释放或吸收,有时还 会发生颜色变化、或生成沉淀、产生气
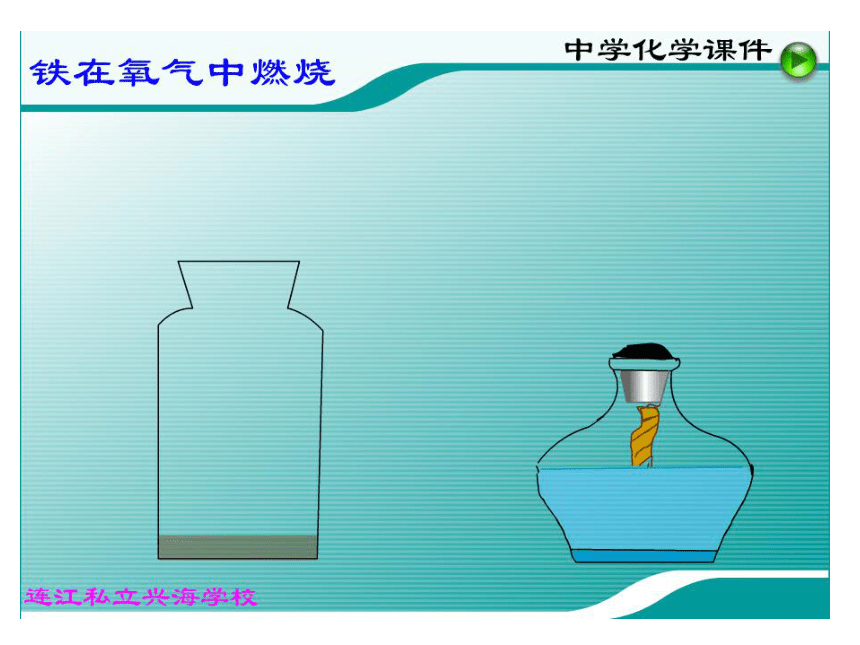
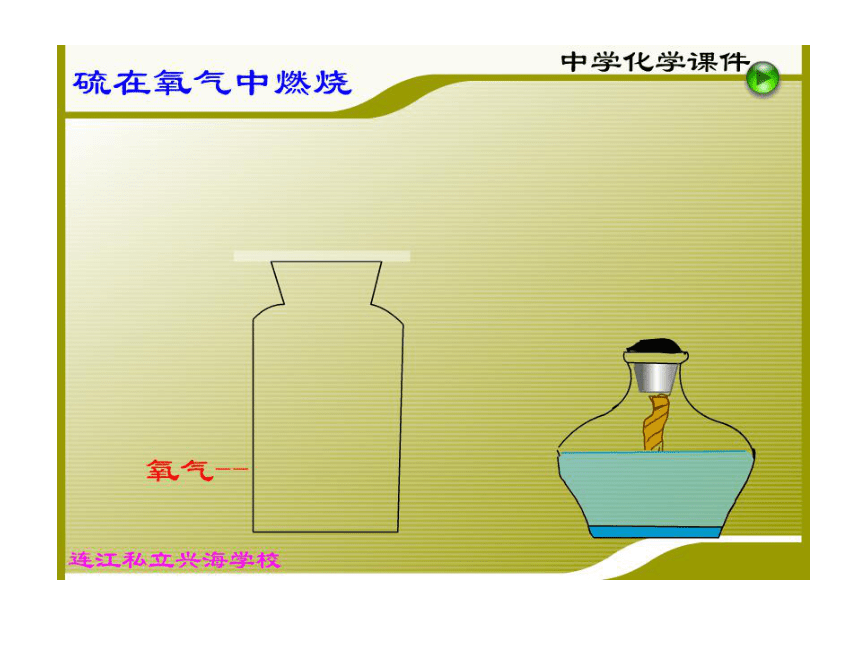
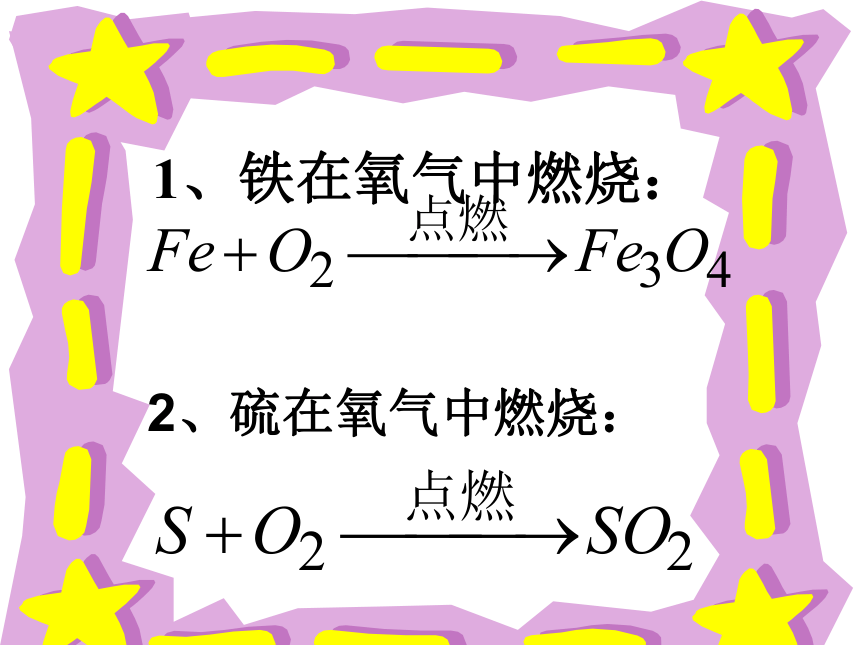
体等现象。 想一想 下面是什么物质发生的化学变化?你会写它们发生化学变化的表达式吗? 1、铁在氧气中燃烧:2、硫在氧气中燃烧:你猜得着吗? 物质发生化学变化前后,总质量是增加、减小、还是不变?第五单元 化学方程式
课题1 质量守恒定律猜想:1、反应后物质的总质量会变小
2、反应后物质的总质量会变大
3、反应后物质的总质量可能不变4、反应后物质的总质量在某些反应可能增加,在某些反应中可能减少,而在某些反应中可能不变演示实验1:白磷燃烧前后质量的测定:(1)在锥形瓶中放一小块白磷
(2)称量锥形瓶内物质的总质量
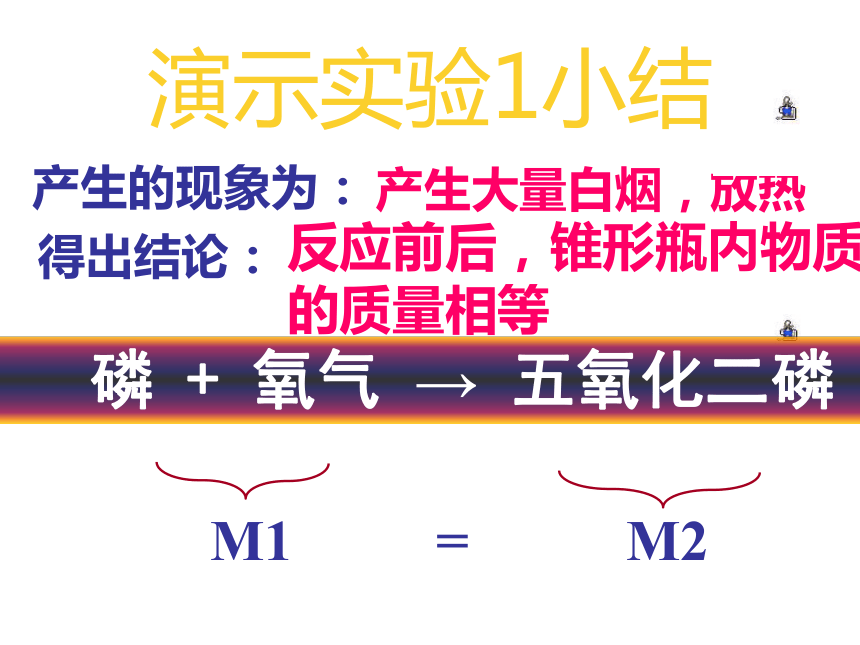
(3)点燃白磷,观察产生的现象 (4)冷却后称量锥形瓶内物质的总质量演示实验1小结 M1 = M2产生的现象为:得出结论:
产生大量白烟,放热反应前后,锥形瓶内物质
的质量相等 磷 + 氧气 → 五氧化二磷分组实验1、铁钉与硫酸铜溶液的反应
2、盐酸与碳酸钠粉末的反应
3、镁条的燃烧
4、二氧化碳通入澄清石灰水
5、氯化钠与水的反应演示实验2:蜡烛燃烧前后质量测定演示实验2小结在开放容器中 M1 > M2石蜡+氧气 → 水 +二氧化碳讨论 如何证明石蜡和氧气反应前后物质的总质量相等呢?请想一想? 在实验中,石蜡和氧气反应前后物质的总质量为什么不相等呢?演示实验3:蜡烛在密闭容器内燃烧
前后质量测定演示实验3小结石蜡+氧气 → 水 +二氧化碳在密闭容器中 M1 = M2
演示实验4:盐酸与碳酸钙的反应演示实验4小结 M1 > M2
有盖时(密闭容器内) M1 = M2
观察到的现象:产生无色气泡。碳酸钙+盐酸→氯化钙+二氧化碳+水无盖时(开放容器内)碳酸钙+盐酸→氯化钙+二氧化碳+水质量守恒定律参加反应的
各物质的质
量总 和生成的各物质的质量
总和参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。理解质量守恒定律的定义时要注意: 1.质量守恒定律的“守恒”指的是质量守恒,其它方面如体积等不一定守恒。2.是指“参加反应的各物质”,的质量总和,没有参加反应的物质不包括在内3. “生成的各物质的质量总和”,应当包括生成的各种物质,如沉淀、气体等。4.“反应生成的物质”仅指该反应过程中新生成的物质质量,在反应之前已经存在的质量无关。
练一练判断对错:
1.因为“质量守恒”所以煤燃烧后产生的煤渣的质量一定和所用煤的质量相等 ( )×2.H2和O2形成混合物的质量等于其反应后生成水的质量 ( )×二、试用分子、原子的观点解释质量守恒的原因。
想一想:原子数目没有增减原子种类没有改变原子质量没有变化化学反应前后质量守恒的原因元素种类变了吗?元素质量变了吗?分子数目变了吗?化学反应前后物质种类呢?分子种类呢?动动脑不变改变可能改变原子数目原子质量原子种类元素质量元素种类物质的种类分子的种类可能
改变分子数目 质量守恒定律适用于一切化学反应1. 进行有关的计算
2. 推测一些物质的组成
3. 解释一些实验事实可运用定律:2、 将24.5 g氯酸钾加热至完全分解,得到固体质量14.9 g,则产生气体____g。
3、加热10 g氯酸钾和二氧化锰的混合物,反应后称得残留物的质量总和为9.52 g,则生成氧气的质量为 g三.质量守恒定律的简单应用.
1、反应A+B=C+D中,已知2 g A和5 gB参加了反应,生成了4 g C,则有____g D生成。 39.6
0.485、在化学反应2XY2+Y2=2Z中Z的化学式为( )
A、X2Y3 B、XY3
C、X2Y6 D、 X2Y4 4、已知石蜡是蜡烛的主要成分,蜡烛在空气中完全燃烧后的产物是CO2和H2O,判断石蜡中一定含有_______元素,可能含有___元素
C、HOB作业:
1、课后复习本节内容深入理解质量守恒定律。2、完成课本P98页习题1、2、3
3、预习课题一的第二部分 化学方程式
再见一分辛劳 一分收获
有志者 事竟成
祝你取得成功!
被破坏 重新组合 聚集成
分子-→原子--→新分子-→新物质
变成 形成 化学变化发生时,一定有新物质生成,还会伴随着能量的释放或吸收,有时还 会发生颜色变化、或生成沉淀、产生气
体等现象。 想一想 下面是什么物质发生的化学变化?你会写它们发生化学变化的表达式吗? 1、铁在氧气中燃烧:2、硫在氧气中燃烧:你猜得着吗? 物质发生化学变化前后,总质量是增加、减小、还是不变?第五单元 化学方程式
课题1 质量守恒定律猜想:1、反应后物质的总质量会变小
2、反应后物质的总质量会变大
3、反应后物质的总质量可能不变4、反应后物质的总质量在某些反应可能增加,在某些反应中可能减少,而在某些反应中可能不变演示实验1:白磷燃烧前后质量的测定:(1)在锥形瓶中放一小块白磷
(2)称量锥形瓶内物质的总质量
(3)点燃白磷,观察产生的现象 (4)冷却后称量锥形瓶内物质的总质量演示实验1小结 M1 = M2产生的现象为:得出结论:
产生大量白烟,放热反应前后,锥形瓶内物质
的质量相等 磷 + 氧气 → 五氧化二磷分组实验1、铁钉与硫酸铜溶液的反应
2、盐酸与碳酸钠粉末的反应
3、镁条的燃烧
4、二氧化碳通入澄清石灰水
5、氯化钠与水的反应演示实验2:蜡烛燃烧前后质量测定演示实验2小结在开放容器中 M1 > M2石蜡+氧气 → 水 +二氧化碳讨论 如何证明石蜡和氧气反应前后物质的总质量相等呢?请想一想? 在实验中,石蜡和氧气反应前后物质的总质量为什么不相等呢?演示实验3:蜡烛在密闭容器内燃烧
前后质量测定演示实验3小结石蜡+氧气 → 水 +二氧化碳在密闭容器中 M1 = M2
演示实验4:盐酸与碳酸钙的反应演示实验4小结 M1 > M2
有盖时(密闭容器内) M1 = M2
观察到的现象:产生无色气泡。碳酸钙+盐酸→氯化钙+二氧化碳+水无盖时(开放容器内)碳酸钙+盐酸→氯化钙+二氧化碳+水质量守恒定律参加反应的
各物质的质
量总 和生成的各物质的质量
总和参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。理解质量守恒定律的定义时要注意: 1.质量守恒定律的“守恒”指的是质量守恒,其它方面如体积等不一定守恒。2.是指“参加反应的各物质”,的质量总和,没有参加反应的物质不包括在内3. “生成的各物质的质量总和”,应当包括生成的各种物质,如沉淀、气体等。4.“反应生成的物质”仅指该反应过程中新生成的物质质量,在反应之前已经存在的质量无关。
练一练判断对错:
1.因为“质量守恒”所以煤燃烧后产生的煤渣的质量一定和所用煤的质量相等 ( )×2.H2和O2形成混合物的质量等于其反应后生成水的质量 ( )×二、试用分子、原子的观点解释质量守恒的原因。
想一想:原子数目没有增减原子种类没有改变原子质量没有变化化学反应前后质量守恒的原因元素种类变了吗?元素质量变了吗?分子数目变了吗?化学反应前后物质种类呢?分子种类呢?动动脑不变改变可能改变原子数目原子质量原子种类元素质量元素种类物质的种类分子的种类可能
改变分子数目 质量守恒定律适用于一切化学反应1. 进行有关的计算
2. 推测一些物质的组成
3. 解释一些实验事实可运用定律:2、 将24.5 g氯酸钾加热至完全分解,得到固体质量14.9 g,则产生气体____g。
3、加热10 g氯酸钾和二氧化锰的混合物,反应后称得残留物的质量总和为9.52 g,则生成氧气的质量为 g三.质量守恒定律的简单应用.
1、反应A+B=C+D中,已知2 g A和5 gB参加了反应,生成了4 g C,则有____g D生成。 39.6
0.485、在化学反应2XY2+Y2=2Z中Z的化学式为( )
A、X2Y3 B、XY3
C、X2Y6 D、 X2Y4 4、已知石蜡是蜡烛的主要成分,蜡烛在空气中完全燃烧后的产物是CO2和H2O,判断石蜡中一定含有_______元素,可能含有___元素
C、HOB作业:
1、课后复习本节内容深入理解质量守恒定律。2、完成课本P98页习题1、2、3
3、预习课题一的第二部分 化学方程式
再见一分辛劳 一分收获
有志者 事竟成
祝你取得成功!
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
