化学人教版2019必修第一册4.2.1 元素周期律(共31张ppt)
文档属性
| 名称 | 化学人教版2019必修第一册4.2.1 元素周期律(共31张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 7.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-24 08:25:28 | ||
图片预览




文档简介
(共31张PPT)
第四章
物质结构 元素周期律
思维课堂
第二节 元素周期律
课时1 元素性质的周期性变化规律
学习目标
1. 结合有关数据和实验事实,认识原子核外电子排布、原子半径、主要化合价等随元素原子序数递增而呈现周期性变化的规律。
2. 以第三周期元素为例,认识同周期元素的金属性、非金属性随元素原子序数递增而呈现周期性变化的规律,构建元素周期律。
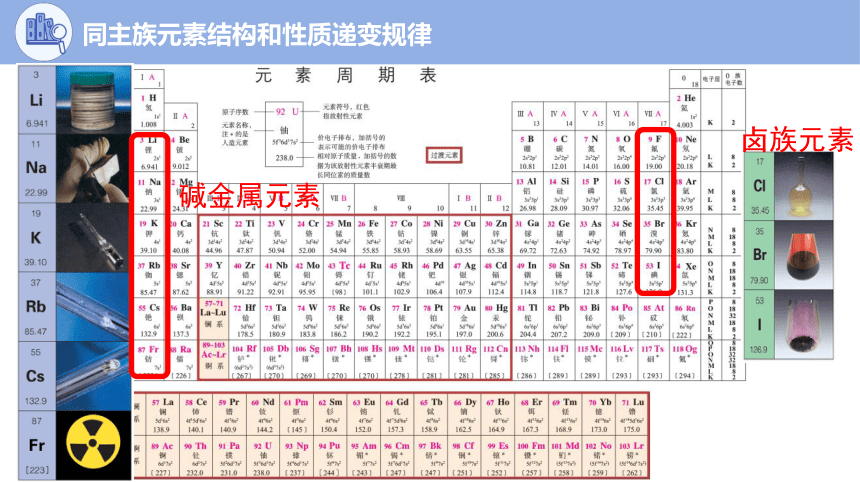
碱金属元素
卤族元素
同主族元素结构和性质递变规律
金属性(碱金属)
逐渐增大
逐渐增强
逐渐增强
逐渐增强
逐渐增强
Li
Na
K
Rb
Cs
碱金属
原子
半径
原子失电
子能力
单质的
还原性
置换氢
的能力
氢氧化物
的碱性
离子的
氧化性
逐渐减弱
同主族元素结构和性质递变规律
非金属性(卤素)
逐渐增大
逐渐减弱
逐渐减弱
逐渐减弱
逐渐减弱
卤素
原子
半径
原子得电
子能力
单质的
氧化性
结合氢
的能力
最高价氧化物对
应水化物的酸性
F
Cl
Br
I
离子的
还原性
逐渐增强
HX
酸性
逐渐增强
同一周期元素的性质又有什么变化规律?
17
9
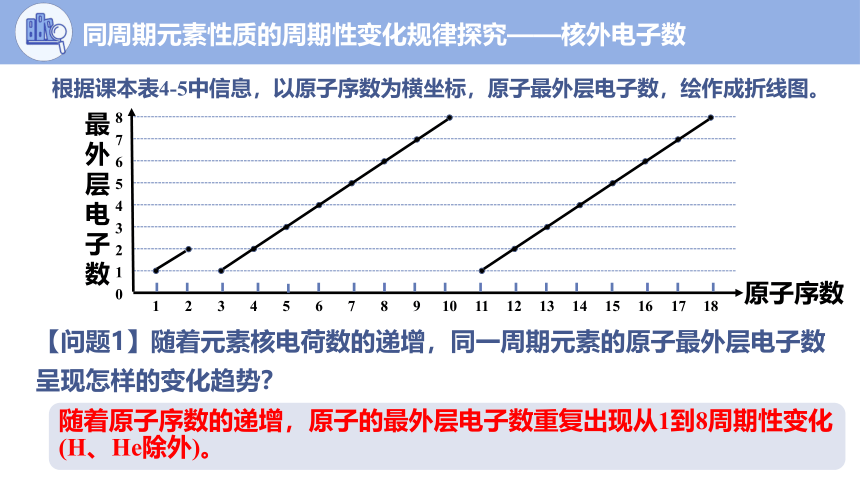
根据课本表4-5中信息,以原子序数为横坐标,原子最外层电子数,绘作成折线图。
7
8
6
4
5
3
1
2
0
最外层电子数
原子序数
1
2
3
4
5
6
7
8
10
11
12
13
14
15
16
18
随着原子序数的递增,原子的最外层电子数重复出现从1到8周期性变化(H、He除外)。
【问题1】随着元素核电荷数的递增,同一周期元素的原子最外层电子数呈现怎样的变化趋势?
同周期元素性质的周期性变化规律探究——核外电子数
7
8
6
4
5
3
1
2
0
+6
+7
+5
+3
+4
+2
0
+1
1
3
2
4
最外层电子数
化合价
原子序数
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
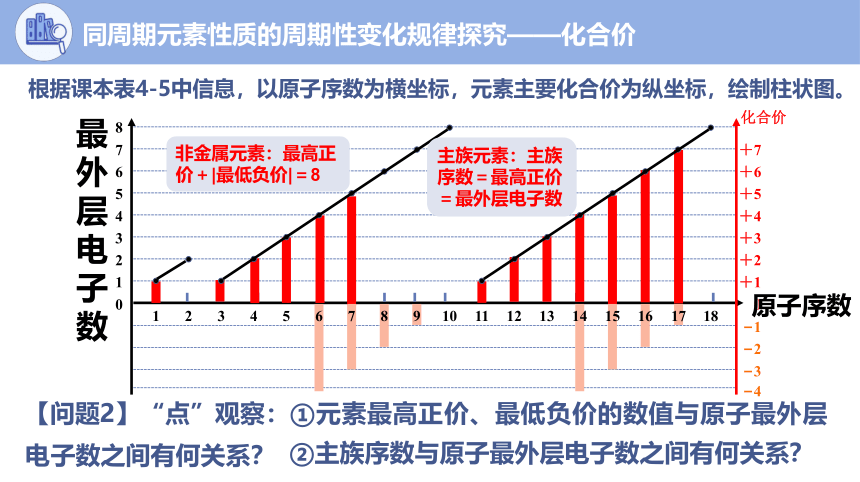
非金属元素:最高正价+|最低负价|=8
【问题2】“点”观察:①元素最高正价、最低负价的数值与原子最外层电子数之间有何关系?
②主族序数与原子最外层电子数之间有何关系?
主族元素:主族序数=最高正价=最外层电子数
根据课本表4-5中信息,以原子序数为横坐标,元素主要化合价为纵坐标,绘制柱状图。
同周期元素性质的周期性变化规律探究——化合价
7
8
6
4
5
3
1
2
0
+6
+7
+5
+3
+4
+2
0
+1
1
3
2
4
最外层电子数
化合价
原子序数
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
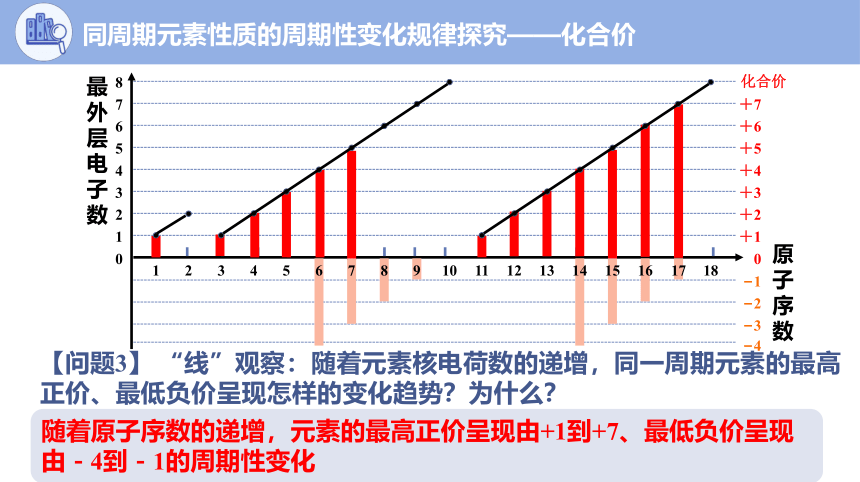
【问题3】 “线”观察:随着元素核电荷数的递增,同一周期元素的最高正价、最低负价呈现怎样的变化趋势?为什么?
随着原子序数的递增,元素的最高正价呈现由+1到+7、最低负价呈现由-4到-1的周期性变化
同周期元素性质的周期性变化规律探究——化合价
7
8
6
4
5
3
1
2
0
+6
+7
+5
+3
+4
+2
0
+1
1
3
2
4
最外层电子数
化合价
原子序数
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
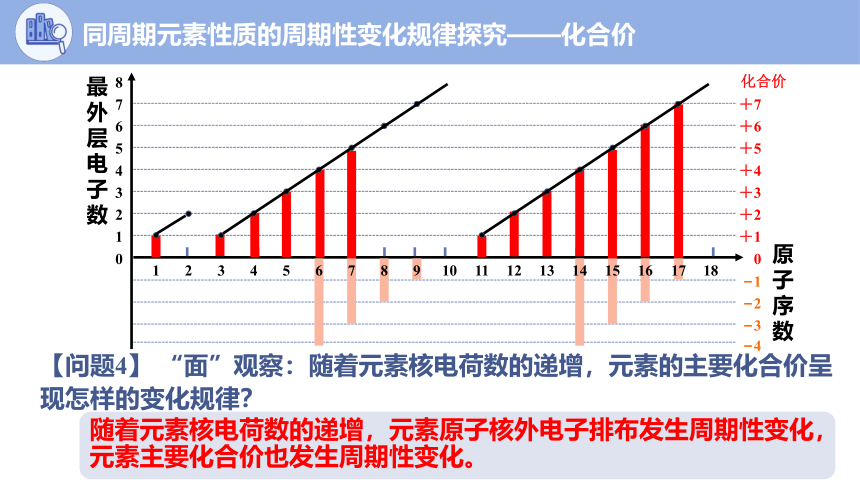
【问题4】 “面”观察:随着元素核电荷数的递增,元素的主要化合价呈现怎样的变化规律?
随着元素核电荷数的递增,元素原子核外电子排布发生周期性变化,元素主要化合价也发生周期性变化。
同周期元素性质的周期性变化规律探究——化合价
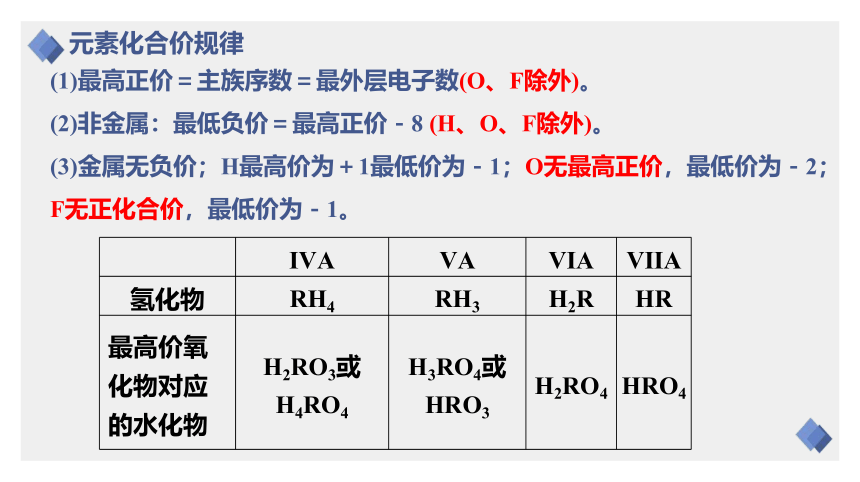
(1)最高正价=主族序数=最外层电子数(O、F除外)。
(2)非金属:最低负价=最高正价-8 (H、O、F除外)。
(3)金属无负价;H最高价为+1最低价为-1;O无最高正价,最低价为-2;F无正化合价,最低价为-1。
ⅣA ⅤA ⅥA ⅦA
氢化物 RH4 RH3 H2R HR
最高价氧化物对应的水化物 H2RO3或H4RO4 H3RO4或HRO3 H2RO4 HRO4
元素化合价规律
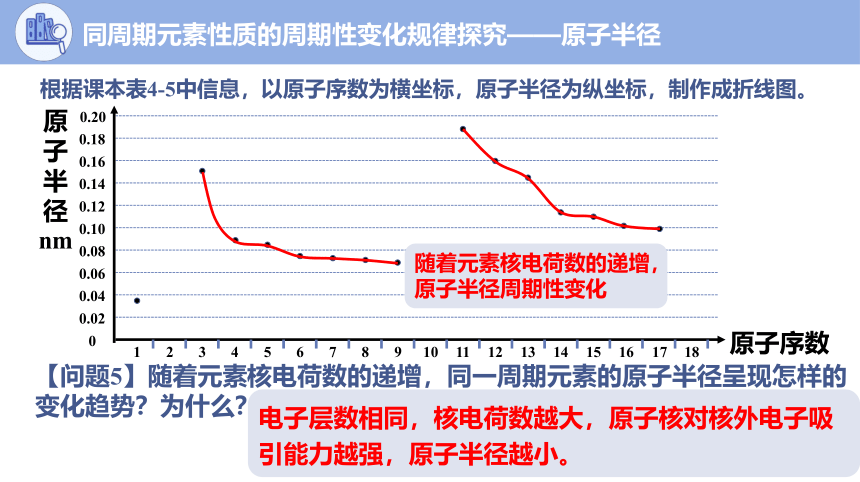
根据课本表4-5中信息,以原子序数为横坐标,原子半径为纵坐标,制作成折线图。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
0.18
0.20
0.16
0.12
0.14
0.10
0.06
0.08
0.04
原子半径
nm
0.02
0
原子序数
【问题5】随着元素核电荷数的递增,同一周期元素的原子半径呈现怎样的变化趋势?为什么?
电子层数相同,核电荷数越大,原子核对核外电子吸引能力越强,原子半径越小。
同周期元素性质的周期性变化规律探究——原子半径
随着元素核电荷数的递增,原子半径周期性变化
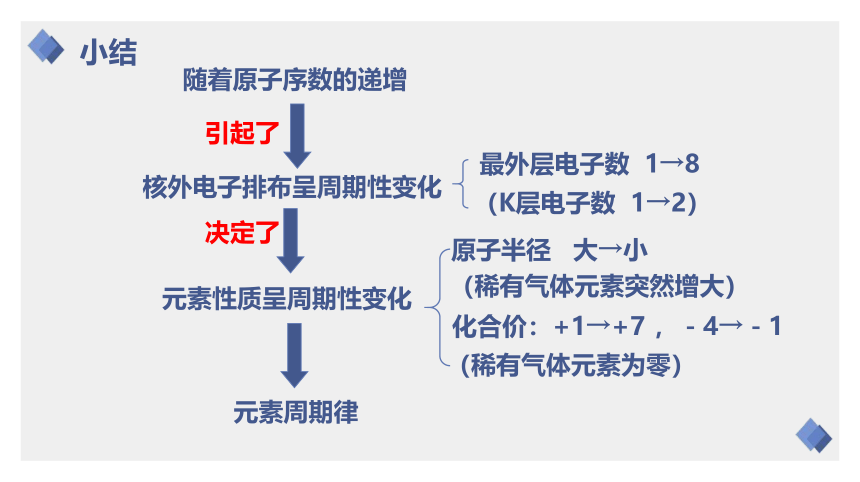
随着原子序数的递增
核外电子排布呈周期性变化
元素性质呈周期性变化
决定了
最外层电子数 1→8
(K层电子数 1→2)
原子半径 大→小
(稀有气体元素突然增大)
化合价:+1→+7 ,-4→-1
(稀有气体元素为零)
引起了
元素周期律
小结
1. 判断正误:
(1)第二周期元素从左至右,最高正价从+1递增到+7( )
(2)原子半径最小的元素是氢元素( )
(3)同周期元素最外层电子数都是从1递增到8( )
(4)氢元素除了有+1价外,也可以有 1价,如NaH( )
×
√
×
√
2. 下图表示1~18号元素原子结构或性质随核电荷数递增的变化。
该图中纵坐标表示( )
A.电子层数 B.最外层电子数
C.最高化合价 D.原子半径
B
(1)电子层数相同时,质子数越多,吸引力越大, 原子半径越小。
Na >Mg>Al>Si
(2)最外层电子数相同的原子(或离子),电子层越多,原子半径(离子半径)越大。
Cs>Rb>K>Na>Li>H
(3)核外电子排布相同(或电子层结构相同)的单核微粒,核电荷数越多,半径越小。
O2->F->Na+>Mg2+
(4)核电荷数相同的单核微粒,价态越高半径越小。
Cl->Cl
比较 Na 、Mg、Al、Si的原子半径大小?
比较Cs、Rb、K、Na、Li、H原子半径?
比较O2-、F-、Na+、Mg2+原子半径?
比较Cl-、Cl 原子半径?
提升:粒子半径大小比较
①电子层数
②核电荷数
微粒半径的比较
思考:粒子半径受哪些因素制约?
①电子层数:
电子层数越多,原子半径越大
原子半径的变化规律
同周期: 从左→右,原子半径逐渐减小
同主族: 从上→下,原子半径逐渐增大
②核电荷数:
当电子层数相同时,核电荷数越大,半径越小
(序大径小)
③核外电子数:
当电子层数和核电荷数相同时,
核外电子数越多,半径越大。
注意:第二周期的Li比第三周期的S、Cl等原子半径大。
小结
(1)r(F) r(Cl)
(4)r(Cl-) r(S2-)
(2)r(Cl) r( S) r( P)
(3)r(Al3+) r(Mg2+) r(Na+) r(F-) r(O2-)
<
<
<
<
<
<
<
<
1. 比较下列微粒半径的大小
2. (双选)下列元素的原子半径依次减小的是( )
A. Na、Mg、Al B. N、O、F
C. P、Si、Al D. C、Si、P
AB
3. (双选)下列粒子半径大小的比较中,正确的是( )
A.Na+Cl->Na+>Al3+
C.NaRb>K>Na
BD
4. 下列各组微粒半径大小比较中,不正确的是( )
A. r(K)>r(Na)>r(Li) B. r(Mg2+)>r(Na+)>r(F-)
C. r( Na+)>r(Mg2+)>r(Al3+) D. r(Cl-)>r(F-)>r(F)
B
根据第三周期元素原子的核外电子排布,请你预测该周期元素金属性和非金属性的变化?
Na Mg Al Si P S Cl
电子层数相同,核电荷数增大,
失电子能力减弱,得电子能力增强
原子半径逐渐减小
元素的金属性逐渐减弱,非金属性逐渐增强
原子核对最外层电子的引力逐渐增强
结构
性质
决定
性质预测
金属性强弱比较方法:
(1)单质与水反应
的难易程度
(2)单质与酸反应
的剧烈程度
(3)最高价氧化物
对应水化物的
碱性强弱
(4)金属单质间的
置换反应
1.实验方案
2.评价方案
(1)将大小相同金属钠、镁条分别放入滴有酚酞的水中
(2)将大小相同的镁条、铝条打磨后放入试管,分别加入等体积盐酸
(3)将大小相同金属钠、镁条、
铝条分别放入滴有酚酞的水中
(4)将大小相同金属钠、镁条、铝条分别放入等浓度等体积的盐酸里
三种元素
一起比较
实验设计
取局部
两两比较
证据组合
Na>Mg>Al
金属单质与水(或酸)反应置换出氢的难易程度
判断元素金属性强弱的依据
寻找证据
比较钠、镁单质与水反应的难易程度
比较镁、铝单质与盐酸反应置换出氢气的难易程度
寻找证据
判断元素金属性强弱的依据
金属元素最高价氧化物对应的水化物——氢氧化物的碱性强弱。
寻找证据
比较Mg(OH)2和Al(OH)3的碱性强弱
【获取信息】
Al(OH)3在酸或强碱溶液中都可以溶解,表明它既能与酸反应,又能与强碱溶液反应。反应如下:
Al(OH)3 + 3H+ = Al3+ + 3H2O
Al(OH)3 + OH- = AlO2- + 2H2O
比较Mg(OH)2和Al(OH)3的碱性强弱
元素金属性:Na > Mg > Al
NaOH是强碱,Mg(OH)2是中强碱,Al(OH)3是两性氢氧化物
碱性强弱:NaOH > Mg(OH)2 > Al(OH)3
判断元素非金属性强弱的依据
元素非金属性
非金属单质与氢气反应生成气态氢化物的难易程度及氢化物的稳定性。
非金属元素的最高价氧化物对应的水化物——最高价含氧酸的酸性强弱。
寻找证据
酸性:H2SiO3 < H3PO4 < H2SO4 < HClO4
元素 最高价氧化物 对应的水化物 酸性强弱
Si 硅酸(H2SiO3) 很弱的酸
P 磷酸(H3PO4) 中强酸
S 硫酸(H2SO4) 强酸
Cl 高氯酸(HClO4) 酸性比硫酸的强
非金属性:Si<P<S<Cl
得出结论:
寻找证据→得出结论
元素 单质与氢气化合的难易 氢化物稳定性
P 磷蒸气与氢气能反应生成气态氢化物 ——磷化氢(PH3)
S 硫在加热时能与氢气反应生成气态氢化物——硫化氢(H2S) 硫化氢在较高温度时可以分解
Cl 氯气与氢气能在光照或点燃的条件下反应生成稳定的气态氢化物——氯化氢 氯化氢是稳定的气态氢化物
非金属性:Si<P<S<Cl
得出结论:
与氢气化合的难易:磷 < 硫 < 氯气;稳定性: H2S<HCl
寻找证据→得出结论
Si P S Cl
与氢气 反应 条件 高温 磷蒸气与H2能反应 需加热 光照或点燃时发生爆炸
变化规律 随着核电荷数增加,与氢气化合越来越________
气态 氢化物 热稳定性 SiH4 很不稳定 PH3 不稳定 H2S 受热分解 HCl
稳定
变化规律 随着核电荷数增加,气态氢化物越来越________
最高价氧化物对应水化物 酸性 H2SiO3 弱酸 H3PO4 中强酸 H2SO4 强酸 HClO4(最强的无机含氧酸)
变化规律 随着核电荷数增加,最高价氧化物对应水化物的酸性越来越_____
结论 非金属性:_________________
容易
稳定
强
Cl>S>P>Si
Si、P、S、Cl的非金属性的比较
小结
对其它周期主族元素进行同样的研究,一般情况下也会得出同样的规律。
Na Mg Al Si P S Cl
金属性逐渐减弱,非金属性逐渐增强
总结
原子结构的周期性变化
元素性质的周期性变化
元素周期律
原子核外电子排布
原子半径
主要化合价
元素性质的周期性变化是 呈周期性变化的必然结果。
元素金属性和非金属性
内容
随着原子序数的递增而呈周期性的变化,这一规律叫做元素周期律。
归纳
决定
实质
随着原子序数的递增
呈周期性变化
元素的性质
内容
总结
1. 下列关于元素金属性和非金属性强弱比较的说法不正确的是 ( )
A.将大理石加入稀盐酸中,能产生CO2气体,说明Cl的非金属性强于C
B.Si与H2化合所需温度远高于S与H2化合所需温度,说明S的非金属性强于Si
C.Na与冷水反应剧烈,而Mg与冷水反应缓慢,说明Na的金属性强于Mg
D.Fe投入CuSO4溶液中,能置换出Cu,说明Fe的金属性比Cu强
A
3. 同周期的X、Y、Z三种主族元素,已知其最高价氧化物对应水化物的酸性强弱顺序是HXO4>H2YO4>H3ZO4,则下列说法正确的是 ( )
A.原子半径:X>Y>Z B.非金属性:X>Y>Z
C.气态氢化物稳定性:XB
2. 下列能说明氯元素的非金属性比硫元素强的是 ( )
①HCl比H2S稳定 ②S2-的还原性比Cl-的强 ③Cl2能与H2S反应生成S④HCl的溶解度比H2S的大 ⑤Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS⑥HCl的酸性比H2S的强
A.①②③⑤ B.①②④⑤ C.②③⑤⑥ D.①②③④⑤⑥
A
4. 元素周期表是学习化学的重要工具,它隐含着许多信息和规律。下表所列是七种短周期的原子半径及主要化合价(已知铍的原子半径为0.089 nm)。
元素代号 A B C D E F G
原子半径/nm 0.037 0.160 0.143 0.102 0.099 0.074 0.075
主要化合价 +1 +2 +3 +6、 2 +7、 1 2 +5、 3
(1)C元素在元素周期表中的位置是第____周期_____族;B的原子结构示意图为________。
(2)D、E气态氢化物的稳定性强弱顺序为_____________(填化学式)。
(3)上述七种元素的最高价氧化物对应水化物中酸性最强的是_________(填化学式)。
三
ⅢA
+12 2 8 1
HCl>H2S
HClO4
5. 已知元素X能形成H2X和XO2化合物,则X的最外层电子数为____。
已知R元素氢化物的分子式为H2R,该元素的最高价氧化物对应水化物的化学式为_______。
6
H2RO4
第四章
物质结构 元素周期律
思维课堂
第二节 元素周期律
课时1 元素性质的周期性变化规律
学习目标
1. 结合有关数据和实验事实,认识原子核外电子排布、原子半径、主要化合价等随元素原子序数递增而呈现周期性变化的规律。
2. 以第三周期元素为例,认识同周期元素的金属性、非金属性随元素原子序数递增而呈现周期性变化的规律,构建元素周期律。
碱金属元素
卤族元素
同主族元素结构和性质递变规律
金属性(碱金属)
逐渐增大
逐渐增强
逐渐增强
逐渐增强
逐渐增强
Li
Na
K
Rb
Cs
碱金属
原子
半径
原子失电
子能力
单质的
还原性
置换氢
的能力
氢氧化物
的碱性
离子的
氧化性
逐渐减弱
同主族元素结构和性质递变规律
非金属性(卤素)
逐渐增大
逐渐减弱
逐渐减弱
逐渐减弱
逐渐减弱
卤素
原子
半径
原子得电
子能力
单质的
氧化性
结合氢
的能力
最高价氧化物对
应水化物的酸性
F
Cl
Br
I
离子的
还原性
逐渐增强
HX
酸性
逐渐增强
同一周期元素的性质又有什么变化规律?
17
9
根据课本表4-5中信息,以原子序数为横坐标,原子最外层电子数,绘作成折线图。
7
8
6
4
5
3
1
2
0
最外层电子数
原子序数
1
2
3
4
5
6
7
8
10
11
12
13
14
15
16
18
随着原子序数的递增,原子的最外层电子数重复出现从1到8周期性变化(H、He除外)。
【问题1】随着元素核电荷数的递增,同一周期元素的原子最外层电子数呈现怎样的变化趋势?
同周期元素性质的周期性变化规律探究——核外电子数
7
8
6
4
5
3
1
2
0
+6
+7
+5
+3
+4
+2
0
+1
1
3
2
4
最外层电子数
化合价
原子序数
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
非金属元素:最高正价+|最低负价|=8
【问题2】“点”观察:①元素最高正价、最低负价的数值与原子最外层电子数之间有何关系?
②主族序数与原子最外层电子数之间有何关系?
主族元素:主族序数=最高正价=最外层电子数
根据课本表4-5中信息,以原子序数为横坐标,元素主要化合价为纵坐标,绘制柱状图。
同周期元素性质的周期性变化规律探究——化合价
7
8
6
4
5
3
1
2
0
+6
+7
+5
+3
+4
+2
0
+1
1
3
2
4
最外层电子数
化合价
原子序数
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
【问题3】 “线”观察:随着元素核电荷数的递增,同一周期元素的最高正价、最低负价呈现怎样的变化趋势?为什么?
随着原子序数的递增,元素的最高正价呈现由+1到+7、最低负价呈现由-4到-1的周期性变化
同周期元素性质的周期性变化规律探究——化合价
7
8
6
4
5
3
1
2
0
+6
+7
+5
+3
+4
+2
0
+1
1
3
2
4
最外层电子数
化合价
原子序数
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
【问题4】 “面”观察:随着元素核电荷数的递增,元素的主要化合价呈现怎样的变化规律?
随着元素核电荷数的递增,元素原子核外电子排布发生周期性变化,元素主要化合价也发生周期性变化。
同周期元素性质的周期性变化规律探究——化合价
(1)最高正价=主族序数=最外层电子数(O、F除外)。
(2)非金属:最低负价=最高正价-8 (H、O、F除外)。
(3)金属无负价;H最高价为+1最低价为-1;O无最高正价,最低价为-2;F无正化合价,最低价为-1。
ⅣA ⅤA ⅥA ⅦA
氢化物 RH4 RH3 H2R HR
最高价氧化物对应的水化物 H2RO3或H4RO4 H3RO4或HRO3 H2RO4 HRO4
元素化合价规律
根据课本表4-5中信息,以原子序数为横坐标,原子半径为纵坐标,制作成折线图。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
0.18
0.20
0.16
0.12
0.14
0.10
0.06
0.08
0.04
原子半径
nm
0.02
0
原子序数
【问题5】随着元素核电荷数的递增,同一周期元素的原子半径呈现怎样的变化趋势?为什么?
电子层数相同,核电荷数越大,原子核对核外电子吸引能力越强,原子半径越小。
同周期元素性质的周期性变化规律探究——原子半径
随着元素核电荷数的递增,原子半径周期性变化
随着原子序数的递增
核外电子排布呈周期性变化
元素性质呈周期性变化
决定了
最外层电子数 1→8
(K层电子数 1→2)
原子半径 大→小
(稀有气体元素突然增大)
化合价:+1→+7 ,-4→-1
(稀有气体元素为零)
引起了
元素周期律
小结
1. 判断正误:
(1)第二周期元素从左至右,最高正价从+1递增到+7( )
(2)原子半径最小的元素是氢元素( )
(3)同周期元素最外层电子数都是从1递增到8( )
(4)氢元素除了有+1价外,也可以有 1价,如NaH( )
×
√
×
√
2. 下图表示1~18号元素原子结构或性质随核电荷数递增的变化。
该图中纵坐标表示( )
A.电子层数 B.最外层电子数
C.最高化合价 D.原子半径
B
(1)电子层数相同时,质子数越多,吸引力越大, 原子半径越小。
Na >Mg>Al>Si
(2)最外层电子数相同的原子(或离子),电子层越多,原子半径(离子半径)越大。
Cs>Rb>K>Na>Li>H
(3)核外电子排布相同(或电子层结构相同)的单核微粒,核电荷数越多,半径越小。
O2->F->Na+>Mg2+
(4)核电荷数相同的单核微粒,价态越高半径越小。
Cl->Cl
比较 Na 、Mg、Al、Si的原子半径大小?
比较Cs、Rb、K、Na、Li、H原子半径?
比较O2-、F-、Na+、Mg2+原子半径?
比较Cl-、Cl 原子半径?
提升:粒子半径大小比较
①电子层数
②核电荷数
微粒半径的比较
思考:粒子半径受哪些因素制约?
①电子层数:
电子层数越多,原子半径越大
原子半径的变化规律
同周期: 从左→右,原子半径逐渐减小
同主族: 从上→下,原子半径逐渐增大
②核电荷数:
当电子层数相同时,核电荷数越大,半径越小
(序大径小)
③核外电子数:
当电子层数和核电荷数相同时,
核外电子数越多,半径越大。
注意:第二周期的Li比第三周期的S、Cl等原子半径大。
小结
(1)r(F) r(Cl)
(4)r(Cl-) r(S2-)
(2)r(Cl) r( S) r( P)
(3)r(Al3+) r(Mg2+) r(Na+) r(F-) r(O2-)
<
<
<
<
<
<
<
<
1. 比较下列微粒半径的大小
2. (双选)下列元素的原子半径依次减小的是( )
A. Na、Mg、Al B. N、O、F
C. P、Si、Al D. C、Si、P
AB
3. (双选)下列粒子半径大小的比较中,正确的是( )
A.Na+
C.Na
BD
4. 下列各组微粒半径大小比较中,不正确的是( )
A. r(K)>r(Na)>r(Li) B. r(Mg2+)>r(Na+)>r(F-)
C. r( Na+)>r(Mg2+)>r(Al3+) D. r(Cl-)>r(F-)>r(F)
B
根据第三周期元素原子的核外电子排布,请你预测该周期元素金属性和非金属性的变化?
Na Mg Al Si P S Cl
电子层数相同,核电荷数增大,
失电子能力减弱,得电子能力增强
原子半径逐渐减小
元素的金属性逐渐减弱,非金属性逐渐增强
原子核对最外层电子的引力逐渐增强
结构
性质
决定
性质预测
金属性强弱比较方法:
(1)单质与水反应
的难易程度
(2)单质与酸反应
的剧烈程度
(3)最高价氧化物
对应水化物的
碱性强弱
(4)金属单质间的
置换反应
1.实验方案
2.评价方案
(1)将大小相同金属钠、镁条分别放入滴有酚酞的水中
(2)将大小相同的镁条、铝条打磨后放入试管,分别加入等体积盐酸
(3)将大小相同金属钠、镁条、
铝条分别放入滴有酚酞的水中
(4)将大小相同金属钠、镁条、铝条分别放入等浓度等体积的盐酸里
三种元素
一起比较
实验设计
取局部
两两比较
证据组合
Na>Mg>Al
金属单质与水(或酸)反应置换出氢的难易程度
判断元素金属性强弱的依据
寻找证据
比较钠、镁单质与水反应的难易程度
比较镁、铝单质与盐酸反应置换出氢气的难易程度
寻找证据
判断元素金属性强弱的依据
金属元素最高价氧化物对应的水化物——氢氧化物的碱性强弱。
寻找证据
比较Mg(OH)2和Al(OH)3的碱性强弱
【获取信息】
Al(OH)3在酸或强碱溶液中都可以溶解,表明它既能与酸反应,又能与强碱溶液反应。反应如下:
Al(OH)3 + 3H+ = Al3+ + 3H2O
Al(OH)3 + OH- = AlO2- + 2H2O
比较Mg(OH)2和Al(OH)3的碱性强弱
元素金属性:Na > Mg > Al
NaOH是强碱,Mg(OH)2是中强碱,Al(OH)3是两性氢氧化物
碱性强弱:NaOH > Mg(OH)2 > Al(OH)3
判断元素非金属性强弱的依据
元素非金属性
非金属单质与氢气反应生成气态氢化物的难易程度及氢化物的稳定性。
非金属元素的最高价氧化物对应的水化物——最高价含氧酸的酸性强弱。
寻找证据
酸性:H2SiO3 < H3PO4 < H2SO4 < HClO4
元素 最高价氧化物 对应的水化物 酸性强弱
Si 硅酸(H2SiO3) 很弱的酸
P 磷酸(H3PO4) 中强酸
S 硫酸(H2SO4) 强酸
Cl 高氯酸(HClO4) 酸性比硫酸的强
非金属性:Si<P<S<Cl
得出结论:
寻找证据→得出结论
元素 单质与氢气化合的难易 氢化物稳定性
P 磷蒸气与氢气能反应生成气态氢化物 ——磷化氢(PH3)
S 硫在加热时能与氢气反应生成气态氢化物——硫化氢(H2S) 硫化氢在较高温度时可以分解
Cl 氯气与氢气能在光照或点燃的条件下反应生成稳定的气态氢化物——氯化氢 氯化氢是稳定的气态氢化物
非金属性:Si<P<S<Cl
得出结论:
与氢气化合的难易:磷 < 硫 < 氯气;稳定性: H2S<HCl
寻找证据→得出结论
Si P S Cl
与氢气 反应 条件 高温 磷蒸气与H2能反应 需加热 光照或点燃时发生爆炸
变化规律 随着核电荷数增加,与氢气化合越来越________
气态 氢化物 热稳定性 SiH4 很不稳定 PH3 不稳定 H2S 受热分解 HCl
稳定
变化规律 随着核电荷数增加,气态氢化物越来越________
最高价氧化物对应水化物 酸性 H2SiO3 弱酸 H3PO4 中强酸 H2SO4 强酸 HClO4(最强的无机含氧酸)
变化规律 随着核电荷数增加,最高价氧化物对应水化物的酸性越来越_____
结论 非金属性:_________________
容易
稳定
强
Cl>S>P>Si
Si、P、S、Cl的非金属性的比较
小结
对其它周期主族元素进行同样的研究,一般情况下也会得出同样的规律。
Na Mg Al Si P S Cl
金属性逐渐减弱,非金属性逐渐增强
总结
原子结构的周期性变化
元素性质的周期性变化
元素周期律
原子核外电子排布
原子半径
主要化合价
元素性质的周期性变化是 呈周期性变化的必然结果。
元素金属性和非金属性
内容
随着原子序数的递增而呈周期性的变化,这一规律叫做元素周期律。
归纳
决定
实质
随着原子序数的递增
呈周期性变化
元素的性质
内容
总结
1. 下列关于元素金属性和非金属性强弱比较的说法不正确的是 ( )
A.将大理石加入稀盐酸中,能产生CO2气体,说明Cl的非金属性强于C
B.Si与H2化合所需温度远高于S与H2化合所需温度,说明S的非金属性强于Si
C.Na与冷水反应剧烈,而Mg与冷水反应缓慢,说明Na的金属性强于Mg
D.Fe投入CuSO4溶液中,能置换出Cu,说明Fe的金属性比Cu强
A
3. 同周期的X、Y、Z三种主族元素,已知其最高价氧化物对应水化物的酸性强弱顺序是HXO4>H2YO4>H3ZO4,则下列说法正确的是 ( )
A.原子半径:X>Y>Z B.非金属性:X>Y>Z
C.气态氢化物稳定性:X
2. 下列能说明氯元素的非金属性比硫元素强的是 ( )
①HCl比H2S稳定 ②S2-的还原性比Cl-的强 ③Cl2能与H2S反应生成S④HCl的溶解度比H2S的大 ⑤Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS⑥HCl的酸性比H2S的强
A.①②③⑤ B.①②④⑤ C.②③⑤⑥ D.①②③④⑤⑥
A
4. 元素周期表是学习化学的重要工具,它隐含着许多信息和规律。下表所列是七种短周期的原子半径及主要化合价(已知铍的原子半径为0.089 nm)。
元素代号 A B C D E F G
原子半径/nm 0.037 0.160 0.143 0.102 0.099 0.074 0.075
主要化合价 +1 +2 +3 +6、 2 +7、 1 2 +5、 3
(1)C元素在元素周期表中的位置是第____周期_____族;B的原子结构示意图为________。
(2)D、E气态氢化物的稳定性强弱顺序为_____________(填化学式)。
(3)上述七种元素的最高价氧化物对应水化物中酸性最强的是_________(填化学式)。
三
ⅢA
+12 2 8 1
HCl>H2S
HClO4
5. 已知元素X能形成H2X和XO2化合物,则X的最外层电子数为____。
已知R元素氢化物的分子式为H2R,该元素的最高价氧化物对应水化物的化学式为_______。
6
H2RO4
