人教版(2019)化学必修第一册 2_2_1氯气的性质导学案(含答案)
文档属性
| 名称 | 人教版(2019)化学必修第一册 2_2_1氯气的性质导学案(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 100.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-24 09:07:04 | ||
图片预览




文档简介
2.2.1 氯气的性质导学案
1、了解氯气的物理性质和用途;
2、初步掌握氯气的化学性质,并从氯的原子结构特点,了解氯气是一种化学性质非常活泼的非金属;
3、提高规范操作能力、实验观察能力、归纳思维能力和分析思维能力。
一、氯气的性质
1、氯气是一种_______________________气味的气体。
2、与金属、非金属单质的反应
钠、铁、铜等都能与氢气在加热的条件下发生反应,方程式如下:
__________________________________________
__________________________________________
__________________________________________
纯净的氢气在氯气中安静的燃烧,发出苍白色的火焰,方程式如下:
__________________________________________
3、与水的反应
1体积的水大约可以溶解______体积的氯气,氯气的水溶液称为________,在常温下溶于水的部分氯气与水发生反应,方程式如下:
___________________________________________
4、与碱反应
在常温下,将Cl2通入NaOH溶液中,可以得到以__________为主要成分的漂白液,反应的化学方程式如下:
____________________________________________________
二、氯气的实验室制法
舍勒发现氯气的方法至今还是实验室制取氯气的主要方法之一。方程式如下:
__________________________________________________________________
知识导入
1915年4月22日,德军与英、法联军在比利时的伊普尔对峙。黎明时,英法联军前线战场的士兵突然看到一股黄绿色气体慢慢向前袭来,很快数百名英、法战士窒息而死,数千名士兵双目失明,你知道这种黄绿色气体是什么吗?
一、氯气的实验室制法
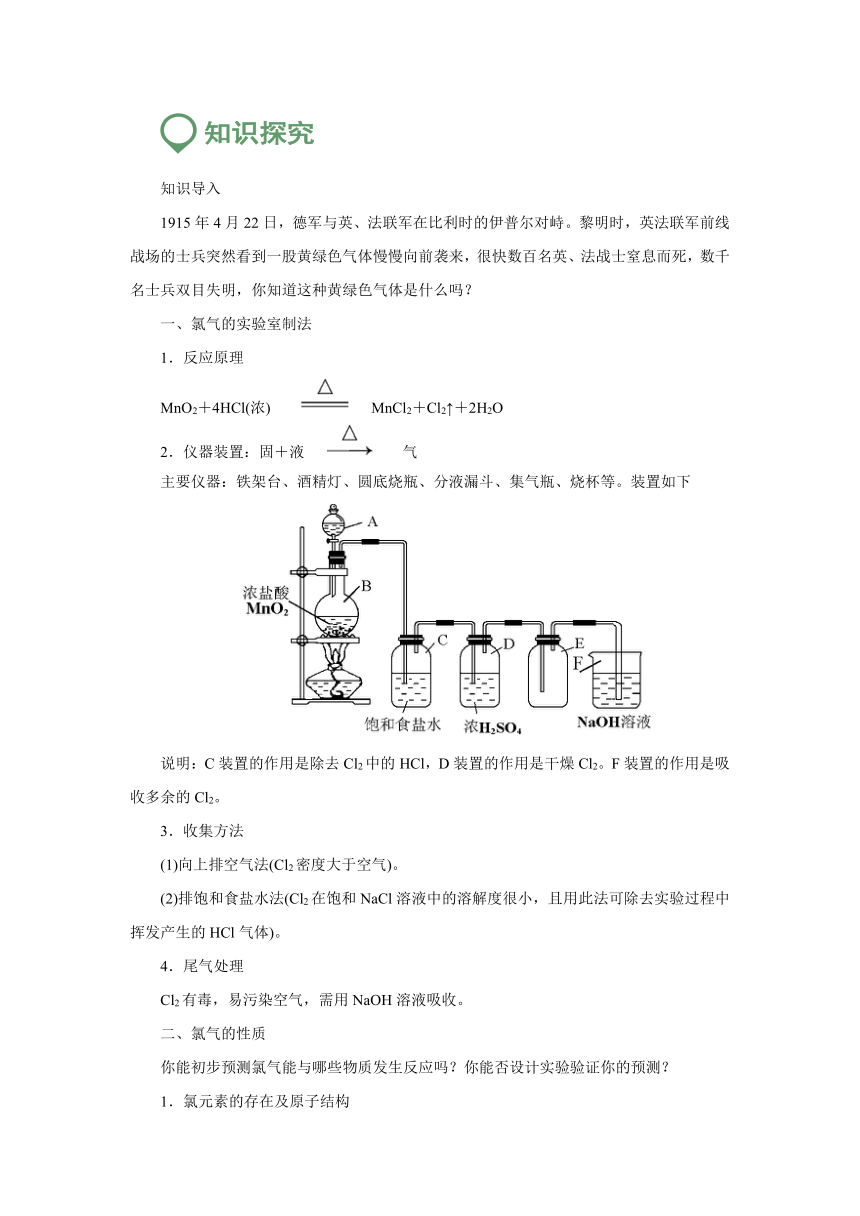
1.反应原理
MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
2.仪器装置:固+液 气
主要仪器:铁架台、酒精灯、圆底烧瓶、分液漏斗、集气瓶、烧杯等。装置如下
说明:C装置的作用是除去Cl2中的HCl,D装置的作用是干燥Cl2。F装置的作用是吸收多余的Cl2。
3.收集方法
(1)向上排空气法(Cl2密度大于空气)。
(2)排饱和食盐水法(Cl2在饱和NaCl溶液中的溶解度很小,且用此法可除去实验过程中挥发产生的HCl气体)。
4.尾气处理
Cl2有毒,易污染空气,需用NaOH溶液吸收。
二、氯气的性质
你能初步预测氯气能与哪些物质发生反应吗?你能否设计实验验证你的预测?
1.氯元素的存在及原子结构
(1)氯元素的存在
自然界中氯以化合态形式存在,主要以NaCl的形式存在于海水和陆地的盐矿中,海洋是氯的巨大的资源宝库。
(2)氯原子的结构
氯原子的核电荷数是17,原子结构示意图如图为。
(3)氯原子的结构特点
氯原子的最外层电子数是7个,原子半径较小。原子核对最外层电子的吸引力较大,在化学反应中容易结合1个电子,使最外电子层达到8个电子的稳定结构,所以,氯气是一种化学性质很活泼的非金属单质,具有较强的氧化性。
2.氯气的物理性质
在通常情况下,氯气呈黄绿色,是一种有强烈刺激性气味的有毒气体,在低温和加压的条件下可以转变为液态或固态。在同温同压下,氯气密度比空气大。在常温下,1体积水约溶解2体积的氯气。使用Cl2要十分注意安全,因为Cl2有毒,且Cl2主要是损伤人的喉黏膜和肺,严重时可窒息死亡。因此,闻Cl2的气味时应用手在瓶口轻轻扇动,使少量气体飘进鼻孔,如图所示。
特别提醒:①通常讲的气体溶解度是指该气体在压强为101 kPa,一定温度时溶解在1体积水里达到饱和状态时的气体体积。气体的体积值为标准状况时的体积值。由此可知,在常温(25℃)、1 L水中能溶解的氯气的最大量,在标准状况下的体积为2 L。②综合氯气的密度、溶解度、毒性和颜色等知识可知:在实验室里收集氯气,可采用向上排空气法,不能用向下排空气法,也不能用排水法;在收集和应用氯气时,要防止使人中毒或污染环境;可通过气体的颜色判断氯气是否充满集气瓶。③氯气在饱和食盐水中的溶解度很小,实验室中可用排饱和食盐水法收集氯气。
3.氯气与金属的反应
(1)与不活泼的金属——铜的反应:
①反应条件:加热。
②反应现象:红热的铜丝在氯气中剧烈燃烧,生成棕黄色的烟(CuCl2),加入水后,溶液呈蓝绿色。
③化学方程式:Cu+Cl2 CuCl2
(2)与活泼金属——钠的反应:
①反应条件:钠去氧化膜,并切碎,加热。
②反应现象:钠在氯气中剧烈燃烧,生成白色的烟(NaCl)。
③化学方程式:2Na+Cl2 2NaCl
(3)与较活泼的金属——Fe、Mg、Al的反应:
①反应条件:加热。
②反应现象:红热的铁丝在氯气中剧烈燃烧,生成棕黄色的烟(FeCl3),加入水后,溶液呈黄色。
③化学方程式:2Fe+3Cl2 2FeCl3
特别提醒:(1)干燥的氯气不能与铁起反应,因此,可用钢瓶储运液氯;
(2)铁元素有+2、+3价,氯气有强氧化性,铁与氯气反应时,铁呈+3价,而铁与稀盐酸、稀硫酸、硫酸铜溶液反应时,铁呈+2价。
4.氯气与非金属的反应
(1)与氢气的反应:
①反应条件:点燃或光照。
②反应现象:纯净的氢气在氯气中安静地燃烧,发出苍白色火焰,生成的氯化氢在集气瓶口呈白雾状(氯化氢与空气中的水蒸气结合形成的盐酸小液滴)。氯气与氢气混合光照,会发生爆炸,生成氯化氢。
③化学方程式:H2+Cl2 2HCl,
H2+Cl2 2HCl。
(2)与磷的反应
①反应条件:点燃。
②反应现象:磷在氯气中剧烈燃烧,在集气瓶口产生大量白色烟雾(三氯化磷是液体,呈雾状;五氯化磷是固体,呈白烟状)。
③化学方程式:2P+3Cl2(不足) 2PCl3,
2P+5Cl2(足量) 2PCl5。
(3)氯化氢与盐酸
氯化氢通常为气体,有刺激性气味,有毒,极易溶于水(在常温下1体积水溶解HCl气体约500体积)
HCl的水溶液叫做盐酸。常用的浓盐酸中的HCl的质量分数约为37%~38%,密度为1.19 g/cm3,HCl的物质的量浓度约为12 mol/L。盐酸里易挥发出HCl气体,盐酸浓度越大或温度越高越易挥发。浓盐酸在空气里会生成白雾,这是因为从浓盐酸里挥发出来的HCl气体跟空气里的水蒸气接触,形成盐酸小液滴的缘故。浓盐酸为无色液体,有刺激性气味,有酸味,工业浓盐酸常因含有杂质(主要是Fe3+)而带黄色。浓盐酸要密封包装,低温储存。
5.氯气与水的反应
(1)Cl2的水溶液叫氯水,该水溶液的颜色为黄绿色,这说明其中含有氯气分子。
(2)Cl2与水反应的化学方程式及电子转移的方向和数目:
在该反应中,氧化剂是Cl2,还原剂是Cl2。写出该反应的离子方程式为Cl2+H2O===H++Cl-+HClO。
(3)氯水中含有的微粒主要有Cl2、H2O、HClO、H+、ClO-、Cl-。
其中包括三种分子,三种离子。
(4)次氯酸的性质
①弱酸性:
HClO的酸性比碳酸的酸性弱,能证明该事实的化学方程式为Ca(ClO)2+CO2+H2O===CaCO3↓+2HClO,跟NaOH溶液反应的离子方程式为HClO+OH-===ClO-+H2O。
说明:次氯酸是一种极弱的酸,其电离方程式为HClOH++ClO-。
a.次氯酸的酸性不能使指示剂变色。
b.次氯酸的酸性比碳酸还弱。
Ca(ClO)2+CO2+H2O===CaCO3↓+2HClO
②不稳定性:
补充实验:次氯酸的见光分解实验
在一个盛满蒸馏水的500 mL的烧瓶中通入Cl2至饱和,然后倒置于水槽中,固定在铁架台上,置于阳光直射的地方,观察现象。
观察到的现象为有无色气泡溢出,浅黄绿色溶液颜色变淡,直至消失。检验该气体的方法为用带火星的木条检验,木条复燃,产生的气体是O2。该反应的化学方程式和离子方程式分别为2HClO 2HCl+O2↑、
2HClO 2H++2Cl-+O2↑。
③强氧化性:
次氯酸是一种强氧化剂,能杀死水中的病菌,所以自来水常用氯气来杀菌消毒。次氯酸的强氧化性还能使某些染料和有机色素褪色,可用作棉、麻和纸张等的漂白剂。
实验中发生的现象为干燥的有色布条没有褪色,而湿润的有色布条褪色了。该事实说明起漂白作用的物质是次氯酸,而不是Cl2。
探究:氯水的成分与性质
(1)反应原理及成分:
Cl2+H2O H++Cl-+HClO
HClO H++ClO-
2HClO 2HCl+O2↑
新制氯水中,所含的分子有:Cl2、H2O、HClO;离子有:H+、Cl-、ClO-、OH-(少量)。
(2)新制氯水与久置氯水的比较(见下表):
新制氯水 久置氯水
成分 Cl2、HCl、HClO、H2O HCl、H2O
颜色 淡黄绿色 无色
性质 酸性、漂白作用 酸性(比新制的强)、无漂白作用
原因 Cl2+H2O HCl+HClO, 2HClO 2HCl+O2↑
(3)氯水的性质
氯水的多种成分决定了它具有多重性质:①Cl2的强氧化性;②HCl的强酸性;③HClO的强氧化性、弱酸性; ④Cl-的性质。在不同的反应中,氯水起作用的成分不同有如下6种情况:
a.只考虑Cl2的性质
新制氯水中存在着大量的Cl2分子,Cl2是新制氯水的主要成分。为了方便,有时实验室中常用氯水代替Cl2。如将新制氯水滴加到淀粉碘化钾溶液中和通入Cl2的效果一样,都是Cl2分子将I-氧化成I2使淀粉变蓝。
Cl2+2KI===2KCl+I2
类似的还有KBr、FeCl2、H2S。如:2FeCl2+Cl2===2FeCl3
将SO2气体通入氯水中,氯水的浅黄绿色褪去,其反应为:
SO2+2H2O+Cl2===H2SO4+2HCl
b.只考虑H+参与反应
向NaHCO3溶液中加适量的氯水,有气泡产生,就是利用了盐酸的强酸性。反应为:NaHCO3+HCl===NaCl+CO2↑+H2O
c.只考虑Cl-参与的反应向AgNO3溶液中加适量的氯水,有白色沉淀产生,就是利用了Cl-的性质,反应为:AgNO3+HCl===AgCl↓+HNO3
d.只考虑HClO参与的反应
将氯水滴在红色纸条上,可使红色褪去,便是HClO将有机色素氧化的结果。
e.考虑HCl和HClO同时参与反应
往新制得的氯水中滴入紫色石蕊试液时,溶液先变红后褪色,便是盐酸的强酸性和HClO的强氧化性的具体体现。
总结:
1、氯气是有毒的,曾被法西斯制成毒气弹用于侵略战争。当这种毒气弹顺风爆炸时,通常可用的防御方法是( )
A.人、畜应躲到低洼的地方
B.人、畜应到较高的地方去
C.人应多饮豆浆和牛乳
D.可用肥皂水浸湿软布蒙面
2、下列气体中,被当作化学武器,首次使用于战争的是 ( )
A.氯气 B.一氧化碳 C.芥子气 D.沙林
3、下列关于氯气的叙述正确的是( )
A.钠在氯气中燃烧产生白色烟雾
B.红热的铜丝可以在氯气中燃烧,产生棕黄色烟雾
C.纯净的氢气可以在氯气中安静地燃烧,发出苍白色火焰
D.氯气可用于漂白,这是氯气的漂白作用
4、下列关于氯气的叙述,错误的是( )
A.是黄绿色气体
B.能溶于水
C.不跟非金属反应
D.易与大多数金属反应生成金属氯化物
5、下列关于氯水的叙述,正确的是 ( )
A.新制氯水中只含有Cl2和H2O分子
B.新制氯水可使蓝色石蕊试纸先变红后褪色
C.光照氯水有气泡逸出,该气体是Cl2
D.氯水放置数天后,酸性增强
6、久置的氯水与新制的氯水比较,下列结论正确的是 ( )
A.颜色相同
B.都能使有色布条褪色
C.pH相同
D.加入AgNO3溶液都能产生白色沉淀
参考答案
自主学习
一、氯气的性质
1、黄绿色、有刺激性
2、2Na + Cl2 2NaCl
2Fe + 3Cl2 2FeCl3
Cu + Cl2 CuCl2
H2 + Cl2 2HCl
3、与水的反应
2,氯水,Cl2 + H2O===HCl + HClO
4、与碱反应
NaClO,Cl2 + 2NaOH = NaCl + NaClO + H2O
二、氯气的实验室制法
MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
随堂检测
1、解析:氯气的密度比空气大,故人、畜应转移到较高地方去,又因为Cl2能被碱性溶液吸收,故可选用BD。
答案:BD
2、答案:A
3、解析:A中钠在氯气中燃烧,生成NaCl固体小颗粒,形成白烟,没有雾出现(雾为液态小液滴),A不正确。B中红热的铜丝在氯气中燃烧生成CuCl2固体小颗粒,生成棕黄色的烟,但没有雾,所以B也不正确。C中的说法完全符合实验事实,因此是正确答案。D中氯气用于漂白,这是对的,但起漂白作用的不是氯气本身,而是它与水反应后生成的次氯酸具有强氧化性,使有机色素氧化而褪色,D的说法不正确。
答案:C
4、解析:本题要求找出错误叙述,在所给的四个选项中有两个是Cl2的物理性质,都正确。氯气是化学性质活泼的非金属,容易跟大多数金属在一定条件下直接反应,D项正确。错误的选项只有C项,因为通过纯净的H2在Cl2中燃烧可知Cl2与非金属是可以反应的。
答案:C
5、解析:在新制的氯水中溶有大量Cl2分子,其中小部分Cl2与水发生反应生成盐酸和次氯酸,HCl完全电离成H+和Cl-,HClO部分电离产生H+、ClO-。所以氯水中含有H2O、Cl2、HClO分子和H+、Cl-、ClO-、OH-离子。HClO有强氧化性、漂白性,见光易分解放出O2。氯水放置数天后HClO分解接近完全,转化为盐酸,酸性增强,pH变小。故选B、D。
答案:BD
6、解析:新制氯水中含有HClO、H2O、Cl2三种分子,H+、ClO-、Cl-、OH-四种离子,其水溶液的颜色取决于Cl2分子的多少,其漂白性取决于HClO分子的多少,溶液的pH取决于H+浓度的大小,与Ag+作用生成沉淀取决于有没有Cl-。氯水久置过程中发生如下反应:Cl2+H2O HCl+HClO,2HClO 2HCl+O2↑,在久置的氯水中因Cl2、HClO不断反应最终变成稀盐酸。因此,颜色比新制的氯水浅,不再具有漂白能力,酸性增强,Cl-浓度增大。
答案:D
1、了解氯气的物理性质和用途;
2、初步掌握氯气的化学性质,并从氯的原子结构特点,了解氯气是一种化学性质非常活泼的非金属;
3、提高规范操作能力、实验观察能力、归纳思维能力和分析思维能力。
一、氯气的性质
1、氯气是一种_______________________气味的气体。
2、与金属、非金属单质的反应
钠、铁、铜等都能与氢气在加热的条件下发生反应,方程式如下:
__________________________________________
__________________________________________
__________________________________________
纯净的氢气在氯气中安静的燃烧,发出苍白色的火焰,方程式如下:
__________________________________________
3、与水的反应
1体积的水大约可以溶解______体积的氯气,氯气的水溶液称为________,在常温下溶于水的部分氯气与水发生反应,方程式如下:
___________________________________________
4、与碱反应
在常温下,将Cl2通入NaOH溶液中,可以得到以__________为主要成分的漂白液,反应的化学方程式如下:
____________________________________________________
二、氯气的实验室制法
舍勒发现氯气的方法至今还是实验室制取氯气的主要方法之一。方程式如下:
__________________________________________________________________
知识导入
1915年4月22日,德军与英、法联军在比利时的伊普尔对峙。黎明时,英法联军前线战场的士兵突然看到一股黄绿色气体慢慢向前袭来,很快数百名英、法战士窒息而死,数千名士兵双目失明,你知道这种黄绿色气体是什么吗?
一、氯气的实验室制法
1.反应原理
MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
2.仪器装置:固+液 气
主要仪器:铁架台、酒精灯、圆底烧瓶、分液漏斗、集气瓶、烧杯等。装置如下
说明:C装置的作用是除去Cl2中的HCl,D装置的作用是干燥Cl2。F装置的作用是吸收多余的Cl2。
3.收集方法
(1)向上排空气法(Cl2密度大于空气)。
(2)排饱和食盐水法(Cl2在饱和NaCl溶液中的溶解度很小,且用此法可除去实验过程中挥发产生的HCl气体)。
4.尾气处理
Cl2有毒,易污染空气,需用NaOH溶液吸收。
二、氯气的性质
你能初步预测氯气能与哪些物质发生反应吗?你能否设计实验验证你的预测?
1.氯元素的存在及原子结构
(1)氯元素的存在
自然界中氯以化合态形式存在,主要以NaCl的形式存在于海水和陆地的盐矿中,海洋是氯的巨大的资源宝库。
(2)氯原子的结构
氯原子的核电荷数是17,原子结构示意图如图为。
(3)氯原子的结构特点
氯原子的最外层电子数是7个,原子半径较小。原子核对最外层电子的吸引力较大,在化学反应中容易结合1个电子,使最外电子层达到8个电子的稳定结构,所以,氯气是一种化学性质很活泼的非金属单质,具有较强的氧化性。
2.氯气的物理性质
在通常情况下,氯气呈黄绿色,是一种有强烈刺激性气味的有毒气体,在低温和加压的条件下可以转变为液态或固态。在同温同压下,氯气密度比空气大。在常温下,1体积水约溶解2体积的氯气。使用Cl2要十分注意安全,因为Cl2有毒,且Cl2主要是损伤人的喉黏膜和肺,严重时可窒息死亡。因此,闻Cl2的气味时应用手在瓶口轻轻扇动,使少量气体飘进鼻孔,如图所示。
特别提醒:①通常讲的气体溶解度是指该气体在压强为101 kPa,一定温度时溶解在1体积水里达到饱和状态时的气体体积。气体的体积值为标准状况时的体积值。由此可知,在常温(25℃)、1 L水中能溶解的氯气的最大量,在标准状况下的体积为2 L。②综合氯气的密度、溶解度、毒性和颜色等知识可知:在实验室里收集氯气,可采用向上排空气法,不能用向下排空气法,也不能用排水法;在收集和应用氯气时,要防止使人中毒或污染环境;可通过气体的颜色判断氯气是否充满集气瓶。③氯气在饱和食盐水中的溶解度很小,实验室中可用排饱和食盐水法收集氯气。
3.氯气与金属的反应
(1)与不活泼的金属——铜的反应:
①反应条件:加热。
②反应现象:红热的铜丝在氯气中剧烈燃烧,生成棕黄色的烟(CuCl2),加入水后,溶液呈蓝绿色。
③化学方程式:Cu+Cl2 CuCl2
(2)与活泼金属——钠的反应:
①反应条件:钠去氧化膜,并切碎,加热。
②反应现象:钠在氯气中剧烈燃烧,生成白色的烟(NaCl)。
③化学方程式:2Na+Cl2 2NaCl
(3)与较活泼的金属——Fe、Mg、Al的反应:
①反应条件:加热。
②反应现象:红热的铁丝在氯气中剧烈燃烧,生成棕黄色的烟(FeCl3),加入水后,溶液呈黄色。
③化学方程式:2Fe+3Cl2 2FeCl3
特别提醒:(1)干燥的氯气不能与铁起反应,因此,可用钢瓶储运液氯;
(2)铁元素有+2、+3价,氯气有强氧化性,铁与氯气反应时,铁呈+3价,而铁与稀盐酸、稀硫酸、硫酸铜溶液反应时,铁呈+2价。
4.氯气与非金属的反应
(1)与氢气的反应:
①反应条件:点燃或光照。
②反应现象:纯净的氢气在氯气中安静地燃烧,发出苍白色火焰,生成的氯化氢在集气瓶口呈白雾状(氯化氢与空气中的水蒸气结合形成的盐酸小液滴)。氯气与氢气混合光照,会发生爆炸,生成氯化氢。
③化学方程式:H2+Cl2 2HCl,
H2+Cl2 2HCl。
(2)与磷的反应
①反应条件:点燃。
②反应现象:磷在氯气中剧烈燃烧,在集气瓶口产生大量白色烟雾(三氯化磷是液体,呈雾状;五氯化磷是固体,呈白烟状)。
③化学方程式:2P+3Cl2(不足) 2PCl3,
2P+5Cl2(足量) 2PCl5。
(3)氯化氢与盐酸
氯化氢通常为气体,有刺激性气味,有毒,极易溶于水(在常温下1体积水溶解HCl气体约500体积)
HCl的水溶液叫做盐酸。常用的浓盐酸中的HCl的质量分数约为37%~38%,密度为1.19 g/cm3,HCl的物质的量浓度约为12 mol/L。盐酸里易挥发出HCl气体,盐酸浓度越大或温度越高越易挥发。浓盐酸在空气里会生成白雾,这是因为从浓盐酸里挥发出来的HCl气体跟空气里的水蒸气接触,形成盐酸小液滴的缘故。浓盐酸为无色液体,有刺激性气味,有酸味,工业浓盐酸常因含有杂质(主要是Fe3+)而带黄色。浓盐酸要密封包装,低温储存。
5.氯气与水的反应
(1)Cl2的水溶液叫氯水,该水溶液的颜色为黄绿色,这说明其中含有氯气分子。
(2)Cl2与水反应的化学方程式及电子转移的方向和数目:
在该反应中,氧化剂是Cl2,还原剂是Cl2。写出该反应的离子方程式为Cl2+H2O===H++Cl-+HClO。
(3)氯水中含有的微粒主要有Cl2、H2O、HClO、H+、ClO-、Cl-。
其中包括三种分子,三种离子。
(4)次氯酸的性质
①弱酸性:
HClO的酸性比碳酸的酸性弱,能证明该事实的化学方程式为Ca(ClO)2+CO2+H2O===CaCO3↓+2HClO,跟NaOH溶液反应的离子方程式为HClO+OH-===ClO-+H2O。
说明:次氯酸是一种极弱的酸,其电离方程式为HClOH++ClO-。
a.次氯酸的酸性不能使指示剂变色。
b.次氯酸的酸性比碳酸还弱。
Ca(ClO)2+CO2+H2O===CaCO3↓+2HClO
②不稳定性:
补充实验:次氯酸的见光分解实验
在一个盛满蒸馏水的500 mL的烧瓶中通入Cl2至饱和,然后倒置于水槽中,固定在铁架台上,置于阳光直射的地方,观察现象。
观察到的现象为有无色气泡溢出,浅黄绿色溶液颜色变淡,直至消失。检验该气体的方法为用带火星的木条检验,木条复燃,产生的气体是O2。该反应的化学方程式和离子方程式分别为2HClO 2HCl+O2↑、
2HClO 2H++2Cl-+O2↑。
③强氧化性:
次氯酸是一种强氧化剂,能杀死水中的病菌,所以自来水常用氯气来杀菌消毒。次氯酸的强氧化性还能使某些染料和有机色素褪色,可用作棉、麻和纸张等的漂白剂。
实验中发生的现象为干燥的有色布条没有褪色,而湿润的有色布条褪色了。该事实说明起漂白作用的物质是次氯酸,而不是Cl2。
探究:氯水的成分与性质
(1)反应原理及成分:
Cl2+H2O H++Cl-+HClO
HClO H++ClO-
2HClO 2HCl+O2↑
新制氯水中,所含的分子有:Cl2、H2O、HClO;离子有:H+、Cl-、ClO-、OH-(少量)。
(2)新制氯水与久置氯水的比较(见下表):
新制氯水 久置氯水
成分 Cl2、HCl、HClO、H2O HCl、H2O
颜色 淡黄绿色 无色
性质 酸性、漂白作用 酸性(比新制的强)、无漂白作用
原因 Cl2+H2O HCl+HClO, 2HClO 2HCl+O2↑
(3)氯水的性质
氯水的多种成分决定了它具有多重性质:①Cl2的强氧化性;②HCl的强酸性;③HClO的强氧化性、弱酸性; ④Cl-的性质。在不同的反应中,氯水起作用的成分不同有如下6种情况:
a.只考虑Cl2的性质
新制氯水中存在着大量的Cl2分子,Cl2是新制氯水的主要成分。为了方便,有时实验室中常用氯水代替Cl2。如将新制氯水滴加到淀粉碘化钾溶液中和通入Cl2的效果一样,都是Cl2分子将I-氧化成I2使淀粉变蓝。
Cl2+2KI===2KCl+I2
类似的还有KBr、FeCl2、H2S。如:2FeCl2+Cl2===2FeCl3
将SO2气体通入氯水中,氯水的浅黄绿色褪去,其反应为:
SO2+2H2O+Cl2===H2SO4+2HCl
b.只考虑H+参与反应
向NaHCO3溶液中加适量的氯水,有气泡产生,就是利用了盐酸的强酸性。反应为:NaHCO3+HCl===NaCl+CO2↑+H2O
c.只考虑Cl-参与的反应向AgNO3溶液中加适量的氯水,有白色沉淀产生,就是利用了Cl-的性质,反应为:AgNO3+HCl===AgCl↓+HNO3
d.只考虑HClO参与的反应
将氯水滴在红色纸条上,可使红色褪去,便是HClO将有机色素氧化的结果。
e.考虑HCl和HClO同时参与反应
往新制得的氯水中滴入紫色石蕊试液时,溶液先变红后褪色,便是盐酸的强酸性和HClO的强氧化性的具体体现。
总结:
1、氯气是有毒的,曾被法西斯制成毒气弹用于侵略战争。当这种毒气弹顺风爆炸时,通常可用的防御方法是( )
A.人、畜应躲到低洼的地方
B.人、畜应到较高的地方去
C.人应多饮豆浆和牛乳
D.可用肥皂水浸湿软布蒙面
2、下列气体中,被当作化学武器,首次使用于战争的是 ( )
A.氯气 B.一氧化碳 C.芥子气 D.沙林
3、下列关于氯气的叙述正确的是( )
A.钠在氯气中燃烧产生白色烟雾
B.红热的铜丝可以在氯气中燃烧,产生棕黄色烟雾
C.纯净的氢气可以在氯气中安静地燃烧,发出苍白色火焰
D.氯气可用于漂白,这是氯气的漂白作用
4、下列关于氯气的叙述,错误的是( )
A.是黄绿色气体
B.能溶于水
C.不跟非金属反应
D.易与大多数金属反应生成金属氯化物
5、下列关于氯水的叙述,正确的是 ( )
A.新制氯水中只含有Cl2和H2O分子
B.新制氯水可使蓝色石蕊试纸先变红后褪色
C.光照氯水有气泡逸出,该气体是Cl2
D.氯水放置数天后,酸性增强
6、久置的氯水与新制的氯水比较,下列结论正确的是 ( )
A.颜色相同
B.都能使有色布条褪色
C.pH相同
D.加入AgNO3溶液都能产生白色沉淀
参考答案
自主学习
一、氯气的性质
1、黄绿色、有刺激性
2、2Na + Cl2 2NaCl
2Fe + 3Cl2 2FeCl3
Cu + Cl2 CuCl2
H2 + Cl2 2HCl
3、与水的反应
2,氯水,Cl2 + H2O===HCl + HClO
4、与碱反应
NaClO,Cl2 + 2NaOH = NaCl + NaClO + H2O
二、氯气的实验室制法
MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
随堂检测
1、解析:氯气的密度比空气大,故人、畜应转移到较高地方去,又因为Cl2能被碱性溶液吸收,故可选用BD。
答案:BD
2、答案:A
3、解析:A中钠在氯气中燃烧,生成NaCl固体小颗粒,形成白烟,没有雾出现(雾为液态小液滴),A不正确。B中红热的铜丝在氯气中燃烧生成CuCl2固体小颗粒,生成棕黄色的烟,但没有雾,所以B也不正确。C中的说法完全符合实验事实,因此是正确答案。D中氯气用于漂白,这是对的,但起漂白作用的不是氯气本身,而是它与水反应后生成的次氯酸具有强氧化性,使有机色素氧化而褪色,D的说法不正确。
答案:C
4、解析:本题要求找出错误叙述,在所给的四个选项中有两个是Cl2的物理性质,都正确。氯气是化学性质活泼的非金属,容易跟大多数金属在一定条件下直接反应,D项正确。错误的选项只有C项,因为通过纯净的H2在Cl2中燃烧可知Cl2与非金属是可以反应的。
答案:C
5、解析:在新制的氯水中溶有大量Cl2分子,其中小部分Cl2与水发生反应生成盐酸和次氯酸,HCl完全电离成H+和Cl-,HClO部分电离产生H+、ClO-。所以氯水中含有H2O、Cl2、HClO分子和H+、Cl-、ClO-、OH-离子。HClO有强氧化性、漂白性,见光易分解放出O2。氯水放置数天后HClO分解接近完全,转化为盐酸,酸性增强,pH变小。故选B、D。
答案:BD
6、解析:新制氯水中含有HClO、H2O、Cl2三种分子,H+、ClO-、Cl-、OH-四种离子,其水溶液的颜色取决于Cl2分子的多少,其漂白性取决于HClO分子的多少,溶液的pH取决于H+浓度的大小,与Ag+作用生成沉淀取决于有没有Cl-。氯水久置过程中发生如下反应:Cl2+H2O HCl+HClO,2HClO 2HCl+O2↑,在久置的氯水中因Cl2、HClO不断反应最终变成稀盐酸。因此,颜色比新制的氯水浅,不再具有漂白能力,酸性增强,Cl-浓度增大。
答案:D
