人教版(2019)化学必修第一册 3_1铁及其化合物导学案(Word含答案以及解析)
文档属性
| 名称 | 人教版(2019)化学必修第一册 3_1铁及其化合物导学案(Word含答案以及解析) |  | |
| 格式 | docx | ||
| 文件大小 | 435.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-24 09:15:30 | ||
图片预览



文档简介
3.1.1铁及其化合物导学案
1、了解铁单质的物理和化学性质。
2、了解FeO、Fe2O3、Fe3O4的性质和应用。
3、掌握Fe(OH)2、Fe(OH)3的制备和性质。
4、掌握Fe2+、Fe3+的检验方法及相互转化。
一、铁单质
1、铁在自然界中主要以 +2、+3 价化合物的形式存在于矿石中。
2、铁有延展性和导热性。
3、铁的化学性质比较活泼,它能与许多物质发生化学反应。铁作为还原剂能与某些非金属单质、酸和盐溶液反应。铁与氧化性较弱的氧化剂(如盐酸、硫酸铜等)反应。红热的铁能与水蒸气发生反应,生成四氧化三铁和氢气。
二、铁的重要化合物
1、铁元素可以形成三种氧化物,分别是氧化亚铁(FeO)、氧化铁(Fe2O3)和四氧化三铁(Fe3O4)
2、Fe2O3是一种红棕色粉末,俗称铁红,通常作油漆、涂料、油墨和橡胶的红色颜料。
3、铁有两种氢氧化物,它们可以分别由相对应的可溶性盐与碱溶液反应而制的。
FeSO4 + 2NaOH = Fe(OH)2 + Na2SO4
4Fe(OH)2 + O2 + 2H2O = 4 Fe(OH)3
4、Fe3+ 的盐溶液遇到KSCN溶液时变成红色,我们可以利用这一反应检验Fe3+的存在。
5、铁盐遇到较强的还原剂会被还原成亚铁盐,亚铁盐在较强的氧化剂作用下会被氧化成铁盐,即Fe3+ 和 Fe2+ 在一定条件下是可以相互转化的。
一、铁的单质
1、铁在自然界中主要以 +2、+3 价化合物的形式存在于矿石中。
2、铁有延展性和导热性。
3、铁的化学性质比较活泼,它能与许多物质发生化学反应。铁作为还原剂能与某些非金属单质、酸和盐溶液反应。铁与氧化性较弱的氧化剂(如盐酸、硫酸铜等)反应。
在常温下铁与水不反应,在高温下铁与水蒸气发生反应。化学反应方程式为:
3Fe+4H2O(g) Fe3O4+4H2
注意:①试管口略向下倾斜。
②酒精灯先放在湿棉花的位置加热一会儿,待有部分水蒸气形成时,再将酒精灯移至放铁粉的位置加热。
③加热一会儿再将导管插入到肥皂液中,因为开始时出来的是空气。
④肥皂液不宜太稀。
⑤实验结束,应先从肥皂液中撤出导管,再移去酒精灯,以防产生倒吸现象。
特别提醒:①铁与水蒸气反应生成的是Fe3O4,不是碱。②Fe3O4为黑色晶体,俗名为磁性氧化铁。
二、 铁的氧化物
1、铁的单质与其他物质反应时,既可以失去两个电子,也可以失去三个电子,也就是说在化合物中铁有+2价和+3价两种化合价,那么它的氧化物应该有多种,这些氧化物的性质如何呢?
化学式 FeO Fe2O3 Fe3O4
俗称 —— 铁红 磁性氧化铁
色态 黑色粉末 红棕色固体 黑色晶体
价态 +2 +3 1/3+2价, 2/3+3价
水溶性 不溶 不溶 不溶
与酸的反应 FeO+2H+=== Fe2++H2O遇氧化性酸生成Fe3+盐 Fe2O3+6H+===2Fe3++3H2O Fe3O4+8H+===Fe2++2Fe3++4H2O
与CO的反应 FexOy+yCO xFe+yCO2
2、铁的氢氧化物
探究实验:向两支试管中分别加入少量FeCl3和FeSO4溶液,然后滴入NaOH溶液,观察现象。
思考:(1)两试管中现象是否相同?
(2)为了使FeSO4与NaOH溶液反应现象更明显,可采取怎样的措施?
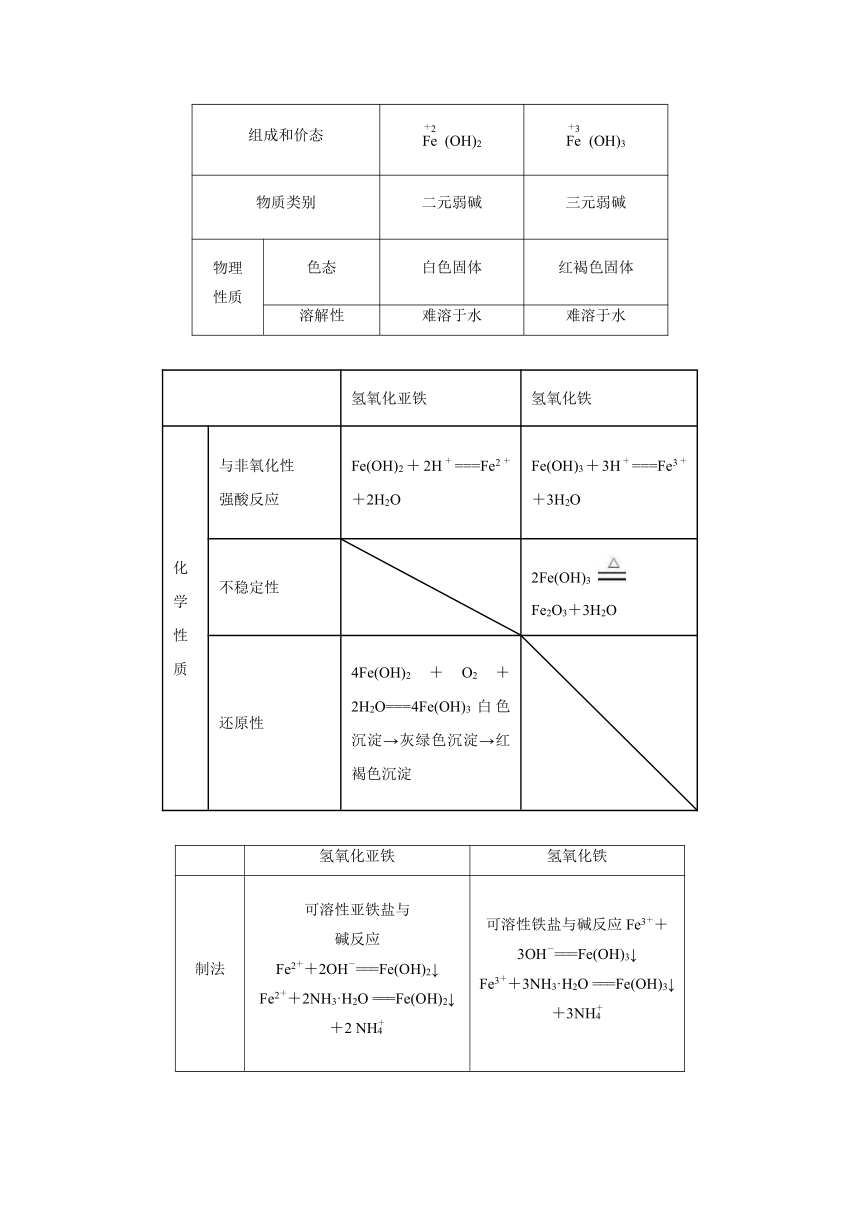
氢氧化铁和氢氧化亚铁的性质
氢氧化亚铁 氢氧化铁
组成和价态 (OH)2 (OH)3
物质类别 二元弱碱 三元弱碱
物理 性质 色态 白色固体 红褐色固体
溶解性 难溶于水 难溶于水
氢氧化亚铁 氢氧化铁
化学性质 与非氧化性 强酸反应 Fe(OH)2+2H+===Fe2++2H2O Fe(OH)3+3H+===Fe3++3H2O
不稳定性 2Fe(OH)3 Fe2O3+3H2O
还原性 4Fe(OH)2+O2+2H2O===4Fe(OH)3白色沉淀→灰绿色沉淀→红褐色沉淀
氢氧化亚铁 氢氧化铁
制法 可溶性亚铁盐与 碱反应 Fe2++2OH-===Fe(OH)2↓ Fe2++2NH3·H2O ===Fe(OH)2↓+2 NH 可溶性铁盐与碱反应Fe3++3OH-===Fe(OH)3↓ Fe3++3NH3·H2O ===Fe(OH)3↓+3NH
3、Fe(OH)2的制备
(1)操作
将吸有NaOH溶液的胶头滴管插入新制备的亚铁盐溶液的液面以下,缓慢挤出NaOH溶液。
(2)原理
Fe2++2OH-===Fe(OH)2↓
(3)注意事项
①Fe2+必须是新制的并放入Fe粉,以防Fe2+被氧化成Fe3+;②除去溶液中溶解的O2,其方法是加热煮沸NaOH溶液;③滴管末端插入试管内的液面以下;④必要时可在液面上加植物油或苯进行液封。
(4)改进方法
为了防止Fe(OH)2被O2氧化,在制备Fe(OH)2时,一般从两个角度考虑,一是反应试剂,二是反应环境。
①反应试剂
取用最新配制的FeSO4溶液;NaOH溶液加热煮沸并冷却后使用,以驱除溶液中溶解的O2。
②反应环境
方法1:装置如右图所示。在试管中加入适量的5%FeSO4溶液,并覆盖一层苯,再用长滴管注入不含O2的1 mol·L-1NaOH溶液。由于苯的液封作用,防止了生成的Fe(OH)2被氧化,因而可较长时间观察到白色的Fe(OH)2沉淀。
方法2:装置如下图所示。实验时,先打开弹簧夹K,再将分液漏斗的旋塞打开,使稀硫酸与铁粉作用,用产生的H2排出装置中的空气;然后关闭K,使生成的H2将试管中的FeSO4溶液压入NaOH溶液中,则可较长时间观察到生成的白色Fe(OH)2沉淀。若拔去广口瓶上的橡皮塞,则白色沉淀迅速变成灰绿色,最后变成红褐色。
特别提醒:①Fe(OH)2在空气中加热,在分解的同时被O2氧化,化学方程式为:4Fe(OH)2+O2 2Fe2O3+4H2O,所以在空气中加热Fe(OH)2得不到FeO。
②Fe(OH)2、Fe(OH)3制备时,铁盐与强碱或弱碱反应均可,它们均不溶于过量的碱液中。
③在含Fe2+的溶液中滴入NaOH溶液时,开始产生白色沉淀,迅速变为灰绿色[已有部分Fe(OH)2被空气氧化为Fe(OH)3],最后慢慢变为红褐色[全部氧化为Fe(OH)3],即现象是:白色沉淀→灰绿色沉淀→红褐色沉淀。
④要观察Fe(OH)2的稳定的白色沉淀,应注意以下几点:
a.排除亚铁盐溶液中的Fe3+,以免Fe3+直接与OH-反应生成Fe(OH)3。
b.尽量排除溶液中溶解的O2,以减慢Fe(OH)2被氧化生成Fe(OH)3的速率。
实验中亚铁盐溶液要现用现配制,不能用久置的亚铁盐溶液,同时在溶液中加入铁屑以防止Fe2+被氧化生成Fe3+。配制碱溶液的蒸馏水也要用新制备的,把滴管的尖嘴插入液面下再加入碱溶液,则可观察到白色絮状沉淀。
4、Fe2+和Fe3+的检验
(1)两支试管中分别加入少量FeCl2溶液和FeCl3溶液,各滴入几滴KSCN溶液,二者现象是否相同?
(2)怎样检验Fe2+和Fe3+的溶液?
(3)若向FeCl3溶液中先加入一定量Fe粉,再滴入KSCN溶液,有何现象?若再滴入氯水又会有什么现象?这说明Fe3+、Fe2+具有什么性质?
Fe2+ Fe3+
(1)观察法 浅绿色 棕黄色
(2)加碱法 ①现象:白色沉淀 灰绿色 红褐色沉淀 ②反应:Fe2++2OH-===Fe(OH)2↓(白色) 4Fe(OH)2+O2+2H2O ===4Fe(OH)3↓(红褐色) ①现象:红褐色沉淀 ②反应: Fe3++3OH-===Fe(OH)3↓(红褐色)
Fe2+ Fe3+
(3)加盐(SCN-)法 ①现象:加入KSCN溶液无明显现象,再滴入氯水变成红色溶液 ②反应:2Fe2++Cl2 ===2Fe3++2Cl- Fe3+ +3SCN-=== Fe(SCN)3(红色) ①现象:加入KSCN溶液,溶液变为红色 ②反应:Fe3++3SCN-=== Fe(SCN)3(红色)
特别提醒:含Fe3+的溶液与含SCN-的溶液混合后的现象不是出现红色沉淀,而是红色溶液。
Fe、Fe2+、Fe3+之间的三角转化
Fe的化合价为0,是最低价态,单质铁只表现还原性,Fe2+中铁的化合价为+2价,处于中间价态,Fe2+既有氧化性,又有还原性,Fe3+中铁的化合价为+3价,为最高价态,Fe3+只具有氧化性。
1、某铁的“氧化物”样品,用5 mol/L盐酸140 mL恰好完全溶解,所得溶液还能吸收标准状况下0.56 L氯气,使其中Fe2+全部转化为Fe3+。该样品可能的化学式是( )
A.Fe2O3 B.Fe3O4 C.Fe4O5 D.Fe5O7
2、m g铁粉与Fe2O3组成的混合物投入到足量的稀H2SO4中,在标准状况下收集到VL H2,所得溶液遇KSCN溶液不显红色,则混合物中Fe2O3的物质的量为( )
A.2.5V mol B.mol C.mol D.mol
3、向一定量的FeO、Fe、Fe3O4的混合物中加入100 mL 1 mol·L-1的盐酸,恰好使混合物完全溶解,放出224 mL(标准状况)的气体,在所得溶液中经检验无Fe3+。若用足量的CO在高温下还原相同质量的此混合物,能得到铁的质量是( )
A.11.2 g B.5.5 g C.2.8 g D.无法计算
4、下列物质不能通过化合反应得到的是( )
A.Al(OH)3 B.Fe(OH)3 C.Al2O3 D.Fe3O4
5、在氯化铁、氯化铜和盐酸的混合溶液中加入铁粉,待反应结束后,所剩余的固体滤出后能被磁铁吸引,则反应后溶液中存在较多的阳离子是( )
A.Cu2+ B.Fe3+ C.Fe2+ D.H+
参考答案
自主学习
一、铁单质
1、+2、+3
3、四氧化三铁和氢气。
二、铁的重要化合物
1、氧化亚铁(FeO)、氧化铁(Fe2O3)和四氧化三铁(Fe3O4)
2、铁红
3、FeSO4 + 2NaOH = Fe(OH)2 + Na2SO4
4Fe(OH)2 + O2 + 2H2O = 4 Fe(OH)3
4、KSCN
随堂检测
1、解析:该Fe的氧化物中Fe的化合价必为+2、+3两种,只要求出氯化物中Fe2+、Fe3+的物质的量,便可知其化学式。
设氧化物中Fe2+为a mol
2Fe2++Cl2===2Fe3++2Cl-
2 1
a =0.025
2∶1=a∶0.025
a=0.05 mol
再依据Cl原子守恒知Fe2+结合Cl-的物质的量为0.05×2=0.1 mol。
Fe3+结合Cl-的物质的量为0.7-0.1=0.6 mol
由FeCl3===Fe3++3Cl-知FeCl3的物质的量为0.2 mol即n(Fe3+)=0.2 mol
则n(Fe2+)∶n(Fe3+)=0.05∶0.2=1∶4
故FeO·2Fe2O3即Fe5O7
答案:D
2、解析:所得溶液遇KSCN溶液不显红色,则知反应所得溶液中无Fe3+,仅有Fe2+,则反应的化学方程式为:
Fe+H2SO4===FeSO4+H2↑
56g 22.4L
2.5Vg VL
设混合物中Fe2O3的物质的量为x,则
Fe + Fe2O3+3H2SO4===3FeSO4+3H2O
xmol xmol
依题意有:56x+160x=m-2.5V,
x=mol。
答案:B
3、答案:C
4、解析: 不溶于水的氧化物,不能与水反应制取相应的氢氧化物,如Fe2O3不溶于水,不能与水化合生成Fe(OH)3,但反应4Fe(OH)2+O2+2H2O===4Fe(OH)3为化合反应。
答案: A
5、解析: 因所剩固体能被磁铁吸引,说明Fe有剩余,2Fe3++Fe===3Fe2+,Cu2++Fe===Cu+Fe2+,2H++Fe===Fe2++H2↑,即Fe3+、Cu2+、H+等可与Fe反应,不可能存在较多。
答案: C
1、了解铁单质的物理和化学性质。
2、了解FeO、Fe2O3、Fe3O4的性质和应用。
3、掌握Fe(OH)2、Fe(OH)3的制备和性质。
4、掌握Fe2+、Fe3+的检验方法及相互转化。
一、铁单质
1、铁在自然界中主要以 +2、+3 价化合物的形式存在于矿石中。
2、铁有延展性和导热性。
3、铁的化学性质比较活泼,它能与许多物质发生化学反应。铁作为还原剂能与某些非金属单质、酸和盐溶液反应。铁与氧化性较弱的氧化剂(如盐酸、硫酸铜等)反应。红热的铁能与水蒸气发生反应,生成四氧化三铁和氢气。
二、铁的重要化合物
1、铁元素可以形成三种氧化物,分别是氧化亚铁(FeO)、氧化铁(Fe2O3)和四氧化三铁(Fe3O4)
2、Fe2O3是一种红棕色粉末,俗称铁红,通常作油漆、涂料、油墨和橡胶的红色颜料。
3、铁有两种氢氧化物,它们可以分别由相对应的可溶性盐与碱溶液反应而制的。
FeSO4 + 2NaOH = Fe(OH)2 + Na2SO4
4Fe(OH)2 + O2 + 2H2O = 4 Fe(OH)3
4、Fe3+ 的盐溶液遇到KSCN溶液时变成红色,我们可以利用这一反应检验Fe3+的存在。
5、铁盐遇到较强的还原剂会被还原成亚铁盐,亚铁盐在较强的氧化剂作用下会被氧化成铁盐,即Fe3+ 和 Fe2+ 在一定条件下是可以相互转化的。
一、铁的单质
1、铁在自然界中主要以 +2、+3 价化合物的形式存在于矿石中。
2、铁有延展性和导热性。
3、铁的化学性质比较活泼,它能与许多物质发生化学反应。铁作为还原剂能与某些非金属单质、酸和盐溶液反应。铁与氧化性较弱的氧化剂(如盐酸、硫酸铜等)反应。
在常温下铁与水不反应,在高温下铁与水蒸气发生反应。化学反应方程式为:
3Fe+4H2O(g) Fe3O4+4H2
注意:①试管口略向下倾斜。
②酒精灯先放在湿棉花的位置加热一会儿,待有部分水蒸气形成时,再将酒精灯移至放铁粉的位置加热。
③加热一会儿再将导管插入到肥皂液中,因为开始时出来的是空气。
④肥皂液不宜太稀。
⑤实验结束,应先从肥皂液中撤出导管,再移去酒精灯,以防产生倒吸现象。
特别提醒:①铁与水蒸气反应生成的是Fe3O4,不是碱。②Fe3O4为黑色晶体,俗名为磁性氧化铁。
二、 铁的氧化物
1、铁的单质与其他物质反应时,既可以失去两个电子,也可以失去三个电子,也就是说在化合物中铁有+2价和+3价两种化合价,那么它的氧化物应该有多种,这些氧化物的性质如何呢?
化学式 FeO Fe2O3 Fe3O4
俗称 —— 铁红 磁性氧化铁
色态 黑色粉末 红棕色固体 黑色晶体
价态 +2 +3 1/3+2价, 2/3+3价
水溶性 不溶 不溶 不溶
与酸的反应 FeO+2H+=== Fe2++H2O遇氧化性酸生成Fe3+盐 Fe2O3+6H+===2Fe3++3H2O Fe3O4+8H+===Fe2++2Fe3++4H2O
与CO的反应 FexOy+yCO xFe+yCO2
2、铁的氢氧化物
探究实验:向两支试管中分别加入少量FeCl3和FeSO4溶液,然后滴入NaOH溶液,观察现象。
思考:(1)两试管中现象是否相同?
(2)为了使FeSO4与NaOH溶液反应现象更明显,可采取怎样的措施?
氢氧化铁和氢氧化亚铁的性质
氢氧化亚铁 氢氧化铁
组成和价态 (OH)2 (OH)3
物质类别 二元弱碱 三元弱碱
物理 性质 色态 白色固体 红褐色固体
溶解性 难溶于水 难溶于水
氢氧化亚铁 氢氧化铁
化学性质 与非氧化性 强酸反应 Fe(OH)2+2H+===Fe2++2H2O Fe(OH)3+3H+===Fe3++3H2O
不稳定性 2Fe(OH)3 Fe2O3+3H2O
还原性 4Fe(OH)2+O2+2H2O===4Fe(OH)3白色沉淀→灰绿色沉淀→红褐色沉淀
氢氧化亚铁 氢氧化铁
制法 可溶性亚铁盐与 碱反应 Fe2++2OH-===Fe(OH)2↓ Fe2++2NH3·H2O ===Fe(OH)2↓+2 NH 可溶性铁盐与碱反应Fe3++3OH-===Fe(OH)3↓ Fe3++3NH3·H2O ===Fe(OH)3↓+3NH
3、Fe(OH)2的制备
(1)操作
将吸有NaOH溶液的胶头滴管插入新制备的亚铁盐溶液的液面以下,缓慢挤出NaOH溶液。
(2)原理
Fe2++2OH-===Fe(OH)2↓
(3)注意事项
①Fe2+必须是新制的并放入Fe粉,以防Fe2+被氧化成Fe3+;②除去溶液中溶解的O2,其方法是加热煮沸NaOH溶液;③滴管末端插入试管内的液面以下;④必要时可在液面上加植物油或苯进行液封。
(4)改进方法
为了防止Fe(OH)2被O2氧化,在制备Fe(OH)2时,一般从两个角度考虑,一是反应试剂,二是反应环境。
①反应试剂
取用最新配制的FeSO4溶液;NaOH溶液加热煮沸并冷却后使用,以驱除溶液中溶解的O2。
②反应环境
方法1:装置如右图所示。在试管中加入适量的5%FeSO4溶液,并覆盖一层苯,再用长滴管注入不含O2的1 mol·L-1NaOH溶液。由于苯的液封作用,防止了生成的Fe(OH)2被氧化,因而可较长时间观察到白色的Fe(OH)2沉淀。
方法2:装置如下图所示。实验时,先打开弹簧夹K,再将分液漏斗的旋塞打开,使稀硫酸与铁粉作用,用产生的H2排出装置中的空气;然后关闭K,使生成的H2将试管中的FeSO4溶液压入NaOH溶液中,则可较长时间观察到生成的白色Fe(OH)2沉淀。若拔去广口瓶上的橡皮塞,则白色沉淀迅速变成灰绿色,最后变成红褐色。
特别提醒:①Fe(OH)2在空气中加热,在分解的同时被O2氧化,化学方程式为:4Fe(OH)2+O2 2Fe2O3+4H2O,所以在空气中加热Fe(OH)2得不到FeO。
②Fe(OH)2、Fe(OH)3制备时,铁盐与强碱或弱碱反应均可,它们均不溶于过量的碱液中。
③在含Fe2+的溶液中滴入NaOH溶液时,开始产生白色沉淀,迅速变为灰绿色[已有部分Fe(OH)2被空气氧化为Fe(OH)3],最后慢慢变为红褐色[全部氧化为Fe(OH)3],即现象是:白色沉淀→灰绿色沉淀→红褐色沉淀。
④要观察Fe(OH)2的稳定的白色沉淀,应注意以下几点:
a.排除亚铁盐溶液中的Fe3+,以免Fe3+直接与OH-反应生成Fe(OH)3。
b.尽量排除溶液中溶解的O2,以减慢Fe(OH)2被氧化生成Fe(OH)3的速率。
实验中亚铁盐溶液要现用现配制,不能用久置的亚铁盐溶液,同时在溶液中加入铁屑以防止Fe2+被氧化生成Fe3+。配制碱溶液的蒸馏水也要用新制备的,把滴管的尖嘴插入液面下再加入碱溶液,则可观察到白色絮状沉淀。
4、Fe2+和Fe3+的检验
(1)两支试管中分别加入少量FeCl2溶液和FeCl3溶液,各滴入几滴KSCN溶液,二者现象是否相同?
(2)怎样检验Fe2+和Fe3+的溶液?
(3)若向FeCl3溶液中先加入一定量Fe粉,再滴入KSCN溶液,有何现象?若再滴入氯水又会有什么现象?这说明Fe3+、Fe2+具有什么性质?
Fe2+ Fe3+
(1)观察法 浅绿色 棕黄色
(2)加碱法 ①现象:白色沉淀 灰绿色 红褐色沉淀 ②反应:Fe2++2OH-===Fe(OH)2↓(白色) 4Fe(OH)2+O2+2H2O ===4Fe(OH)3↓(红褐色) ①现象:红褐色沉淀 ②反应: Fe3++3OH-===Fe(OH)3↓(红褐色)
Fe2+ Fe3+
(3)加盐(SCN-)法 ①现象:加入KSCN溶液无明显现象,再滴入氯水变成红色溶液 ②反应:2Fe2++Cl2 ===2Fe3++2Cl- Fe3+ +3SCN-=== Fe(SCN)3(红色) ①现象:加入KSCN溶液,溶液变为红色 ②反应:Fe3++3SCN-=== Fe(SCN)3(红色)
特别提醒:含Fe3+的溶液与含SCN-的溶液混合后的现象不是出现红色沉淀,而是红色溶液。
Fe、Fe2+、Fe3+之间的三角转化
Fe的化合价为0,是最低价态,单质铁只表现还原性,Fe2+中铁的化合价为+2价,处于中间价态,Fe2+既有氧化性,又有还原性,Fe3+中铁的化合价为+3价,为最高价态,Fe3+只具有氧化性。
1、某铁的“氧化物”样品,用5 mol/L盐酸140 mL恰好完全溶解,所得溶液还能吸收标准状况下0.56 L氯气,使其中Fe2+全部转化为Fe3+。该样品可能的化学式是( )
A.Fe2O3 B.Fe3O4 C.Fe4O5 D.Fe5O7
2、m g铁粉与Fe2O3组成的混合物投入到足量的稀H2SO4中,在标准状况下收集到VL H2,所得溶液遇KSCN溶液不显红色,则混合物中Fe2O3的物质的量为( )
A.2.5V mol B.mol C.mol D.mol
3、向一定量的FeO、Fe、Fe3O4的混合物中加入100 mL 1 mol·L-1的盐酸,恰好使混合物完全溶解,放出224 mL(标准状况)的气体,在所得溶液中经检验无Fe3+。若用足量的CO在高温下还原相同质量的此混合物,能得到铁的质量是( )
A.11.2 g B.5.5 g C.2.8 g D.无法计算
4、下列物质不能通过化合反应得到的是( )
A.Al(OH)3 B.Fe(OH)3 C.Al2O3 D.Fe3O4
5、在氯化铁、氯化铜和盐酸的混合溶液中加入铁粉,待反应结束后,所剩余的固体滤出后能被磁铁吸引,则反应后溶液中存在较多的阳离子是( )
A.Cu2+ B.Fe3+ C.Fe2+ D.H+
参考答案
自主学习
一、铁单质
1、+2、+3
3、四氧化三铁和氢气。
二、铁的重要化合物
1、氧化亚铁(FeO)、氧化铁(Fe2O3)和四氧化三铁(Fe3O4)
2、铁红
3、FeSO4 + 2NaOH = Fe(OH)2 + Na2SO4
4Fe(OH)2 + O2 + 2H2O = 4 Fe(OH)3
4、KSCN
随堂检测
1、解析:该Fe的氧化物中Fe的化合价必为+2、+3两种,只要求出氯化物中Fe2+、Fe3+的物质的量,便可知其化学式。
设氧化物中Fe2+为a mol
2Fe2++Cl2===2Fe3++2Cl-
2 1
a =0.025
2∶1=a∶0.025
a=0.05 mol
再依据Cl原子守恒知Fe2+结合Cl-的物质的量为0.05×2=0.1 mol。
Fe3+结合Cl-的物质的量为0.7-0.1=0.6 mol
由FeCl3===Fe3++3Cl-知FeCl3的物质的量为0.2 mol即n(Fe3+)=0.2 mol
则n(Fe2+)∶n(Fe3+)=0.05∶0.2=1∶4
故FeO·2Fe2O3即Fe5O7
答案:D
2、解析:所得溶液遇KSCN溶液不显红色,则知反应所得溶液中无Fe3+,仅有Fe2+,则反应的化学方程式为:
Fe+H2SO4===FeSO4+H2↑
56g 22.4L
2.5Vg VL
设混合物中Fe2O3的物质的量为x,则
Fe + Fe2O3+3H2SO4===3FeSO4+3H2O
xmol xmol
依题意有:56x+160x=m-2.5V,
x=mol。
答案:B
3、答案:C
4、解析: 不溶于水的氧化物,不能与水反应制取相应的氢氧化物,如Fe2O3不溶于水,不能与水化合生成Fe(OH)3,但反应4Fe(OH)2+O2+2H2O===4Fe(OH)3为化合反应。
答案: A
5、解析: 因所剩固体能被磁铁吸引,说明Fe有剩余,2Fe3++Fe===3Fe2+,Cu2++Fe===Cu+Fe2+,2H++Fe===Fe2++H2↑,即Fe3+、Cu2+、H+等可与Fe反应,不可能存在较多。
答案: C
