人教版(2019)化学必修第一册 2.2.1 氯气的性质 课件(共35张PPT)
文档属性
| 名称 | 人教版(2019)化学必修第一册 2.2.1 氯气的性质 课件(共35张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 434.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-24 09:07:38 | ||
图片预览











文档简介
(共35张PPT)
高中化学
氯气的性质
自主学习
一、氯气的发现
18世纪70年代,瑞典化学家______将________与_______混合加热制得了氯气,但未确认,直到1810年,英国化学家戴维才确认氯气。
舍勒
软锰矿
浓盐酸
自主学习
二、氯的存在及氯原子结构
1.氯元素在自然界中主要以______、MgCl2、CaCl2等形式存在于海水、盐湖和盐矿中。
2.氯的原子结构示意图为_________,氯原子最外电子层上有7个电子,在化学反应中很容易______1个电子,使最外层达到8个电子的稳定结构。氯气是很活泼的非金属单质,具有__________。
NaCl
得到
强氧化性
自主学习
颜色 状态 气味 毒性 溶解性(25℃)
_____色 气体 刺激性气味 _____ 1体积的水可溶解
约___体积的氯气
黄绿
有毒
2
三、氯气的性质
情境导入
学好并普及化学基础知识,保护全家人生命安全
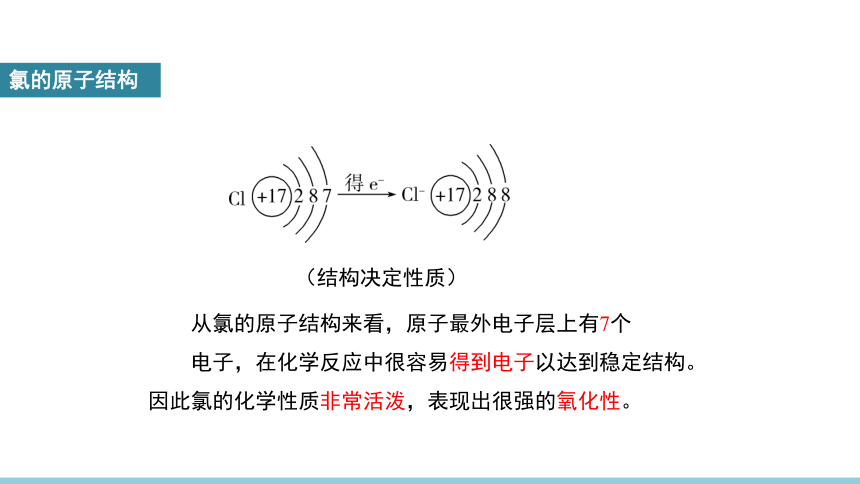
氯的原子结构
(结构决定性质)
从氯的原子结构来看,原子最外电子层上有7个
电子,在化学反应中很容易得到电子以达到稳定结构。因此氯的化学性质非常活泼,表现出很强的氧化性。
氯气的物理性质
氯气的物理性质
氯气是黄绿色有刺激性气味的气体,密度比空气大,有毒,易液化 ,
能溶于水,1体积水可溶解2体积氯气。
[想一想]
1.实验室中应怎样闻气体?
用手在瓶口轻轻扇动,使少量气体飘进鼻孔
知识小结
1.低温和加压的条件下,氯气(Cl2)可转变为液态(称为液氯)和固态,二者都是纯净物。
2.氯气比空气密度大,若遇到Cl2泄露,逃生时要逆风并向高处走。
3.氯气有毒,人吸入少量氯气会使鼻和喉头的黏膜受到刺激,引起咳嗽和胸部疼痛,吸入大量氯气会中毒致死。因此做相关实验时要注意安全。
4.因氯气的密度比空气大,故可采用向上排空气法收集氯气。
氯气的化学性质
1、与金属单质的反应
①与钠的反应:
②与铁的反应:
③与铜的反应:
注意:氯气的氧化性很强,与变价金属反应时,通常将其氧化为高价态。
氯气的化学性质
2Na+Cl2===2NaCl
△
2Fe+3Cl2===2FeCl3
△
Cu+Cl2===CuCl2
△
Na在Cl2中燃烧,产生白烟
Fe在Cl2燃烧,产生棕红色烟,溶于水得棕黄色溶液
Cu在Cl2燃烧,棕黄色烟,
溶于水后溶液呈蓝绿色
氯气的化学性质
2、与非金属单质的反应
氯气的化学性质
氯气能与大多数非金属单质发生化合反应。以H2为例:
[实验装置]
氯气的化学性质
2、与非金属单质的反应
氯气的化学性质
氯气能与大多数非金属单质发生化合反应。以H2为例:
[实验操作]
在空气中点燃氢气,然后把导管缓慢伸入盛满氯气的集气瓶中,观察现象
氯气的化学性质
2、与非金属单质的反应
氯气的化学性质
氯气能与大多数非金属单质发生化合反应。以H2为例:
[实验现象]
观察到纯净的H2在Cl2中安静的燃烧,发出苍白的火焰。燃烧结束后,抽去盖在集气瓶瓶口处的玻璃片,集气瓶瓶口上方出现白雾。
氯气的化学性质
2、与非金属单质的反应
氯气的化学性质
氯气能与大多数非金属单质发生化合反应。以H2为例:
[实验结论]
纯净的H2可以在Cl2中安静的燃烧,反应的化学方程式为
H2+Cl2====2HCl
点燃
知识小结
1.H2与Cl2混合,在强光照射下可能会发生爆炸。
2.为了保证实验安全,H2在点燃之前必须先检验纯度,只有符合点燃纯度要求的H2才能点燃。
3.实际工业生产可利用H2在Cl2中燃烧的反应制备盐酸。
4.可燃物与氧化剂(O2、Cl2等)在一定条件(点燃、灼烧等)下发生的发光发热的剧烈反应都可以称为燃烧,即燃烧不一定要有O2参与。如H2可在Cl2中燃烧。
氯气的化学性质
3、与水的反应
氯气的化学性质
①与水反应的化学方程式:
与水反应的离子方程式:
Cl2+H2O HCl+HClO
Cl2+H2O H++Cl-+HClO
[想一想]
2.氯水的成分?
三分子:水、氯气、次氯酸;
四离子:H+、Cl-、ClO-、OH-
[想一想]
3.氯水的保存方法?
棕色试剂瓶,避光保存;不可久置
②液氯、新制氯水、久置氯水的区别
液氯 新制氯水 久置氯水
成分 氯气 三分子:水、氯气、次氯酸 四离子:H+、Cl-、ClO-、OH- 氯化氢水溶液(盐酸)
分类 纯净物 混合物 混合物
颜色 黄绿色 浅黄绿色 接近无色
氯气的化学性质
3、与水的反应
氯气的化学性质
氯气的性质
化学性质
a.Cl2(氧化性):能氧化S2-、SO32-、Fe2+、I-、Br-等
b.HClO(不稳定性、漂白性):光(或加热)有气泡产生使湿润的有色布条或品红溶液褪色;
3、与水的反应
③新制氯水的性质
Cl2+H2O HCl+HClO
Cl2+H2O H++Cl-+HClO
氯气用于杀菌、消毒、漂白,就是因为和水反应生成了次氯酸,利用次氯酸的强氧化性。
氯气的性质
化学性质
3、与水的反应
③新制氯水的性质
d.H+(酸性):加入碳酸盐、活泼金属产生气泡;
c.Cl-(沉淀性):加入硝酸酸化的硝酸银,产生白色沉淀
氯气使紫色石蕊溶液先变红后褪色。
氯气的化学性质
3、与水的反应
氯气的化学性质
a.一元弱酸(比碳酸弱)
b.强氧化性(杀菌、消毒、漂白)
c.不稳定(见光或受热分解)
化学方程式: 2HClO====2HCl+O2↑
光照
④次氯酸的性质
氯气的化学性质
4、与碱的反应
氯气的化学性质
①Cl2+2NaOH===NaCl+NaClO+H2O
(常用于尾气吸收,除去多余氯气)
漂白液主要成分是 NaCl、NaClO ,有效成分是NaClO 。
氯气的化学性质
4、与碱的反应
氯气的化学性质
②2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O
漂白粉其主要成分:CaCl2、Ca(ClO)2 ,
有效成分:Ca(ClO)2。
漂粉精的有效成分:Ca(ClO)2。
漂白原理:Ca(ClO)2+H2O+CO2===CaCO3↓+2HClO
氯气的化学性质
4、与碱的反应
氯气的化学性质
③次氯酸盐的强氧化性
a.漂白性:ClO-是一种弱酸的酸根离子。
漂白液或漂白粉在潮湿的空气中,会与二氧化碳反应生成HClO,故漂白液、漂白粉具有漂白性。
氯气的化学性质
4、与碱的反应
氯气的化学性质
③次氯酸盐的强氧化性
b.强氧化性:ClO-不论在酸性还是碱性条件下都能跟S2-、SO32-、I-、Fe2+等发生氧化还原反应,
即ClO-与S2-、SO32-、I-、Fe2+不能大量共存。
氯气的化学性质
5、与还原性无机化合物反应
氯气的化学性质
①与碘化钾溶液反应:2I-+Cl2===I2+2Cl-
②与SO2水溶液反应:Cl2+SO2+2H2O===4H++2Cl-+SO42-
③与FeCl2溶液反应:2Fe2++Cl2===2Fe3++2Cl-
随堂检测
1.下列物质中含有Cl-的是( )
A.液
B.KClO3溶液
C.HCl气体
D.NaCl溶液
D
随堂检测
2.下列微粒中化学性质最活泼的是( )
A.Cl B.Cl- C.HCl D.HClO4
A
随堂检测
3.下列各组物质在一定条件下反应,其中生成+3价铁盐的是( )
A.铁和稀硫酸
B.铁和氯化铜溶液
C.铁和氯气
D.铁和氧气
C
随堂检测
4.下列关于氯气的说法中正确的是( )
A.铜丝在氯气中燃烧产生棕色的烟,产物溶于水后得到棕色的溶液
B.铁与氯气、盐酸反应均生成三氯化铁
C.氢气在氯气中燃烧产生苍白色火焰,瓶口有白雾出现
D.钠在氯气中燃烧产生白色火焰,并有白烟生成
C
随堂检测
5.自来水可以用氯气消毒。如果实验室中临时没有蒸馏水,可以用自来水配制某些急需的药品,但有些药品若用自来水配制,则明显会导致药品变质。下列哪些药品不能用自来水配制( )
A.Na2SO4 B.NaCl C.AgNO3 D. AlCl3
C
随堂检测
6.有关Cl2的性质,下列说法不正确的是( )
A.Cl2有毒但可用于自来水消毒
B.能与NaOH溶液反应生成两种正盐
C.能与Fe反应生成FeCl2
D.一定条件下与H2反应产生苍白色火焰
C
知识小结
氯气的化学性质
A
氯水的性质
B
高中化学
再见
高中化学
氯气的性质
自主学习
一、氯气的发现
18世纪70年代,瑞典化学家______将________与_______混合加热制得了氯气,但未确认,直到1810年,英国化学家戴维才确认氯气。
舍勒
软锰矿
浓盐酸
自主学习
二、氯的存在及氯原子结构
1.氯元素在自然界中主要以______、MgCl2、CaCl2等形式存在于海水、盐湖和盐矿中。
2.氯的原子结构示意图为_________,氯原子最外电子层上有7个电子,在化学反应中很容易______1个电子,使最外层达到8个电子的稳定结构。氯气是很活泼的非金属单质,具有__________。
NaCl
得到
强氧化性
自主学习
颜色 状态 气味 毒性 溶解性(25℃)
_____色 气体 刺激性气味 _____ 1体积的水可溶解
约___体积的氯气
黄绿
有毒
2
三、氯气的性质
情境导入
学好并普及化学基础知识,保护全家人生命安全
氯的原子结构
(结构决定性质)
从氯的原子结构来看,原子最外电子层上有7个
电子,在化学反应中很容易得到电子以达到稳定结构。因此氯的化学性质非常活泼,表现出很强的氧化性。
氯气的物理性质
氯气的物理性质
氯气是黄绿色有刺激性气味的气体,密度比空气大,有毒,易液化 ,
能溶于水,1体积水可溶解2体积氯气。
[想一想]
1.实验室中应怎样闻气体?
用手在瓶口轻轻扇动,使少量气体飘进鼻孔
知识小结
1.低温和加压的条件下,氯气(Cl2)可转变为液态(称为液氯)和固态,二者都是纯净物。
2.氯气比空气密度大,若遇到Cl2泄露,逃生时要逆风并向高处走。
3.氯气有毒,人吸入少量氯气会使鼻和喉头的黏膜受到刺激,引起咳嗽和胸部疼痛,吸入大量氯气会中毒致死。因此做相关实验时要注意安全。
4.因氯气的密度比空气大,故可采用向上排空气法收集氯气。
氯气的化学性质
1、与金属单质的反应
①与钠的反应:
②与铁的反应:
③与铜的反应:
注意:氯气的氧化性很强,与变价金属反应时,通常将其氧化为高价态。
氯气的化学性质
2Na+Cl2===2NaCl
△
2Fe+3Cl2===2FeCl3
△
Cu+Cl2===CuCl2
△
Na在Cl2中燃烧,产生白烟
Fe在Cl2燃烧,产生棕红色烟,溶于水得棕黄色溶液
Cu在Cl2燃烧,棕黄色烟,
溶于水后溶液呈蓝绿色
氯气的化学性质
2、与非金属单质的反应
氯气的化学性质
氯气能与大多数非金属单质发生化合反应。以H2为例:
[实验装置]
氯气的化学性质
2、与非金属单质的反应
氯气的化学性质
氯气能与大多数非金属单质发生化合反应。以H2为例:
[实验操作]
在空气中点燃氢气,然后把导管缓慢伸入盛满氯气的集气瓶中,观察现象
氯气的化学性质
2、与非金属单质的反应
氯气的化学性质
氯气能与大多数非金属单质发生化合反应。以H2为例:
[实验现象]
观察到纯净的H2在Cl2中安静的燃烧,发出苍白的火焰。燃烧结束后,抽去盖在集气瓶瓶口处的玻璃片,集气瓶瓶口上方出现白雾。
氯气的化学性质
2、与非金属单质的反应
氯气的化学性质
氯气能与大多数非金属单质发生化合反应。以H2为例:
[实验结论]
纯净的H2可以在Cl2中安静的燃烧,反应的化学方程式为
H2+Cl2====2HCl
点燃
知识小结
1.H2与Cl2混合,在强光照射下可能会发生爆炸。
2.为了保证实验安全,H2在点燃之前必须先检验纯度,只有符合点燃纯度要求的H2才能点燃。
3.实际工业生产可利用H2在Cl2中燃烧的反应制备盐酸。
4.可燃物与氧化剂(O2、Cl2等)在一定条件(点燃、灼烧等)下发生的发光发热的剧烈反应都可以称为燃烧,即燃烧不一定要有O2参与。如H2可在Cl2中燃烧。
氯气的化学性质
3、与水的反应
氯气的化学性质
①与水反应的化学方程式:
与水反应的离子方程式:
Cl2+H2O HCl+HClO
Cl2+H2O H++Cl-+HClO
[想一想]
2.氯水的成分?
三分子:水、氯气、次氯酸;
四离子:H+、Cl-、ClO-、OH-
[想一想]
3.氯水的保存方法?
棕色试剂瓶,避光保存;不可久置
②液氯、新制氯水、久置氯水的区别
液氯 新制氯水 久置氯水
成分 氯气 三分子:水、氯气、次氯酸 四离子:H+、Cl-、ClO-、OH- 氯化氢水溶液(盐酸)
分类 纯净物 混合物 混合物
颜色 黄绿色 浅黄绿色 接近无色
氯气的化学性质
3、与水的反应
氯气的化学性质
氯气的性质
化学性质
a.Cl2(氧化性):能氧化S2-、SO32-、Fe2+、I-、Br-等
b.HClO(不稳定性、漂白性):光(或加热)有气泡产生使湿润的有色布条或品红溶液褪色;
3、与水的反应
③新制氯水的性质
Cl2+H2O HCl+HClO
Cl2+H2O H++Cl-+HClO
氯气用于杀菌、消毒、漂白,就是因为和水反应生成了次氯酸,利用次氯酸的强氧化性。
氯气的性质
化学性质
3、与水的反应
③新制氯水的性质
d.H+(酸性):加入碳酸盐、活泼金属产生气泡;
c.Cl-(沉淀性):加入硝酸酸化的硝酸银,产生白色沉淀
氯气使紫色石蕊溶液先变红后褪色。
氯气的化学性质
3、与水的反应
氯气的化学性质
a.一元弱酸(比碳酸弱)
b.强氧化性(杀菌、消毒、漂白)
c.不稳定(见光或受热分解)
化学方程式: 2HClO====2HCl+O2↑
光照
④次氯酸的性质
氯气的化学性质
4、与碱的反应
氯气的化学性质
①Cl2+2NaOH===NaCl+NaClO+H2O
(常用于尾气吸收,除去多余氯气)
漂白液主要成分是 NaCl、NaClO ,有效成分是NaClO 。
氯气的化学性质
4、与碱的反应
氯气的化学性质
②2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O
漂白粉其主要成分:CaCl2、Ca(ClO)2 ,
有效成分:Ca(ClO)2。
漂粉精的有效成分:Ca(ClO)2。
漂白原理:Ca(ClO)2+H2O+CO2===CaCO3↓+2HClO
氯气的化学性质
4、与碱的反应
氯气的化学性质
③次氯酸盐的强氧化性
a.漂白性:ClO-是一种弱酸的酸根离子。
漂白液或漂白粉在潮湿的空气中,会与二氧化碳反应生成HClO,故漂白液、漂白粉具有漂白性。
氯气的化学性质
4、与碱的反应
氯气的化学性质
③次氯酸盐的强氧化性
b.强氧化性:ClO-不论在酸性还是碱性条件下都能跟S2-、SO32-、I-、Fe2+等发生氧化还原反应,
即ClO-与S2-、SO32-、I-、Fe2+不能大量共存。
氯气的化学性质
5、与还原性无机化合物反应
氯气的化学性质
①与碘化钾溶液反应:2I-+Cl2===I2+2Cl-
②与SO2水溶液反应:Cl2+SO2+2H2O===4H++2Cl-+SO42-
③与FeCl2溶液反应:2Fe2++Cl2===2Fe3++2Cl-
随堂检测
1.下列物质中含有Cl-的是( )
A.液
B.KClO3溶液
C.HCl气体
D.NaCl溶液
D
随堂检测
2.下列微粒中化学性质最活泼的是( )
A.Cl B.Cl- C.HCl D.HClO4
A
随堂检测
3.下列各组物质在一定条件下反应,其中生成+3价铁盐的是( )
A.铁和稀硫酸
B.铁和氯化铜溶液
C.铁和氯气
D.铁和氧气
C
随堂检测
4.下列关于氯气的说法中正确的是( )
A.铜丝在氯气中燃烧产生棕色的烟,产物溶于水后得到棕色的溶液
B.铁与氯气、盐酸反应均生成三氯化铁
C.氢气在氯气中燃烧产生苍白色火焰,瓶口有白雾出现
D.钠在氯气中燃烧产生白色火焰,并有白烟生成
C
随堂检测
5.自来水可以用氯气消毒。如果实验室中临时没有蒸馏水,可以用自来水配制某些急需的药品,但有些药品若用自来水配制,则明显会导致药品变质。下列哪些药品不能用自来水配制( )
A.Na2SO4 B.NaCl C.AgNO3 D. AlCl3
C
随堂检测
6.有关Cl2的性质,下列说法不正确的是( )
A.Cl2有毒但可用于自来水消毒
B.能与NaOH溶液反应生成两种正盐
C.能与Fe反应生成FeCl2
D.一定条件下与H2反应产生苍白色火焰
C
知识小结
氯气的化学性质
A
氯水的性质
B
高中化学
再见
