京改版九年级化学上册5.3化合价课件(共14张PPT)
文档属性
| 名称 | 京改版九年级化学上册5.3化合价课件(共14张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 726.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 北京课改版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-23 00:00:00 | ||
图片预览





文档简介
(共14张PPT)
化合价
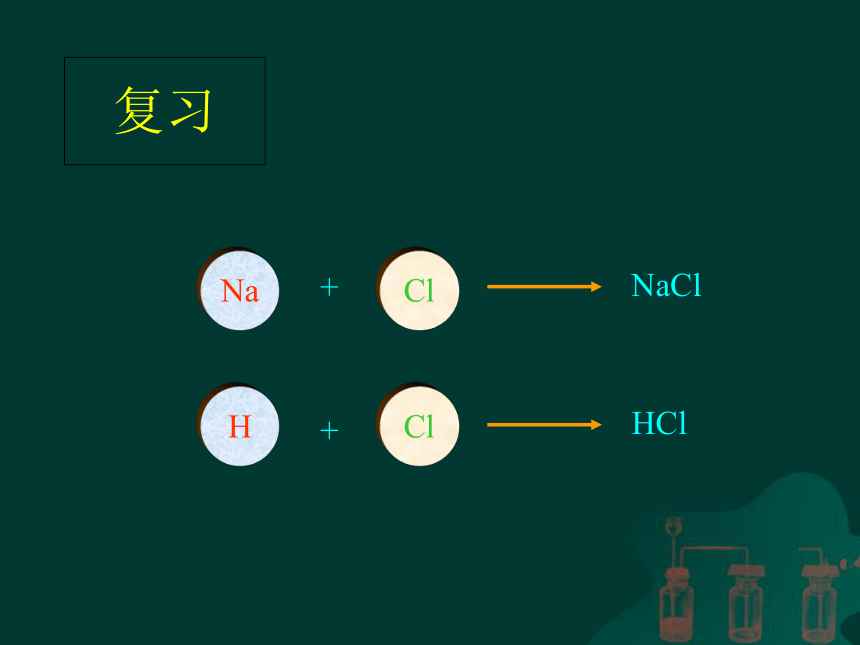
Na
Cl
复习
NaCl
H
Cl
HCl
+
+
Na
NaCl
Cl
氯化钠的形成
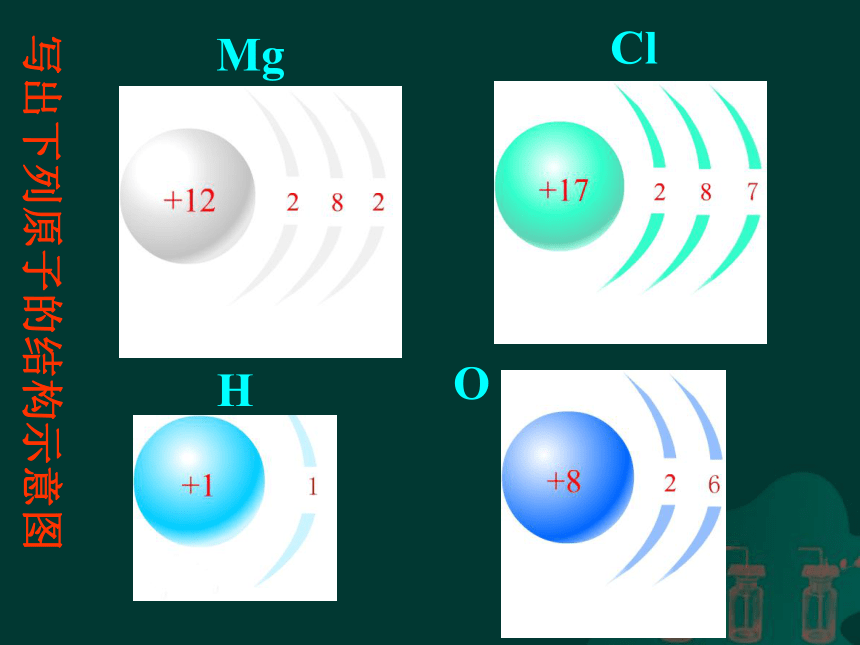
Cl
Mg
O
H
写出下列原子的结构示意图
氯化镁失去镁最外层两个电子形成Mg2+,Cl得一个电子形成Cl-,相反电荷的离子互相作用,形成离子化合物MgCl2。
在水分子中,一个氧原子提供两个电子分别与两个氢原子提供的两个电子形成两对共用电子对,形成稳定的共价化合物水。
小结
据原子结构,元素的原子在结合时,原子个数是一定的,不能随意改动。这是元素形成化合物时的一种性质。这种性质就是元素的化合价。
化合价
化合价
注意
化合价有正价和负价
化合价的实质:是元素在形成化合物时表现出的化学性质。取决于原子最外层电子数。
因为化合价是在形成化合物时表现出的性质,所以单质的化合价为零。
化合价规律:
思考
(1)在离子化合物和共价化合物中,元素化合价的实质是否相同?
(2)离子化合物和共价化合物中元素化合价的正负与数值是如何确定的?
(3)化合价的原则是什么?
元素化合价的确定
化合物
离子化合物
共价化合物
数值
正价
负价
原则
单质中元素的化合价为零
一个原子得失电子
的数目
一个原子共用电子
对数
一个原子失去电子
的数目
电子对偏离的原子
电子对偏向的原子
一个原子得到电子
的数目
化合物中正负化合价的代数和为零
练习
(1)离子化合物硫化钠的化学式为Na2S。在硫化钠中,1个硫原子得 个电子,硫元素为 价。一个钠原子失 电子,钠元素为 价。
(2)共价化合物硫化氢的化学式为H2S。在硫化氢中,1个氢原子与硫原子共用电子对的数目是 ,1个硫原子与氢原子共用电子对的数目是 ,共用电子对偏离 ,偏向 ,氢元素为 价,硫元素为 价。
(3)已知氢元素为+1价,氧元素为-2价。标出下列物质中各元素的化合价。
H2O ,CaO,NaOH,H2SO4,Cu,H2S,K2O
常见原子团的化合价
化合物中,通常氢为+1价,氧为-2价,金属元素显正价
元素的变价:许多元素的原子在不同的条件下可显示不同的化合价。
例:Cu为+1,+2,Fe为+2,+3
熟记原子团的化合价:原子团的化合价是组成元素的化合价的代数和。
常见原子团根价
氢氧根: 硝酸根: 硫酸根:
碳酸根: 铵根: 磷酸根:
顺口溜
一价氢、氯、氧钠、钾
二价氧、镁、钙、钡、锌
三铝四硅五价磷
铁二三来铜二一
二四六硫要记真
标出下列划线元素的化合价
Na2O Cu(OH)2 WO3
H2SO4 Na2CO3 KNO3
NH4NO3
练习
+1 +2 +6
+6 +1 +5
-3 +5
化合价
Na
Cl
复习
NaCl
H
Cl
HCl
+
+
Na
NaCl
Cl
氯化钠的形成
Cl
Mg
O
H
写出下列原子的结构示意图
氯化镁失去镁最外层两个电子形成Mg2+,Cl得一个电子形成Cl-,相反电荷的离子互相作用,形成离子化合物MgCl2。
在水分子中,一个氧原子提供两个电子分别与两个氢原子提供的两个电子形成两对共用电子对,形成稳定的共价化合物水。
小结
据原子结构,元素的原子在结合时,原子个数是一定的,不能随意改动。这是元素形成化合物时的一种性质。这种性质就是元素的化合价。
化合价
化合价
注意
化合价有正价和负价
化合价的实质:是元素在形成化合物时表现出的化学性质。取决于原子最外层电子数。
因为化合价是在形成化合物时表现出的性质,所以单质的化合价为零。
化合价规律:
思考
(1)在离子化合物和共价化合物中,元素化合价的实质是否相同?
(2)离子化合物和共价化合物中元素化合价的正负与数值是如何确定的?
(3)化合价的原则是什么?
元素化合价的确定
化合物
离子化合物
共价化合物
数值
正价
负价
原则
单质中元素的化合价为零
一个原子得失电子
的数目
一个原子共用电子
对数
一个原子失去电子
的数目
电子对偏离的原子
电子对偏向的原子
一个原子得到电子
的数目
化合物中正负化合价的代数和为零
练习
(1)离子化合物硫化钠的化学式为Na2S。在硫化钠中,1个硫原子得 个电子,硫元素为 价。一个钠原子失 电子,钠元素为 价。
(2)共价化合物硫化氢的化学式为H2S。在硫化氢中,1个氢原子与硫原子共用电子对的数目是 ,1个硫原子与氢原子共用电子对的数目是 ,共用电子对偏离 ,偏向 ,氢元素为 价,硫元素为 价。
(3)已知氢元素为+1价,氧元素为-2价。标出下列物质中各元素的化合价。
H2O ,CaO,NaOH,H2SO4,Cu,H2S,K2O
常见原子团的化合价
化合物中,通常氢为+1价,氧为-2价,金属元素显正价
元素的变价:许多元素的原子在不同的条件下可显示不同的化合价。
例:Cu为+1,+2,Fe为+2,+3
熟记原子团的化合价:原子团的化合价是组成元素的化合价的代数和。
常见原子团根价
氢氧根: 硝酸根: 硫酸根:
碳酸根: 铵根: 磷酸根:
顺口溜
一价氢、氯、氧钠、钾
二价氧、镁、钙、钡、锌
三铝四硅五价磷
铁二三来铜二一
二四六硫要记真
标出下列划线元素的化合价
Na2O Cu(OH)2 WO3
H2SO4 Na2CO3 KNO3
NH4NO3
练习
+1 +2 +6
+6 +1 +5
-3 +5
同课章节目录
- 第1章 走进化学
- 第一节 化学让世界更美好
- 第二节 实验是化学的基础
- 第2章 空气之谜
- 第一节 空气
- 第二节 氧气的制法
- 第三节 氧气的性质
- 第3章 构成物质的微粒
- 第一节 原子
- 第二节 原子核外电子的排布 离子
- 第三节 分子
- 第4章 最常见的液体——水
- 第一节 水的净化
- 第二节 水的变化
- 第三节 水资源的开发、利用和保护
- 第5章 化学元素与物质组成的表示
- 第一节 初步认识化学元素
- 第二节 物质组成的表示——化学式
- 第三节 化合价
- 第6章 燃烧的学问
- 第一节 探索燃烧与灭火
- 第二节 化学反应中的能量变化
- 第三节 化石燃料
- 第7章 化学反应的定量研究
- 第一节 质量守恒定律
- 第二节 化学方程式
- 第三节 依据化学方程式的简单计算
- 第8章 碳的世界
- 第一节 碳的单质
- 第二节 二氧化碳的性质和用途
- 第三节 二氧化碳的实验室制法
