化学人教版(2019)必修第一册3.1.1铁的单质(共31张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册3.1.1铁的单质(共31张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 56.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-24 10:25:16 | ||
图片预览









文档简介
(共31张PPT)
高中化学
第1课时 铁的单质
铁在自然界中的存在
陨铁 铁单质
赤铁矿(氧化铁Fe2O3)
磁铁矿(四氧化三铁Fe3O4)
化合态
丹霞地貌的岩石
因含有Fe2O3而呈红色
⒈以单质形态存在
⒉以化合物(+2、+3)形态存在:
铁在自然界中的存在
自然界中的铁,主要以+2价和+3价化合物的形态存在于矿石中
铁元素在地壳中的含量仅次于氧、硅和铝,居第四位。
陨铁
赤铁矿(Fe2O3)
黄铁矿(FeS2)
自然界中的铁,主要以+2价和+3价化合物的形态存在于矿石中
铁在自然界中的存在
铁在自然界中的存在
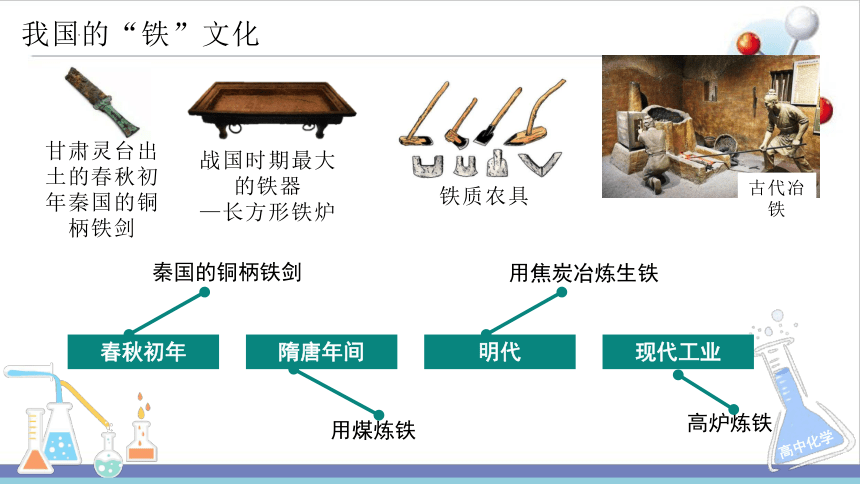
春秋初年
隋唐年间
明代
现代工业
秦国的铜柄铁剑
用煤炼铁
用焦炭冶炼生铁
高炉炼铁
我国的“铁”文化
甘肃灵台出土的春秋初年秦国的铜柄铁剑
战国时期最大的铁器
—长方形铁炉
铁质农具
古代冶铁
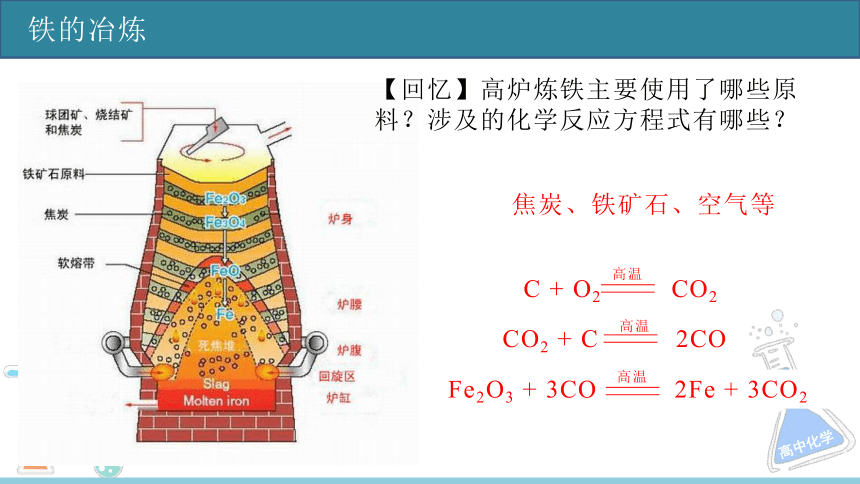
铁的冶炼
Fe2O3 + 3CO 2Fe + 3CO2
高温
C + O2 CO2
高温
【回忆】高炉炼铁主要使用了哪些原料?涉及的化学反应方程式有哪些?
焦炭、铁矿石、空气等
CO2 + C 2CO
高温
一、铁的物理性质
【活动】阅读课本P65第一段并结合所学知识,归纳铁单质的物理性质。
纯的铁块
铁粉
铁线
导热性
导磁性
一、铁的物理性质
颜色 状态 密度 熔点 沸点 金属共性 特性
固体
银白色,有金属光泽
7.86
g/cm3
1535℃
2750℃
导热、导电、延展性好
能被磁体吸引
铁粉
铁粉的晶体几何形状被破坏,铁粉没有吸收完的光被漫反射,能够进入人眼的可见光很少,所以呈黑色。
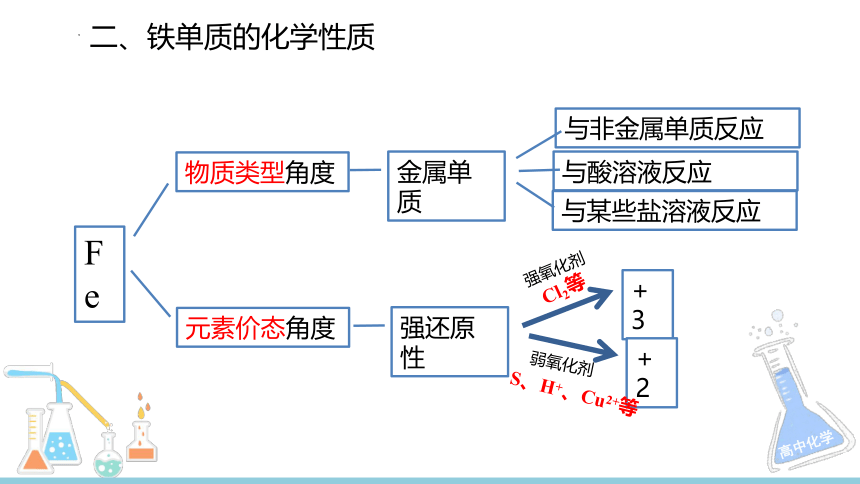
Fe
物质类型角度
元素价态角度
强还原性
金属单质
+3
强氧化剂
+2
弱氧化剂
与非金属单质反应
与酸溶液反应
与某些盐溶液反应
S、H+、Cu2+等
Cl2等
二、铁单质的化学性质
(1)与O2反应
3Fe+2O2=== Fe3O4
点燃
剧烈燃烧,火星四射
铁在潮湿的空气中易被腐蚀,生成铁锈,
点燃:
常温:
(2)与Cl2反应
剧烈燃烧,生成棕色烟
Fe2O3·xH2O。
(3)与S反应
Fe+S===FeS
生成黑褐色固体
2Fe+3Cl2===2FeCl3
1、与非金属单质反应
氧化性:Cl2 > S
(3)Fe在足量Cl2中燃烧生成FeCl3,在少量Cl2中燃烧生成FeCl2( )
(2)根据铁与Cl2、S反应的条件可以判断Cl2、S的氧化性强弱( )
1.判断下列描述的正误(正确的打“√”,错误的打“×”)
(1)FeS、FeCl2、FeCl3均可以通过单质化合得到( )
×
×
[解析] FeCl2不能通过单质化合得到。
×
[解析]根据反应产物可判断Cl2、S的氧化性的强弱。
[解析] 铁与氯气反应只能生成FeCl3,与氯气的用量无关。
2、与酸(特指稀硫酸、盐酸)反应:
Fe + 2HCl = FeCl2 + H2↑
Fe + H2SO4 = FeSO4 + H2 ↑
知识小贴士:
与稀硝酸或者在加热条件下与浓硫酸、浓硝酸发生反应,但是无H2产生
离子方程式:Fe+2H+=Fe2++H2↑
常温下,Fe遇浓硫酸、浓硝酸发生钝化(表面生成致密的氧化膜)
3、铁与部分盐溶液反应
把溶液中活泼性小于铁的金属置换出来
a. 与CuSO4溶液反应:Fe+CuSO4=FeSO4+Cu
b. 与AgNO3溶液反应:Fe+2AgNO3=Fe(NO3)2+2Ag
c. 与FeCl3溶液反应:Fe+2FeCl3=3FeCl2
Fe+Cu2+=Fe2++Cu
Fe+2Ag+=Fe2++2Ag
Fe+2Fe3+=3Fe2+
[思考]
请写出铁与氯气反应,与盐酸反应,和硫酸铜溶液反应的化学方程式,并思考下面两个问题。
问题1:铁的化合价变化有何异同?
问题2:为什么会产生这样的异同?
2Fe+3Cl2=2FeCl3
Fe+2HCl=2FeCl2+H2↑
Fe+CuSO4=FeSO4+Cu
0
0
0
+2
+2
+3
Fe+较弱的氧化剂(HCl、CuSO4)→+2价铁的化合物
Fe+较强的氧化剂(Cl2)→+3价铁的化合物
产生异同的原因:
铁单质有还原性:
一、铁的单质
【思考】在钢铁厂的生产过程中,炽热的铁水或钢水注入模具之前,模具必须进行充分的干燥处理,不得留有水,这是为什么呢?
钢水注入干燥的模具
二、铁的化学性质
1. 铁和水在常温下能反应吗?如何提供水蒸气?如何提供反应所需的高温?
2. 预测铁与水反应的产物是什么?从物质的类别和元素的价态的变化完成对反应的预测。
3. 如何验证铁与水反应生成的气体产物?
4. 如何组装并完成实验?
实验探究:
Fe FeO Fe2O3 Fe3O4 Fe(OH)2 Fe(OH)3
黑色 黑色 红棕色 黑色 白色 红褐色
受热 不分解 受热 不分解 受热 不分解 受热 不分解 不稳定 500 ℃
分解为Fe2O3
①如何验证气体产物?
Fe + H2O(g) → Fe3O4 + H2
高温
②进行还原铁粉与水蒸气反应并验证气体产物,其实验装置应有几部分构成?
水蒸气的产生装置
水蒸气与铁粉的反应装置
气体产物检验装置
实验探究
思考与讨论
4、铁与水蒸气反应
二、铁的化学性质
实验装置 装置1 装置2
4、铁与水蒸气反应
二、铁的化学性质
操作及现象 铁粉逐渐红热,产生大量的肥皂泡
实验 结论
实验 说明
用小试管收集一试管气体,点燃,听到轻微的“噗”声,产生淡蓝色火焰,证明生成H2
用火柴点燃肥皂泡,听到爆鸣声,证明生成H2
①湿棉花的作用是在受热时提供反应所需的水蒸气;
②酒精灯的火焰用防风罩套住,可以使加热效果更好;
③肥皂液在该实验中可以起到“收集”氢气的作用。
铁能与水蒸气反应,并有H2生成,反应的化学方程式为
3Fe+4H2O(g) Fe3O4+4H2
高温
改进点:1.改变水蒸气的生成方式 2.氢气的收集、检验方式
生成水蒸气
排水法收集H2
向下排空气法
短进长出收集H2
思考:从水蒸气生成方式和氢气的检验方式角度思考,如何改进实验装置?
铁有+2、+3价两种价态,单质铁与 反应时只生成+3价铁;与 反应时只生成+2价铁;与 反应时既生成+2价铁也生成+3价铁。
所选试剂:①Cl2 ②O2 ③H2O(g) ④S ⑤盐酸
⑦稀硫酸 ⑧CuSO4溶液
①
④⑤⑦⑧
②③
用如图所示装置进行Fe与水蒸气反应的实验,下列有关说法不正确的是( )
A.装置A的作用是为实验提供持续不断的水蒸气
B.装置B中反应的化学方程式是2Fe+3H2O(g)===Fe2O3+3H2
C.装置C中加入的固体干燥剂可能是碱石灰
D.点燃装置D处的气体前必须检验气体的纯度
高温
B
(1)A 装置的作用是 ,烧瓶底部放碎瓷片的作用是 。
(2) 写出装置B中发生反应的化学方程式: 。
(3)D的作用是 。
(4)E中的实验现象是 。
(5)A 、B两个装置中应先点燃 处的酒精灯(或酒精喷灯 ) ,点燃 E处酒精灯之前应进行的操 作是 。
1.某化学兴趣小组利用如图装置(铁架台及夹持装置已省略)进行“铁与水蒸气反应”的实验,并检验产物的性质,请回答下列问题:
收集H2并检验其纯度
产生水蒸气
防止加热时液体暴沸
吸收未反应的水蒸气,干燥H2
黑色固体变成红色,玻璃管内壁上有水珠生成
A
【小结】金属与水的反应
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu ……
与冷水剧烈反应生成
碱和氢气
与热水反应生成
碱和氢气
不与水反应
高温下与水蒸气反应生成
氧化物和氢气
1、活泼金属如K、Na等可与冷水迅速剧烈反应(放热反应),生成可溶性碱和H2。
2、Mg与冷水反应缓慢,但在加热条件(或用沸水), Mg与水的反应加快。Al与冷水很难反应,与沸水反应缓慢。
B. 从1L2mol/L的H2SO4溶液中取出0.5L,该溶液的浓度为1mol/L
B,溶液的浓度与溶液的体积多少无关,错误;
3.下列有关物质性质与用途具有对应关系的是
(4)由氯离子的检验方法可知,检验可能存在的物质所用试剂为稀硝酸、硝酸银溶液,故答案为:稀硝酸、硝酸银溶液。
(1)一定不存在的物质是CaCO3、Na2SO4、CuSO4,故答案为:CaCO3、Na2SO4、CuSO4;
B. 淀粉溶液中:K+、NH4+、SO42-、I-
③滴定前读数是0.01ml,滴定后的读数是27.60ml,因此实际消耗硫代硫酸钠溶液的体积是27.50ml,则根据反应式2BaCrO4+6I-+16H+=3I2+2Ba2++2Cr3++8H2O、2S2O32一+I2=S4O62—+2 I-可知Cr3+~3S2O32一,所以废水Ba2+的浓度为 。
则2C(s)+2H2(g)+O2(g)=CH3COOH(l)的反应热为( )
C. 30℃,4 mL硫酸,3 mL水 D. 30℃,5 mL硫酸,2 mL水
12.下列原子中,第一电离能最大的是( )
【点睛】热化学方程式中需要注明物质的状态、焓变的正负号、焓变的数值及单位,且1mol纯物质燃烧生成稳定氧化物时放出的热量为燃烧热、中和反应生成1mol水时放出的热量为中和热,以此来解答。
故选D。
随堂检测
1、下列关于铁的叙述中错误的是( )
A、纯净的铁是光亮的银白色金属
B、铁能被磁体吸引
C、铁具有导电性,能代替铜作为导线材料
D、铁具有延展性和导热性,可制作炊具
C
随堂检测
C
2、下列关于铁与水蒸气反应的说法中不正确的是( )
A、反应中有氢气产生
B、此反应需在高温条件下才能发生
C、铁和水蒸气反应的原理是与钠与水反应类似
D、该反应中水做氧化剂
随堂检测
C
3、下列说法正确的是( )
A、赤铁矿的主要成分是Fe3O4
B、 Fe2O3为碱性氧化物,可与水反应生成Fe(OH)3
C、铁锈的主要成分是Fe2O3
D、 Fe3O4中铁元素有+2价和+3价,Fe3O4是混合物
随堂检测
B
4、下列物质反应后一定有+3价铁生成的是( )
①过量的Fe与Cl2反应 ②Fe与过量稀硫酸反应
③FeCl2溶液中通入少量Cl2
④Fe和Fe2O3的混合物溶于盐酸中
A.只有① B.只有①③
C.只有①②③ D.全部
随堂检测
B
5、下列既能由金属和氯气直接制取,又能由金属和盐酸直接制取的是( )
A.FeCl2 B.AlCl3
C.FeCl3 D.CuCl2
知识小结
铁的物理性质
A
铁的化学性质
B
金属与水反应的一般规律
C
高中化学
第1课时 铁的单质
铁在自然界中的存在
陨铁 铁单质
赤铁矿(氧化铁Fe2O3)
磁铁矿(四氧化三铁Fe3O4)
化合态
丹霞地貌的岩石
因含有Fe2O3而呈红色
⒈以单质形态存在
⒉以化合物(+2、+3)形态存在:
铁在自然界中的存在
自然界中的铁,主要以+2价和+3价化合物的形态存在于矿石中
铁元素在地壳中的含量仅次于氧、硅和铝,居第四位。
陨铁
赤铁矿(Fe2O3)
黄铁矿(FeS2)
自然界中的铁,主要以+2价和+3价化合物的形态存在于矿石中
铁在自然界中的存在
铁在自然界中的存在
春秋初年
隋唐年间
明代
现代工业
秦国的铜柄铁剑
用煤炼铁
用焦炭冶炼生铁
高炉炼铁
我国的“铁”文化
甘肃灵台出土的春秋初年秦国的铜柄铁剑
战国时期最大的铁器
—长方形铁炉
铁质农具
古代冶铁
铁的冶炼
Fe2O3 + 3CO 2Fe + 3CO2
高温
C + O2 CO2
高温
【回忆】高炉炼铁主要使用了哪些原料?涉及的化学反应方程式有哪些?
焦炭、铁矿石、空气等
CO2 + C 2CO
高温
一、铁的物理性质
【活动】阅读课本P65第一段并结合所学知识,归纳铁单质的物理性质。
纯的铁块
铁粉
铁线
导热性
导磁性
一、铁的物理性质
颜色 状态 密度 熔点 沸点 金属共性 特性
固体
银白色,有金属光泽
7.86
g/cm3
1535℃
2750℃
导热、导电、延展性好
能被磁体吸引
铁粉
铁粉的晶体几何形状被破坏,铁粉没有吸收完的光被漫反射,能够进入人眼的可见光很少,所以呈黑色。
Fe
物质类型角度
元素价态角度
强还原性
金属单质
+3
强氧化剂
+2
弱氧化剂
与非金属单质反应
与酸溶液反应
与某些盐溶液反应
S、H+、Cu2+等
Cl2等
二、铁单质的化学性质
(1)与O2反应
3Fe+2O2=== Fe3O4
点燃
剧烈燃烧,火星四射
铁在潮湿的空气中易被腐蚀,生成铁锈,
点燃:
常温:
(2)与Cl2反应
剧烈燃烧,生成棕色烟
Fe2O3·xH2O。
(3)与S反应
Fe+S===FeS
生成黑褐色固体
2Fe+3Cl2===2FeCl3
1、与非金属单质反应
氧化性:Cl2 > S
(3)Fe在足量Cl2中燃烧生成FeCl3,在少量Cl2中燃烧生成FeCl2( )
(2)根据铁与Cl2、S反应的条件可以判断Cl2、S的氧化性强弱( )
1.判断下列描述的正误(正确的打“√”,错误的打“×”)
(1)FeS、FeCl2、FeCl3均可以通过单质化合得到( )
×
×
[解析] FeCl2不能通过单质化合得到。
×
[解析]根据反应产物可判断Cl2、S的氧化性的强弱。
[解析] 铁与氯气反应只能生成FeCl3,与氯气的用量无关。
2、与酸(特指稀硫酸、盐酸)反应:
Fe + 2HCl = FeCl2 + H2↑
Fe + H2SO4 = FeSO4 + H2 ↑
知识小贴士:
与稀硝酸或者在加热条件下与浓硫酸、浓硝酸发生反应,但是无H2产生
离子方程式:Fe+2H+=Fe2++H2↑
常温下,Fe遇浓硫酸、浓硝酸发生钝化(表面生成致密的氧化膜)
3、铁与部分盐溶液反应
把溶液中活泼性小于铁的金属置换出来
a. 与CuSO4溶液反应:Fe+CuSO4=FeSO4+Cu
b. 与AgNO3溶液反应:Fe+2AgNO3=Fe(NO3)2+2Ag
c. 与FeCl3溶液反应:Fe+2FeCl3=3FeCl2
Fe+Cu2+=Fe2++Cu
Fe+2Ag+=Fe2++2Ag
Fe+2Fe3+=3Fe2+
[思考]
请写出铁与氯气反应,与盐酸反应,和硫酸铜溶液反应的化学方程式,并思考下面两个问题。
问题1:铁的化合价变化有何异同?
问题2:为什么会产生这样的异同?
2Fe+3Cl2=2FeCl3
Fe+2HCl=2FeCl2+H2↑
Fe+CuSO4=FeSO4+Cu
0
0
0
+2
+2
+3
Fe+较弱的氧化剂(HCl、CuSO4)→+2价铁的化合物
Fe+较强的氧化剂(Cl2)→+3价铁的化合物
产生异同的原因:
铁单质有还原性:
一、铁的单质
【思考】在钢铁厂的生产过程中,炽热的铁水或钢水注入模具之前,模具必须进行充分的干燥处理,不得留有水,这是为什么呢?
钢水注入干燥的模具
二、铁的化学性质
1. 铁和水在常温下能反应吗?如何提供水蒸气?如何提供反应所需的高温?
2. 预测铁与水反应的产物是什么?从物质的类别和元素的价态的变化完成对反应的预测。
3. 如何验证铁与水反应生成的气体产物?
4. 如何组装并完成实验?
实验探究:
Fe FeO Fe2O3 Fe3O4 Fe(OH)2 Fe(OH)3
黑色 黑色 红棕色 黑色 白色 红褐色
受热 不分解 受热 不分解 受热 不分解 受热 不分解 不稳定 500 ℃
分解为Fe2O3
①如何验证气体产物?
Fe + H2O(g) → Fe3O4 + H2
高温
②进行还原铁粉与水蒸气反应并验证气体产物,其实验装置应有几部分构成?
水蒸气的产生装置
水蒸气与铁粉的反应装置
气体产物检验装置
实验探究
思考与讨论
4、铁与水蒸气反应
二、铁的化学性质
实验装置 装置1 装置2
4、铁与水蒸气反应
二、铁的化学性质
操作及现象 铁粉逐渐红热,产生大量的肥皂泡
实验 结论
实验 说明
用小试管收集一试管气体,点燃,听到轻微的“噗”声,产生淡蓝色火焰,证明生成H2
用火柴点燃肥皂泡,听到爆鸣声,证明生成H2
①湿棉花的作用是在受热时提供反应所需的水蒸气;
②酒精灯的火焰用防风罩套住,可以使加热效果更好;
③肥皂液在该实验中可以起到“收集”氢气的作用。
铁能与水蒸气反应,并有H2生成,反应的化学方程式为
3Fe+4H2O(g) Fe3O4+4H2
高温
改进点:1.改变水蒸气的生成方式 2.氢气的收集、检验方式
生成水蒸气
排水法收集H2
向下排空气法
短进长出收集H2
思考:从水蒸气生成方式和氢气的检验方式角度思考,如何改进实验装置?
铁有+2、+3价两种价态,单质铁与 反应时只生成+3价铁;与 反应时只生成+2价铁;与 反应时既生成+2价铁也生成+3价铁。
所选试剂:①Cl2 ②O2 ③H2O(g) ④S ⑤盐酸
⑦稀硫酸 ⑧CuSO4溶液
①
④⑤⑦⑧
②③
用如图所示装置进行Fe与水蒸气反应的实验,下列有关说法不正确的是( )
A.装置A的作用是为实验提供持续不断的水蒸气
B.装置B中反应的化学方程式是2Fe+3H2O(g)===Fe2O3+3H2
C.装置C中加入的固体干燥剂可能是碱石灰
D.点燃装置D处的气体前必须检验气体的纯度
高温
B
(1)A 装置的作用是 ,烧瓶底部放碎瓷片的作用是 。
(2) 写出装置B中发生反应的化学方程式: 。
(3)D的作用是 。
(4)E中的实验现象是 。
(5)A 、B两个装置中应先点燃 处的酒精灯(或酒精喷灯 ) ,点燃 E处酒精灯之前应进行的操 作是 。
1.某化学兴趣小组利用如图装置(铁架台及夹持装置已省略)进行“铁与水蒸气反应”的实验,并检验产物的性质,请回答下列问题:
收集H2并检验其纯度
产生水蒸气
防止加热时液体暴沸
吸收未反应的水蒸气,干燥H2
黑色固体变成红色,玻璃管内壁上有水珠生成
A
【小结】金属与水的反应
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu ……
与冷水剧烈反应生成
碱和氢气
与热水反应生成
碱和氢气
不与水反应
高温下与水蒸气反应生成
氧化物和氢气
1、活泼金属如K、Na等可与冷水迅速剧烈反应(放热反应),生成可溶性碱和H2。
2、Mg与冷水反应缓慢,但在加热条件(或用沸水), Mg与水的反应加快。Al与冷水很难反应,与沸水反应缓慢。
B. 从1L2mol/L的H2SO4溶液中取出0.5L,该溶液的浓度为1mol/L
B,溶液的浓度与溶液的体积多少无关,错误;
3.下列有关物质性质与用途具有对应关系的是
(4)由氯离子的检验方法可知,检验可能存在的物质所用试剂为稀硝酸、硝酸银溶液,故答案为:稀硝酸、硝酸银溶液。
(1)一定不存在的物质是CaCO3、Na2SO4、CuSO4,故答案为:CaCO3、Na2SO4、CuSO4;
B. 淀粉溶液中:K+、NH4+、SO42-、I-
③滴定前读数是0.01ml,滴定后的读数是27.60ml,因此实际消耗硫代硫酸钠溶液的体积是27.50ml,则根据反应式2BaCrO4+6I-+16H+=3I2+2Ba2++2Cr3++8H2O、2S2O32一+I2=S4O62—+2 I-可知Cr3+~3S2O32一,所以废水Ba2+的浓度为 。
则2C(s)+2H2(g)+O2(g)=CH3COOH(l)的反应热为( )
C. 30℃,4 mL硫酸,3 mL水 D. 30℃,5 mL硫酸,2 mL水
12.下列原子中,第一电离能最大的是( )
【点睛】热化学方程式中需要注明物质的状态、焓变的正负号、焓变的数值及单位,且1mol纯物质燃烧生成稳定氧化物时放出的热量为燃烧热、中和反应生成1mol水时放出的热量为中和热,以此来解答。
故选D。
随堂检测
1、下列关于铁的叙述中错误的是( )
A、纯净的铁是光亮的银白色金属
B、铁能被磁体吸引
C、铁具有导电性,能代替铜作为导线材料
D、铁具有延展性和导热性,可制作炊具
C
随堂检测
C
2、下列关于铁与水蒸气反应的说法中不正确的是( )
A、反应中有氢气产生
B、此反应需在高温条件下才能发生
C、铁和水蒸气反应的原理是与钠与水反应类似
D、该反应中水做氧化剂
随堂检测
C
3、下列说法正确的是( )
A、赤铁矿的主要成分是Fe3O4
B、 Fe2O3为碱性氧化物,可与水反应生成Fe(OH)3
C、铁锈的主要成分是Fe2O3
D、 Fe3O4中铁元素有+2价和+3价,Fe3O4是混合物
随堂检测
B
4、下列物质反应后一定有+3价铁生成的是( )
①过量的Fe与Cl2反应 ②Fe与过量稀硫酸反应
③FeCl2溶液中通入少量Cl2
④Fe和Fe2O3的混合物溶于盐酸中
A.只有① B.只有①③
C.只有①②③ D.全部
随堂检测
B
5、下列既能由金属和氯气直接制取,又能由金属和盐酸直接制取的是( )
A.FeCl2 B.AlCl3
C.FeCl3 D.CuCl2
知识小结
铁的物理性质
A
铁的化学性质
B
金属与水反应的一般规律
C
