化学人教版(2019)必修第一册3.2.2 铝及其化合物(共28张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册3.2.2 铝及其化合物(共28张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 122.7MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-24 10:03:41 | ||
图片预览







文档简介
(共28张PPT)
你在日常生活中见到过哪些铝制品?
想一想
现在铝主要是以合金的形式加以应用。铝合金可以有更多的优点,克服其质软的缺点。如在铝中加入镁,便制得铝镁合金,其硬度比纯的镁和铝都大许多,而且保留了其质轻的特点,常用于制造飞机的机身、火箭的箭体;制造门窗、美化居室环境;制造船舶。
组织建设
第二节 金属材料
(第2课时 铝和铝合金 )
)
第三章 铁 金属材料
学习目标
1、通过实验探究铝及其化合物的性质和转化, 认识两性氧化物,两性氢氧化物。丰富对金属多样性的认识。
2、体会实验对认识和研究物质性质的重要作用。
四、铝和铝合金
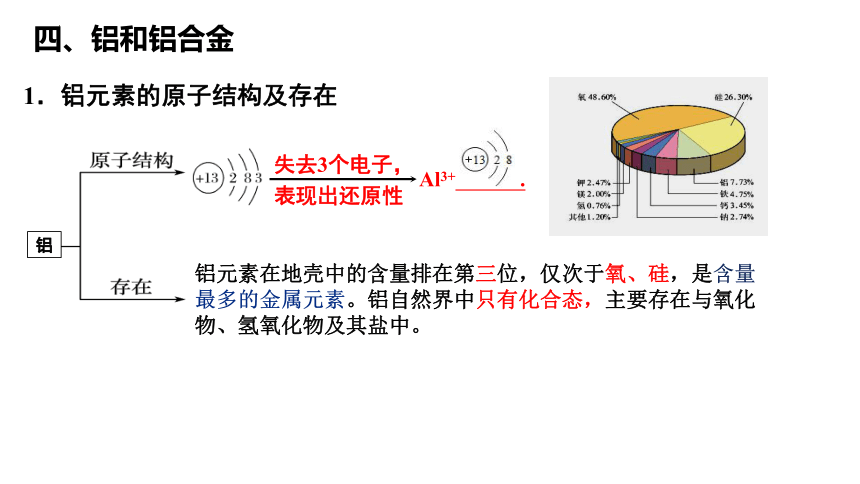
1.铝元素的原子结构及存在
铝
失去3个电子,
表现出还原性
Al3+ .
铝元素在地壳中的含量排在第三位,仅次于氧、硅,是含量最多的金属元素。铝自然界中只有化合态,主要存在与氧化物、氢氧化物及其盐中。
(1)物理性质
你见过铝的单质吗?总结一下铝的物理性质吧
①颜色:
②状态:
③密度:
④硬度:
⑤熔、沸点:
⑥金属共性:
银白色,有金属光泽
固体
密度2.7g/cm3
较软
熔点660.4℃ 沸点2467℃
有良好的导电、导热和延展性
2、铝单质
思考:铝容易被空气氧化,但为什么人们日常生活中总喜欢使用铝或铝合金制造的物品呢?
因为表面覆盖着的致密的氧化膜薄膜起着保护内部金属的作用。
(2)化学性质:
①与非金属的反应:
2Al + 3Cl2 = 2AlCl3
2Al + 3S = 2Al2S3
点燃
Δ
感受铝的氧化膜的存在
4Al + 3O2 ====== 2Al2O3
常温或点燃
阅读课本P76资料卡片,了解对铝制品的表面处理
对铝制品的表面处理:化学方法。加厚、着色如化学氧化(用铬酸作氧化剂可以使氧化膜产生美丽的颜色)。
②与硫酸铜溶液的反应:
2Al +3 Cu2+ = 3Cu+2Al3+
③与盐酸的反应:
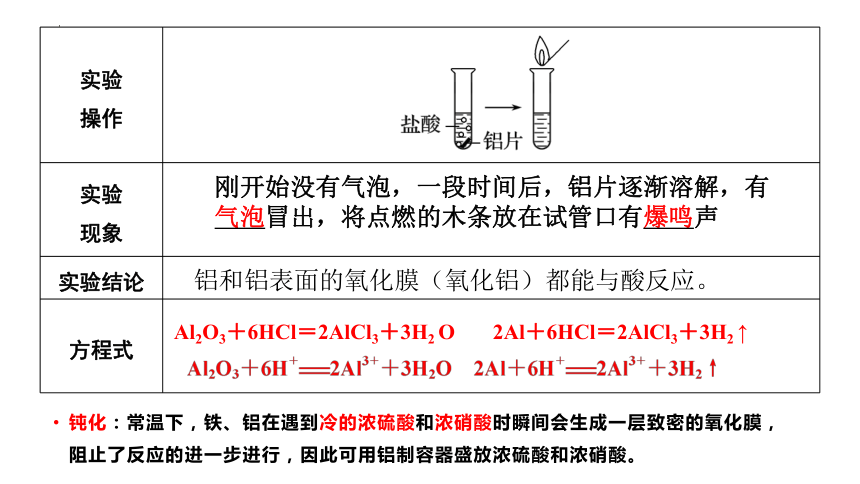
【实验3-4】在一支试管中加入5mL盐酸,再向试管中放入一小块铝片。观察现象。过一段时间后,将点燃的木条放在试管口,你观察到什么现象?
实验 操作
实验 现象
实验结论
方程式
Al2O3+6HCl=2AlCl3+3H2 O 2Al+6HCl=2AlCl3+3H2 ↑
刚开始没有气泡,一段时间后,铝片逐渐溶解,有气泡冒出,将点燃的木条放在试管口有爆鸣声
铝和铝表面的氧化膜(氧化铝)都能与酸反应。
钝化:常温下,铁、铝在遇到冷的浓硫酸和浓硝酸时瞬间会生成一层致密的氧化膜,阻止了反应的进一步进行,因此可用铝制容器盛放浓硫酸和浓硝酸。
【实验3-5】在两支试管中分别加入少量的NaOH溶液,然后向其中一只试管中放入一小块铝片,向另一只试管中放入砂纸仔细打磨过(除去表面的氧化膜)的一小块铝片。观察现象。过一段时间后,将点燃的木条分别放在两只试管口,你观察到什么现象?
实验操作
实验现象 试管①中一开始无气泡产生,一段时间后,铝片_____,有无色气泡冒出,试管②中铝片溶解,立即产生无色气泡,将点燃的木条放在试管口,都有_______
实验结论
方程式
溶解
爆鸣声
Al2O3+2NaOH=2NaAlO2(偏铝酸钠)+H2O、
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
铝和铝表面的氧化膜(氧化铝)都能与强碱反应。
④与碱的反应:
(铝的特性)
注意事项:
铝只与强碱反应,很难与弱碱反应
铝是还原剂,水为氧化剂
[问题讨论]
1.铝锅为什么可以用来煮饭?
铝具有良好的导热性能、常温下铝的表面被氧化,生成一层致密氧化物薄膜。
2、铝制品能否长期存放食物?为什么?
不能
因为食物中含有的酸、碱、盐会与氧化铝、铝反应,腐蚀铝制品。
清洗铝锅不要用钢丝等磨损性大的东西擦洗。
拓展:铝与氧化物反应——铝热反应
2Al+Fe2O3==2Fe+Al2O3
高温
铝热反应:
铝在高温条件下和某金属氧化物发生的反应
铝热剂
铝热剂:
铝粉和金属氧化物的混合物
铝热反应的应用:焊接钢轨,冶炼金属。
现象:
剧烈反应,发出耀眼的光芒,纸漏斗被烧穿,有红热液珠落下,液珠冷却后变为黑色。
Mg条的作用:引燃剂
KClO3的作用:助燃剂
2Al+Fe2O3==2Fe+Al2O3
高温
2Al+Cr2O3==2Cr+Al2O3
4Al+3MnO2==3Mn+2Al2O3
10Al+3V2O5==6V+5Al2O3
高温
高温
高温
[试一试]:
写出Al分别与Cr2O3 、MnO2 、V2O5 的反应
练习1:向一个铝质易拉罐中充满CO2,然后往罐中注入足量的浓NaOH溶液,立即用胶布封严罐口。一会听到罐内发出“咔、咔”的响声,且易拉罐变瘪;再过一会儿易拉罐又鼓起来恢复原样。请完成下列空白
(1)易拉罐变瘪的原因是 ,
反应的离子方程式 ____ 。
(2)易拉罐又鼓起来的原因是 。
NaOH溶液与CO2气体反应,导致易拉罐内压强变小。
CO2+2OH- =CO32- + H2O
Al与NaOH溶液产生H2, 易拉罐内压强又变大2Al+2OH- +2H2O=2AlO2- +3H2 ↑
3.氧化铝 (俗称刚玉)
(1)物理性质:白色固体,难溶于水,熔点高(2050℃),硬度大,沸点高(2980℃),用于制造耐火材料—耐火坩埚、耐火管、耐高温的实验仪器。
刚玉的主要成分是Al2O3 ,其中把含少量铬元素的刚玉称为红宝石;含少量的铁和钛元素的刚玉称为蓝宝石。
铝土矿
由氧化铝的水合物和少量的氧化铁和二氧化硅杂质组成
刚玉(蓝宝石、红宝石) 氧化铝的天然晶体,硬度大仅次于金刚石、金刚砂(SiC)(
(2)化学性质
Al2O3 + 6HCl = 2AlCl3 + 3H2O
Al2O3 + 2NaOH = 2NaAlO2 + H2O
Al2O3 + 6H+ = 2Al3+ + 3H2O
Al2O3 + 2OH- = 2AlO2- + H2O
两性氧化物:既能与酸反应生成盐和水,又能与碱反应生成盐和水的金属氧化物
①与酸反应:
②与强碱反应:
(3)用途:
①耐火材料(Al2O3熔点高)
②冶炼金属铝:
2Al2O3(熔融)
4Al+3O2
通电
冰晶石
助熔剂
耐火坩埚
耐火砖
燃器具点火瓷头
练习2:为了除去MgO中混有的少量杂质Al2O3,可选用的试剂是( )
A.KOH溶液 B.氨水 C.稀盐酸 D.稀醋酸
A
【练习3】 氧化铝可以用来制造耐火坩埚,这是利用了它的什么性质?能否用它来熔化NaOH固体?
利用了熔点高的性质;不能用它来熔化NaOH固体,因为氧化铝与熔融NaOH反应。
拓展:4、氢氧化铝
(1)物理性质
白色胶状固体,几乎不溶于水,能凝聚水中的悬浮物,并能吸附色素
(2)用途
②胃酸中和剂:能与酸反应且碱性不强
①净水剂:能吸附水中的悬浮物
(3)制备
实验室没有现存的Al(OH)3,现提供如下试剂: Al2(SO4)3溶液、稀盐酸、氨水、NaOH溶液,应该选择哪些试剂来制备?
【交流与讨论】
实验内容 实验现象 结论(化学方程式)
(1) 先产生白色沉淀,后沉淀溶解
(2) 有白色沉淀产生且氨水过量时沉淀不溶解
(3) 白色沉淀溶解,溶液变为澄清透明
试
管
①
试管②
试管②
Al(OH)3 + NaOH = NaAlO2 + 2H2O
Al2(S04)3 + 6NaOH = 2Al(OH)3 + 3Na2S04
Al2(SO4)3+6NH3·H2O = 2Al(OH)3↓+ 3(NH4)2SO4
2Al(OH)3 + 6HCl = 2AlCl3+ 3H2O
Al3++3NH3 H2O==Al(OH)3↓+3NH4+
白色胶状沉淀
结论:实验室里常用铝盐溶液与氨水反应来制取氢氧化铝
Al(OH)3+NaOH=NaAlO2+2H2O
能与酸和碱反应生成盐和水的氢氧化物
结论:Al(OH)3能溶于酸和强碱溶液,是一种两性氢氧化物
Al(OH)3 + 3HCl = AlCl3 + 3H2O
②与NaOH溶液反应:
③不稳定性:受热易分解
2Al(OH)3 == Al2O3+3H2O
工业上制取纯净氧化铝
(4)化学性质
①与盐酸反应:
1.下列既能跟盐酸反应,又能跟氢氧化钠溶液反应的物质是
①Al2O3 ②Al ③NaHCO3 ④Al(OH)3
A.①②③ B.①②④ C.①②③④ D.②③④
2. 下列反应的离子方程式书写正确的是( )
A.钠和冷水反应:Na+2H2O==Na++2OH-+H2↑
B.金属铝溶于NaOH溶液:Al+2OH-==AlO-+H2↑
C.金属铝溶于盐酸中:2Al+6H+==2Al3++3H2↑
D.铁与稀硫酸反应:2Fe+6H+==2Fe3++3H2↑
3.下列变化不可能通过一步实验 直接完成的是( )
A.Al(OH)3→Al2O3 B.Al2O3→Al (OH)3
C.Al→AlO2- D.Al3+→Al(OH)3
B
拓展5、硫酸铝钾[KAl(SO4)2](是由两种不同的金属离子和一种酸根离子组成的化合物,是一种复盐)(1)电离方程式: (2)十二水合硫酸铝钾①化学式: ,俗名: 。②性质:无色晶体,可溶于水,在天然水中生成 ,可用作 剂。
KAl(SO4)2·12H2O
明矾
Al(OH)3(胶体)
净水
主要组成元素 主要特性 主要用途
铝合金 硬铝 Al、Mg、Cu、Si、Mn等(Mg 0.5%、Cu 4%、Si 0.7%、Mn 0.5%) 密度小,强度和硬度都比纯铝的大,具有较强的抗腐蚀能力 用于汽车、飞机、火箭、船舶等制造业
镁铝合金 Mg、Al 强度和硬度都比纯铝和纯镁的大 用于火箭、飞机、轮船等制造业
为什么生活中很少见到以纯铝为材料的制品?
纯铝的硬度和强度都比较小,不适合作为生产生活中的材料使用,使用较多的是具有不同组成和性质的铝合金。
6、铝合金—— 铝合金是目前用途广泛的合金之一
AlO2- Al(OH)3 Al3+
Al
Al2O3
① O2
② OH-
③ H+
④ OH-
⑨ H+
⑩ H+
⑧ OH-
⑦ OH-
⑤ H+
小结:
铝及其重要化合物的相互转化
⑥ 加热
科学研究发现,老年性痴呆症与铝有密切关系。同时还发现,铝对人体的脑、心、肝、肾功能都有损害。因此,世界卫生组织于1989年正式将铝确定为食品污染物而加以控制。提出成年人每天允许铝摄入量为36 mg。如经常吃油条等油炸食品,喝铝罐装饮料等,或是经常食用铝制炊具炒出的饭菜,都会使人的摄铝量增加,从而影响脑细胞功能,导致记忆力下降,思维能力迟钝。
老年痴呆阿莫兹海默病
你在日常生活中见到过哪些铝制品?
想一想
现在铝主要是以合金的形式加以应用。铝合金可以有更多的优点,克服其质软的缺点。如在铝中加入镁,便制得铝镁合金,其硬度比纯的镁和铝都大许多,而且保留了其质轻的特点,常用于制造飞机的机身、火箭的箭体;制造门窗、美化居室环境;制造船舶。
组织建设
第二节 金属材料
(第2课时 铝和铝合金 )
)
第三章 铁 金属材料
学习目标
1、通过实验探究铝及其化合物的性质和转化, 认识两性氧化物,两性氢氧化物。丰富对金属多样性的认识。
2、体会实验对认识和研究物质性质的重要作用。
四、铝和铝合金
1.铝元素的原子结构及存在
铝
失去3个电子,
表现出还原性
Al3+ .
铝元素在地壳中的含量排在第三位,仅次于氧、硅,是含量最多的金属元素。铝自然界中只有化合态,主要存在与氧化物、氢氧化物及其盐中。
(1)物理性质
你见过铝的单质吗?总结一下铝的物理性质吧
①颜色:
②状态:
③密度:
④硬度:
⑤熔、沸点:
⑥金属共性:
银白色,有金属光泽
固体
密度2.7g/cm3
较软
熔点660.4℃ 沸点2467℃
有良好的导电、导热和延展性
2、铝单质
思考:铝容易被空气氧化,但为什么人们日常生活中总喜欢使用铝或铝合金制造的物品呢?
因为表面覆盖着的致密的氧化膜薄膜起着保护内部金属的作用。
(2)化学性质:
①与非金属的反应:
2Al + 3Cl2 = 2AlCl3
2Al + 3S = 2Al2S3
点燃
Δ
感受铝的氧化膜的存在
4Al + 3O2 ====== 2Al2O3
常温或点燃
阅读课本P76资料卡片,了解对铝制品的表面处理
对铝制品的表面处理:化学方法。加厚、着色如化学氧化(用铬酸作氧化剂可以使氧化膜产生美丽的颜色)。
②与硫酸铜溶液的反应:
2Al +3 Cu2+ = 3Cu+2Al3+
③与盐酸的反应:
【实验3-4】在一支试管中加入5mL盐酸,再向试管中放入一小块铝片。观察现象。过一段时间后,将点燃的木条放在试管口,你观察到什么现象?
实验 操作
实验 现象
实验结论
方程式
Al2O3+6HCl=2AlCl3+3H2 O 2Al+6HCl=2AlCl3+3H2 ↑
刚开始没有气泡,一段时间后,铝片逐渐溶解,有气泡冒出,将点燃的木条放在试管口有爆鸣声
铝和铝表面的氧化膜(氧化铝)都能与酸反应。
钝化:常温下,铁、铝在遇到冷的浓硫酸和浓硝酸时瞬间会生成一层致密的氧化膜,阻止了反应的进一步进行,因此可用铝制容器盛放浓硫酸和浓硝酸。
【实验3-5】在两支试管中分别加入少量的NaOH溶液,然后向其中一只试管中放入一小块铝片,向另一只试管中放入砂纸仔细打磨过(除去表面的氧化膜)的一小块铝片。观察现象。过一段时间后,将点燃的木条分别放在两只试管口,你观察到什么现象?
实验操作
实验现象 试管①中一开始无气泡产生,一段时间后,铝片_____,有无色气泡冒出,试管②中铝片溶解,立即产生无色气泡,将点燃的木条放在试管口,都有_______
实验结论
方程式
溶解
爆鸣声
Al2O3+2NaOH=2NaAlO2(偏铝酸钠)+H2O、
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
铝和铝表面的氧化膜(氧化铝)都能与强碱反应。
④与碱的反应:
(铝的特性)
注意事项:
铝只与强碱反应,很难与弱碱反应
铝是还原剂,水为氧化剂
[问题讨论]
1.铝锅为什么可以用来煮饭?
铝具有良好的导热性能、常温下铝的表面被氧化,生成一层致密氧化物薄膜。
2、铝制品能否长期存放食物?为什么?
不能
因为食物中含有的酸、碱、盐会与氧化铝、铝反应,腐蚀铝制品。
清洗铝锅不要用钢丝等磨损性大的东西擦洗。
拓展:铝与氧化物反应——铝热反应
2Al+Fe2O3==2Fe+Al2O3
高温
铝热反应:
铝在高温条件下和某金属氧化物发生的反应
铝热剂
铝热剂:
铝粉和金属氧化物的混合物
铝热反应的应用:焊接钢轨,冶炼金属。
现象:
剧烈反应,发出耀眼的光芒,纸漏斗被烧穿,有红热液珠落下,液珠冷却后变为黑色。
Mg条的作用:引燃剂
KClO3的作用:助燃剂
2Al+Fe2O3==2Fe+Al2O3
高温
2Al+Cr2O3==2Cr+Al2O3
4Al+3MnO2==3Mn+2Al2O3
10Al+3V2O5==6V+5Al2O3
高温
高温
高温
[试一试]:
写出Al分别与Cr2O3 、MnO2 、V2O5 的反应
练习1:向一个铝质易拉罐中充满CO2,然后往罐中注入足量的浓NaOH溶液,立即用胶布封严罐口。一会听到罐内发出“咔、咔”的响声,且易拉罐变瘪;再过一会儿易拉罐又鼓起来恢复原样。请完成下列空白
(1)易拉罐变瘪的原因是 ,
反应的离子方程式 ____ 。
(2)易拉罐又鼓起来的原因是 。
NaOH溶液与CO2气体反应,导致易拉罐内压强变小。
CO2+2OH- =CO32- + H2O
Al与NaOH溶液产生H2, 易拉罐内压强又变大2Al+2OH- +2H2O=2AlO2- +3H2 ↑
3.氧化铝 (俗称刚玉)
(1)物理性质:白色固体,难溶于水,熔点高(2050℃),硬度大,沸点高(2980℃),用于制造耐火材料—耐火坩埚、耐火管、耐高温的实验仪器。
刚玉的主要成分是Al2O3 ,其中把含少量铬元素的刚玉称为红宝石;含少量的铁和钛元素的刚玉称为蓝宝石。
铝土矿
由氧化铝的水合物和少量的氧化铁和二氧化硅杂质组成
刚玉(蓝宝石、红宝石) 氧化铝的天然晶体,硬度大仅次于金刚石、金刚砂(SiC)(
(2)化学性质
Al2O3 + 6HCl = 2AlCl3 + 3H2O
Al2O3 + 2NaOH = 2NaAlO2 + H2O
Al2O3 + 6H+ = 2Al3+ + 3H2O
Al2O3 + 2OH- = 2AlO2- + H2O
两性氧化物:既能与酸反应生成盐和水,又能与碱反应生成盐和水的金属氧化物
①与酸反应:
②与强碱反应:
(3)用途:
①耐火材料(Al2O3熔点高)
②冶炼金属铝:
2Al2O3(熔融)
4Al+3O2
通电
冰晶石
助熔剂
耐火坩埚
耐火砖
燃器具点火瓷头
练习2:为了除去MgO中混有的少量杂质Al2O3,可选用的试剂是( )
A.KOH溶液 B.氨水 C.稀盐酸 D.稀醋酸
A
【练习3】 氧化铝可以用来制造耐火坩埚,这是利用了它的什么性质?能否用它来熔化NaOH固体?
利用了熔点高的性质;不能用它来熔化NaOH固体,因为氧化铝与熔融NaOH反应。
拓展:4、氢氧化铝
(1)物理性质
白色胶状固体,几乎不溶于水,能凝聚水中的悬浮物,并能吸附色素
(2)用途
②胃酸中和剂:能与酸反应且碱性不强
①净水剂:能吸附水中的悬浮物
(3)制备
实验室没有现存的Al(OH)3,现提供如下试剂: Al2(SO4)3溶液、稀盐酸、氨水、NaOH溶液,应该选择哪些试剂来制备?
【交流与讨论】
实验内容 实验现象 结论(化学方程式)
(1) 先产生白色沉淀,后沉淀溶解
(2) 有白色沉淀产生且氨水过量时沉淀不溶解
(3) 白色沉淀溶解,溶液变为澄清透明
试
管
①
试管②
试管②
Al(OH)3 + NaOH = NaAlO2 + 2H2O
Al2(S04)3 + 6NaOH = 2Al(OH)3 + 3Na2S04
Al2(SO4)3+6NH3·H2O = 2Al(OH)3↓+ 3(NH4)2SO4
2Al(OH)3 + 6HCl = 2AlCl3+ 3H2O
Al3++3NH3 H2O==Al(OH)3↓+3NH4+
白色胶状沉淀
结论:实验室里常用铝盐溶液与氨水反应来制取氢氧化铝
Al(OH)3+NaOH=NaAlO2+2H2O
能与酸和碱反应生成盐和水的氢氧化物
结论:Al(OH)3能溶于酸和强碱溶液,是一种两性氢氧化物
Al(OH)3 + 3HCl = AlCl3 + 3H2O
②与NaOH溶液反应:
③不稳定性:受热易分解
2Al(OH)3 == Al2O3+3H2O
工业上制取纯净氧化铝
(4)化学性质
①与盐酸反应:
1.下列既能跟盐酸反应,又能跟氢氧化钠溶液反应的物质是
①Al2O3 ②Al ③NaHCO3 ④Al(OH)3
A.①②③ B.①②④ C.①②③④ D.②③④
2. 下列反应的离子方程式书写正确的是( )
A.钠和冷水反应:Na+2H2O==Na++2OH-+H2↑
B.金属铝溶于NaOH溶液:Al+2OH-==AlO-+H2↑
C.金属铝溶于盐酸中:2Al+6H+==2Al3++3H2↑
D.铁与稀硫酸反应:2Fe+6H+==2Fe3++3H2↑
3.下列变化不可能通过一步实验 直接完成的是( )
A.Al(OH)3→Al2O3 B.Al2O3→Al (OH)3
C.Al→AlO2- D.Al3+→Al(OH)3
B
拓展5、硫酸铝钾[KAl(SO4)2](是由两种不同的金属离子和一种酸根离子组成的化合物,是一种复盐)(1)电离方程式: (2)十二水合硫酸铝钾①化学式: ,俗名: 。②性质:无色晶体,可溶于水,在天然水中生成 ,可用作 剂。
KAl(SO4)2·12H2O
明矾
Al(OH)3(胶体)
净水
主要组成元素 主要特性 主要用途
铝合金 硬铝 Al、Mg、Cu、Si、Mn等(Mg 0.5%、Cu 4%、Si 0.7%、Mn 0.5%) 密度小,强度和硬度都比纯铝的大,具有较强的抗腐蚀能力 用于汽车、飞机、火箭、船舶等制造业
镁铝合金 Mg、Al 强度和硬度都比纯铝和纯镁的大 用于火箭、飞机、轮船等制造业
为什么生活中很少见到以纯铝为材料的制品?
纯铝的硬度和强度都比较小,不适合作为生产生活中的材料使用,使用较多的是具有不同组成和性质的铝合金。
6、铝合金—— 铝合金是目前用途广泛的合金之一
AlO2- Al(OH)3 Al3+
Al
Al2O3
① O2
② OH-
③ H+
④ OH-
⑨ H+
⑩ H+
⑧ OH-
⑦ OH-
⑤ H+
小结:
铝及其重要化合物的相互转化
⑥ 加热
科学研究发现,老年性痴呆症与铝有密切关系。同时还发现,铝对人体的脑、心、肝、肾功能都有损害。因此,世界卫生组织于1989年正式将铝确定为食品污染物而加以控制。提出成年人每天允许铝摄入量为36 mg。如经常吃油条等油炸食品,喝铝罐装饮料等,或是经常食用铝制炊具炒出的饭菜,都会使人的摄铝量增加,从而影响脑细胞功能,导致记忆力下降,思维能力迟钝。
老年痴呆阿莫兹海默病
