2022-2023年鲁教版九年级下册化学 第八单元 海水中的化学 单元检测 (含答案)
文档属性
| 名称 | 2022-2023年鲁教版九年级下册化学 第八单元 海水中的化学 单元检测 (含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 186.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-23 21:31:55 | ||
图片预览


文档简介
第八单元--海水中的化学
一、单选题
1.已知20℃时KNO3的溶解度为31.6 g。下列关于对它的理解正确的是( )
A.20℃,100 g水中最多能溶解31.6 g KNO3固体
B.20℃时,100 g KNO3溶液中溶解31.6 g KNO3固体
C.100 g水中溶解了31.6 g KNO3固体达到饱和
D.20℃时,31.6 g KNO3固体溶于水形成饱和溶液
2.在“粗盐的提纯”实验中,一定用不到的仪器是
A.铁架台、蒸发皿 B.酒精灯、漏斗
C.细口瓶、试管 D.量筒、烧杯
3.下图为Ca(OH)2的溶解度曲线;下表为20℃时溶解度的相对大小。下列说法正确的是( )
溶解度/g 一般称为
<0.01 难溶
0.01~1 微溶
1~10 可溶
>10 易容
A.Ca(OH)2 属于易溶物质
B.Ca(OH)2的溶解度随温度的升高而增大
C.30℃时,Ca(OH)2的饱和溶液中溶质与溶剂的质量比为3﹕20
D.70℃时Ca(OH)2的饱和溶液,降温到50℃时没有析出固体
4.某同学总结的Ca(OH)2的化学性质如图,下列说法错误的是
A.甲一定是碳酸盐
B.反应②为放热反应
C.反应③可用于检验某种温室气体
D.向澄清石灰水中加入紫色石蕊试液,试液由紫色变为蓝色
5.下列离子能在含有硫酸的溶液中大量共存的是( )
A.Mg2+、
B.Na+、
C.K+、OH-
D.Ba2+、C1-
6.下列物质既可以做治疗胃酸的胃药,又可以做面点发酵剂的是
A.NaCl
B.NaOH
C.NaHCO3
D.Na2SO4
7.小金在配制硝酸钾溶液时得到下表数据,据此分析以下说法正确的是( )
序号 温度/℃ 水的质量/克 加入硝酸钾的质量/克 所得溶液的质量/克
① 10 100 40 120.9
② 60 100 40 140
A.10℃时硝酸钾的溶解度为40克
B.②所得溶液一定是60℃时硝酸钾的饱和溶液
C.若通过加热将①中剩余硝酸钾全部溶解,则溶液的溶质质量分数与加热前保持一致
D.若将②所得溶液降温至10℃,则溶液的溶质质量分数会变小
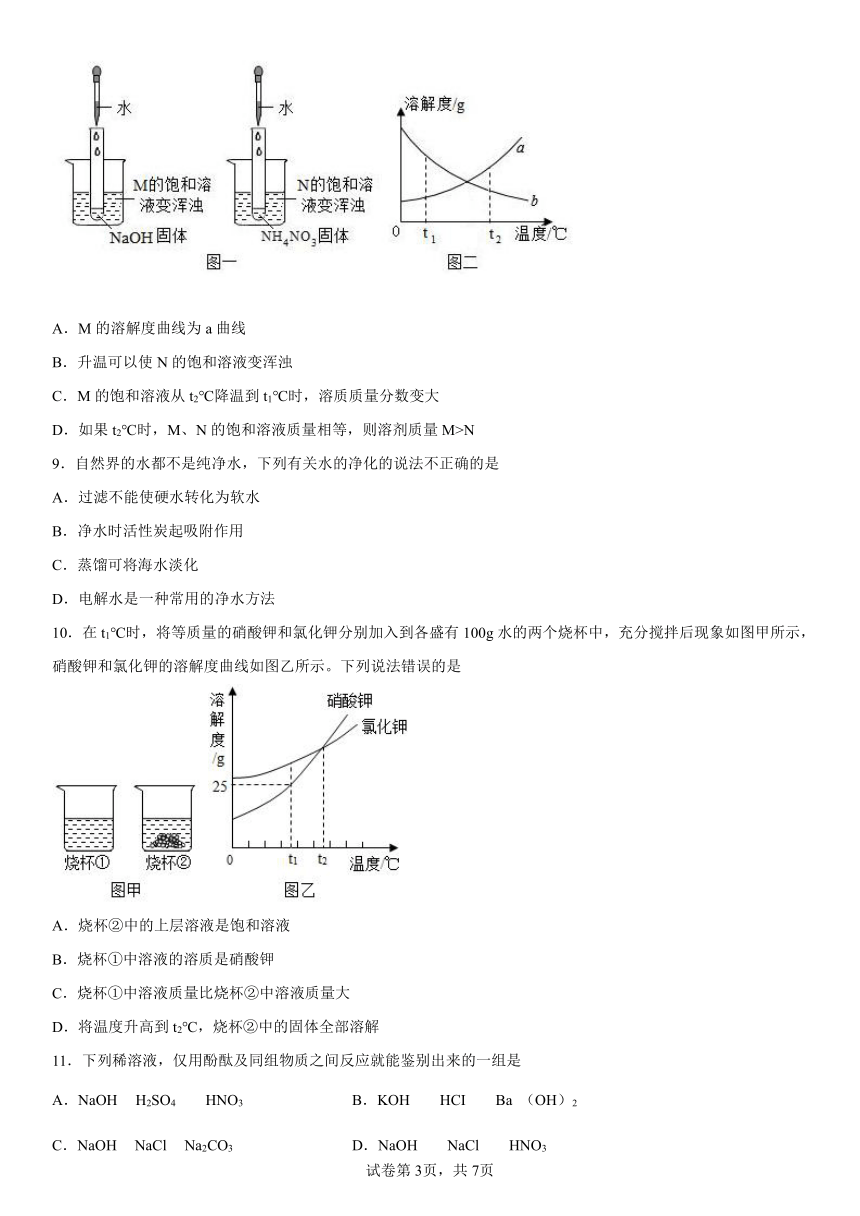
8.某同学在探究物质溶解的热现象及温度对物质溶解度影响时,设计了如下实验,现象如图一所示,溶解度曲线如图二所示,下列说法正确的是
A.M的溶解度曲线为a曲线
B.升温可以使N的饱和溶液变浑浊
C.M的饱和溶液从t2℃降温到t1℃时,溶质质量分数变大
D.如果t2℃时,M、N的饱和溶液质量相等,则溶剂质量M>N
9.自然界的水都不是纯净水,下列有关水的净化的说法不正确的是
A.过滤不能使硬水转化为软水
B.净水时活性炭起吸附作用
C.蒸馏可将海水淡化
D.电解水是一种常用的净水方法
10.在t1℃时,将等质量的硝酸钾和氯化钾分别加入到各盛有100g水的两个烧杯中,充分搅拌后现象如图甲所示,硝酸钾和氯化钾的溶解度曲线如图乙所示。下列说法错误的是
A.烧杯②中的上层溶液是饱和溶液
B.烧杯①中溶液的溶质是硝酸钾
C.烧杯①中溶液质量比烧杯②中溶液质量大
D.将温度升高到t2℃,烧杯②中的固体全部溶解
11.下列稀溶液,仅用酚酞及同组物质之间反应就能鉴别出来的一组是
A.NaOH H2SO4 HNO3 B.KOH HCI Ba (OH)2
C.NaOH NaCl Na2CO3 D.NaOH NaCl HNO3
12.能使气体物质溶解度增大的操作是
A.增加溶剂 B.振荡溶液 C.增大压强 D.升高温度
13.在“粗盐的初步提纯”实验中,下列操作正确的是( )
A.取用粗盐 B.溶解粗盐
C.过滤粗盐水 D.蒸干滤液
14.下列各组物质的稀溶液,不需要加入其他试剂就能鉴别出来的是( )
A.FeCl3 NaCl NaOH KCl
B.CuSO4 Ba(OH)2 HCl HNO3
C.Na2SO4 BaCl2 Na2CO3 HNO3
D.Ca(OH)2 K2CO3 CaCl2 NaCl
15.实验室用如图所示的装置蒸馏海水,下列说法不正确的是
A.蒸馏烧瓶中加入沸石的目的是防止暴沸 B.蒸馏后分子没有改变
C.连接好装置,使各连接部位严密不漏气 D.该装置不需要用石棉网
二、填空题
16.请用数字和化学符号填空:
(1)氧化铝_______________;
(2)2个三氧化硫分子_______________;
(3)5个铵根离子_______________;
(4)海水中含量最高的金属元素_______________。
17.酸、碱、盐是我们身边重要的化合物。请根据所学知识回答相关问题:
(1)随着新能源汽车的发展,动力电池领域对氢氧化锂的需求量越来越大。氢氧化锂(LiOH)与氢氧化钠化学性质相似,其原因是溶液中都有______(填离子符号)。
(2)盐酸可用于金属表面除锈,请写出盐酸除铁锈的化学方程式_______。
(3)波尔多液是由硫酸铜和石灰乳等配成的杀菌剂。喷洒波尔多液后,果蔬表面有一些蓝色斑点(一种难溶性碱),蓝色斑点的成分是_____(填化学式)。
(4)下列试剂能将稀盐酸、氯化钠溶液、澄清石灰水三种溶液一次鉴别出来的是_____(填序号)
A 稀硫酸 B 酚酞溶液 C 碳酸钠溶液
18.如图是X、Y、Z三种物质的溶解度曲线图,认真阅读完成下列各小题
(1)在_____℃时,Y、Z两物质溶解度相等。
(2)t2℃时,将20gZ放入装有50g水的烧杯中,充分搅拌可能得到_______gZ的饱和溶液。
(3)在t1℃时把质量均为mg的X、Y、Z三种固体溶于水中形成饱和溶液,需水质量最多的是_。
(4)下列说法正确的有_______(只需填正确的选项序号)。
①Z物质有可能是气体
②若X中含有少量的Y,可用蒸发结晶提纯X
③将t3℃时等质量的X、Y饱和溶液同时降温到t1℃,析出晶体的质量是X>Y
④要将t1℃时接近饱和的X溶液变成饱和溶液,如不改变该溶液的组成,可选择降低温度的方法
⑤将t3℃时Z的饱和溶液降温至t2℃后,溶液的溶质质量分数会变大
(5)t2℃时,将X、Y、Z三种物质的饱和溶液降温至t1℃,所得溶液的溶质质量分数由大到小的顺序是_______ 。
19.请用给定物质的序号填空:
①氮气 ②一氧化碳 ③硫酸 ④大理石 ⑤金刚石
(1)重要的建筑材料是__;
(2)天然存在的最硬的物质是__;
(3)常用作保护气的是__;
(4)具有可燃性又有还原性的气体是__;
(5)用于生产化肥、农药、火药、染料等的是__.
三、实验题
20.某化学兴趣小组的同学做粗盐(含有难溶性杂质)提纯实验,如图是同学们做粗盐提纯实验的操作示意图.
请回答下列问题:
(1)操作⑥中的错误是___________。
(2)粗盐提纯实验的操作顺序为(填操作序号)__________、称量精盐并计算产率。
(3)操作④中,玻璃棒的作用是________,当观察到__________时,停止加热。
(4)若溶解的过程中加入的水过导致粗盐没有完全溶解,则最后算的精盐的产率__________(偏高或偏低)。
21.科学兴趣小组的同学做粗盐(只含有难溶性杂质)提纯实验,并用所得的精盐配制50g6%的氯化钠溶液。回答下列问题:
实验一:粗盐提纯
(1)上图中操作有错误的是______(填数字序号)。
(2)操作⑥中,当观察到蒸发皿中_____时,停止加热。
(3)海水晒盐采用上图操作⑥的原理,不采用冷却氯化钠浓溶液的方法,原因是氯化钠的溶解度_____。
实验二:用提纯得到的精盐配制50g6%的氯化钠溶液
(1)计算。需要氯化钠_____g,蒸馏水______mL。
(2)称量、量取。量取水的体积时,若仰视读数,所配溶液的溶质质量分数会______6%(填“>”“<”或“=”)。
(3)溶解。用玻璃棒搅拌的目的是_______。
(4)装瓶、贴标签。
四、计算题
22.向 Ba(OH)2 溶液中先滴加一定量CuSO4 溶液,直至沉淀质量为 m 克,再不断滴加H2SO4 溶液。整个过程中,产生沉淀的质量与加入溶液的质量关系如图所示。回答下列问题
(1)生成氢氧化铜的质量是多少
(2)通过计算确定m的值。
23.某实验小组的同学用氢氧化钡溶液和盐酸进行酸碱中和反应的实验时,向烧杯中的氢氧化钡溶液加入一定量的稀盐酸后,发现忘记滴加指示剂。因此,他们停止滴加稀盐酸,并对烧杯内溶液中的溶质成分进行探究。取10g烧杯中的溶液,向其中逐滴滴入溶质质量分数为13.25%的碳酸钠溶液。测得溶液pH与加入的碳酸钠溶液的质量关系如图所示。
(1)通过如图所示可知,当碳酸钠溶液质量加到_____时,溶液中盐酸恰好处理完。
(2)请计算原烧杯溶液中氯化钡的质量分数。(要有必要的解题过程)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
2.C
3.D
4.A
5.A
6.C
7.D
8.D
9.D
10.B
11.D
12.C
13.C
14.C
15.D
16.(1) Al2O3 2SO3 (2) 5NH4+ Na
17.(1) OH- (2) Cu(OH)2 C
18.(1)t2
(2)65
(3)X
(4)①③④
(5)Z>Y>X
19.(1) ④ ⑤ ① (2) ② ③
20.(1) 没有利用玻璃棒引流 ①⑤②③⑥④ (2) 使液体均匀受热,防止液体飞溅 (3) 较多固体 偏低
21.(1) ⑤ 有较多的固体出现时 (2) 随温度变化不大 3g (3) 47mL < 加速溶解
22.(1)0.98g(2)3.31
23.(1)2
(2)结合以上分析和图形中pH值的变化,反应氯化钡消耗的碳酸碳溶液的质量为6g-2g=4g;设原烧杯溶液中的质量为x,
208 106
x
解得x=1.04g
原烧杯溶液中氯化钡的质量分数:。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.已知20℃时KNO3的溶解度为31.6 g。下列关于对它的理解正确的是( )
A.20℃,100 g水中最多能溶解31.6 g KNO3固体
B.20℃时,100 g KNO3溶液中溶解31.6 g KNO3固体
C.100 g水中溶解了31.6 g KNO3固体达到饱和
D.20℃时,31.6 g KNO3固体溶于水形成饱和溶液
2.在“粗盐的提纯”实验中,一定用不到的仪器是
A.铁架台、蒸发皿 B.酒精灯、漏斗
C.细口瓶、试管 D.量筒、烧杯
3.下图为Ca(OH)2的溶解度曲线;下表为20℃时溶解度的相对大小。下列说法正确的是( )
溶解度/g 一般称为
<0.01 难溶
0.01~1 微溶
1~10 可溶
>10 易容
A.Ca(OH)2 属于易溶物质
B.Ca(OH)2的溶解度随温度的升高而增大
C.30℃时,Ca(OH)2的饱和溶液中溶质与溶剂的质量比为3﹕20
D.70℃时Ca(OH)2的饱和溶液,降温到50℃时没有析出固体
4.某同学总结的Ca(OH)2的化学性质如图,下列说法错误的是
A.甲一定是碳酸盐
B.反应②为放热反应
C.反应③可用于检验某种温室气体
D.向澄清石灰水中加入紫色石蕊试液,试液由紫色变为蓝色
5.下列离子能在含有硫酸的溶液中大量共存的是( )
A.Mg2+、
B.Na+、
C.K+、OH-
D.Ba2+、C1-
6.下列物质既可以做治疗胃酸的胃药,又可以做面点发酵剂的是
A.NaCl
B.NaOH
C.NaHCO3
D.Na2SO4
7.小金在配制硝酸钾溶液时得到下表数据,据此分析以下说法正确的是( )
序号 温度/℃ 水的质量/克 加入硝酸钾的质量/克 所得溶液的质量/克
① 10 100 40 120.9
② 60 100 40 140
A.10℃时硝酸钾的溶解度为40克
B.②所得溶液一定是60℃时硝酸钾的饱和溶液
C.若通过加热将①中剩余硝酸钾全部溶解,则溶液的溶质质量分数与加热前保持一致
D.若将②所得溶液降温至10℃,则溶液的溶质质量分数会变小
8.某同学在探究物质溶解的热现象及温度对物质溶解度影响时,设计了如下实验,现象如图一所示,溶解度曲线如图二所示,下列说法正确的是
A.M的溶解度曲线为a曲线
B.升温可以使N的饱和溶液变浑浊
C.M的饱和溶液从t2℃降温到t1℃时,溶质质量分数变大
D.如果t2℃时,M、N的饱和溶液质量相等,则溶剂质量M>N
9.自然界的水都不是纯净水,下列有关水的净化的说法不正确的是
A.过滤不能使硬水转化为软水
B.净水时活性炭起吸附作用
C.蒸馏可将海水淡化
D.电解水是一种常用的净水方法
10.在t1℃时,将等质量的硝酸钾和氯化钾分别加入到各盛有100g水的两个烧杯中,充分搅拌后现象如图甲所示,硝酸钾和氯化钾的溶解度曲线如图乙所示。下列说法错误的是
A.烧杯②中的上层溶液是饱和溶液
B.烧杯①中溶液的溶质是硝酸钾
C.烧杯①中溶液质量比烧杯②中溶液质量大
D.将温度升高到t2℃,烧杯②中的固体全部溶解
11.下列稀溶液,仅用酚酞及同组物质之间反应就能鉴别出来的一组是
A.NaOH H2SO4 HNO3 B.KOH HCI Ba (OH)2
C.NaOH NaCl Na2CO3 D.NaOH NaCl HNO3
12.能使气体物质溶解度增大的操作是
A.增加溶剂 B.振荡溶液 C.增大压强 D.升高温度
13.在“粗盐的初步提纯”实验中,下列操作正确的是( )
A.取用粗盐 B.溶解粗盐
C.过滤粗盐水 D.蒸干滤液
14.下列各组物质的稀溶液,不需要加入其他试剂就能鉴别出来的是( )
A.FeCl3 NaCl NaOH KCl
B.CuSO4 Ba(OH)2 HCl HNO3
C.Na2SO4 BaCl2 Na2CO3 HNO3
D.Ca(OH)2 K2CO3 CaCl2 NaCl
15.实验室用如图所示的装置蒸馏海水,下列说法不正确的是
A.蒸馏烧瓶中加入沸石的目的是防止暴沸 B.蒸馏后分子没有改变
C.连接好装置,使各连接部位严密不漏气 D.该装置不需要用石棉网
二、填空题
16.请用数字和化学符号填空:
(1)氧化铝_______________;
(2)2个三氧化硫分子_______________;
(3)5个铵根离子_______________;
(4)海水中含量最高的金属元素_______________。
17.酸、碱、盐是我们身边重要的化合物。请根据所学知识回答相关问题:
(1)随着新能源汽车的发展,动力电池领域对氢氧化锂的需求量越来越大。氢氧化锂(LiOH)与氢氧化钠化学性质相似,其原因是溶液中都有______(填离子符号)。
(2)盐酸可用于金属表面除锈,请写出盐酸除铁锈的化学方程式_______。
(3)波尔多液是由硫酸铜和石灰乳等配成的杀菌剂。喷洒波尔多液后,果蔬表面有一些蓝色斑点(一种难溶性碱),蓝色斑点的成分是_____(填化学式)。
(4)下列试剂能将稀盐酸、氯化钠溶液、澄清石灰水三种溶液一次鉴别出来的是_____(填序号)
A 稀硫酸 B 酚酞溶液 C 碳酸钠溶液
18.如图是X、Y、Z三种物质的溶解度曲线图,认真阅读完成下列各小题
(1)在_____℃时,Y、Z两物质溶解度相等。
(2)t2℃时,将20gZ放入装有50g水的烧杯中,充分搅拌可能得到_______gZ的饱和溶液。
(3)在t1℃时把质量均为mg的X、Y、Z三种固体溶于水中形成饱和溶液,需水质量最多的是_。
(4)下列说法正确的有_______(只需填正确的选项序号)。
①Z物质有可能是气体
②若X中含有少量的Y,可用蒸发结晶提纯X
③将t3℃时等质量的X、Y饱和溶液同时降温到t1℃,析出晶体的质量是X>Y
④要将t1℃时接近饱和的X溶液变成饱和溶液,如不改变该溶液的组成,可选择降低温度的方法
⑤将t3℃时Z的饱和溶液降温至t2℃后,溶液的溶质质量分数会变大
(5)t2℃时,将X、Y、Z三种物质的饱和溶液降温至t1℃,所得溶液的溶质质量分数由大到小的顺序是_______ 。
19.请用给定物质的序号填空:
①氮气 ②一氧化碳 ③硫酸 ④大理石 ⑤金刚石
(1)重要的建筑材料是__;
(2)天然存在的最硬的物质是__;
(3)常用作保护气的是__;
(4)具有可燃性又有还原性的气体是__;
(5)用于生产化肥、农药、火药、染料等的是__.
三、实验题
20.某化学兴趣小组的同学做粗盐(含有难溶性杂质)提纯实验,如图是同学们做粗盐提纯实验的操作示意图.
请回答下列问题:
(1)操作⑥中的错误是___________。
(2)粗盐提纯实验的操作顺序为(填操作序号)__________、称量精盐并计算产率。
(3)操作④中,玻璃棒的作用是________,当观察到__________时,停止加热。
(4)若溶解的过程中加入的水过导致粗盐没有完全溶解,则最后算的精盐的产率__________(偏高或偏低)。
21.科学兴趣小组的同学做粗盐(只含有难溶性杂质)提纯实验,并用所得的精盐配制50g6%的氯化钠溶液。回答下列问题:
实验一:粗盐提纯
(1)上图中操作有错误的是______(填数字序号)。
(2)操作⑥中,当观察到蒸发皿中_____时,停止加热。
(3)海水晒盐采用上图操作⑥的原理,不采用冷却氯化钠浓溶液的方法,原因是氯化钠的溶解度_____。
实验二:用提纯得到的精盐配制50g6%的氯化钠溶液
(1)计算。需要氯化钠_____g,蒸馏水______mL。
(2)称量、量取。量取水的体积时,若仰视读数,所配溶液的溶质质量分数会______6%(填“>”“<”或“=”)。
(3)溶解。用玻璃棒搅拌的目的是_______。
(4)装瓶、贴标签。
四、计算题
22.向 Ba(OH)2 溶液中先滴加一定量CuSO4 溶液,直至沉淀质量为 m 克,再不断滴加H2SO4 溶液。整个过程中,产生沉淀的质量与加入溶液的质量关系如图所示。回答下列问题
(1)生成氢氧化铜的质量是多少
(2)通过计算确定m的值。
23.某实验小组的同学用氢氧化钡溶液和盐酸进行酸碱中和反应的实验时,向烧杯中的氢氧化钡溶液加入一定量的稀盐酸后,发现忘记滴加指示剂。因此,他们停止滴加稀盐酸,并对烧杯内溶液中的溶质成分进行探究。取10g烧杯中的溶液,向其中逐滴滴入溶质质量分数为13.25%的碳酸钠溶液。测得溶液pH与加入的碳酸钠溶液的质量关系如图所示。
(1)通过如图所示可知,当碳酸钠溶液质量加到_____时,溶液中盐酸恰好处理完。
(2)请计算原烧杯溶液中氯化钡的质量分数。(要有必要的解题过程)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
2.C
3.D
4.A
5.A
6.C
7.D
8.D
9.D
10.B
11.D
12.C
13.C
14.C
15.D
16.(1) Al2O3 2SO3 (2) 5NH4+ Na
17.(1) OH- (2) Cu(OH)2 C
18.(1)t2
(2)65
(3)X
(4)①③④
(5)Z>Y>X
19.(1) ④ ⑤ ① (2) ② ③
20.(1) 没有利用玻璃棒引流 ①⑤②③⑥④ (2) 使液体均匀受热,防止液体飞溅 (3) 较多固体 偏低
21.(1) ⑤ 有较多的固体出现时 (2) 随温度变化不大 3g (3) 47mL < 加速溶解
22.(1)0.98g(2)3.31
23.(1)2
(2)结合以上分析和图形中pH值的变化,反应氯化钡消耗的碳酸碳溶液的质量为6g-2g=4g;设原烧杯溶液中的质量为x,
208 106
x
解得x=1.04g
原烧杯溶液中氯化钡的质量分数:。
答案第1页,共2页
答案第1页,共2页
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
