专题3《微粒间作用力与物质性质》章末习题2022-2023学年下学期高二化学苏教版(2019)选择性必修2(Word含答案)
文档属性
| 名称 | 专题3《微粒间作用力与物质性质》章末习题2022-2023学年下学期高二化学苏教版(2019)选择性必修2(Word含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-24 20:58:27 | ||
图片预览


文档简介
专题3《微粒间作用力与物质性质》章末习题
一、单选题
1.已知非金属元素A、B、C、D是原子序数依次增大的4种短周期元素,其中A是元素周期表中原子半径最小的元素,D是地壳中含量最多的元素,B原子核外电子数是未成对电子数的3倍,E原子核外电子层数为4,其基态原子的内层轨道全部排满电子,且最外层电子数与A相同。下列有关说法正确的是
A.元素B、C、D的第一电离能由大到小的顺序为:D>C>B
B.由A与C以个数比1∶1组成的化合物中不可能含有离子键
C.A与B、A与C、A与D均能形成18电子的分子
D.如图为D和E两种元素组成的化合物的晶胞,则E离子的配位数为4
2.下列物质发生状态变化时,克服了范德华力的是
A.食盐熔化 B.HCl溶于水
C.碘升华 D.氢氧化钠熔化
3.钴的一种化合物的晶胞结构如图所示,已知A点的原子坐标参数为(0,0,0),B点为(,0,),下列说法中错误的是
A.配合物中Co2+价电子排布式为3d7
B.距离Co2+最近且等距的O2-的数目为6
C.C点的原子坐标参数为(,,)
D.该物质的化学式为TiCoO2
4.砷化镓是一种重要的半导体材料,熔点1238。它在600以下,能在空气中稳定存在,并且不被非氧化性的酸侵蚀。砷化镓晶胞结构如图。下列说法正确的是
A.砷化镓是一种分子晶体
B.砷化镓中不存在配位键
C.晶胞中Ga原子与As原子的数量比为4:1
D.晶胞中Ga与周围等距且最近的As形成的空间构型为正四面体
5.下列有关晶胞的叙述中,正确的是。
A.晶胞是晶体结构中最小的重复单元
B.晶胞中的任何一个粒子都属于该晶胞
C.所有晶体都是由平行六面体无隙组合而成
D.不同晶体中的晶胞的大小和形状均相同
6.关于晶体的下列说法中,正确的是
A.共价晶体中可能含有离子键
B.离子晶体中可能含有共价键
C.离子晶体中只含有离子键,不含有共价键
D.任何晶体中,若含有阳离子就一定有阴离子
7.KIO3晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立方结构,边长a=0.446nm,晶胞中K、I、O分别处于顶角、体心、面心位置,如图所示。下列说法不正确的是
A.K与O间的最短距离为0. 315 nm
B.与K紧邻的O个数为12
C.在KIO3晶胞结构的另一种表示中,I处于各顶角位置,则K处于体心位置,O处于棱心位置
D.若KIO3晶体的密度为ρ g/cm3,则阿伏加德罗常数的值可表示为
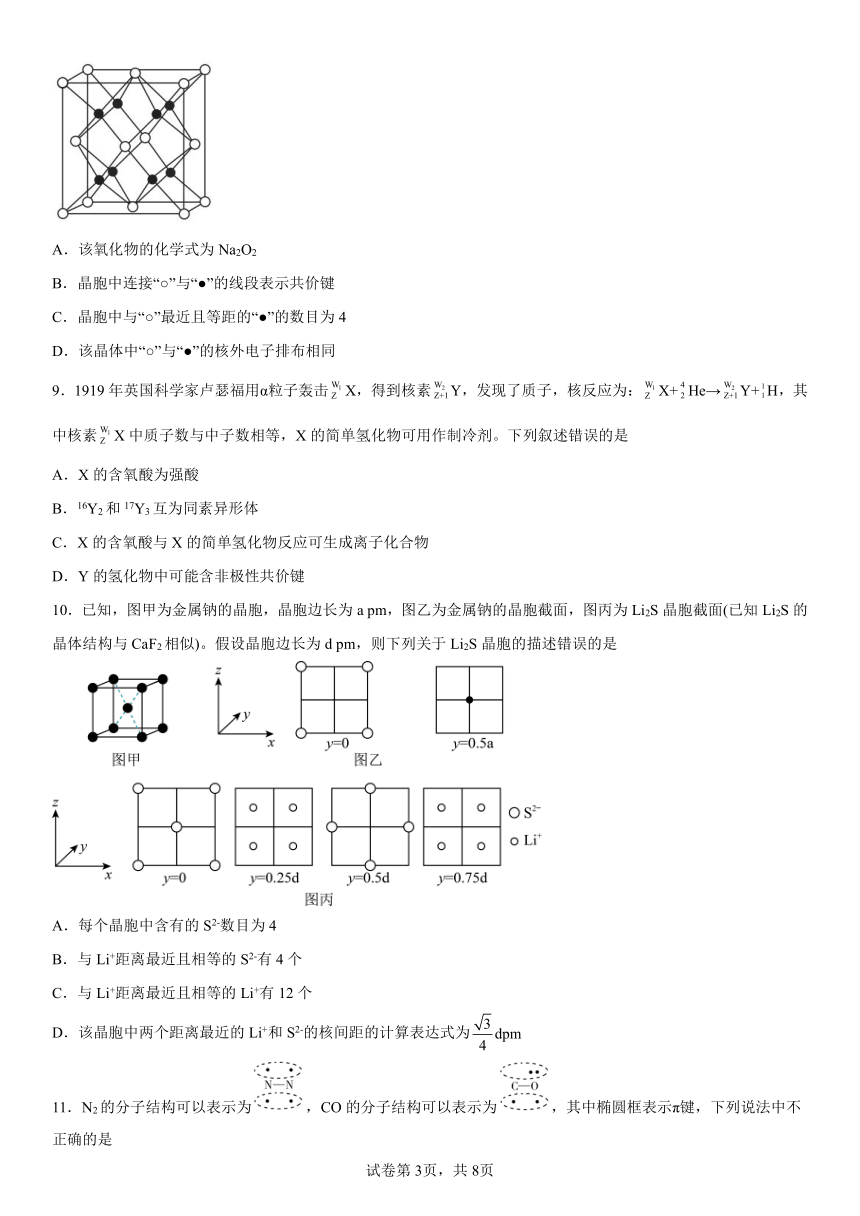
8.钠的一种氧化物的正方体晶胞如图所示(“●”或“○”均表示一个简单离子)。下列说法正确的是
A.该氧化物的化学式为Na2O2
B.晶胞中连接“○”与“●”的线段表示共价键
C.晶胞中与“○”最近且等距的“●”的数目为4
D.该晶体中“○”与“●”的核外电子排布相同
9.1919年英国科学家卢瑟福用α粒子轰击X,得到核素Y,发现了质子,核反应为:X+He→Y+H,其中核素X中质子数与中子数相等,X的简单氢化物可用作制冷剂。下列叙述错误的是
A.X的含氧酸为强酸
B.16Y2和17Y3互为同素异形体
C.X的含氧酸与X的简单氢化物反应可生成离子化合物
D.Y的氢化物中可能含非极性共价键
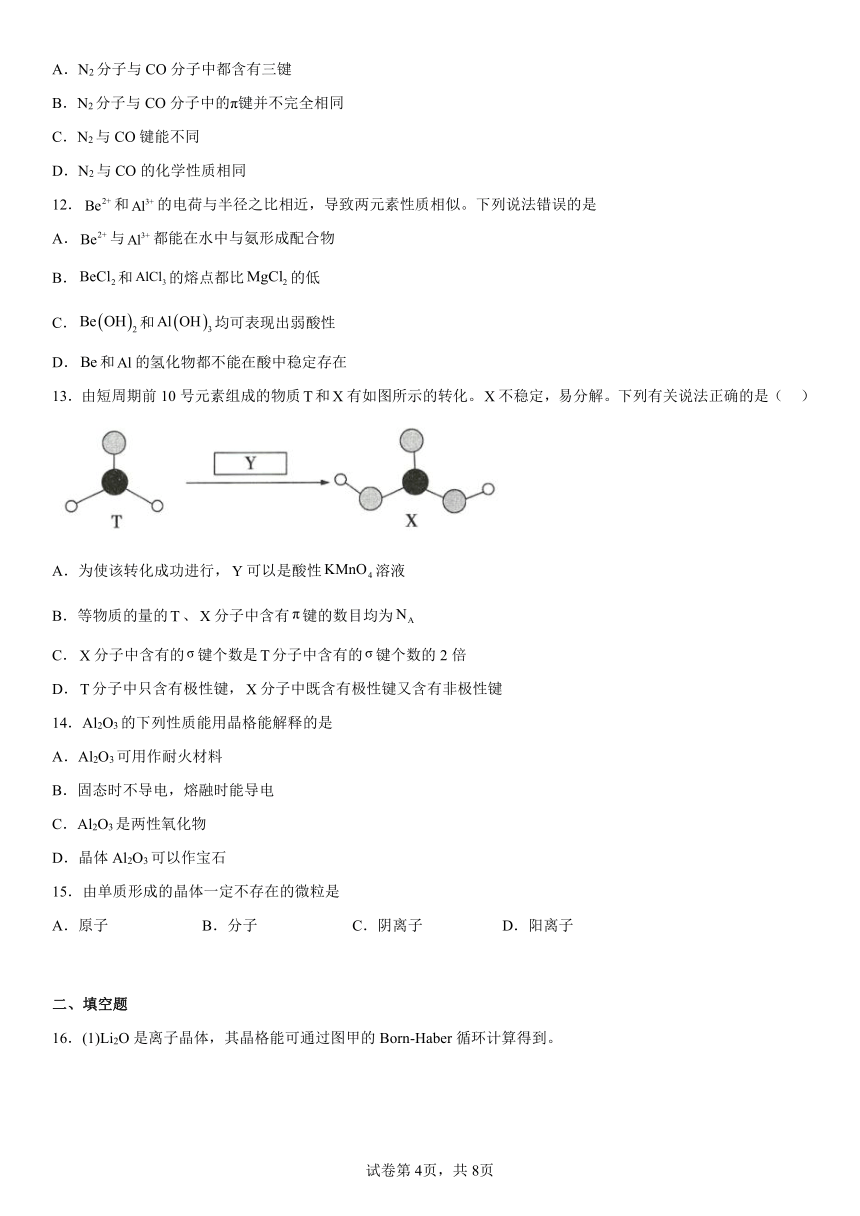
10.已知,图甲为金属钠的晶胞,晶胞边长为a pm,图乙为金属钠的晶胞截面,图丙为Li2S晶胞截面(已知Li2S的晶体结构与CaF2相似)。假设晶胞边长为d pm,则下列关于Li2S晶胞的描述错误的是
A.每个晶胞中含有的S2-数目为4
B.与Li+距离最近且相等的S2-有4个
C.与Li+距离最近且相等的Li+有12个
D.该晶胞中两个距离最近的Li+和S2-的核间距的计算表达式为
11.N2的分子结构可以表示为,CO的分子结构可以表示为,其中椭圆框表示π键,下列说法中不正确的是
A.N2分子与CO分子中都含有三键
B.N2分子与CO分子中的π键并不完全相同
C.N2与CO键能不同
D.N2与CO的化学性质相同
12.和的电荷与半径之比相近,导致两元素性质相似。下列说法错误的是
A.与都能在水中与氨形成配合物
B.和的熔点都比的低
C.和均可表现出弱酸性
D.和的氢化物都不能在酸中稳定存在
13.由短周期前10号元素组成的物质和有如图所示的转化。不稳定,易分解。下列有关说法正确的是( )
A.为使该转化成功进行,可以是酸性溶液
B.等物质的量的、分子中含有键的数目均为
C.分子中含有的键个数是分子中含有的键个数的2倍
D.分子中只含有极性键,分子中既含有极性键又含有非极性键
14.Al2O3的下列性质能用晶格能解释的是
A.Al2O3可用作耐火材料
B.固态时不导电,熔融时能导电
C.Al2O3是两性氧化物
D.晶体Al2O3可以作宝石
15.由单质形成的晶体一定不存在的微粒是
A.原子 B.分子 C.阴离子 D.阳离子
二、填空题
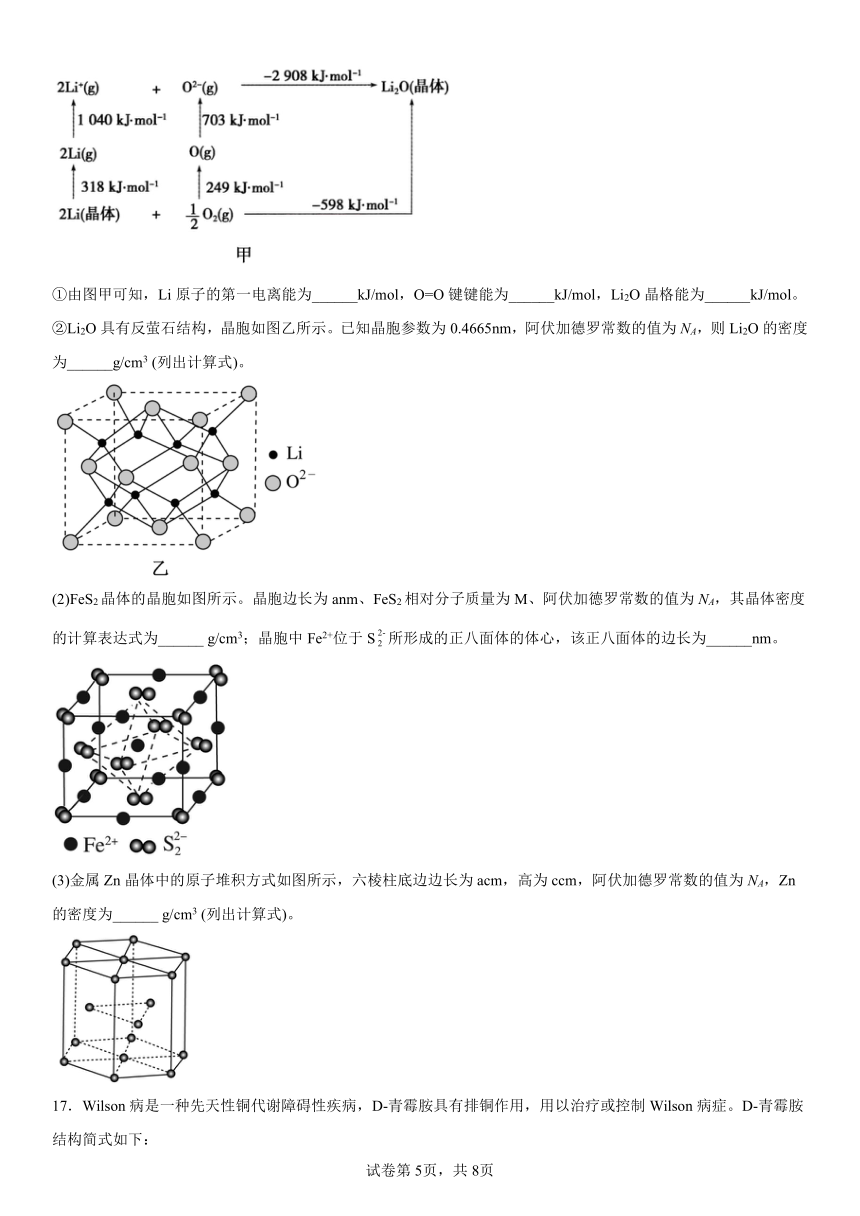
16.(1)Li2O是离子晶体,其晶格能可通过图甲的Born-Haber循环计算得到。
①由图甲可知,Li原子的第一电离能为______kJ/mol,O=O键键能为______kJ/mol,Li2O晶格能为______kJ/mol。
②Li2O具有反萤石结构,晶胞如图乙所示。已知晶胞参数为0.4665nm,阿伏加德罗常数的值为NA,则Li2O的密度为______g/cm3 (列出计算式)。
(2)FeS2晶体的晶胞如图所示。晶胞边长为anm、FeS2相对分子质量为M、阿伏加德罗常数的值为NA,其晶体密度的计算表达式为______ g/cm3;晶胞中Fe2+位于S所形成的正八面体的体心,该正八面体的边长为______nm。
(3)金属Zn晶体中的原子堆积方式如图所示,六棱柱底边边长为acm,高为ccm,阿伏加德罗常数的值为NA,Zn的密度为______ g/cm3 (列出计算式)。
17.Wilson病是一种先天性铜代谢障碍性疾病,D-青霉胺具有排铜作用,用以治疗或控制Wilson病症。D-青霉胺结构简式如下:
回答下列问题:
(1)写出Cu的简化电子排布式:_______。
(2)D-青霉胺在用于临床治疗时对于症状改善较慢,常有并发症出现,因而近年采用锌剂(ZnSO4)替代治疗,ZnSO4可由硫化锌制备。立方硫化锌晶胞结构如图:
其中a代表S2-,b代表Zn2+。则该晶体中S2-的配位数为_______;若晶体的密度为ρ g/cm3,则1个晶胞的体积为_______cm3(设NA为阿伏加德罗常数的值,列出计算式)。
18.区分晶体Ni和非晶体Ni的最可靠的科学方法为_______
19.晶体模型如下图所示:
(1)在晶体中,每个周围同时吸引_______个,每个周围也同时吸引着_______个;在晶胞中含有_______个、_______个,晶体中每个周围与它距离最近且相等的共有_______个。
(2)对于氯化钠晶体,下列描述正确的是_______。
A.它是离子晶体
B.相邻的阴、阳离子核间距等于阴、阳离子半径之和
C.与氯化铯晶体结构相同
D.每个与6个紧邻
20.的晶胞如图所示,金属离子与氧离子间的作用力为_______,的配位数是_______。
21.Li是最轻的固体金属,采用Li作为负极材料的电池具有小而轻、能量密度大等优良性能,得到广泛应用。回答下列问题:
(1)Li与H-具有相同的电子构型,r(Li+)小于r(H-),原因是_______。
(2)Li2O是离子晶体,其晶格能可通过如图的Borm-Haber循环计算得到。
Li2O晶格能为_______kJ·mol 1。
22.下表给出了14种元素的电负性:
元素 电负性 元素 电负性 元素 电负性
Al 1.5 B 2.0 Be 1.5
C 2.5 Cl 3.0 F 4.0
Li 1.0 Mg 1.2 N 3.0
Na 0.9 O 3.5 P 2.1
S 2.5 Si 1.8
(1)从表中可看出同一周期中,从左到右,主族元素的电负性_______;同一主族中,从上到下,元素的电负性_______。主族元素的电负性随原子序数递增呈_______变化。
(2)短周期主族元素中,电负性最大的元素与电负性最小的元素形成的化合物属于_______化合物。
(3)已知:两成键元素间的电负性差值大于1.7时,通常形成离子键,两成键元素间的电负性差值小于1.7时,通常形成共价键。、、、中为离子化合物的是_______,为共价化合物的是_______。
23.金属导电性的解释_______
24.苯胺()的晶体类型是_______。苯胺与甲苯()的相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是_______。
25.现有下列八种晶体:
A.水晶 B.冰醋酸 C.氧化镁 D.白磷 E.晶体氩 F.氯化铵 G.铝 H.金刚石
(1)属于共价晶体的是___________,直接由原子构成的晶体是___________,直接由原子构成的分子晶体是___________。
(2)由极性分子构成的晶体是___________,含有共价键的离子晶体是___________,属于分子晶体的单质是___________。
(3)在一定条件下能导电而不发生化学变化的是___________,受热熔化后化学键不发生变化的是___________,熔化时需克服共价键的是___________。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
【解析】A是元素周期表中原子半径最小的元素,则为H元素;D是地壳中含量最多的元素,为O元素;B原子核外电子数是未成对电子数的3倍,假设未成对电子数为1,则核外电子数为3,不符合题意,假设未成对电子数为2,则核外电子数为6,为C元素;非金属元素A、B、C、D是原子序数依次增大的4种短周期元素,所以C为N元素;E原子核外电子层数为4,其基态原子的内层轨道全部排满电子,且最外层电子数与A相同,则E为Cu元素,据此分析解答。
【解析】根据上述分析可知,A、B、C、D、E分别为H、C、N、O、Cu元素,据此分析解答。
A.VA族的p能级处于半充满的稳定结构,比同周期VIA族的第一电离能大,元素B、C、D的第一电离能由大到小的顺序为:C(N) > D(O) >B(C),A错误;
B.C为N元素,则含N和H的化合物中含铵根离子,铵根离子与阴离子之间存在离子键,B错误;
C.A与B可形成C2H6、A与C可形成N2H4、A与D可形成H2O2,均能形成18电子的分子,C正确;
D.D为O元素,E为Cu元素,根据晶胞结构可知,白球与黑球的个数比为=1:2,所以白球是O,黑球为Cu,则E离子的配位数为2,D错误;
故选C。
2.C
【解析】A.氯化钠是离子化合物,熔化时离子键断裂,故A不符合题意;
B.HCl溶于水时克服的是共价键,故B不符合题意;
C.碘升华时克服的是范德华力,故C符合题意。
D.氢氧化钠是离子化合物,熔化时离子键断裂,故D不符合题意。
综上所述,答案为诶C。
3.D
【解析】A.钴元素的原子序数为27,钴原子的价电子排布式为3d74s2,则配合物中Co2+离子的价电子排布式为3d7,故A正确;
B.由晶胞结构可知,距离Co2+最近且等距的O2-的数目为6,故B正确;
C.由A点的原子坐标参数为(0,0,0),B点为(,0,)可知,晶胞的边长为1,C点位于体心,则原子坐标参数为(,,),故C正确;
D.由晶胞结构可知,晶胞中位于顶点的Ti4+离子的个数为8×=1,位于体心上的Co2+离子的个数为1,位于面心上的O2—离子的个数为6×=3,则该物质的化学式为TiCoO3,故D错误;
故选D。
4.D
【解析】A. 根据砷化镓熔点数据和晶胞结构(空间网状)可知砷化镓为原子晶体,A错误;
B. Ga最外层有3个电子,每个Ga与4个As成键,所以砷化镓必有配位键,B错误;
C. 晶胞中,Ga位于顶点和面心,则数目为,As位于晶胞内,数目为4,所以晶胞中Ga原子与As原子的数目之比为1 : 1,C错误;
D. 由图可知,晶胞中Ga与周围等距且最近的As形成的空间构型为正四面体,D正确;
故选D。
5.A
【解析】A.晶体结构中的最小重复单元是晶胞,A正确;
B.由于晶胞要无隙并置排列,必然出现相邻晶胞共用粒子的情况,B错误;
C.大部分晶体是由平行六面体形晶胞无隙并置而成,但不是所有晶体,C错误;
D.不同晶体中的晶胞形状可能相同,但晶胞的大小不相同,如果形状和大小均相同,则是同一种晶胞,D错误;
答案选A。
6.B
【解析】A.共价晶体中不可能含有离子键,含有离子键的晶体为离子晶体,故A错误;
B.离子晶体中可能含有共价键,如氢氧化钠晶体中含有离子键和共价键,故B正确;
C.离子晶体中一定含有离子键,可能含有共价键,如氢氧化钠晶体中含有离子键和共价键,故C错误;
D.晶体中,含有阳离子,不一定有阴离子,如金属晶体中含有金属阳离子和自由电子,故D错误;
故选B。
7.D
【解析】A.K与O间的最短距离为晶胞面对角线长的一半,即,故A正确;
B.由晶胞结构可知,与K紧邻的O有12个,故B正确;
C.想象8个晶胞紧密堆积,则I处于顶角, O处于棱心,K处于体心,故C正确;
D.设表示阿伏加德罗常数的值,由晶胞结构可知,其含有1个K,1个I,3个O,则该晶胞含有1个,故有,则,故选D。
答案选D
8.D
【解析】由晶胞图可知,黑色原子有8个在体内,白色原子有8个在顶点、6个在面心,根据均摊法进行计算,,可知白色原子和黑色原子之比为1:2,故该氧化物为Na2O,白色的为氧离子,黑色的为钠离子,据此分析解答。
【解析】A.由分析可知,该氧化物的化学式为Na2O,A错误;
B.氧化钠中含有离子键,晶胞中连接氧离子与钠离子的线段表示离子键,B错误;
C.由晶胞图可知,晶胞中与氧离子最近且等距的钠离子的数目为8,C错误;
D.钠离子和氧离子的核外电子数均为10,最外层电子均为8,核外电子排布相同,D正确;
故答案选D。
9.A
【解析】A.Y的原子序数比X的原子序数大1,X的简单氢化物可用作制冷剂,推出X为N,Y为O,核素中质子数与中子数相等,则为14,为17,则核反应为:。为弱酸,A错误;
B.和互为同素异形体,B错误;
C.与反应生成,为离子化合物,C错误;
D.中既含有极性共价键,也含有非极性共价键,D正确;
故选A。
10.C
【解析】根据图丙可知Li2S的晶胞结构为:,据此分析解答。
【解析】A.根据晶胞结构可知在该晶胞中S2-个数=8×+6×=4,A正确;
B.每个Li+连接4个距离最近且相等的S2-,所以与Li+距离最近且相等的S2-有4个,B正确;
C.该晶胞中含有8个Li+,两个距离最近的Li+之间距离为晶胞边长d的一半,与Li+距离最近且相等的Li+有6个,分别位于该Li+的上、下、前、后、左、右六个方向,C错误;
D.该晶胞中该晶胞中两个距离最近的Li+和S2-的核间距为晶胞体对角线的,该晶胞边长为d pm,体对角线为,则该晶胞中该晶胞中两个距离最近的Li+和S2-的核间距的计算表达式为,D正确;
故合理选项是C。
11.D
【解析】A.从题图可以看出,N2分子与CO分子中均含有1个σ键和2个π键,所以二者都含有三键,A项正确;
B.N2分子中的2个π键是由每个N原子各提供2个p电子以“肩并肩”的方式重叠形成的,而CO分子中的2个π键,其中1个π键,成键电子完全由氧原子提供,B项正确;
C.由不同元素形成的三键,键能不同,C项正确;
D.键能不同,则化学性质也不相同,D项错误。
故答案选D。
12.A
【解析】A.半径小,不能容纳6个氮原子和它配位,则不能在水中与氨形成配合物,A项错误;
B.和属于分子晶体,而属于离子晶体,则和的熔点都比的低,B项正确;
C.和均为两性氢氧化物,则均可表现出弱酸性,C项正确;
D.和的氢化物与酸反应,生成对应的盐和氢气,则都不能在酸中稳定存在,D项正确;
答案选A。
13.A
【解析】由球棍模型可知,T为,X不稳定,易分解,则X为,Y为氧化剂。
【解析】A.由醛变成酸,可以选择氧化性较强的酸性溶液,A项正确;
B.的、分子中含有键的数目为,等物质的量并不一定是,故B错误;
C.X分子中含有的键个数为5,T分子中含有的键个数为3,C项错误;
D.T、X分子均只含有极性键,无非极性键,D项错误;
答案选A。
【点睛】化合物中,单键是键,双键:一个键,一个键;三键:一个键,两个键。
14.A
【解析】A.Al2O3中Al3+和O2-所带电荷都比较多,半径又都很小,因此Al2O3的晶格能很大,熔点很高,故Al2O3可作耐火材料,能用晶格能解释,故A选;
B.Al2O3固态时不导电,熔融时能导电,说明熔融状态能够电离出自由移动的离子,与晶格能无关,故B不选;
C.Al2O3是两性氧化物是指氧化铝能够与强酸反应,也能与强碱反应,与晶格能无关,故C不选;
D.晶体Al2O3俗称刚玉,导热好,硬度高,透红外,化学稳定性好,具有较好的光学性能,可以用作宝石,与晶格能无关,故D不选;
故选A。
15.C
【解析】由单质形成的晶体可能有:硅、金刚石(原子晶体),S8、Cl2(分子晶体),Na、Mg(金属晶体),在这些晶体中,构成晶体的微粒分别是原子、分子、金属阳离子和自由电子,构成离子晶体的微粒是阴、阳离子,但离子晶体不可能是单质,故选C。
16. 520 498 2908
【解析】(1)根据图象及第一电离能概念(气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量)可知,原子的第一电离能是520kJ/mol;O=O键的键能是498kJ/mol;结合晶格能概念(1mol离子晶体完全气化为气态阴、阳离子所吸收的能量)和图中数据可得Li2O晶格能是2908kJ/mol。根据“切割法”,一个晶胞中含有Li+的个数为8,含O2-的个数为,一个晶胞中含有4个Li2O,故Li2O的密度为;
(2)晶胞边长为anm=a×10-7cm,则晶胞的体积;由晶胞结构可知,12个处于晶胞的棱上,1个处于晶胞体心,处于晶胞的8个顶点和6个面心,则每个晶胞中含有个数为,含有S个数为。FeS2的相对分子质量为M,阿伏加德罗常数的值为NA,则晶体的密度为。晶胞中位于所形成的正八面体的体心,则该正八面体的边长为;
(3)由晶胞图知,一个晶胞中含有的原子数为,晶胞的体积,一个晶胞的质量为,则密度为。
17.(1)[Ar]3d104s1
(2) 4
【解析】(1)
为29号元素,其简化电子排布式为。
(2)
以前面面心的为研究对象,每个晶胞内部有2个距离相等且最近的,则晶胞相邻的晶胞内还有2个距离相等且最近的,所以该晶体中的配位数为4;根据均摊法,该晶胞含有的个数为,含有的个数为4,所以1个晶胞的质量,晶胞的体积为。
18.X射线衍射法
【解析】区分晶体和非晶体的最可靠的科学方法是X射线衍射法;故答案为X射线衍射法。
19.(1) 6 6 4 4 12
(2)AD
【解析】(1)
在NaCl晶体中,每个Na+周围同时吸引6个Cl-,每个Cl-周围同时吸引6个Na+;该晶胞中,Na+的个数为12+1=4,Cl-的个数为=4;晶体中每个Na+周围与它距离最近且相等的Na+共有12个。
(2)
A.氯化钠晶体是由Na+、Cl-构成的粒子晶体,A正确;
B.氯化钠晶体中,相邻的阴、阳离子核间距不等于阴、阳离子半径之和,B错误;
C.氯化钠晶体呈面心立方堆积,氯化铯晶体呈体心立方堆积,二者晶体结构不同,C错误;
D.氯化钠晶体中以Na+为中心向三维方向伸展,有6个Cl-与Na+紧邻,D正确;
故选AD。
20. 离子键 12
【解析】阴、阳离子间的作用力为离子键;距离最近的为,共有12个与位于体心处的距离相等且最近,故的配位数为12。
21.(1)Li+核电荷数较大
(2)2908
【解析】(1)
Li+和H+电子层结构相同,而具有相同电子层结构的离子,核电荷数越大,离子半径越小,故答案为:Li+核电荷数较大;
(2)
离子晶体的晶格能是指拆开离子晶体使之形成气态阴离子和气态阳离子时所吸收的能量,从题图中可得到:(晶体) ,故晶格能为。
22.(1) 逐渐增大 逐渐减小 周期性
(2)离子
(3)
【解析】(1)
由题表中数据可知,第二周期元素从,随着原子序数的递增,元素的电负性逐渐增大,第三周期元素从,随着原子序数的递增,元素的电负性也逐渐增大;同一主族中,从上到下,元素的电负性逐渐减小;
(2)
短周期主族元素中,电负性最大的是F,电负性最小的是Na,两者形成的化合物的化学式为,属于离子化合物;
(3)
中两元素电负性差值为,大于1.7,形成离子键,属于离子化合物;中两元素电负性差值为,小于1.7,形成共价键,属于共价化合物;中两元素电负性差值为,小于1.7,形成共价键,属于共价化合物;中两元素电负性差值为,小于1.7,形成共价键,属于共价化合物,综上分析,属于离子化合物的是:;属于共价化合物的是:。
23.在金属晶体中,充满着带负电的“电子气”(自由电子),这些电子气的运动是没有一定方向的,但在外加电场的条件下,自由电子定向运动形成电流,所以金属容易导电
【解析】略
24. 分子晶体 苯胺分子之间存在氢键
【解析】苯胺中只含有共价键,根据其熔、沸点数据可知,苯胺的晶体类型为分子晶体。苯胺分子间存在氢键,导致其熔、沸点高于甲苯。
25. AH AEH E B F DE G BDE AH
【解析】(1)水晶为SiO2晶体,由Si原子和O原子构成,属于共价晶体,金刚石由C原子构成,属于共价晶体,故此处填A、H;直接由原子构成的晶体包括原子晶体A、H,以及由单原子分子构成的分子晶体E,故此处填A、E、H;稀有气体是单原子分子,其晶体是直接由原子构成的分子晶体,故此处填E;
(2)醋酸分子正负电荷中心不重合,属于极性分子,故此处填B;NH4Cl由离子构成,其晶体属于离子晶体,且铵根离子内部存在共价键,故此处填F;白磷、氩都是由分子构成的单质,故此处填D、E;
(3)金属晶体能导电且不发生化学变化,故此处填G;分子晶体受热熔化后分子不变,化学键不发生变化,故此处填BDE;共价晶体熔化时需克服共价键,故此处填AH。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.已知非金属元素A、B、C、D是原子序数依次增大的4种短周期元素,其中A是元素周期表中原子半径最小的元素,D是地壳中含量最多的元素,B原子核外电子数是未成对电子数的3倍,E原子核外电子层数为4,其基态原子的内层轨道全部排满电子,且最外层电子数与A相同。下列有关说法正确的是
A.元素B、C、D的第一电离能由大到小的顺序为:D>C>B
B.由A与C以个数比1∶1组成的化合物中不可能含有离子键
C.A与B、A与C、A与D均能形成18电子的分子
D.如图为D和E两种元素组成的化合物的晶胞,则E离子的配位数为4
2.下列物质发生状态变化时,克服了范德华力的是
A.食盐熔化 B.HCl溶于水
C.碘升华 D.氢氧化钠熔化
3.钴的一种化合物的晶胞结构如图所示,已知A点的原子坐标参数为(0,0,0),B点为(,0,),下列说法中错误的是
A.配合物中Co2+价电子排布式为3d7
B.距离Co2+最近且等距的O2-的数目为6
C.C点的原子坐标参数为(,,)
D.该物质的化学式为TiCoO2
4.砷化镓是一种重要的半导体材料,熔点1238。它在600以下,能在空气中稳定存在,并且不被非氧化性的酸侵蚀。砷化镓晶胞结构如图。下列说法正确的是
A.砷化镓是一种分子晶体
B.砷化镓中不存在配位键
C.晶胞中Ga原子与As原子的数量比为4:1
D.晶胞中Ga与周围等距且最近的As形成的空间构型为正四面体
5.下列有关晶胞的叙述中,正确的是。
A.晶胞是晶体结构中最小的重复单元
B.晶胞中的任何一个粒子都属于该晶胞
C.所有晶体都是由平行六面体无隙组合而成
D.不同晶体中的晶胞的大小和形状均相同
6.关于晶体的下列说法中,正确的是
A.共价晶体中可能含有离子键
B.离子晶体中可能含有共价键
C.离子晶体中只含有离子键,不含有共价键
D.任何晶体中,若含有阳离子就一定有阴离子
7.KIO3晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立方结构,边长a=0.446nm,晶胞中K、I、O分别处于顶角、体心、面心位置,如图所示。下列说法不正确的是
A.K与O间的最短距离为0. 315 nm
B.与K紧邻的O个数为12
C.在KIO3晶胞结构的另一种表示中,I处于各顶角位置,则K处于体心位置,O处于棱心位置
D.若KIO3晶体的密度为ρ g/cm3,则阿伏加德罗常数的值可表示为
8.钠的一种氧化物的正方体晶胞如图所示(“●”或“○”均表示一个简单离子)。下列说法正确的是
A.该氧化物的化学式为Na2O2
B.晶胞中连接“○”与“●”的线段表示共价键
C.晶胞中与“○”最近且等距的“●”的数目为4
D.该晶体中“○”与“●”的核外电子排布相同
9.1919年英国科学家卢瑟福用α粒子轰击X,得到核素Y,发现了质子,核反应为:X+He→Y+H,其中核素X中质子数与中子数相等,X的简单氢化物可用作制冷剂。下列叙述错误的是
A.X的含氧酸为强酸
B.16Y2和17Y3互为同素异形体
C.X的含氧酸与X的简单氢化物反应可生成离子化合物
D.Y的氢化物中可能含非极性共价键
10.已知,图甲为金属钠的晶胞,晶胞边长为a pm,图乙为金属钠的晶胞截面,图丙为Li2S晶胞截面(已知Li2S的晶体结构与CaF2相似)。假设晶胞边长为d pm,则下列关于Li2S晶胞的描述错误的是
A.每个晶胞中含有的S2-数目为4
B.与Li+距离最近且相等的S2-有4个
C.与Li+距离最近且相等的Li+有12个
D.该晶胞中两个距离最近的Li+和S2-的核间距的计算表达式为
11.N2的分子结构可以表示为,CO的分子结构可以表示为,其中椭圆框表示π键,下列说法中不正确的是
A.N2分子与CO分子中都含有三键
B.N2分子与CO分子中的π键并不完全相同
C.N2与CO键能不同
D.N2与CO的化学性质相同
12.和的电荷与半径之比相近,导致两元素性质相似。下列说法错误的是
A.与都能在水中与氨形成配合物
B.和的熔点都比的低
C.和均可表现出弱酸性
D.和的氢化物都不能在酸中稳定存在
13.由短周期前10号元素组成的物质和有如图所示的转化。不稳定,易分解。下列有关说法正确的是( )
A.为使该转化成功进行,可以是酸性溶液
B.等物质的量的、分子中含有键的数目均为
C.分子中含有的键个数是分子中含有的键个数的2倍
D.分子中只含有极性键,分子中既含有极性键又含有非极性键
14.Al2O3的下列性质能用晶格能解释的是
A.Al2O3可用作耐火材料
B.固态时不导电,熔融时能导电
C.Al2O3是两性氧化物
D.晶体Al2O3可以作宝石
15.由单质形成的晶体一定不存在的微粒是
A.原子 B.分子 C.阴离子 D.阳离子
二、填空题
16.(1)Li2O是离子晶体,其晶格能可通过图甲的Born-Haber循环计算得到。
①由图甲可知,Li原子的第一电离能为______kJ/mol,O=O键键能为______kJ/mol,Li2O晶格能为______kJ/mol。
②Li2O具有反萤石结构,晶胞如图乙所示。已知晶胞参数为0.4665nm,阿伏加德罗常数的值为NA,则Li2O的密度为______g/cm3 (列出计算式)。
(2)FeS2晶体的晶胞如图所示。晶胞边长为anm、FeS2相对分子质量为M、阿伏加德罗常数的值为NA,其晶体密度的计算表达式为______ g/cm3;晶胞中Fe2+位于S所形成的正八面体的体心,该正八面体的边长为______nm。
(3)金属Zn晶体中的原子堆积方式如图所示,六棱柱底边边长为acm,高为ccm,阿伏加德罗常数的值为NA,Zn的密度为______ g/cm3 (列出计算式)。
17.Wilson病是一种先天性铜代谢障碍性疾病,D-青霉胺具有排铜作用,用以治疗或控制Wilson病症。D-青霉胺结构简式如下:
回答下列问题:
(1)写出Cu的简化电子排布式:_______。
(2)D-青霉胺在用于临床治疗时对于症状改善较慢,常有并发症出现,因而近年采用锌剂(ZnSO4)替代治疗,ZnSO4可由硫化锌制备。立方硫化锌晶胞结构如图:
其中a代表S2-,b代表Zn2+。则该晶体中S2-的配位数为_______;若晶体的密度为ρ g/cm3,则1个晶胞的体积为_______cm3(设NA为阿伏加德罗常数的值,列出计算式)。
18.区分晶体Ni和非晶体Ni的最可靠的科学方法为_______
19.晶体模型如下图所示:
(1)在晶体中,每个周围同时吸引_______个,每个周围也同时吸引着_______个;在晶胞中含有_______个、_______个,晶体中每个周围与它距离最近且相等的共有_______个。
(2)对于氯化钠晶体,下列描述正确的是_______。
A.它是离子晶体
B.相邻的阴、阳离子核间距等于阴、阳离子半径之和
C.与氯化铯晶体结构相同
D.每个与6个紧邻
20.的晶胞如图所示,金属离子与氧离子间的作用力为_______,的配位数是_______。
21.Li是最轻的固体金属,采用Li作为负极材料的电池具有小而轻、能量密度大等优良性能,得到广泛应用。回答下列问题:
(1)Li与H-具有相同的电子构型,r(Li+)小于r(H-),原因是_______。
(2)Li2O是离子晶体,其晶格能可通过如图的Borm-Haber循环计算得到。
Li2O晶格能为_______kJ·mol 1。
22.下表给出了14种元素的电负性:
元素 电负性 元素 电负性 元素 电负性
Al 1.5 B 2.0 Be 1.5
C 2.5 Cl 3.0 F 4.0
Li 1.0 Mg 1.2 N 3.0
Na 0.9 O 3.5 P 2.1
S 2.5 Si 1.8
(1)从表中可看出同一周期中,从左到右,主族元素的电负性_______;同一主族中,从上到下,元素的电负性_______。主族元素的电负性随原子序数递增呈_______变化。
(2)短周期主族元素中,电负性最大的元素与电负性最小的元素形成的化合物属于_______化合物。
(3)已知:两成键元素间的电负性差值大于1.7时,通常形成离子键,两成键元素间的电负性差值小于1.7时,通常形成共价键。、、、中为离子化合物的是_______,为共价化合物的是_______。
23.金属导电性的解释_______
24.苯胺()的晶体类型是_______。苯胺与甲苯()的相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是_______。
25.现有下列八种晶体:
A.水晶 B.冰醋酸 C.氧化镁 D.白磷 E.晶体氩 F.氯化铵 G.铝 H.金刚石
(1)属于共价晶体的是___________,直接由原子构成的晶体是___________,直接由原子构成的分子晶体是___________。
(2)由极性分子构成的晶体是___________,含有共价键的离子晶体是___________,属于分子晶体的单质是___________。
(3)在一定条件下能导电而不发生化学变化的是___________,受热熔化后化学键不发生变化的是___________,熔化时需克服共价键的是___________。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
【解析】A是元素周期表中原子半径最小的元素,则为H元素;D是地壳中含量最多的元素,为O元素;B原子核外电子数是未成对电子数的3倍,假设未成对电子数为1,则核外电子数为3,不符合题意,假设未成对电子数为2,则核外电子数为6,为C元素;非金属元素A、B、C、D是原子序数依次增大的4种短周期元素,所以C为N元素;E原子核外电子层数为4,其基态原子的内层轨道全部排满电子,且最外层电子数与A相同,则E为Cu元素,据此分析解答。
【解析】根据上述分析可知,A、B、C、D、E分别为H、C、N、O、Cu元素,据此分析解答。
A.VA族的p能级处于半充满的稳定结构,比同周期VIA族的第一电离能大,元素B、C、D的第一电离能由大到小的顺序为:C(N) > D(O) >B(C),A错误;
B.C为N元素,则含N和H的化合物中含铵根离子,铵根离子与阴离子之间存在离子键,B错误;
C.A与B可形成C2H6、A与C可形成N2H4、A与D可形成H2O2,均能形成18电子的分子,C正确;
D.D为O元素,E为Cu元素,根据晶胞结构可知,白球与黑球的个数比为=1:2,所以白球是O,黑球为Cu,则E离子的配位数为2,D错误;
故选C。
2.C
【解析】A.氯化钠是离子化合物,熔化时离子键断裂,故A不符合题意;
B.HCl溶于水时克服的是共价键,故B不符合题意;
C.碘升华时克服的是范德华力,故C符合题意。
D.氢氧化钠是离子化合物,熔化时离子键断裂,故D不符合题意。
综上所述,答案为诶C。
3.D
【解析】A.钴元素的原子序数为27,钴原子的价电子排布式为3d74s2,则配合物中Co2+离子的价电子排布式为3d7,故A正确;
B.由晶胞结构可知,距离Co2+最近且等距的O2-的数目为6,故B正确;
C.由A点的原子坐标参数为(0,0,0),B点为(,0,)可知,晶胞的边长为1,C点位于体心,则原子坐标参数为(,,),故C正确;
D.由晶胞结构可知,晶胞中位于顶点的Ti4+离子的个数为8×=1,位于体心上的Co2+离子的个数为1,位于面心上的O2—离子的个数为6×=3,则该物质的化学式为TiCoO3,故D错误;
故选D。
4.D
【解析】A. 根据砷化镓熔点数据和晶胞结构(空间网状)可知砷化镓为原子晶体,A错误;
B. Ga最外层有3个电子,每个Ga与4个As成键,所以砷化镓必有配位键,B错误;
C. 晶胞中,Ga位于顶点和面心,则数目为,As位于晶胞内,数目为4,所以晶胞中Ga原子与As原子的数目之比为1 : 1,C错误;
D. 由图可知,晶胞中Ga与周围等距且最近的As形成的空间构型为正四面体,D正确;
故选D。
5.A
【解析】A.晶体结构中的最小重复单元是晶胞,A正确;
B.由于晶胞要无隙并置排列,必然出现相邻晶胞共用粒子的情况,B错误;
C.大部分晶体是由平行六面体形晶胞无隙并置而成,但不是所有晶体,C错误;
D.不同晶体中的晶胞形状可能相同,但晶胞的大小不相同,如果形状和大小均相同,则是同一种晶胞,D错误;
答案选A。
6.B
【解析】A.共价晶体中不可能含有离子键,含有离子键的晶体为离子晶体,故A错误;
B.离子晶体中可能含有共价键,如氢氧化钠晶体中含有离子键和共价键,故B正确;
C.离子晶体中一定含有离子键,可能含有共价键,如氢氧化钠晶体中含有离子键和共价键,故C错误;
D.晶体中,含有阳离子,不一定有阴离子,如金属晶体中含有金属阳离子和自由电子,故D错误;
故选B。
7.D
【解析】A.K与O间的最短距离为晶胞面对角线长的一半,即,故A正确;
B.由晶胞结构可知,与K紧邻的O有12个,故B正确;
C.想象8个晶胞紧密堆积,则I处于顶角, O处于棱心,K处于体心,故C正确;
D.设表示阿伏加德罗常数的值,由晶胞结构可知,其含有1个K,1个I,3个O,则该晶胞含有1个,故有,则,故选D。
答案选D
8.D
【解析】由晶胞图可知,黑色原子有8个在体内,白色原子有8个在顶点、6个在面心,根据均摊法进行计算,,可知白色原子和黑色原子之比为1:2,故该氧化物为Na2O,白色的为氧离子,黑色的为钠离子,据此分析解答。
【解析】A.由分析可知,该氧化物的化学式为Na2O,A错误;
B.氧化钠中含有离子键,晶胞中连接氧离子与钠离子的线段表示离子键,B错误;
C.由晶胞图可知,晶胞中与氧离子最近且等距的钠离子的数目为8,C错误;
D.钠离子和氧离子的核外电子数均为10,最外层电子均为8,核外电子排布相同,D正确;
故答案选D。
9.A
【解析】A.Y的原子序数比X的原子序数大1,X的简单氢化物可用作制冷剂,推出X为N,Y为O,核素中质子数与中子数相等,则为14,为17,则核反应为:。为弱酸,A错误;
B.和互为同素异形体,B错误;
C.与反应生成,为离子化合物,C错误;
D.中既含有极性共价键,也含有非极性共价键,D正确;
故选A。
10.C
【解析】根据图丙可知Li2S的晶胞结构为:,据此分析解答。
【解析】A.根据晶胞结构可知在该晶胞中S2-个数=8×+6×=4,A正确;
B.每个Li+连接4个距离最近且相等的S2-,所以与Li+距离最近且相等的S2-有4个,B正确;
C.该晶胞中含有8个Li+,两个距离最近的Li+之间距离为晶胞边长d的一半,与Li+距离最近且相等的Li+有6个,分别位于该Li+的上、下、前、后、左、右六个方向,C错误;
D.该晶胞中该晶胞中两个距离最近的Li+和S2-的核间距为晶胞体对角线的,该晶胞边长为d pm,体对角线为,则该晶胞中该晶胞中两个距离最近的Li+和S2-的核间距的计算表达式为,D正确;
故合理选项是C。
11.D
【解析】A.从题图可以看出,N2分子与CO分子中均含有1个σ键和2个π键,所以二者都含有三键,A项正确;
B.N2分子中的2个π键是由每个N原子各提供2个p电子以“肩并肩”的方式重叠形成的,而CO分子中的2个π键,其中1个π键,成键电子完全由氧原子提供,B项正确;
C.由不同元素形成的三键,键能不同,C项正确;
D.键能不同,则化学性质也不相同,D项错误。
故答案选D。
12.A
【解析】A.半径小,不能容纳6个氮原子和它配位,则不能在水中与氨形成配合物,A项错误;
B.和属于分子晶体,而属于离子晶体,则和的熔点都比的低,B项正确;
C.和均为两性氢氧化物,则均可表现出弱酸性,C项正确;
D.和的氢化物与酸反应,生成对应的盐和氢气,则都不能在酸中稳定存在,D项正确;
答案选A。
13.A
【解析】由球棍模型可知,T为,X不稳定,易分解,则X为,Y为氧化剂。
【解析】A.由醛变成酸,可以选择氧化性较强的酸性溶液,A项正确;
B.的、分子中含有键的数目为,等物质的量并不一定是,故B错误;
C.X分子中含有的键个数为5,T分子中含有的键个数为3,C项错误;
D.T、X分子均只含有极性键,无非极性键,D项错误;
答案选A。
【点睛】化合物中,单键是键,双键:一个键,一个键;三键:一个键,两个键。
14.A
【解析】A.Al2O3中Al3+和O2-所带电荷都比较多,半径又都很小,因此Al2O3的晶格能很大,熔点很高,故Al2O3可作耐火材料,能用晶格能解释,故A选;
B.Al2O3固态时不导电,熔融时能导电,说明熔融状态能够电离出自由移动的离子,与晶格能无关,故B不选;
C.Al2O3是两性氧化物是指氧化铝能够与强酸反应,也能与强碱反应,与晶格能无关,故C不选;
D.晶体Al2O3俗称刚玉,导热好,硬度高,透红外,化学稳定性好,具有较好的光学性能,可以用作宝石,与晶格能无关,故D不选;
故选A。
15.C
【解析】由单质形成的晶体可能有:硅、金刚石(原子晶体),S8、Cl2(分子晶体),Na、Mg(金属晶体),在这些晶体中,构成晶体的微粒分别是原子、分子、金属阳离子和自由电子,构成离子晶体的微粒是阴、阳离子,但离子晶体不可能是单质,故选C。
16. 520 498 2908
【解析】(1)根据图象及第一电离能概念(气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量)可知,原子的第一电离能是520kJ/mol;O=O键的键能是498kJ/mol;结合晶格能概念(1mol离子晶体完全气化为气态阴、阳离子所吸收的能量)和图中数据可得Li2O晶格能是2908kJ/mol。根据“切割法”,一个晶胞中含有Li+的个数为8,含O2-的个数为,一个晶胞中含有4个Li2O,故Li2O的密度为;
(2)晶胞边长为anm=a×10-7cm,则晶胞的体积;由晶胞结构可知,12个处于晶胞的棱上,1个处于晶胞体心,处于晶胞的8个顶点和6个面心,则每个晶胞中含有个数为,含有S个数为。FeS2的相对分子质量为M,阿伏加德罗常数的值为NA,则晶体的密度为。晶胞中位于所形成的正八面体的体心,则该正八面体的边长为;
(3)由晶胞图知,一个晶胞中含有的原子数为,晶胞的体积,一个晶胞的质量为,则密度为。
17.(1)[Ar]3d104s1
(2) 4
【解析】(1)
为29号元素,其简化电子排布式为。
(2)
以前面面心的为研究对象,每个晶胞内部有2个距离相等且最近的,则晶胞相邻的晶胞内还有2个距离相等且最近的,所以该晶体中的配位数为4;根据均摊法,该晶胞含有的个数为,含有的个数为4,所以1个晶胞的质量,晶胞的体积为。
18.X射线衍射法
【解析】区分晶体和非晶体的最可靠的科学方法是X射线衍射法;故答案为X射线衍射法。
19.(1) 6 6 4 4 12
(2)AD
【解析】(1)
在NaCl晶体中,每个Na+周围同时吸引6个Cl-,每个Cl-周围同时吸引6个Na+;该晶胞中,Na+的个数为12+1=4,Cl-的个数为=4;晶体中每个Na+周围与它距离最近且相等的Na+共有12个。
(2)
A.氯化钠晶体是由Na+、Cl-构成的粒子晶体,A正确;
B.氯化钠晶体中,相邻的阴、阳离子核间距不等于阴、阳离子半径之和,B错误;
C.氯化钠晶体呈面心立方堆积,氯化铯晶体呈体心立方堆积,二者晶体结构不同,C错误;
D.氯化钠晶体中以Na+为中心向三维方向伸展,有6个Cl-与Na+紧邻,D正确;
故选AD。
20. 离子键 12
【解析】阴、阳离子间的作用力为离子键;距离最近的为,共有12个与位于体心处的距离相等且最近,故的配位数为12。
21.(1)Li+核电荷数较大
(2)2908
【解析】(1)
Li+和H+电子层结构相同,而具有相同电子层结构的离子,核电荷数越大,离子半径越小,故答案为:Li+核电荷数较大;
(2)
离子晶体的晶格能是指拆开离子晶体使之形成气态阴离子和气态阳离子时所吸收的能量,从题图中可得到:(晶体) ,故晶格能为。
22.(1) 逐渐增大 逐渐减小 周期性
(2)离子
(3)
【解析】(1)
由题表中数据可知,第二周期元素从,随着原子序数的递增,元素的电负性逐渐增大,第三周期元素从,随着原子序数的递增,元素的电负性也逐渐增大;同一主族中,从上到下,元素的电负性逐渐减小;
(2)
短周期主族元素中,电负性最大的是F,电负性最小的是Na,两者形成的化合物的化学式为,属于离子化合物;
(3)
中两元素电负性差值为,大于1.7,形成离子键,属于离子化合物;中两元素电负性差值为,小于1.7,形成共价键,属于共价化合物;中两元素电负性差值为,小于1.7,形成共价键,属于共价化合物;中两元素电负性差值为,小于1.7,形成共价键,属于共价化合物,综上分析,属于离子化合物的是:;属于共价化合物的是:。
23.在金属晶体中,充满着带负电的“电子气”(自由电子),这些电子气的运动是没有一定方向的,但在外加电场的条件下,自由电子定向运动形成电流,所以金属容易导电
【解析】略
24. 分子晶体 苯胺分子之间存在氢键
【解析】苯胺中只含有共价键,根据其熔、沸点数据可知,苯胺的晶体类型为分子晶体。苯胺分子间存在氢键,导致其熔、沸点高于甲苯。
25. AH AEH E B F DE G BDE AH
【解析】(1)水晶为SiO2晶体,由Si原子和O原子构成,属于共价晶体,金刚石由C原子构成,属于共价晶体,故此处填A、H;直接由原子构成的晶体包括原子晶体A、H,以及由单原子分子构成的分子晶体E,故此处填A、E、H;稀有气体是单原子分子,其晶体是直接由原子构成的分子晶体,故此处填E;
(2)醋酸分子正负电荷中心不重合,属于极性分子,故此处填B;NH4Cl由离子构成,其晶体属于离子晶体,且铵根离子内部存在共价键,故此处填F;白磷、氩都是由分子构成的单质,故此处填D、E;
(3)金属晶体能导电且不发生化学变化,故此处填G;分子晶体受热熔化后分子不变,化学键不发生变化,故此处填BDE;共价晶体熔化时需克服共价键,故此处填AH。
答案第1页,共2页
答案第1页,共2页
